Flutamid-Ct 250Mg Tabletten
F achinformation
1. BEZEICHNUNG DES ARZNEIMITTELS Flutamid-CT 250 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Tablette enthält 250 mg Flutamid.
Sonstiger Bestandteil mit bekannter Wirkung: Lactose
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
Gelbliche runde Tabletten.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung von Patienten mit fortgeschrittenem Prostatakarzinom, bei denen eine Suppression der Testosteronwirkungen indiziert ist:
Initialtherapie in Kombination mit einem LH-RH-Analogon oder in Verbindung mit Orchiektomie (komplette Androgenblockade) sowie bei Patienten, die bereits mit einem LH-RH-Analogon behandelt werden bzw. bei denen bereits eine chirurgische Ablatio testis erfolgt ist.
Zur Behandlung von Patienten, die auf andere endokrine Therapieformen nicht ansprachen oder für die eine andere endokrine Therapie nicht verträglich, aber notwendigerweise indiziert ist.
4.2 Dosierung und Art der Anwendung
Dosierung
Soweit nicht anders verordnet:
3-mal täglich 250 mg Flutamid, entsprechend 750 mg pro Tag, oral einnehmen.
Die Tabletten werden vorzugsweise nach den Mahlzeiten mit etwas Flüssigkeit unzerkaut eingenommen.
Im Rahmen der Initialtherapie mit einem LH-RH-Analogon lassen sich Auftreten und Intensität eines Tumor-Flare-Phänomens durch eine einleitende Behandlung mit Flutamid-CT 250 mg reduzieren.
Deshalb wird empfohlen, mit der Einnahme von 3-mal täglich 250 mg Flutamid, entsprechend 750 mg Flutamid pro Tag, mindestens 3 Tage vor der erstmaligen Verabreichung des LH-RH-Analogons zu beginnen.
Die Behandlungsdauer bestimmt der behandelnde Arzt.
Für Flutamid-CT 250 mg gibt es keine Indikation für die Anwendung bei Kindern.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei eingeschränkter Leberfunktion ist bei längerer Behandlungsdauer im Einzelfall über die Anwendung von Flutamid-CT 250 mg nach sorgfältiger Abwägung von Nutzen und Risiko zu entscheiden. Vor Behandlungsbeginn sind Leberfunktionstests durchzuführen. Die Behandlung mit Flutamid-CT 250 mg sollte nicht begonnen werden, wenn die Serum-Transaminasenwerte des Patienten das 2- bis 3-fache der Normalwerte überschreiten.
Da über Abweichungen der Transaminasenwerte, cholestatischer Ikterus, hepatische Nekrosen und hepatische Enzephalopathie im Zusammenhang mit der Anwendung von Flutamid berichtet wurde, sind regelmäßig Leberfunktionstests in Betracht zu ziehen. Möglicherweise auftretende Beeinträchtigungen der Leberfunktion sind im Allgemeinen nach Absetzen der Therapie mit Flutamid-CT 250 mg reversibel. Es wurde im Zusammenhang mit der Flutamid-Behandlung über Todesfälle infolge eines schwerwiegenden Verlaufs von Leberfunktionsstörungen berichtet.
Geeignete Laboruntersuchungen bezüglich der Leberfunktion sind bei jedem Patienten einmal monatlich während der ersten 4 Monate durchzuführen, danach in regelmäßigen Intervallen oder wenn erste Symptome/Anzeichen von Leberdysfunktion (z. B. Juckreiz, dunkler Urin, andauernde Anorexie, Gelbsucht, Schmerzen im rechten Oberbauch oder unspezifische "grippeartige Symptome") auftreten. Wenn labordiagnostische Befunde Hinweise auf Leberschäden oder Gelbsucht ergeben, die ihre Ursache nicht in bioptisch gesicherten Lebermetastasen haben, ist Flutamid-CT 250 mg abzusetzen. Bei Anstieg der Serum-Transaminasenwerte über das 2- bis 3-fache der Normalwerte bei klinisch unauffälligen Patienten sollte Flutamid-CT 250 mg ebenfalls abgesetzt werden.
Flutamid-CT 250 mg ist nur für den Gebrauch bei männlichen Patienten vorgesehen.
Während der Behandlung sollten kontrazeptive Maßnahmen ergriffen und konsequent fortgeführt werden.
Flutamid-CT 250 mg sollte bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht angewendet werden.
Flutamid-CT 250 mg kann zu erhöhten Testosteron- und Östradiolplasmaspiegeln und damit zu einer Flüssigkeitsretention führen. In schweren Fällen kann dies zu einem erhöhten Risiko von Angina pectoris und Herzinsuffizienz führen. Daher ist dieses Arzneimittel bei Vorliegen einer kardiovaskulären Erkrankung mit Vorsicht einzusetzen. Flutamid-CT 250 mg kann Ödeme oder Schwellungen der Fußknöchel bei solchen Patienten verschlimmern, die hierfür anfällig sind.
Ein Anstieg des Östradiolspiegels kann zu einer Prädisposition für thromboembolische Ereignisse führen.
Im Falle einer Langzeittherapie bei Patienten ohne medikamentöse oder chirurgische Kastration ist in regelmäßigen Abständen die Spermienzahl zu bestimmen.
Androgendeprivationstherapie kann QT-Intervall verlängern
Bei Patienten mit einer Vorgeschichte von bzw. mit Risikofaktoren für QT-Verlängerung und bei Patienten mit Begleitmedikationen, die das QT-Intervall verlängern können (siehe Abschnitt 4.5), sollte vor dem Einsatz von Flutamid-CT 250 mg das Nutzen/Risiko-Verhältnis einschließlich des Potentials für Torsade de pointes abgewogen werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Flutamid-CT 250 mg nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Siehe auch Abschnitt 4.4
Wechselwirkungen zwischen Flutamid und Leuprolid traten nicht auf. In der Kombinationstherapie von Flutamid mit LH-RH-Agonisten müssen jedoch die möglichen Nebenwirkungen beider Arzneimittel berücksichtigt werden.
Bei gleichzeitiger Gabe von oralen Antikoagulantien kann die Prothrombinzeit nach Beginn der Therapie mit Flutamid verlängert sein. Deshalb empfiehlt sich die engmaschige Kontrolle dieses Parameters, gegebenenfalls ist eine Dosisanpassung des Antikoagulans erforderlich.
Bei gleichzeitiger Anwendung von Theophyllin und Flutamid wurde in manchen Fällen von erhöhten Theophyllin-Plasmakonzentrationen berichtet. Theophyllin wird primär durch das Enzym CYP 1A2 verstoffwechselt, welches hauptsächlich verantwortlich für die Umwandlung von Flutamid in den aktiven Metaboliten 2-Hydroxyflutamid ist.
Die gleichzeitige Anwendung potentiell hepatotoxischer Arzneimittel ist nur nach sorgfältiger Nutzen-Risiko-Abwägung vorzunehmen.
Aufgrund des bekannten Potenzials einer Leber- und Nierentoxizität des Wirkstoffs ist der übermäßige Konsum von Alkohol zu vermeiden.
Da eine Androgendeprivationstherapie das QT-Intervall verlängern kann, ist die gleichzeitige Anwendung von Flutamid-CT 250 mg mit Arzneimitteln, die bekanntermaßen das QT-Intervall verlängern oder Arzneimittel, die Torsade de pointes hervorrufen können wie Antiarrhythmika der Klasse IA (z. B. Quinidin, Disopyramid) oder Klasse III (z. B. Amiodaron, Sotalol, Dofetilid, Ibutilid), Methadon, Moxifloxacin, Neuroleptika usw. sogfältig abzuwägen (siehe Abschnitt 4.4).
4.6 Fertilität, Schwangerschaft und Stillzeit
Flutamid ist nur für den Gebrauch bei männlichen Patienten vorgesehen. Während der Behandlung sollten kontrazeptive Maßnahmen ergriffen und konsequent fortgeführt werden.
Eine Anwendung von Flutamid während der Schwangerschaft kann zu einer Schädigung des Kindes führen. In Tierstudien wurde die Reproduktionstoxizität von Flutamid mit der antiandrogenen Aktivität dieses Wirkstoffes in Verbindung gebracht. Es kam zu verkürztem 24-Stunden-Überleben beim Nachwuchs von Ratten, die während der Trächtigkeit mit FlutamidDosen von 30, 100 oder 200 mg/kg/Tag (etwa das 3-, 9-, und 19-fache der menschlichen Dosis) behandelt wurden. Bei den höheren Dosierungen wurde eine leichte Erhöhung von geringfügigen Abweichungen in der Entwicklung von Sternebra und Vertebra bei Föten von Ratten beobachtet. Bei den beiden höheren Dosismengen kam es auch zur Feminisierung der männlichen Ratten. Beim Nachwuchs von Kaninchen, die die höchste Dosis (15 mg/kg/Tag, das entspricht der 1,4-fachen menschlichen Dosis) erhalten hatten, kam es zu einer verkürzten Überlebensrate.
Es wurden keine Studien bei Schwangeren oder stillenden Frauen durchgeführt.
Daher ist die Möglichkeit in Betracht zu ziehen, dass Flutamid den Fötus schädigen kann, sofern es bei Schwangeren angewendet wird oder dass es in die Muttermilch von stillenden Frauen ausgeschieden wird.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien mit Flutamid zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Es wurde jedoch über mögliche Nebenwirkungen wie Müdigkeit, Schwindel und Verwirrtheit berichtet, die die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen können.
4.8 Nebenwirkungen
Die am häufigsten beobachteten Nebenwirkungen in klinischen Studien bei der Monotherapie mit Flutamid sind Gynäkomastie und/oder Brustschmerzen, manchmal mit Galaktorrhö einhergehend. Diese Nebenwirkungen sind im Allgemeinen reversibel, wenn die Behandlung abgesetzt oder die Dosis reduziert wird.
Initial ist unter einer Monotherapie mit Flutamid ein reversibler Anstieg von Serumtestosteron möglich, außerdem kann es zu Flush sowie zu einer Änderung des Behaarungstypus kommen.
Die am häufigsten beobachteten Nebenwirkungen in klinischen Studien bei der Kombinationstherapie von Flutamid mit LH-RH-Agonisten waren Hitzewallungen, verminderte Libido, Impotenz, Diarrhö, Übelkeit und Erbrechen. Mit Ausnahme der Diarrhö sind dies bekannte Nebenwirkungen bei der Monotherapie mit einem LH-RH-Agonisten mit vergleichbarer Häufigkeit.
Die unter Flutamid-Monotherapie sehr häufig auftretende Gynäkomastie war bei der Kombinationstherapie deutlich reduziert.
In klinischen Studien zeigte sich kein signifikanter Unterschied bei der GynäkomastieHäufigkeit zwischen der Placebo/LH-RH-Agonist-Behandlung und Flutamid/LH-RH-Agonist-Behandlung.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
|
Sehr häufig |
> 1/10 |
|
Häufig |
> 1/100 bis < 1/10 |
|
Gelegentlich |
> 1/1.000 bis < 1/100 |
|
Selten |
> 1/10.000 bis < 1/1.000 |
|
Sehr selten |
< 1/10.000 |
|
Nicht bekannt |
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar |
|
System-Organ-Klasse |
Monotherapie |
Kombinationstherapie mit LH-RH-Analogon |
|
Infektionen und parasitäre Erkrankungen | ||
|
Selten: |
Herpes zoster | |
|
Gutartige, bösartige und unspezifische Neubildungen (einschl Zysten und Polypen) | ||
|
Sehr selten: |
Neoplasien der männlichen Brust* | |
|
Erkrankungen des Blutes und des Lymphsystems | ||
|
Selten: |
Lymphödeme |
Anämie, Leukopenie, Thrombozytopenie |
|
Sehr selten: |
Hämolytische Anämie, megalozytäre Anämie, Methämoglobinämie, Sulfhämoglobinämie | |
|
Erkrankungen des Immunsystems | ||
|
Selten: |
Lupusähnliches Syndrom | |
|
Stoffwechsel- und Ernährungsstörungen | ||
|
Häufig: |
Gesteigerter Appetit | |
|
Selten: |
Anorexie |
Anorexie. |
|
Sehr selten: |
Hyperglykämie, Verschlimmerung eines Diabetes mellitus | |
|
Psychiatrische Erkrankungen | ||
|
Häufig: |
Schlaflosigkeit | |
|
Selten: |
Angst, Depression |
Depression, Angst |
|
Erkrankungen des Nervensystems | ||
|
Selten: |
Schwindel, Kopfschmerzen |
Benommenheit, Konfusion, Nervosität |
|
Augenerkrankungen | ||
|
Selten: |
verschwommenes Sehen | |
|
Herzerkrankungen | ||
|
Nicht bekannt: |
QT-Verlängerung (siehe Abschnitt 4.4 und 4.5) |
QT-Verlängerung (siehe Abschnitt 4.4 und 4.5) |
|
Gefäßerkrankungen | ||
|
Sehr häufig: |
Hitzewallungen | |
|
Selten: |
Hitzewallungen |
Hypertonie |
|
Nicht bekannt: |
Thromboembolien | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | ||
|
Sehr selten: |
Lungensymptome (wie z. B. Dyspnö, interstitielle Lungenerkrankung) | |
|
Erkrankungen des Gastrointestinaltraktes | ||
|
Sehr häufig: |
Diarrhö, Übelkeit, Erbrechen | |
|
Häufig: |
Diarrhö, Übelkeit, Erbrechen | |
|
Selten: |
Unspezifische gastrointestinale Störungen, Sodbrennen, Magenverstimmung, ulkusähnliche Schmerzen, Obstipation |
unspezifische gastrointestinale Störungen |
|
Leber- und Gallenerkrankungen | ||
|
Häufig: |
Hepatitis | |
|
Gelegentlich: |
Hepatitis | |
|
Selten: |
Leberfunktionsstörungen, Ikterus | |
|
Sehr selten: |
Cholestatischer Ikterus, hepatische Enzephalopathie, hepatische Nekrose, Leberschädigung mit letalem Ausgang | |
|
Erkrankungen der Haut und des Unterhautzellgewebes | ||
|
Selten: |
Pruritus, Ekchymosen, |
Ausschlag/Rötung. |
|
Sehr selten: |
Photosensitivitäts-Reaktionen |
Photosensitivitätsreaktionen, Erythema, Ulzera, epidermale Nekrolyse |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | ||
|
Selten: |
neuromuskuläre Symptome | |
|
Erkrankungen der Nieren und Harnwege | ||
|
Selten: |
Urogenitaltrakt-Symptome | |
|
Sehr selten: |
Bernsteinfarbene oder grünlich-gelbe Verfärbung des Urins | |
|
Erkrankungen der Geschlechtsorgane und Brustdrüse | ||
|
Sehr häufig: |
Gynäkomastie und/oder Brustschmerzen, Galaktorrhö |
Verminderte Libido, Impotenz. |
|
Gelegentlich: |
Gynäkomastie | |
|
Selten: |
Verminderte Libido, reduzierte Spermienzahl | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | ||
|
Häufig: |
Müdigkeit | |
|
Selten: |
Ödeme, Schwäche, Unwohlsein, Durst, Schmerzen im Brustkorb |
Ödeme, Irritation der Injektionsstelle |
|
Untersuchungen | ||
|
Häufig: |
Vorübergehende abnorme Leberfunktion | |
|
Selten: |
erhöhte Blut-Harnstoffwerte, erhöhte Serumkreatininwerte | |
*Sekundäre Malignome:
In wenigen Fällen wurden unter der Behandlung mit Flutamid Tumoren (Neoplasien) der männlichen Brust beobachtet. Bei einem der Fälle, einem Patient mit benigner Prostatahyperplasie, verschlimmerte sich ein Brustknoten, der bereits 3 bis 4 Monate vor Beginn der Flutamid-Monotherapie festgestellt worden war. Nach operativer Entfernung wurde dieser als geringgradig differenziertes, duktales Karzinom diagnostiziert. Bei dem anderen Fall handelte es sich um einen Patienten mit fortgeschrittenem Prostatakarzinom, bei dem eine Gynäkomastie und ein Knoten 2 bzw. 6 Monate nach Beginn einer FlutamidMonotherapie beobachtet wurde. 9 Monate nach Therapiebeginn wurde der Knoten entfernt und als mäßig differenzierter, invasiver, duktaler Tumor Grad T4N0M0, G3 diagnostiziert.
Selten treten kardiovaskuläre Störungen auf, im Vergleich mit Diethylstilbestrol jedoch mit signifikant geringerer Wahrscheinlichkeit.
Zusätzlich wurde über Kopfhaarverlust und Muskelkrämpfe berichtet.
Kleinknotige Veränderungen des Brustdrüsenkörpers können gelegentlich auftreten.
Nach der Markteinführung wurden Fälle von akutem Nierenversagen, interstitieller Nephritis und myokardialer Ischämie mit unbekannter Häufigkeit beobachtet.
In der Regel erforderte die Intensität dieser Nebenwirkungen keine Dosisreduktion und kein Absetzen der Therapie.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
In tierexperimentellen Studien zu Flutamid allein, wurden als Zeichen einer Überdosierung Hypoaktivität, Piloerektion, langsame Atmung, Ataxie und/oder Tränenbildung, Anorexie, Beruhigung, Emesis und Methämoglobinämie beobachtet.
In klinischen Studien wurde Flutamid in Dosen bis zu 1.500 mg/Tag über einen Zeitraum bis zu 36 Wochen gegeben, ohne dass schwerwiegende Nebenwirkungen beobachtet wurden. Die Nebenwirkungen, über die berichtet wurde, umfassten Gynäkomastie, Spannungsgefühl in der Brust und einen Anstieg der SGOT.
Die Einzeldosis von Flutamid, die gewöhnlich mit Symptomen einer Überdosierung verbunden ist oder als lebensbedrohlich eingestuft wird, wurde nicht bestimmt.
Da Flutamid in hohem Maße an Proteine gebunden ist, dürfte eine Dialyse zur Behandlung einer Überdosierung unnütz sein. Wie bei der Handhabung von Überdosierungen bei jedem Medikament ist zu berücksichtigen, dass mehrere Wirkstoffe eingenommen worden sein könnten. Es sind allgemeine supportive Maßnahmen, einschließlich einer häufigen Kontrolle der Vitalzeichen und einer engmaschigen Überwachung des Patienten indiziert. Eine Magenspülung kann in Betracht gezogen werden.
Da Flutamid eine Anilidverbindung ist, besteht theoretisch die Möglichkeit, dass es eine Methämoglobinämie hervorruft. Daher könnte ein Patient mit akuter Vergiftung zyanotisch sein.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antineoplastische und immunmodulierende Mittel, Endokrine Therapie, Hormonantagonisten und verwandte Mittel, Antiandrogene, Flutamid
ATC-Code: L02BB01
Flutamid ist ein Anilidderivat, ein nichtsteroidales Antiandrogen. Bei tierexperimentellen Untersuchungen zeigte Flutamid starke antiandrogene Wirkungen. Grundlage dieser antiandrogenen Wirkung ist eine Inhibition der Androgenaufnahme und/oder der nukleären Bindung in den Zielorganen. Wenn Flutamid in Kombination mit einer operativen oder medikamentösen Kastration verabreicht wird, erreicht man eine Suppression der testikulären und adrenalen Androgenaktivität.
5.2 Pharmakokinetische Eigenschaften
Flutamid wird nach peroraler Aufnahme gut resorbiert. Entsprechende Untersuchungen mit radioaktiv markiertem Flutamid zeigten, dass der Wirkstoff rasch und ausgiebig in seine Metaboliten umgewandelt wird, die bis zu 8 Stunden nach der Verabreichung im Plasma nachweisbar sind. Innerhalb der ersten 2 Tage werden etwa 46 % der verabreichten Dosis über den Urin und 2 % über den Stuhl ausgeschieden. Der radioaktive Marker wird durch Metabolisierung entfernt, so dass es aufgrund einer Retention des Markers in Form tritiierten Wassers anscheinend zu einer Verlangsamung der Ausscheidung kommt. Demnach sind die Vorgänge der Ausscheidung und Metabolisierung innerhalb von 2 Tagen im Wesentlichen abgeschlossen.
5.3 Präklinische Daten zur Sicherheit
In Toxizitätsstudien nach wiederholter oraler Gabe von Flutamid an Ratte, Hund oder Affe wurden Wirkungen beobachtet, die für starke antiandrogene Substanzen charakteristisch sind.
Bei sämtlichen Spezies wurden, bedingt durch die antiandrogene Aktivität, eine Größenabnahme der Prostata und der Samenanlage sowie eine Größenabnahme der Hoden und eine herabgesetzte Spermatogenese beobachtet.
Flutamid zeigte in In-vivo- und In-vitro-Untersuchungen keine mutagenen Wirkungen. In einer Kanzerogenitätsstudie an Ratten wurde bei höheren Dosierungen eine dosisabhängige Zunahme von Brustadenomen und -karzinomen festgestellt.
Der Einfluss von Flutamid auf die Fertilität und Entwicklung der Nachkommen wurde an der Ratte untersucht. Darüber hinaus wurden Studien zur Teratogenität am Kaninchen durchgeführt. Die Effekte, die in diesen Studien auftraten (Infertilität, Feminisierung männlicher Nachkommen) sind durch die antiandrogene Wirkung von Flutamid bedingt. Diese Wirkungen sind für die klinische Anwendung von Flutamid zur Therapie des Prostatakarzinoms nicht relevant.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumdodecylsulfat, Magnesiumstearat, Lactose, Maisstärke, Mikrokristalline Cellulose, Siliciumdioxid.
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
21 Tabletten 84 Tabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
AbZ-Pharma GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMER(N)
25971.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 23. Mai 1995
Datum der letzten Verlängerung der Zulassung: 2. November 2009
10. STAND DER INFORMATION
November 2014
11. VERKAUFSABGRENZUNG Verschreibungspflichtig
Zusätzliche Angaben der Firma CT Arzneimittel GmbH zur Bioverfügbarkeit von Flutamid-CT 250 mg Tabletten
Eine für Flutamid-CT 250 mg 1992/93 durchgeführte Bioverfügbarkeitsuntersuchung an 20 Probanden ergab im Vergleich zum Referenzpräparat:
Pharmakokinetische Parameter von Hydroxyflutamid nach Einmalgabe von 1 Tablette Test-bzw. Referenzpräparat (entsprechend jeweils 250 mg Flutamid):
|
Testpräparat (MW ± SD) |
Referenzpräparat (MW ± SD) | |
|
Cmax [ng/ml] |
772,74 ± 231,75 |
779,84 ± 258,88 |
|
tmax [h] |
2,21 ± 0,54 |
2,17 ± 0,57 |
|
AUCo-tlast[h x ng/ml] |
5754,55 ±1912,78 |
5746,65 ±1969,86 |
Cmax maximale Plasmakonzentration
tmax Zeitpunkt der maximalen Plasmakonzentration
AUC0-tlast Fläche unter der Konzentrations-Zeit-Kurve MW Mittelwert
SD Standardabweichung
Plasmakonzentration [ng/ml]
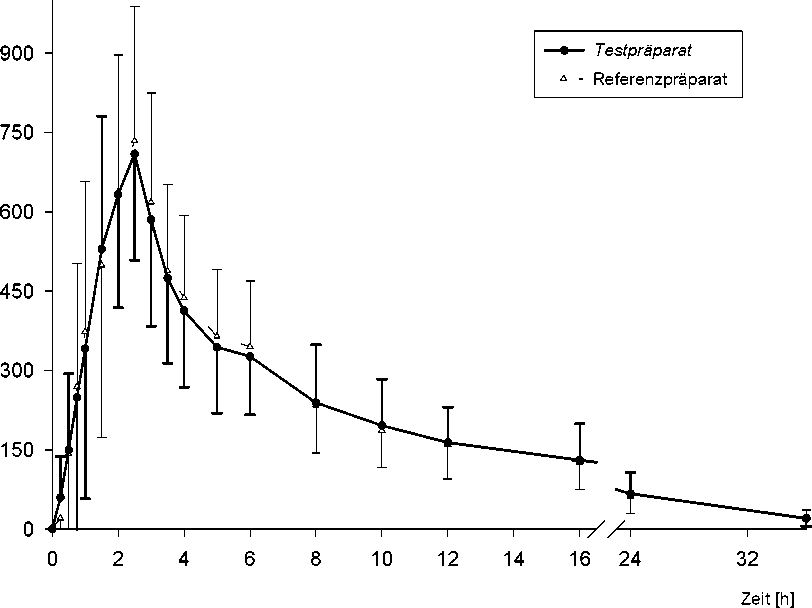
Abb.: Mittelwerte und Standardabweichungen der Plasmakonzentration von Hydroxyflutamid nach Einmalgabe von 1 Tablette Test- bzw. Referenzpräparat.
Bioverfügbarkeit/Bioäquivalenzentscheid
Die mittlere relative Bioverfügbarkeit von Flutamid-CT 250 mg im Vergleich zum Referenzpräparat beträgt 101,9 % (berechnet aus den geometrischen Mittelwerten).
Die statistische Bewertung der pharmakokinetischen Zielgrößen AUC0-tlast und Cmax dieser Studie beweist Bioäquivalenz zum Referenzpräparat.
11