Fulvestrant 1 A Pharma 250 Mg Injektionslösung In Einer Fertigspritze
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
Gebrauchsinformation: Information für Patienten
Fulvestrant - 1 A Pharma 250 mg Injektionslösung in einer Fertigspritze
Fulvestrant
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Fulvestrant - 1 A Pharma und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Fulvestrant - 1 A Pharma beachten?
3. Wie ist Fulvestrant - 1 A Pharma anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Fulvestrant - 1 A Pharma aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Fulvestrant - 1 A Pharma und wofür wird es angewendet?
Fulvestrant - 1 A Pharma enthält den Wirkstoff Fulvestrant, der zu der Gruppe der Östrogen-Blocker gehört. Östrogene gehören zu den weiblichen Geschlechtshormonen und können in bestimmten Fällen am Wachstum von Brustkrebs beteiligt sein.
Fulvestrant - 1 A Pharma wird zur Behandlung von fortgeschrittenem oder metastasiertem Brustkrebs bei Frauen nach der Menopause angewendet.
2. Was sollten Sie vor der Anwendung von Fulvestrant - 1 A Pharma beachten?
Fulvestrant - 1 A Pharma darf nicht angewendet werden,
• wenn Sie allergisch gegen Fulvestrant oder einen der in Abschnitt 6 genannten sonstigen Bestandteile dieses Arzneimittels sind,
• wenn Sie schwanger sind oder stillen,
• wenn Sie schwerwiegende Leberprobleme haben.
Warnhinweise und Vorsichtsmaßnahmen
Informieren Sie Ihren Arzt, wenn einer der folgenden Punkte auf Sie zutrifft:
• Nieren- oder Leberprobleme
• niedrige Anzahl an Blutplättchen (diese helfen bei der Blutgerinnung) oder Blutungsstörungen
• frühere Schwierigkeiten mit Blutgerinnseln
• Osteoporose (Abnahme der Knochendichte)
• Alkoholismus
Kinder und Jugendliche
Fulvestrant - 1 A Pharma ist nicht angezeigt für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren.
Auswirkungen bei Fehlgebrauch zu Dopingzwecken
Die Anwendung von Fulvestrant - 1 A Pharma kann bei Dopingkontrollen zu positiven Ergebnissen führen. Eine missbräuchliche Anwendung des Arzneimittels Fulvestrant - 1 A Pharma zu Dopingzwecken kann zu einer Gefährdung Ihrer Gesundheit führen.
Anwendung von Fulvestrant - 1 A Pharma zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt, Apotheker oder das medizinische Fachpersonal, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben, oder beabsichtigen, andere Arzneimittel einzunehmen/anzuwenden.
Teilen Sie Ihrem Arzt vor allem mit, wenn Sie Antikoagulanzien einnehmen (Arzneimittel, die die Bildung von Blutgerinnseln verhindern).
Schwangerschaft und Stillzeit
Sie dürfen Fulvestrant - 1 A Pharma nicht anwenden, wenn Sie schwanger sind. Wenn Sie schwanger werden könnten, sollten Sie während der Behandlung mit Fulvestrant - 1 A Pharma eine wirksame Verhütungsmethode anwenden.
Sie dürfen nicht stillen, während Sie mit Fulvestrant - 1 A Pharma behandelt werden.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es ist nicht zu erwarten, dass Fulvestrant - 1 A Pharma Ihre Verkehrstüchtigkeit oder Ihre Fähigkeit zum Bedienen von Maschinen beeinträchtigt. Wenn Sie sich nach einer Behandlung mit Fulvestrant - 1 A Pharma jedoch müde fühlen, dürfen Sie sich nicht an das Steuer eines Fahrzeugs setzen oder eine Maschine bedienen.
Fulvestrant - 1 A Pharma enthält Ethanol (Alkohol), Benzylalkohol und Benzylbenzoat
Fulvestrant - 1 A Pharma enthält 10 % Gewicht/Volumen (w/v) Ethanol (Alkohol), das sind bis zu 1.000 mg pro Dosis, entsprechend 20 ml Bier oder 8 ml Wein pro Dosis.
Ein gesundheitliches Risiko besteht u. a. bei Leberkranken, Alkoholkranken., Epileptikern, Patienten mit organischen Erkrankungen des Gehirns, Schwangeren, Stillenden und Kindern.
Fulvestrant - 1 A Pharma enthält 100 mg Benyzylalkohol pro ml. Darf nicht bei Frühgeborenen oder Neugeborenen angewendet werden. Benzylalkohol kann bei Säuglingen und Kindern bis zu 3 Jahren toxische und allergische Reaktionen hervorrufen.
Fulvestrant - 1 A Pharma enthält 150 mg Benzylbenzoat pro ml. Bei Neugeborenen besteht wegen des Gehalts an Benzylbenzoat ein erhöhtes Risiko für das Auftreten von Gelbsucht.
3. Wie ist Fulvestrant - 1 A Pharma anzuwenden?
Die Dosierung wird von Ihrem Arzt individuell für Sie festgelegt.
Die empfohlene Dosis beträgt 500 mg Fulvestrant (zwei 250 mg Injektionen) 1-mal monatlich, wobei 2 Wochen nach der ersten Dosis eine zusätzliche 500 mg Dosis gegeben wird.
Ihr Arzt oder das medizinische Fachpersonal wird Ihnen Fulvestrant - 1 A Pharma langsam als intramuskuläre Injektion in Ihr Gesäß verabreichen, eine Injektion in jede Gesäßhälfte.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Sollten Sie eine der folgenden Nebenwirkungen bemerken, kann es sein, dass Sie umgehend eine medizinische Behandlung benötigen:
• allergische (Überempfindlichkeits-) Reaktionen, darunter Schwellungen von Gesicht, Lippen, Zunge und/oder Rachen
• Thromboembolien (erhöhtes Risiko für Blutgerinnsel)1
• Entzündung der Leber (Hepatitis)
• Leberversagen
Informieren Sie Ihren Arzt, Apotheker oder das medizinische Fachpersonal, wenn Sie eine der folgenden Nebenwirkungen bemerken:
Sehr häufige Nebenwirkungen (kann mehr als 1 von 10 Behandelten betreffen)
• Reaktionen an der Injektionsstelle, wie z. B. Schmerzen und/oder Entzündung
• unnormale Leberenzymwerte (im Bluttest)1
• Übelkeit (Gefühl, krank zu sein)
• Schwäche, Müdigkeit1
Häufige Nebenwirkungen (kann bis zu 1 von 10 Behandelten betreffen)
• Kopfschmerzen
• Hitzewallungen
• Erbrechen, Durchfall oder Appetitlosigkeit1
• Hautausschlag
• Infektionen des Harntrakts
• Rückenschmerzen1
• erhöhtes Bilirubin (Gallenfarbstoff, der von der Leber produziert wird)1
• Thromboembolien (erhöhtes Risiko für Blutgerinnsel)1
• allergische Reaktionen (Überempfindlichkeitsreaktionen), darunter Schwellungen von Gesicht, Lippen, Zunge und/oder Rachen
Gelegentliche Nebenwirkungen (kann bis zu 1 von 100 Behandelten betreffen)
• verminderte Anzahl an Blutplättchen (Thrombozytopenie)
• vaginale Blutungen, dicker, weißlicher Ausfluss und Candidose (Pilzinfektion)
• blaue Flecken und Bluten an der Injektionsstelle
• erhöhtes Gamma-GT, ein in einem Bluttest nachgewiesenes Leberenzym
• Entzündung der Leber (Hepatitis)
• Leberversagen
wegen der Grunderkrankung nicht bewertet werden kann.
Selten können Überempfindlichkeitsreaktionen durch Benzylalkohol auftreten. Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Fulvestrant - 1 A Pharma aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Im Kühlschrank lagern (2°C - 8°C).
Die Fertigspritze in der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem Umkarton nach „verwendbar bis“ angegebenen Verfallsdatum nicht mehr verwenden. Das Verfallsdatum bezieht sich auf den letzten Tag des angegebenen Monats.
Sie dürfen dieses Arzneimittel nicht verwenden, wenn Sie bemerken, dass die Spritze oder deren Inhalt in irgendeiner Weise beeinträchtigt ist, wie z. B. Beschädigung der Spritze, trübe Lösung, Schwebeteilchen in der Lösung oder Änderung der Farbe der Lösung.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was Fulvestrant - 1 A Pharma enthält
• Der Wirkstoff ist Fulvestrant.
Jede Fertigspritze enthält 250 mg Fulvestrant in 5 ml Lösung (50 mg/ml).
• Der Wirkstoff ist Fulvestrant.
Jede Fertigspritze enthält 250 mg Fulvestrant in 5 ml Lösung (50 mg/ml).
• Die sonstigen Bestandteile sind: Ethanol 96 %, Benzylalkohol, Benzylbenzoat, natives Rizinusöl
Enthält 100 mg Benzylalkohol pro Milliliter.
Wie Fulvestrant - 1 A Pharma aussieht und Inhalt der Packung
Fulvestrant - 1 A Pharma ist eine klare, farblose bis gelbe, viskose Injektionslösung in einer Fertigspritze.
Fulvestrant - 1 A Pharma ist in Packungen mit 1 oder 2 Fertigspritze/n zur Einmalanwendung erhältlich. Außerdem sind sterile Injektionsnadeln mit Sicherheitssystem (Sicherheitsinjektionsnadeln) beigefügt.
Pharmazeutischer Unternehmer
1 A Pharma GmbH Keltenring 1 + 3 82041 Oberhaching Telefon: 089/6138825-0 Telefax: 089/6138825-65 E-Mail: medwiss@1apharma.com
Hersteller
EBEWE Pharma Ges.m.b.H. Nfg. KG Mondseestraße 11 4866 Unterach Österreich
|
Lek Pharmaceuticals d.d. | |
|
Verovskova 57 1526 Ljubljana Slowenien | |
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Belgien: Fulvestrand Sandoz 250 mg oplossing voor injectie, voorgevulde spuit
Bulgarien: OynBecrpaHT CaHgo3 250 mg/5 ml HH^e^HOHeH pa3TBop b
npegBapmenHO HantnHeHa cnpnH^BKa Deutschland: Fulvestrant - 1 A Pharma 250 mg Injektionslösung in einer
Fertigspritze
Dänemark: Fulvestrant Sandoz
Estland: Fulvestrant Sandoz
Finnland: Fulvestrant Sandoz 250 mg injektioneste, liuos esitäytetyssä ruiskussa
Frankreich: FULVESTRANT SANDOZ 250 mg, solution injectable en seringue
preremplie
Irland: Fulvestrant Rowex 250 mg/5 ml solution for injection in pre-filled
syringe
Island: Fulvestrant Sandoz 250 mg stungulyf, lausn i afylltri sprautu
Italien: Fulvestrant Sandoz
Kroatien: Fulvestrant Sandoz 250 mg otopina za injekciju u napunjenoj strcaljki
Litauen: Fulvestrant Sandoz 50 mg/ml injekcinis tirpalas uzpildytame svirkste
Luxemburg: Fulvestrant Sandoz 250 mg solution injectable, seringue preremplie
Niederlande : Fulvestrant Sandoz 50 mg/ml, oplossing voor injectie in voorgevulde
injectiespuit
Norwegen: Fulvestrant Sandoz 250 mg injeksjonsv^ske, opplosning i ferdigfylt
sprayte
Österreich: Fulvestrant Sandoz 50mg/ml - Infusionslösung in einer Fertigspritze
Polen : Fulvestrant Sandoz
Portugal: Fulvestrant Sandoz
Rumänien : FULVESTRANT SANDOZ 50 mg/ml solupe injectabilä in seringä
preumplutä
Schweden : Fulvestrant Sandoz 250 mg injektionsvätska, lösning i förfylld spruta
Slowakei : Fulvestrant Sandoz 250 mg
Slowenien : Fulvestrant Lek 250 mg raztopina za injiciranje v napolnjeni
injekcijski brizgi
Spanien: Afultrant 250 mg solucion inyectable en jeringa precargada EFG
Fulvestrant Sandoz 250 mg
Tschechische
Republik:
Ungarn:
Vereinigtes
Königreich:
Fulvestrant Sandoz 250 mg oldatos injekcio elöretöltött fecskendöben Fulvestrant 250 mg, Solution for Injection in pre-filled syringe
Diese Packungsbeilage wurde zuletzt überarbeitet im Januar 2016.
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt: Anwendungshinweise
Warnhinweis - Die Sicherheitsinjektionsnadel darf vor der Anwendung nicht autoklaviert werden. Die Hände müssen während der Anwendung und Entsorgung immer hinter der Nadel bleiben.
Die Fertigspritzen werden mit einer BD SafetyGlide® oder Terumo SurGuard® Sicherheitsinjektionsnadel geliefert.
Anwendungshinweise für die BD SafetyGlide® Sicherheitsinjektionsnadel Bei jeder der beiden Spritzen:
• Entnehmen Sie die Spritze und die Sicherheitsinjektionsnadel vorsichtig aus der Packung.
• Entfernen Sie die Schutzkappe von der Spitze des Spritzenzylinders.
• Öffnen Sie die äußere Verpackung der Sicherheitsinjektionsnadel (BD Safety Glide®). Verbinden Sie die Injektionsnadel mit dem Luer-Lock-Anschluss.
• Schrauben Sie die Injektionsnadel auf das Luer-Lock-Verbindungsstück. Schrauben Sie so lange, bis beide Teile fest miteinander verbunden sind.
• Ziehen Sie die Schutzabdeckung gerade von der Spritze ab, um eine Beschädigung der Nadelspitze zu vermeiden.
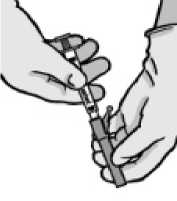
• Entfernen Sie die Injektionsnadelhülle.
• Halten Sie die Spritze mit der Nadel nach oben und drücken Sie den Kolben behutsam bis sich das Arzneimittel oben in der Spritze befindet. Es sollte keine Luft mehr im Spritzenzylinder sein.
• Verabreichen Sie die Injektion langsam intramuskulär (1-2 Minuten/Injektion) in das Gesäß. Damit das Produkt möglichst anwenderfreundlich ist, liegt die Nadelöffnung oben, wenn der Hebelarm ebenfalls oben ist.
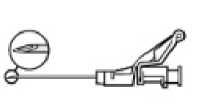
• Nach Beendigung der Injektion geben Sie dem aktivierungsgesteuerten Hebelarm sofort mit einem Finger einen Stoß, um den Sicherheitsmechanismus zu aktivieren.
HINWEIS: Halten Sie die Spritze beim Aktivieren von sich selbst und von anderen weg. Achten Sie auf den „Klick“ und überzeugen Sie sich visuell davon, dass die Nadelspitze vollständig bedeckt ist.
Anwendungshinweise für die Terumo SurGuard® Sicherheitsinjektionsnadel
Bei jeder der beiden Spritzen:
• Entnehmen Sie die Spritze und die Sicherheitsinjektionsnadel vorsichtig aus der Packung.
• Entfernen Sie die Schutzkappe von der Spitze des Spritzenzylinders.
• Befestigen Sie die Spritze unter Verwendung einer aseptischen Arbeitsweise an der Sicherheitsinjektionsnadel. Greifen Sie dazu die Nadel an der Basis, nicht an der Schutzhülle, und drehen Sie die Spritze im Uhrzeigersinn fest.
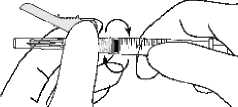
• Ziehen Sie den Nadelschutz von der Nadel weg in Richtung Spritzenzylinder bis zu dem gezeigten Winkel. Entfernen Sie dann die Injektionsnadelhülle.
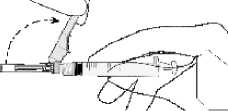
• Halten Sie die Spritze mit der Nadel nach oben und drücken Sie den Kolben behutsam bis sich das Arzneimittel oben in der Spritze befindet. Es sollte keine Luft mehr im Spritzenzylinder sein.
• Verabreichen Sie die Injektion langsam intramuskulär (1-2 Minuten/Injektion) in das Gesäß.
• Nach Beendigung der Injektion ziehen Sie die Nadel aus der Haut und aktivieren Sie den Schutzmechanismus einhändig durch eine der folgenden 3 Methoden:
- Aktivierung mit dem Zeigefinger
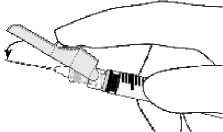
- Aktivierung mit dem Daumen
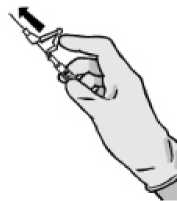
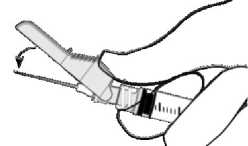
- Aktivierung auf einer Oberfläche
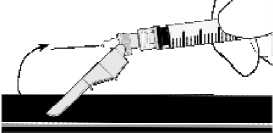
Die Aktivierung wird durch einen hörbaren und/oder spürbaren „Klick” bestätigt und kann visuell überprüft werden. Falls Sie sich nicht sicher sind, dass der Nadelschutz vollständig aktiviert ist, wiederholen Sie diesen Schritt.
Entsorgung
Die Fertigspritzen sind ausschließlich zur einmaligen Anwendung vorgesehen.
Nicht verwendetes Arzneimittel oder Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen.
Schließt Nebenwirkungen ein, bei denen die genaue Rolle von Fulvestrant - 1 A Pharma