Glucosteril 40%
FACHINFORMATION/ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Glucosteril® 40 %, Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 100 ml Injektionslösung enthalten:
Glucose-Monohydrat (Ph. Eur.) 44,0 g ^ wasserfreie Glucose 40,0 g
Gesamtenergie pH-Wert Titrationsacidität theor. Osmolarität
6720 kJ/l * 1600 kcal/l
3,0 - 4,5
0,5 - 2,0 mmol NaOH/l 2220 mosm/l
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung Klare, farblose Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Glucosezufuhr zur Energiebereitstellung; hochkalorische Kalorienzufuhr bei Indikationen zur Flüssigkeitsrestriktion; hypoglykämische Zustände, Kohlenhydratkomponente in der parenteralen Ernährung.
Glucosteril 40 % wird angewendet bei Erwachsenen, Neugeborenen, Kleinkindern und Kindern.
4.2 Dosierung und Art der Anwendung Dosierung
Erwachsene
Je nach Bedarf und Anweisung des Arztes, jedoch nicht mehr als 0,625 ml/kg KG und Stunde ^ 0,25 g Glucose/kg KG und Stunde.
Kinder und Jugendliche
Die maximale Tagesdosis für Glucosteril 40 % beträgt:
Frühgeborene: bis zu 18 g/kg Körpergewicht und Tag
^ bis zu 45 ml/kg Körpergewicht und Tag
Neugeborene: bis zu 15 g/kg Körpergewicht und Tag
^ bis zu 37,5 ml/kg Körpergewicht und Tag
1. - 2. Lebensjahr:
3. - 5. Lebensjahr:
6. -10. Lebensjahr:
bis zu 15 g/kg Körpergewicht und Tag ^ bis zu 37,5 ml/kg Körpergewicht und Tag
bis zu 12 g/kg Körpergewicht und Tag ^ bis zu 30 ml/kg Körpergewicht und Tag
bis zu 10 g/kg Körpergewicht und Tag ^ bis zu 25 ml/kg Körpergewicht und Tag
10. -14. Lebensjahr: bis zu 8 g/kg Körpergewicht und Tag
^ bis zu 20 ml/kg Körpergewicht und Tag
Unter veränderten Stoffwechselbedingungen (z. B. Postaggressionsstoffwechsel, hypoxische Zustände, Organinsuffizienz) kann die oxidative Verstoffwechselung eingeschränkt sein. In diesen Fällen ist die Zufuhr zu begrenzen.
Die allgemeinen Grundsätze für die Anwendung und Dosierung von Kohlenhydraten sowie die Richtlinien zur Flüssigkeitszufuhr sind zu beachten.
Unter normalen Stoffwechselbedingungen ist die Gesamtzufuhr von Kohlenhydraten auf 300 - 400 g /Tag zu beschränken. Die Limitierung ergibt sich aus der Ausschöpfung der möglichen Oxidationsrate. Bei Überschreiten dieser Dosis treten unerwünschte Wirkungen, z. B. eine Leberverfettung, auf. Unter eingeschränkten Stoffwechselbedingungen, z. B. im Postaggressionsstoffwechsel, bei hypoxischen Zuständen oder Organinsuffizienz, kann die oxidative Verstoffwechselung von Glucose eingeschränkt sein, die mit Hyperglykämie und Insulinresistenz einhergeht und mit erhöhter Morbidität verbunden sein kann. Daher ist die Tagesdosis auf 200 - 300 g (entsprechend 2 - 4 g/kg KG) zu reduzieren; die individuelle Adaption der Dosierung erfordert ein adäquates Monitoring.
Für Glucose sind bei Erwachsenen folgende Dosierungsbeschränkungen strikt einzuhalten: 0,25 g/kg KG und Stunde und bis zu 6,0 g/kg KG und Tag.
Bei Verabreichung von Kohlenhydratlösungen, gleich welcher Konzentration, müssen regelmäßige Blutzuckerkontrollen durchgeführt werden.
Wissenschaftliche Studien haben ergeben, dass bei Intensivpatienten die Mortalität mit dem Blutzuckerspiegel korreliert. Der Blutzuckerspiegel sollte möglichst 120 mg/dl (6,7 mmol/l) nicht übersteigen.
Zur Vermeidung von Überdosierungen, insbesondere bei Einsatz höherkonzentrierter Lösungen, ist die Zufuhr über Infusionspumpen zu empfehlen.
Art der Anwendung Intravenöse Anwendung
Glucoselösungen stellen im Rahmen einer parenteralen Ernährung nur einen Baustein dar. Für die vollständige parenterale Ernährung ist die gleichzeitige Substitution von Aminosäuren, Fetten, Elektrolyten, Vitaminen und Spurenelementen erforderlich.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Hyperglykämie, Hypokaliämie, Azidose.
Aus der mit der Glucoseapplikation verbundenen Flüssigkeitszufuhr können weitere Gegenanzeigen resultieren. Hierzu zählen Hyperhydratationszustände und hypotone Dehydratation.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vorsicht ist geboten bei erhöhter Serumosmolarität, insbesondere bei Verwendung hochkonzentrierter Lösungen und zügiger Infusionsgeschwindigkeit.
Eine Glucoseintoleranz (Diabetes mellitus, Postaggressionsstoffwechsel) kann unter Glucoseinfusion zu Hyperglykämien bis hin zum hyperosmolaren Koma führen, das eine hohe Letalität aufweist. Je älter der Patient ist und je schwerer die Erkrankung bzw. ein Trauma sind, desto häufiger kommt es im Rahmen des Postaggressionsstoffwechsels zu einer Glucoseintoleranz, besonders dann, wenn zusätzlich ein bis dahin nicht erkannter Diabetes mellitus vorliegt. Bei bereits bekanntem Diabetes mellitus ist darüber hinaus eine sorgfältige Abstimmung mit der meist erforderlichen Insulintherapie vorzunehmen. Der Einsatz einer Insulintherapie, insbesondere während des Postaggressionsstoffwechsels, beinhaltet die Gefahr schwerwiegender Hypoglykämien, da wegen der bestehenden Regulationsstörung häufig schnell wechselnde Blutglucosekonzentrationen auftreten können. Eine engmaschige Kontrolle der Blutglucosekonzentration ist daher erforderlich.
Bei starkem Anstieg der Blutglucose sollte die Infusion unterbrochen und Blutzuckerspitzen evtl. mit Insulin therapiert werden.
Kontrollen des Flüssigkeits-, Elektrolyt- und Säure-Basen-Status sind erforderlich.
Glucosehaltige Lösungen dürfen nicht im selben System wie Blutkonserven verabreicht werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Glucoselösungen dürfen nicht im selben System wie Blutkonserven verabreicht werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Glucoselösungen werden während der Schwangerschaft häufig für die Kalorienzufuhr sowie als Trägersubstanz für andere Arzneimittel (insbesondere für Oxytocin) verwendet. Es gibt keine Anzeichen dafür, dass es durch die Anwendung von Glucose-Injektionslösungen während Schwangerschaft, Wehen oder Stillzeit zu schädlichen Wirkungen auf das Kind kommt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Glucosteril 40 % hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei bestimmungsgemäßem Gebrauch sind keine Nebenwirkungen bekannt.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts von Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit.
Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website www.bfarm.de anzuzeigen.
4.9 Überdosierung
Überdosierung kann zu Hyperglykämie, Glucosurie, Hyperosmolarität, hyperglykämischem, hyperosmolarem Koma, Überwässerung und Elektrolytstörungen führen. Die genannten Störungen können durch Reduktion der Glucosezufuhr, Insulingabe und Elektrolytzufuhr behandelt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lösungen zur parenteralen Ernährung, Kohlenhydrate,
ATC-Code: B05BA03
Glucose wird als natürliches Substrat der Zellen im Organismus ubiquitär verstoffwechselt. Glucose ist unter physiologischen Bedingungen das wichtigste energieliefernde Kohlenhydrat mit einem Brennwert von ca. 16,8 kJ bzw. 4 kcal/g.
Unter anderem sind Nervengewebe, Erythrozyten und Nierenmark obligat auf die Zufuhr von Glucose angewiesen. Der Normalwert der Glucosekonzentration im Blut wird mit 50 - 95 mg/100 ml bzw. 2,8 -5,3 mmol/l angegeben (nüchtern).
Glucose dient einerseits dem Aufbau von Glykogen als Speicherform für Kohlenhydrate und unterliegt andererseits dem glykolytischen Abbau von Pyruvat bzw. Lactat zur Energiegewinnung in den Zellen. Glucose dient außerdem der Aufrechterhaltung des Blutzuckerspiegels und der Biosynthese wichtiger Körperbestandteile. An der hormonellen Regulation des Blutzuckerspiegels sind im wesentlichen Insulin, Glukagon, Glukokortikoide und Katecholamine beteiligt.
Bei der Infusion verteilt sich Glucose zunächst im intravasalen Raum, um dann in den Intrazellulärraum aufgenommen zu werden.
5.2 Pharmakokinetische Eigenschaften
Glucose wird in der Glykolyse zu Pyruvat bzw. Lactat metabolisiert. Unter aeroben Bedingungen wird Pyruvat vollständig zu Kohlendioxid und Wasser oxidiert. Die Endprodukte der vollständigen Oxidation von Glucose werden über die Lunge (Kohlendioxid) und die Nieren (Wasser) eliminiert.
Beim Gesunden wird Glucose praktisch nicht renal eliminiert. In pathologischen Stoffwechselsituationen (z. B. Diabetes mellitus, Postaggressionsstoffwechsel), die mit Hyperglykämien (Glucosekonzentrationen im Blut über 120 mg/100 ml bzw. 6,7 mmol/l) einhergehen, wird bei Überschreiten der maximalen tubulären Transportkapazität (180 mg/100 ml bzw. 10 mmol/l) Glucose auch über die Nieren ausgeschieden (Glucosurie).
Voraussetzung für eine optimale Utilisation von zugeführter Glucose ist ein normaler Elektrolyt- und Säure-Basen-Status. So kann insbesondere eine Azidose eine Einschränkung der oxidativen Verwertung anzeigen.
Es bestehen enge Wechselbeziehungen zwischen den Elektrolyten und dem Kohlenhydratstoffwechsel, davon ist besonders Kalium betroffen. Eine verstärkte Glucoseverwertung geht mit einem erhöhten Kaliumbedarf einher. Bei Nichtbeachtung dieses Zusammenhanges können erhebliche Störungen im Kaliumstoffwechsel entstehen, die u. a. zu massiven Herzrhythmusstörungen Anlass geben können.
Unter pathologischen Stoffwechselbedingungen können Glucoseverwertungsstörungen (Glucoseintoleranzen) auftreten. Dazu zählen in erster Linie der Diabetes mellitus sowie die bei sog. Stressstoffwechselzuständen (z. B. intra- und postoperativ, schwere Erkrankungen, Verletzungen) hormonell induzierte Herabsetzung der Glucosetoleranz, die auch ohne exogene Substratzufuhr zu Hyperglykämien führen können. Hyperglykämien können - je nach Ausprägung - zu osmotisch bedingten Flüssigkeitsverlusten über die Niere mit konsekutiver hypertoner Dehydratation, hyperosmolaren Störungen bis hin zum hyperosmolaren Koma führen.
Eine übermäßige Glucosezufuhr, insbesondere im Rahmen eines Postaggressionssyndroms, kann zu einer deutlichen Verstärkung der Glucoseutilisationsstörung führen und, bedingt durch die Einschränkung der oxidativen Glucoseverwertung, zur vermehrten Umwandlung von Glucose in Fett beitragen. Dies wiederum kann u. a. mit einer gesteigerten Kohlendioxidbelastung des Organismus (Probleme bei der Entwöhnung vom Respirator) sowie vermehrter Fettinfiltration der Gewebe - insbesondere der Leber -verbunden sein.
Besonders gefährdet durch Störungen der Glucosehomöostase sind Patienten mit Schädel-HirnVerletzungen und Hirnödem. Hier können bereits geringfügige Störungen der Blutglucosekonzentration und dem damit verbundenen Anstieg der Plasma (Serum)osmolarität zu einer erheblichen Verstärkung der zerebralen Schäden beitragen.
5.3 Präklinische Daten zur Sicherheit
Die Sicherheit von Glucose bei Tieren ist irrelevant, da diese Substanz ein normaler Bestandteil des tierischen und menschlichen Plasmas ist.
Die Sicherheit des Arzneimittelzusatzes muss hiervon getrennt betrachtet werden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Wasser für Injektionszwecke Salzsäure 25 % (zur pH-Wert-Einstellung)
Natriumhydroxid (zur pH-Wert-Einstellung)
6.2 Inkompatibilitäten
Da Glucoselösungen einen sauren pH-Wert aufweisen, können beim Mischen mit anderen Arzneimitteln Inkompatibilitäten auftreten.
Das Arzneimittel darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Haltbarkeit des Produktes in der Originalpackung 2 Jahre
Haltbarkeit nach Anbruch des Arzneimittels
Die Ampullen sind zur einmaligen Verwendung bestimmt. Nicht benötigter Inhalt ist zu verwerfen.
Haltbarkeit nach Mischen mit anderen Komponenten Chemische und physikalische Stabilität siehe Abschnitt 6.6.
Aus mikrobiologischer Sicht sollte das Arzneimittel unmittelbar verwendet werden, wenn Additive zugesetzt wurden. Falls dieses nicht sofort verwendet wird, ist der Anwender für die Bedingungen der Aufbewahrung bis zur Anwendung verantwortlich, die normalerweise nicht länger als 24 Stunden bei 2 -8 °C dauern soll.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Aufbewahrungsbedingungen nach Anbruch des Arzneimittels, siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Polyethylenampullen
Ampulle zu 10 ml
Packung zu 20 x 10 ml
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen für die Beseitigung.
Nicht verwenden, wenn das Behältnis beschädigt ist. Nur verwenden, wenn die Glucoselösung klar und farblos bis leicht gelblich ist.
Kompatibilität
Glucosteril 40 % dürfen nur Arzneimittellösungen oder Lösungen zur parenteralen Ernährung zugesetzt werden, deren Kompatibilität dokumentiert wurde.
Nur zum einmaligen Gebrauch. Mischungen mit Zusätzen sind unter aseptischen Bedingungen herzustellen.
Nach Applikation nicht verbrauchte Mischlösung ist zu verwerfen.
Handhabung der Ampullen
Bei der Entnahme von Arzneimitteln aus Kunststoffampullen sind die Prinzipien aseptischen Arbeitens entsprechend der einschlägigen Richtlinien des Robert-Koch-Institutes (RKI) einzuhalten.

Trennen Sie die gewünschte Ampulle ab.
|
2. | ||
|
1 |
1v ^1a\ | |
|
Halten Sie die Ampulle am Verschluss mit einer Hand fest und schütteln Sie sie einmal nach unten, so dass sich kein Tropfen mehr im oberen Bereich der Ampulle befindet. Dadurch wird ein Herausspritzen der Lösung beim Öffnen vermieden. | ||
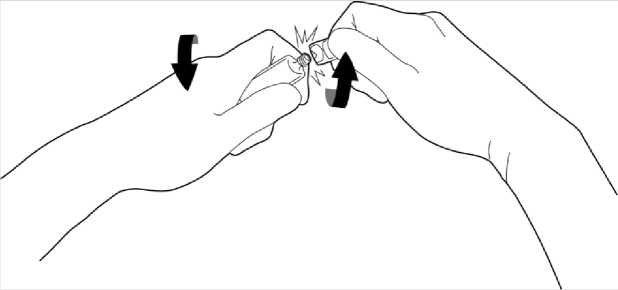
Öffnen Sie die Ampulle, indem Sie den Verschluss mit einer Drehbewegung entfernen.
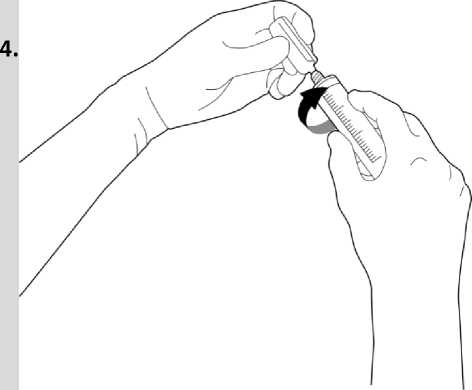
Die geöffnete Ampulle kann auf eine Spritze mit Luer-Anschluss aufgeschraubt werden.
7. INHABER DER ZULASSUNG
Fresenius Kabi Deutschland GmbH
D-61346 Bad Homburg
Tel.: +49 6172 686 8200
Fax: +49 6172 686 8239
E-Mail: kundenberatung@fresenius-kabi.de
8. ZULASSUNGSNUMMER
6072666.04.01
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung/Datum der letzten Verlängerung der Zulassung 11. Februar 2005
10. STAND DER INFORMATION
Januar 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 8 von 8