Ig Vena 50 G/L Infusionslösung
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Ig Vena 50 g/l Infusionslösung
Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Diese Packungsbeilage beinhaltet:
1. Was ist Ig Vena und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Ig Vena beachten?
3. Wie ist Ig Vena anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Ig Vena aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. WAS IST IG VENA UND WOFÜR WIRD ES ANGEWENDET?
Ig Vena ist eine Lösung von normalem Immunglobulin vom Menschen zur intravenösen Anwendung. Immunglobuline sind menschliche Antikörper, welche auch im Blut vorhanden sind.
Ig Vena wird verwendet zur:
Behandlung von Erwachsenen, und Kindern und Jugendlichen (0-18 Jahre), welche nicht genug Antikörper haben (Substitutionsbehandlung) in folgenden Fällen:
1. Patienten, die einen angeborenen Mangel an Antikörperproduktion haben (Primäre Immunmangelkrankheiten)
2. Patienten mit Erkrankungen (Krebs), welche das Blut betreffen (chronische lympathische Leukämie) und zu einer verminderten Antikörperproduktion (Hypogammaglobulinämie) und wiederkehrenden bakteriellen Infektionen führen, wenn die vorbeugende Gabe von Antibiotika keine Wirkung erzielt hat.
3. Patienten mit Krebserkrankungen des Knochenmarks (Multiples Myelom), die zu einer verminderten Antikörperproduktion (Hypogammaglobulinämie) und wiederkehrenden bakteriellen Infektionen führen, wenn diese Patienten nicht auf eine Pneumokokkenimpfung angesprochen haben.
4. Patienten mit verminderter Antikörperproduktion (Hypogammaglobulinämie) nach einer allogenen Knochenmarktransplantation KMT (Knochenmark, das nicht vom Patienten kommt).
5. Angeborenes AIDS mit wiederkehrenden bakteriellen Infektionen.
Behandlung von Erwachsenen, und Kindern und Jugendlichen (0-18 Jahre) mit bestimmten entzündlichen Erkrankungen (Immunmodulation), in folgenden Situationen:
1. Patienten, die nicht genug Blutplättchen haben (Primäre ITP - Immunthrombozytopenie), und die ein hohes Blutungsrisiko aufweisen sowie vor Operationen zur Korrektur der Blutplättchenzahl.
2. Patienten mit Guillain Barre Syndrom. Das ist eine akute Erkrankung, charakterisiert durch die Entzündung der peripheren Nerven, welche eine schwere Muskelschwäche vorallem in den Beinen und Armen auslöst.
3. Patienten mit Chronisch Inflammatorisch Demyelinisierender Polyneuropathie (CIDP). Diese chronische Erkrankung ist eine seltene Störung der peripheren Nerven und ist charakterisiert durch eine langsam ansteigende Schwäche in den Beinen und, seltener, in den Armen.
4. Patienten mit Kawasaki Syndrom. Das ist eine akute Erkrankung, meistens in kleinen Kindern, charakterisiert durch Entzündungen der Blutgefäße im ganzen Körper.
2. WAS SOLLTEN SIE VOR DER ANWENDUNG VON Ig Vena BEACHTEN Ig Vena darf nicht angewendet werden
• Wenn Sie überempfindlich (allergisch) gegen normales Immunglobulin vom Menschen oder gegen einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
• Wenn Sie Antikörper gegen IgA Immunglobuline in Ihrem Blut haben. Das ist sehr selten und kann vorkommen, wenn Sie keine Immunglobuline des Typs IgA produzieren.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, bevor Sie Ig Vena anwenden
Ihr Arzt oder das medizinische Fachpersonal werden Sie während der Gesamtdauer der Ig Vena Infusion begleiten und beobachten, um sicher zu gehen, dass keine Nebenwirkungen auftreten.
Bestimmte Nebenwirkungen können häufiger auftreten:
- bei zu hoher Infusionsgeschwindigkeit
- wenn Sie an einer Erkrankung leiden mit niedrigen Antikörpermengen in Ihrem Blut (Hypooder Agammaglobulinämie, mit oder ohne IgA-Mangel)
- wenn Sie normales Immunglobulin vom Menschen das erste Mal erhalten
- in seltenen Fällen, bei einem Arzneimittelwechsel, oder wenn die Behandlung für längere Zeit unterbrochen wurde.
• Unter bestimmten Umständen können Immunglobulinprodukte das Risiko von Herzinfarkten, Schlaganfällen, Lungenembolien oder tiefen Venenthrombosen erhöhen, da sie die Blutviskosität erhöhen.
Deshalb wird Ihr Arzt in folgenden Situationen besondere Vorsicht walten lassen:
- Sie sind übergewichtig
- Sie sind fortgeschrittenen Alters
- Sie leiden an Diabetes mellitus
- Sie leiden an Bluthochdruck
- Sie leiden an Blutvolumenmangel (Hypovolämia)
- Sie hatten schon Probleme mit Gefäßkrankheiten
- Sie neigen zu verstärkter Blutgerinnung (angeborenen und erworbene Gerinnungserkrankungen)
- Sie leiden an thrombotischen Ereignissen
- Sie leiden an einer Krankheit, welche eine Verdickung Ihres Blutes bedingt (Viskosität)
- Sie sind schon länger bettlägrig
- Sie haben oder hatten Nierenprobleme oder nehmen Medikamente, welche Ihre Nieren beeinträchtigen können (nephrotoxische Medikamente), da Fälle von akutem
Nierenversagen berichtet wurden. Im Falle von Nierenerkrankungen wird Ihr Arzt eine Behandlungsunterbrechung in Betracht ziehen.
• Sie können überempfindlich (allergisch) auf Immunglobuline (Antikörper) reagieren, ohne es zu wissen.
Das kann sogar vorkommen, wenn sie schon früher normales Immunglobulin vom Menschen erhalten und es gut vertragen haben. Dies kann insbesondere der Fall sein, wenn Sie keine Antikörper des Typs IgA haben (IgA Defizienz mit Anti-IgA-Antikörpern). In diesem seltenen Fall können Überempfindlichkeitsreaktionen (allergische Reaktionen) wie starker Blutdruckabfall oder Schock auftreten.
Im Falle einer Nebenwirkung kann Ihr Arzt entscheiden, ob die Infusionsgeschwindigkeit reduziert oder die Infusion komplett gestoppt werden soll. Außerdem wird er je nach Schwere und Art der Nebenwirkung über die erforderliche Behandlung entscheiden.
Bei einem Schock sind die aktuellen medizinischen Standardmaßnahmen für eine Schockbehandlung anzuwenden.
Bitte informieren Sie ihren Arzt, wenn eine der oben genannten Gegebenheiten auf Sie zutrifft. Ihr Arzt wird dann besonders sorgfältig die Verschreibung von und die Behandlung mit Ig Vena abwägen.
Virussicherheit
Zu den Standardmaßnahmen, um Infektionen aufgrund der Verwendung von Arzneimitteln aus menschlichem Blut oder Plasma zu verhindern, zählen: sorgfältige Spenderauswahl, um diejenigen auszuschließen, die eventuell Infektionen aufweisen, Testung aller Einzelspenden und der Plasmapools auf Anzeichen von Viren/Infektionen und schließen effektive Virusinaktivierungs-/Viruseliminierungsverfahren im Herstellungsprozess ein.
Trotz dieser Maßnahmen kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu auftretende Viren oder andere Pathogene.
Die verwendeten Verfahren werden bei umhüllten Viren wie dem humanen Immunschwäche-Virus (HIV), dem Hepatitis B-Virus (HBV), dem Hepatitis C-Virus (HCV) und bei dem nicht umhüllten Hepatitis A-Virus (HAV) als wirksam betrachtet.
Bei nicht umhüllten Viren wie Parvovirus B19 sind sie möglicherweise von eingeschränktem Wert. Die klinischen Erfahrungen zeigen ein geringes Risiko hinsichtlich einer Übertragung von Hepatitis A oder Parvovirus B19 durch Immunglobuline; man geht davon aus, dass der Antikörpergehalt der Produkte einen wesentlichen Beitrag zur Virensicherheit leistet.
Jede Verabreichung soll mittels beigefügter Selbstklebeetikette in der Krankengeschichte dokumentiert werden.
Kinder und Jugendliche
Es sind keine zusätzlichen spezifischen Maßnahmen oder spezifische Überwachung notwendig.
Anwendung von Ig Vena zusammen mit anderen Arzneimitteln
Informieren Sie bitte Ihren Arzt, wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden.
Normales Immunglobulin vom Menschen darf keinesfalls mit anderen Arzneimitteln gemischt verabreicht werden.
Lebendvirusimpfstoffe
Die Verabreichung von Immunglobulinen wie Ig Vena kann die Wirkung von VirusLebendimpfstoffen wie Masern, Röteln, Mumps und Varizellen über einen Zeitraum von mindestens 6 Wochen bis zu 3 Monaten beeinträchtigen. Nach Verabreichung des Arzneimittels soll daher ein Zeitraum von 3 Monaten verstreichen, bevor eine Impfung mit einem Lebendvirusimpfstoff erfolgt. Bei Masern kann dieser Zeitraum bis zu einem Jahr andauern. Deshalb sollten bei Patienten, die eine Masernimpfung erhalten haben, die Antikörperspiegel überprüft werden.
Blutuntersuchungen
Nach Verabreichung von Immunglobulinen wie Ig Vena kann es durch den vorübergehenden Anstieg der verschiedenen passiv übertragenen Antikörper in Ihrem Blut zu falsch-positiven Testergebnissen bei Blutuntersuchungen kommen.
Die passive Übertragung von Antikörpern gegen Erythrozytenantigene, z. B. A, B, D (welche die Blutgruppe bestimmen) kann einige Blut-Tests auf Anti-Erythrozyten-Antikörper wie zum Beispiel den direkten Antiglobulin Test (DAT, direkter Coombs Test) beeinträchtigen.
Blutzuckermesstests
Bestimmte Blutzuckermesstests (zum Beispiel jene, welche auf Glucose-Dehydrogenase-Pyrrolochinolinchinon (GDH-PQQ) oder Glucose-Dye-Oxidoreduktase basieren) erkennen fälschlicherweise die in Ig Vena enthaltene Maltose (100 mg/ml) als Glucose. Das kann zu fälschlich erhöhten Glucosemesswerten während und bis zu 15 Stunden nach einer Infusion führen und somit zu einer unangemessenen Insulinverabreichung, welche wiederum in einer lebensbedrohlichen oder sogar fatalen Hypoglykämie enden kann.
Zudem können Fälle einer echten Hypoglykämie unbemerkt bleiben, wenn der Grad der Unterzuckerung durch fälschlich erhöhte Blutzuckerwerte verschleiert wird. Demzufolge muss bei Verabreichung von Ig Vena oder anderen parenteralen maltosehältigen Produkten, der Blutzuckergehalt mittels einer glucose-spezifischen Testmethode bestimmt werden. Die Gebrauchsinformation des Blutzuckertests sowie jene der Teststreifen sollte sorgfältig gelesen werden, um festzustellen, ob der Test für die gleichzeitige Verabreichung von maltosehältigen, parenteralen Produkten geeignet ist. Bei Unklarheit, wenden Sie sich an den Hersteller der Testmethode, um zu erfahren, ob der Test bei gleichzeitiger Verabreichung von maltosehältigen, parenteralen Produkten geeignet ist.
Kinder und Jugendliche
Obwohl keine spezifischen Wechselwirkungsstudien bei Kindern und Jugendlichen durchgeführt wurden, sind keine Unterschiede zur Erwachsenenpopulation zu erwarten.
Schwangerschaft, Stillzeit und Zeugungs-/Gebährfähigkeit
- Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt.. Ihr Arzt wird entscheiden, ob Sie Ig Vena während der Schwangerschaft oder der Stillperiode verabreicht bekommen dürfen.
- Es liegen keine kontrollierten klinischen Studien zur Unbedenklichkeit der Anwendung von Ig Vena in der Schwangerschaft vor. Es konnte gezeigt werden, dass IVIg Produkte die Plazenta durchqueren können, insbesondere im dritten Drittel der Schwangerschaft. Es werden jedoch seit Jahren Arzneimittel, welche Antikörper enthalten, in Schwangeren verwendet, und es konnte gezeigt werden, dass keine schädigende Wirkung auf den Verlauf der Schwangerschaft, den Fötus oder das Neugeborene zu erwarten sind.
- Wenn Sie stillen und Ig Vena verabreicht bekommen, können die Antikörper des Arzneimittels in die Muttermilch gelangen. Ihr Baby ist dadurch möglicherweise vor bestimmten Infektionen geschützt.
- Klinische Erfahrung mit Immunglobulinen lassen auf keinerlei schädigende Wirkungen auf die Fertilität schließen.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Manche unerwünschte Wirkungen von Ig Vena können die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinflussen. Patienten, bei denen unerwünschte Arzneimittelreaktionen auftreten, sollten abwarten bis diese vollständig überwunden sind, bevor sie selbst fahren oder Maschinen bedienen.
Ig Vena enthält Maltose und Natrium
Das Arzneimittel enthält 100 mg Maltose pro ml.
Das Arzneimittel enthält 69 mg Natrium pro Liter. Dies soll bei Patienten, die eine kontrollierte Natriumdiät einhalten müssen, beachtet werden.
3. WIE IST Ig Vena ANZUWENDEN?
Ig Vena sollte nur in Kliniken und medizinischen Einrichtungen von Ärzten oder medizinischem Fachpersonal verabreicht werden
Dosierung und Dosisintervall richten sich nach dem jeweiligen Anwendungsgebiet. Ihr Arzt wird die für Sie geeignete Dosis und das passende Behandlungsschema festlegen.
Am Anfang der Infusion werden Sie Ig Vena mit einer langsamen Infusionsgeschwindigkeit verabreicht bekommen. Wenn Sie die Infusion gut vertragen kann der Arzt die Geschwindigkeit stufenweise erhöhen.
Anwendung bei Kindern und Jugendlichen
Art und Dauer der Anwendung bei Kinder und Jugendlichen (0-18 Jahre) unterscheiden sich nicht von jenen bei Erwachsenen, da die Dosierung für jede Indikation je nach Körpergewicht erfolgt und dem klinischen Befund des Patienten angepasst wird.
Wenn Sie eine größere Menge von Ig Vena erhalten haben, als Sie sollten
Wenn Sie eine größere Menge Ig Vena verabreicht bekommen haben als Sie sollten, kann es zu einer Eiweißüberlastung im Blut kommen und dadurch kann Ihr Blut zu dickflüssig werden (Hyperviskosität). Das kann vor allem passieren, wenn Sie ein Risikopatient sind, und hier besonders in älteren Patienten und in Patienten mit Herz- oder Nierenproblemen.
Wenn Sie weitere Fragen zur Einnahme dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
- Manchmal können Schüttelfrost, Kopfschmerz, Schwindel, Fieber, Erbrechen, allergische Reaktionen, Übelkeit, Gelenkschmerzen, Blutdruckabfall und leichte Rückenschmerzen vorkommen.
- Selten können normale Immunglobuline vom Menschen einen plötzlichen Blutdruckabfall verursachen und in Einzelfällen kann ein anaphylaktischer (allergischer) Schock auftreten, auch wenn der Patient bei früheren Anwendungen keine Reaktion gezeigt hat.
- Fälle vorübergehender aseptischer Meningitis (Hirnhautentzündung) und Einzelfälle von kurzfristiger Verminderung der roten Blutkörperchen (hämolytischer Anämie/ Hämolyse -Blutarmut), die sich wieder rückbildeten und auch seltene Fälle vorübergehender Hautreaktionen wurden bei der Gabe von normalem Immunglobulin vom Menschen beobachtet.
- Ein Anstieg von Serumkreatinin im Blut und/oder akutes Nierenversagen wurden beobachtet.
- Sehr selten sind thromboembolische Zwischenfälle (Bildung von Blutgerinnsel), welche Herzinfarkt, Schlaganfall, Lungenembolie und tiefe Venenthrombose auslösen können, berichtet worden.
Während der klinischen Studie KB034 wurden 756 Ig Vena Dosen an 33 erwachsene CIDP
Patienten verabreicht. Im Verlauf dieser Studie litt ein Patient einmal an Kopfschmerz.
Zusätzliche Nebenwirkungen bei Kindern und Jugendlichen
Es wird erwartet, dass sich Häufigkeit, Art und Schweregrad von unerwünschten Wirkungen in
Kindern und Jugendlichen nicht von denen in erwachsenen Patienten unterscheiden.
Informationen zur Virussicherheit finden Sie im Abschnitt 2 unter „Was sollten Sie vor der
Anwendung von Ig Vena besonders beachten (Virussicherheit)“.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen direkt anzeigen: in Deutschland über das Paul-Ehrlich-Institut, Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Pharmakovigilanz II, Paul-EhrlichStraße 51-59, D-63225 Langen, Tel: +49 6103 77 0, Fax: +49 6103 77 1234, Website: http://www.pei.de und in Österreich über das_ Bundesamt für Sicherheit im Gesundheitswesen, Traisengasse 5, 1200 WIEN, Fax: + 43 (0) 50 555 36207, Website: http://www.basg.gv.at.
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST Ig Vena AUFZUBEWAHREN?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen das Arzneimittel nach dem auf dem Etikett der Durchstechflasche und dem Umkarton nach „Verwendbar bis“ angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Im Kühlschrank lagern (2°C - 8°C).
Sobald die Durchstechflasche mit der Infusion geöffnet wurde, soll der Inhalt sofort verwendet werden.
Durchstechflasche im Umkarton aufbewahren.
Nicht einfrieren.
Verwenden Sie das Arzneimittel nicht, wenn die Lösung trüb ist, oder Farbveränderungen oder Ablagerungen aufweist.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN
Was Ig Vena enthält
Der Wirkstoff ist normales Immunglobulin vom Menschen.
1 ml Infusionslösung enthält 50 mg normales Immunglobulin vom Menschen.
Die Lösung enthält 50 g/l menschlicher Proteine, die mindestens zu 95% IgG (Immunglobulin G) sind.
Verteilung der IgG Subklassen:
IgG1 62,1 %
IgG2 34,8 %
IgG3 2,5 %
IgG4 0,6 %
Der maximale IgA Gehalt beträgt 50 Mikrogramm/ml.
Hergestellt aus menschlichem Spenderplasma.
Die sonstigen Bestandteile sind Maltose und Wasser für Injektionszwecke.
Wie Ig Vena aussieht und Inhalt der Packung
Ig Vena ist eine Infusionslösung, die klar oder leicht opaleszierend, farblos oder leicht gelblich erscheint.
Ig Vena 1 g/20 ml Infusionslösung 20 ml Durchstechflasche
Pharmazeutischer Unternehmer und Hersteller:
Pharmazeutischer Unternehmer:
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca) Italien.
Hersteller: Kedrion S.p.A. - 55027 Bolognana, Gallicano (Lucca), Italien.
Dieses Arzneimittel ist in den Mitgliedstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
|
Österreich |
Ig Vena 50 g/l Infusionslösung |
|
Deutschland |
Ig Vena 50 g/l Infusionslösung |
|
Griechenland |
Ig VENA |
|
Italien |
IG VENA |
|
Polen |
Ig VENA |
|
Portugal |
Ig Vena |
AT: Z.Nr.: 2-00321 DE: PEI.H.03409.01.1
Diese Packungsbeilage wurde zuletzt überarbeitet im Januar 2015.
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt: Anweisungen für eine korrekte Anwendung:
• Ig Vena sollte vor der Verabreichung auf Raum- oder Körpertemperatur erwärmt werden
• Vor Verabreichung soll eine Sichtprüfung der Infusionslösung auf ungelöste Partikel und Verfärbungen stattfinden. Lösungen, die trüb sind oder Ablagerungen aufweisen, dürfen nicht verwendet werden.
• Ig Vena sollte intravenös verabreicht werden mit einer initialen Infusionsgeschwindigkeit von 0,46 - 0,92 ml/kg/Stunde (10 - 20 Tropfen pro Minute) während der ersten 20 - 30 Minuten. Bei guter Verträglichkeit kann die Infusionsgeschwindigkeit stufenweise bis auf ein Maximum von 1,85 ml/kg/Stunde (40 Tropfen/Minute) erhöht werden.
Besondere Vorsichtsmaßnahmen
Manche schwere Nebenwirkungen des Produktes können durch die Infusionsgeschwindigkeit bedingt sein.
Mögliche Komplikationen können oft vermieden werden:
- wenn sichergestellt wurde, dass der Patient auf normales Immunglobulin vom Menschen nicht sensibilisiert ist, indem man das Produkt zu Beginn sehr langsam infundiert (0,46 - 0,92 ml/kg/Stunde)
- wenn sichergestellt ist, dass der Patient über die Infusionsdauer sorgfältig auf etwaige Symptome überwacht wird. Insbesondere sollten Patienten, die das erste Mal normales Immunglobulin vom Menschen erhalten, oder bei denen ein Arzneimittelwechsel durchgeführt wurde oder welche eine längere Therapieunterbrechung seit der letzten Infusion hatten, sorgfältig für die Dauer der Erstinfusion und während der ersten Stunde nach der Erstinfusion überwacht werden, um mögliche Nebenwirkungen zu bemerken. Alle anderen Patienten sollten nach der Verabreichung mindestens 20 Minuten unter Beobachtung bleiben.
Bei allen Patienten erfordert die Gabe von IVlg:
- Adäquate Hydratation vor Beginn der IVIg-Infusion
- Überwachung der Urinausscheidung
- Überwachung des Serumkreatinin-Spiegels
- Vermeidung der gleichzeitigen Gabe von Schleifendiuretika.
Bei unerwünschter Reaktion muss entweder die Infusionsgeschwindigkeit reduziert werden oder die Infusion abgebrochen werden.
Die erforderliche Behandlung richtet sich nach Art und Schwere der Nebenwirkung.
Bei einem Schock sind die aktuellen medizinischen Standardmaßnahmen für eine Schockbehandlung anzuwenden.
Kinder und Jugendliche
Es sind keine zusätzlichen spezifischen Maßnahmen oder spezifische Überwachung von Kindern und Jugendlichen notwendig. Dabei wird nicht erwartet, dass es Unterschiede zwischen Erwachsenen und der pädiatrischen Population (0-18 Jahre) gibt.
Thromboembolie
Es gibt klinische Hinweise auf einen Zusammenhang zwischen intravenösen Immunglobulin (IVIg) Gaben und thromboembolischen Ereignissen wie Herzinfarkt, Hirndurchblutungsstörungen (inklusive Schlaganfall), Lungenembolie und tiefer Venenthrombose, dies ist möglicherweise auf eine relative Erhöhung der Blutviskosität durch Immunglobuline bei Risikopatienten zurückzuführen. Vorsicht ist angebracht bei der Verordnung und Anwendung von IVIg bei übergewichtigen Patienten und bei solchen mit vorbestehenden Risikofaktoren für thrombotische Ereignisse (wie fortgeschrittenes Alter, Bluthochdruck, Diabetes mellitus und Gefäßkrankheiten oder Thrombosen in der Anamnese; ebenso bei Patienten mit erworbener oder angeborener Thromboseneigung; bei Patienten mit lang andauernder Bettlägrigkeit; mit schwerem Volumenmangel; mit Krankheiten, die zu einer Erhöhung der Blutviskosität führen).
In Patienten mit erhöhtem Risiko für thromboembolische Ereignisse sollten Infusionen von IVIg Produkte mit der geringsten Infusionsrate und in der geringsten noch sinnvollen Dosis erfolgen.
Akutes Nierenversagen
Es gibt Berichte über Fälle von akutem Nierenversagen bei Patienten, die IVIg erhalten haben. In fast allen Fällen konnten Risikofaktoren identifiziert werden, wie vorbestehende Nierenleistungsschwäche, Diabetes mellitus, Volumenmangel, Übergewicht, gleichzeitige Gabe nierentoxischer Medikamente oder ein Lebensalter über 65 Jahre.
Bei Verschlechterung der Nierenfunktion sollte man den Abbruch der IVIg Behandlung in Erwägung ziehen.
Berichte von eingeschränkter Nierenfunktion und akutem Nierenversagen liegen für viele zugelassene Immunglobulinprodukte vor, welche unterschiedliche sonstige Bestandteile wie Saccharose, Glucose und Maltose beinhalten. Jene Präparate, die Saccharose als Stabilisator enthalten, sind jedoch in einem unverhältnismäßig hohen Anteil dafür verantwortlich. Daher sollte bei Risikopatienten die Verwendung von IVIg Produkten ohne derartige sonstige Bestandteile bedacht werden. Zusätzlich sollte bei Patienten mit bekanntem Risiko für ein akutes Nierenversagen das Präparat mit der geringstmöglichen Dosierung und Infusionsrate verabreicht werden.
Aseptisches Meningitis-Syndrom (AMS)
Es gibt Berichte über Fälle von aseptischem Meningitis-Syndrom in Patienten, die IVIg erhalten haben. Das Beenden der IVIg Behandlung brachte eine Besserung der AMS innerhalb weniger Tage ohne weitere Folgen. Die Erkrankung beginnt normalerweise innerhalb weniger Stunden bis 2 Tage nach der IVIg Therapie. Liquoruntersuchungen sind oft positiv für Pleozytose mit bis zu mehreren tausend Zellen pro mm3, vor allem der Granulozytenfamilie, und erhöhtem Proteingehalt mit bis zu mehreren hundert mg/dl.
AMS kann häufiger im Zusammenhang mit Hoch-Dosis (2 g/kg KG) IVIg Behandlungen auftreten. Hämolytische Anämie
IVIg-Produkte können Blutgruppen-Antikörper enthalten, welche als Hämolysine wirken und daher eine in vivo Anlagerung von Immunglobulinen an Erthrozyten hervorrufen können. Dies kann zu einem positiven Antiglobulin-Test (Coombs-Test) und, in seltenen Fällen, zur Hämolyse führen. Durch den vermehrten Abbau von roten Blutzellen kann es im Anschluß an eine IVIg Therapie zu einer hämolytischen Anämie kommen. IVIg Empfänger sollten daher genau auf klinische Anzeichen und Symptome einer Hämolyse beobachtet werden.
Dieses Arzneimittel beinhaltet 100 mg Maltose pro Milliliter als sonstigen Bestandteil. Maltose kann manche Blutzuckermesstests beeinflussen und zu fälschlich erhöhten Glucosewerten und damit zu einer unangemessenen Insulinverabreichung führen. Dies wiederum kann eine lebensbedrohlichen Hypoglykämie und gegebenenfalls den Tod auslösen. Zudem können Fälle einer echten Hypoglykämie unbemerkt bleiben, wenn der Grad der Unterzuckerung durch fälschlich erhöhte Blutzuckerwerte verschleiert bleibt. Für genaue Informationen siehe auch Abschnitt “Blutzuckermesstests”.
Dosierung
Der Beginn und die Überwachung einer Substitutionstherapie sollten unter Aufsicht eines Arztes mit Erfahrung in der Behandlung von Immundefekten stattfinden.
Dosierung und Dosisintervalle richten sich nach dem jeweiligen Anwendungsgebiet.
Bei Substitutionsbehandlungen kann eine individuelle Dosierung für jeden Patienten in Abhängigkeit von der pharmakokinetischen und klinischen Reaktion notwendig sein.
Folgende Dosierungsangaben können als Richtlinie gelten:
Substitutionsbehandlung bei primären Immundefekten
Bei der Dosierung sollte ein IgG-Talspiegel von mindestens 5 - 6 g/l angestrebt werden (gemessen vor der nächsten Infusion). Nach Behandlungsbeginn werden 3 - 6 Monate benötigt, um ein Gleichgewicht einzustellen.
Die empfohlene Initialdosis beträgt einmalig 0,4 - 0,8 g/kg Körpergewicht (KG) gefolgt von mindestens 0,2 g/kg KG verabreicht alle 3 - 4 Wochen. Um einen gleichmäßigen Talspiegel von 5 - 6 g/l aufrechtzuerhalten, ist eine Erhaltungsdosis von 0,2 - 0,8 g/kg KG pro Monat erforderlich. Die Dosierungsintervalle können bei Vorliegen eines steady states 3 - 4 Wochen betragen.
Die Talspiegel sollten regelmäßig kontrolliert und im Zusammenhang mit der Infektionshäufigkeit bewertet werden. Es kann notwendig sein, die Dosierung zu erhöhen und einen höheren Talspiegel anzustreben, um die Infektionshäufigkeit zu vermindern.
Hypogammaglobulinämie und rezidivierende bakterielle Infektionen in Patienten mit chronischer lymphatischer Leukämie, welche nicht auf die Gabe von _ prophylaktischen Antibiotika angesprochen haben; Hypogammaglobulinämie und rezidivierende bakterielle Infektionen in Patienten in der Plateauphase des multiplen Myeloms, die nicht auf eine Pneumokokkenimmunisierung angesprochen haben; kongenitales AIDS mit rezidivierenden bakteriellen Infektionen:
Die empfohlene Dosis beträgt 0,2 - 0,4 g/kg KG alle 3 - 4 Wochen.
Hypogammaglobulinämie in Patienten nach allogener hämatopoetischer Stammzelltransplantation Die empfohlene Dosis beträgt 0,2-0,4 g/kg alle 3-4 Wochen. Die Talspiegel sollten über 5 g/l gehalten werden.
Primäre Immunthrombozytopenie (ITP):
Es gibt zwei unterschiedliche Behandlungsstrategien:
• 0,8 - 1,0 g/kg KG am 1. Tag; diese Dosis kann innerhalb von 3 Tagen wiederholt werden;
• 0,4 g/kg KG täglich für 2 - 5 Tage. Die Behandlung kann bei einem Rückfall wiederholt werden.
Guillain Barre Syndrom:
0,4 g/kg/Tag aufgeteilt auf fünf Tage.
Chronische Inflammatorische Demyelinisierende Polyneuropathie (CIDP):
Initialdosis: 2 g/kg verteilt auf 4 aufeinanderfolgenden Tagen. Es wird empfohlen die Initialdosis alle drei bis vier Wochen erneut zu geben, bis ein maximales Ansprechen erreicht wurde.
Erhaltungsdosis: diese sollte vom behandelnden Arzt ermittelt werden. Es wird empfohlen nach Erreichen des maximalen Ansprechens die Dosis zu reduzieren und die Verabreichungsfrequenz anzupassen bis die geringst mögliche, wirksame Erhaltungsdosis definiert wurde.
Es konnte gezeigt werden, dass die Initialdosis in bis zu 7 aufeinanderfolgenden Behandlungen innerhalb von 6 Monaten gut vertragen wird.
Kawasaki Syndrom:
1,6 - 2,0 g/kg KG sollten auf mehrere Dosen verteilt über zwei bis fünf Tage gegeben werden; oder 2 g/kg KG als Einzeldosis. Die Patienten sollten gleichzeitig mit Acetylsalicylsäure (ASS) behandelt werden.
Die Dosierungsempfehlungen werden in folgender Tabelle zusammengefasst:_
|
Indikation |
Dosierung |
Häufigkeit der Verabreichung |
|
Substitutionsbehandlung bei primären Immundefekten |
- Initialdosis: 0,4 - 0,8 g/kg - anschließend: 0,2 - 0,8 g/kg |
alle 3 - 4 Wochen, um den IgG-Talspiegel auf mindestens 5 - 6 g/l zu halten |
|
Substitutionsbehandlung bei sekundären Immundefekten |
0,2 - 0,4 g/kg |
alle 3 - 4 Wochen, um den IgG-Talspiegel auf mindestens 5 - 6 g/l zu halten |
|
Kongenitales AIDS |
0,2 - 0,4 g/kg |
alle 3 - 4 Wochen |
|
Hypogammaglobulinämie (<4 g/l) in Patienten nach allogener hämatopoetischer Stammzelltransplantation |
0,2 - 0,4 g/kg |
alle 3 - 4 Wochen um einen IgG Talspiegel von über 5 g/l zu erreichen |
|
Immunmodulation: Primäre Immunthrombozytopenie |
0,8 - 1 g/kg oder |
am Tag 1, ggf. gefolgt von der gleichen Dosis innerhalb von 3 Tagen |
|
0,4 g/kg/Tag |
über 2 - 5 Tage | |
|
Guillain Barre Syndrom |
0,4 g/kg/Tag |
über 5 Tage |
|
Chronisch Inflammatorisch Demyelinisierende Polyneuropathie (CIDP)* |
Initialdosis 2 g/kg |
über 4 aufeinanderfolgenden Tage verteilt alle 3 - 4 Wochen |
|
Danach: Erhaltungsdosis |
Diese muss an die Patientenbedürfnisse angepasst werden, siehe oben | |
|
Kawasaki Syndrom |
1,6 - 2 g/kg oder |
auf mehrere Dosen verteilt über 2 - 5 Tage, zusammen mit Acetylsalicylsäure |
|
2 g/kg |
als Einzeldosis zusammen mit | |
|
Acetylsalicylsäure |
*Die Dosis beruht auf der angewendeten Dosis in der klinischen Studie mit Ig Vena
Spezielle Patientengruppen
Die Erfahrung in Patienten, welche älter als 65 Jahre sind, ist begrenzt.
Kinder und Jugendliche
Art und Dauer der Anwendung bei Kinder und Jugendlichen (0-18 Jahre) unterscheiden sich nicht von jenen bei Erwachsenen, da die Dosierung für jede Indikation je nach Körpergewicht erfolgt und dem klinischen Befund der oben genannten Erkrankungen angepasst wird
CIDP
Wegen der Seltenheit der Krankheit und der dadurch insgesamt geringen Anzahl an Patienten sind nur limitierte Erfahrungen über die Verwendung von intravenösen Immunglobulinen in Kindern mit CIDP vorhanden. Daher sind nur Daten aus der Literatur verfügbar. Allerdings zeigen alle publizierten Daten einheitlich, dass IVIg Behandlungen gleichermaßen in Erwachsenen und Kindern wirksam sind, so wie es auch für andere bereits etablierte IVIg Indikationen der Fall ist
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Ig Vena 50 g/l Infusionslösung
Normales Immunglobulin (IVIG) vom Menschen zur intravenösen Anwendung
- Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Diese Packungsbeilage beinhaltet:
1. Was ist Ig Vena und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Ig Vena beachten?
3. Wie ist Ig Vena anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Ig Vena aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. WAS IST IG VENA UND WOFÜR WIRD ES ANGEWENDET?
Ig Vena ist eine Lösung von normalem Immunglobulin vom Menschen zur intravenösen Anwendung. Immunglobuline sind menschliche Antikörper, welche auch im Blut vorhanden sind.
Ig Vena wird verwendet zur:
Behandlung von Erwachsenen, und Kindern und Jugendlichen (0-18 Jahre) welche nicht genug Antikörper haben (Substitutionsbehandlung) in folgenden Fällen:
6. Patienten, die einen angeborenen Mangel an Antikörperproduktion haben (Primäre Immunmangelkrankheiten)
7. Patienten mit Erkrankungen (Krebs), welche das Blut betreffen (chronische lympathische Leukämie) und zu einer verminderten Antikörperproduktion (Hypogammaglobulinämie) und wiederkehrenden bakteriellen Infektionen führen, wenn die vorbeugende Gabe von Antibiotika keine Wirkung erzielt hat.
8. Patienten mit Krebserkrankungen des Knochenmarks (Multiples Myelom), die zu einer verminderten Antikörperproduktion (Hypogammaglobulinämie) und wiederkehrenden bakteriellen Infektionen führen, wenn diese Patienten nicht auf eine Pneumokokkenimpfung angesprochen haben.
9. Patienten mit verminderter Antikörperproduktion (Hypogammaglobulinämie) nach einer allogenen Knochenmarktransplantation KMT (Knochenmark, das nicht vom Patienten kommt).
10. Angeborenes AIDS mit wiederkehrenden bakteriellen Infektionen.
Behandlung von Erwachsenen, und Kindern und Jugendlichen (0-18 Jahre) mit bestimmten entzündlichen Erkrankungen (Immunmodulation), in folgenden Situationen:
5. Patienten, die nicht genug Blutplättchen haben (primäre ITP - Immunthrombozytopenie), und die ein hohes Blutungsrisiko aufweisen sowie vor Operationen zur Korrektur der Blutplättchenzahl.
6. Patienten mit Guillain Barre Syndrom. Das ist eine akute Erkrankung, charakterisiert durch die Entzündung der peripheren Nerven, welche eine schwere Muskelschwäche vorallem in den Beinen und Armen auslöst.
7. Patienten mit chronisch inflammatorisch demyelinisierender Polyneuropathie (CIDP). Diese chronische Erkrankung ist eine seltene Störung der peripheren Nerven und ist charakterisiert durch eine langsam ansteigende Schwäche in den Beinen und, seltener, in den Armen.
8. Patienten mit Kawasaki Syndrom. Das ist eine akute Erkrankung, meistens in kleinen Kindern, charakterisiert durch Entzündungen der Blutgefäße im ganzen Körper.
2. WAS SOLLTEN SIE VOR DER ANWENDUNG VON Ig Vena BEACHTEN Ig Vena darf nicht angewendet werden
• Wenn Sie überempfindlich (allergisch) gegen normales Immunglobulin vom Menschen oder gegen einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
• Wenn Sie Antikörper gegen IgA Immunglobuline in Ihrem Blut haben. Das ist sehr selten und kann vorkommen, wenn Sie keine Immunglobuline des Typs IgA produzieren.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, bevor Sie Ig Vena anwenden
Ihr Arzt oder das medizinische Fachpersonal werden Sie während der Gesamtdauer der Ig Vena Infusion begleiten und beobachten, um sicher zu gehen, dass keine Nebenwirkungen auftreten.
Bestimmte Nebenwirkungen können häufiger auftreten:
- bei zu hoher Infusionsgeschwindigkeit
- wenn Sie an einer Erkrankung leiden mit niedrigen Antikörpermengen in Ihrem Blut (Hypooder Agammaglobulinämie, mit oder ohne IgA-Mangel)
- wenn Sie normales Immunglobulin vom Menschen das erste Mal erhalten
- in seltenen Fällen, bei einem Arzneimittelwechsel, oder wenn die Behandlung für längere Zeit unterbrochen wurde.
• Unter bestimmten Umständen können Immunglobulinprodukte das Risiko von Herzinfarkten, Schlaganfällen, Lungenembolien oder tiefen Venenthrombosen erhöhen, da sie die Blutviskosität erhöhen.
Deshalb wird Ihr Arzt in folgenden Situationen besondere Vorsicht walten lassen:
- Sie sind übergewichtig
- Sie sind fortgeschrittenen Alters
- Sie leiden an Diabetes mellitus
- Sie leiden an Bluthochdruck
- Sie leiden an Blutvolumenmangel (Hypovolämia)
- Sie hatten schon Probleme mit Gefäßkrankheiten
- Sie neigen zu verstärkter Blutgerinnung (angeborenen und erworbene Gerinnungserkrankungen)
- Sie leiden an thrombotischen Ereignissen
- Sie leiden an einer Krankheit, welche eine Verdickung Ihres Blutes bedingt (Viskosität)
- Sie sind schon länger bettlägerig
- Sie haben oder hatten Nierenprobleme oder nehmen Medikamente, welche Ihre Nieren beeinträchtigen können (nephrotoxische Medikamente), da Fälle von akutem
Nierenversagen berichtet wurden. Im Falle von Nierenerkrankungen wird Ihr Arzt eine Behandlungsunterbrechung in Betracht ziehen.
• Sie können überempfindlich (allergisch) auf Immunglobuline (Antikörper) reagieren, ohne es zu wissen.
Das kann sogar vorkommen, wenn sie schon früher normales Immunglobulin vom Menschen erhalten und es gut vertragen haben. Dies kann insbesondere der Fall sein, wenn Sie keine Antikörper des Typs IgA haben (IgA Defizienz mit Anti-IgA-Antikörpern). In diesem seltenen Fall können Überempfindlichkeitsreaktionen (allergische Reaktionen) wie starker Blutdruckabfall oder Schock auftreten.
Im Falle einer Nebenwirkung kann Ihr Arzt entscheiden, ob die Infusionsgeschwindigkeit reduziert oder die Infusion komplett gestoppt werden soll. Außerdem wird er je nach Schwere und Art der Nebenwirkung über die erforderliche Behandlung entscheiden.
Bei einem Schock sind die aktuellen medizinischen Standardmaßnahmen für eine Schockbehandlung anzuwenden.
Bitte informieren Sie ihren Arzt wenn eine der oben genannten Gegebenheiten auf Sie zutrifft. Ihr Arzt wird dann besonders sorgfältig die Verschreibung von und die Behandlung mit Ig Vena abwägen.
Virussicherheit
Zu den Standardmaßnahmen, um Infektionen aufgrund der Verwendung von Arzneimitteln aus menschlichem Blut oder Plasma zu verhindern, zählen: sorgfältige Spenderauswahl, um diejenigen auszuschließen, die eventuell Infektionen aufweisen, Testung aller Einzelspenden und der Plasmapools auf Anzeichen von Viren/Infektionen und schließen effektive Virusinaktivierungs-/Viruseliminierungsverfahren im Herstellungsprozess ein.
Trotz dieser Maßnahmen kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu auftretende Viren oder andere Pathogene.
Die verwendeten Verfahren werden bei umhüllten Viren wie dem humanen Immunschwäche-Virus (HIV), dem Hepatitis B-Virus (HBV), dem Hepatitis C-Virus (HCV) und bei dem nicht umhüllten Hepatitis A-Virus (HAV) als wirksam betrachtet.
Bei nicht umhüllten Viren wie Parvovirus B19 sind sie möglicherweise von eingeschränktem Wert. Die klinischen Erfahrungen zeigen ein geringes Risiko hinsichtlich einer Übertragung von Hepatitis A oder Parvovirus B19 durch Immunglobuline; man geht davon aus, dass der Antikörpergehalt der Produkte einen wesentlichen Beitrag zur Virensicherheit leistet.
Jede Verabreichung soll mittels beigefügter Selbstklebeetikette in der Krankengeschichte dokumentiert werden.
Kinder und Jugendliche
Es sind keine zusätzlichen spezifischen Maßnahmen oder spezifische Überwachung notwendig.
Anwendung von Ig Vena zusammen mit anderen Arzneimitteln
Informieren Sie bitte Ihren Arzt, wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden.
Normales Immunglobulin vom Menschen darf keinesfalls mit anderen Arzneimitteln gemischt verabreicht werden.
Lebendvirusimpfstoffe
Die Verabreichung von Immunglobulinen wie Ig Vena kann die Wirkung von VirusLebendimpfstoffen wie Masern, Röteln, Mumps und Varizellen über einen Zeitraum von mindestens 6 Wochen bis zu 3 Monaten beeinträchtigen. Nach Verabreichung des Arzneimittels soll daher ein Zeitraum von 3 Monaten verstreichen, bevor eine Impfung mit einem Lebendvirusimpfstoff erfolgt. Bei Masern kann dieser Zeitraum bis zu einem Jahr andauern. Deshalb sollten bei Patienten, die eine Masernimpfung erhalten haben, die Antikörperspiegel überprüft werden.
Blutuntersuchungen
Nach Verabreichung von Immunglobulinen wie Ig Vena kann es durch den vorübergehenden Anstieg der verschiedenen passiv übertragenen Antikörper in Ihrem Blut zu falsch-positiven Testergebnissen bei Blutuntersuchungen kommen.
Die passive Übertragung von Antikörpern gegen Erythrozytenantigene, z. B. A, B, D (welche die Blutgruppe bestimmen) kann einige Blut-Tests auf Anti-Erythrozyten-Antikörper wie zum Beispiel den direkten Antiglobulin Test (DAT, direkter Coombs Test) beeinträchtigen.
Blutzuckermesstests
Bestimmte Blutzuckermesstests (zum Beispiel jene, welche auf Glucose-Dehydrogenase-Pyrrolochinolinchinon (GDH-PQQ) oder Glucose-Dye-Oxidoreduktase basieren) erkennen fälschlicherweise die in Ig Vena enthaltene Maltose (100 mg/ml) als Glucose. Das kann zu fälschlich erhöhten Glucosemesswerten während und bis zu 15 Stunden nach einer Infusion führen und somit zu einer unangemessenen Insulinverabreichung, welche wiederum in einer lebensbedrohlichen oder sogar fatalen Hypoglykämie enden kann.
Zudem können Fälle einer echten Hypoglykämie unbemerkt bleiben, wenn der Grad der Unterzuckerung durch fälschlich erhöhte Blutzuckerwerte verschleiert wird. Demzufolge muss bei Verabreichung von Ig Vena oder anderen parenteralen maltosehältigen Produkten, der Blutzuckergehalt mittels einer glucose-spezifischen Testmethode bestimmt werden. Die Gebrauchsinformation des Blutzuckertests sowie jene der Teststreifen sollte sorgfältig gelesen werden, um festzustellen, ob der Test für die gleichzeitige Verabreichung von maltosehältigen, parenteralen Produkten geeignet ist. Bei Unklarheit, wenden Sie sich an den Hersteller der Testmethode, um zu erfahren, ob der Test bei gleichzeitiger Verabreichung von maltosehältigen, parenteralen Produkten geeignet ist.
Kinder und Jugendliche
Obwohl keine spezifischen Wechselwirkungsstudien bei Kindern und Jugendlichen durchgeführt wurden, sind keine Unterschiede zur Erwachsenenpopulation zu erwarten.
Schwangerschaft, Stillzeit und Zeugungs-/Gebährfähigkeit
- Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt. Ihr Arzt wird entscheiden, ob Sie Ig Vena während der Schwangerschaft oder der Stillperiode verabreicht bekommen dürfen.
- Es liegen keine kontrollierten klinischen Studien zur Unbedenklichkeit der Anwendung von Ig Vena in der Schwangerschaft vor. Es konnte gezeigt werden, dass IVIg Produkte die Plazenta durchqueren können, insbesondere im dritten Drittel der Schwangerschaft. Es werden jedoch seit Jahren Arzneimittel, welche Antikörper enthalten, in Schwangeren verwendet, und es konnte gezeigt werden, dass keine schädigende Wirkung auf den Verlauf der Schwangerschaft, den Fötus oder das Neugeborene zu erwarten sind.
- Wenn Sie stillen und Ig Vena verabreicht bekommen, können die Antikörper des Arzneimittels in die Muttermilch gelangen. Ihr Baby ist dadurch möglicherweise vor bestimmten Infektionen geschützt.
- Klinische Erfahrung mit Immunglobulinen lassen auf keinerlei schädigende Wirkungen auf die Fertilität schließen.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Manche unerwünschte Wirkungen von Ig Vena können die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinflussen. Patienten, bei denen unerwünschte Arzneimittelreaktionen auftreten, sollten abwarten bis diese vollständig überwunden sind, bevor sie selbst fahren oder Maschinen bedienen.
Ig Vena enthält Maltose und Natrium
Das Arzneimittel enthält 100 mg Maltose pro ml.
Das Arzneimittel enthält 69 mg Natrium pro Liter. Dies soll bei Patienten, die eine kontrollierte Natriumdiät einhalten müssen, beachtet werden.
3. WIE IST Ig Vena ANZUWENDEN?
Ig Vena sollte nur in Kliniken und medizinischen Einrichtungen von Ärzten oder medizinischem Fachpersonal verabreicht werden.Dosierung und Dosisintervall richten sich nach dem jeweiligen Anwendungsgebiet. Ihr Arzt wird die für Sie geeignete Dosis und das passende Behandlungsschema festlegen.
Am Anfang der Infusion werden Sie Ig Vena mit einer langsamen Infusionsgeschwindigkeit verabreicht bekommen. Wenn Sie die Infusion gut vertragen kann der Arzt die Geschwindigkeit stufenweise erhöhen.
Anwendung bei Kindern und Jugendlichen
Art und Dauer der Anwendung bei Kinder und Jugendlichen (0-18 Jahre) unterscheiden sich nicht von jenen bei Erwachsenen, da die Dosierung für jede Indikation je nach Körpergewicht erfolgt und dem klinischen Befund des Patienten angepasst wird.
Wenn Sie eine größere Menge von Ig Vena erhalten haben, als Sie sollten
Wenn Sie eine größere Menge Ig Vena verabreicht bekommen haben als Sie sollten, kann es zu einer Eiweißüberlastung im Blut kommen und dadurch kann Ihr Blut zu dickflüssig werden (Hyperviskosität). Das kann vor allem passieren, wenn Sie ein Risikopatient sind, und hier besonders in älteren Patienten und in Patienten mit Herz- oder Nierenproblemen.
Wenn Sie weitere Fragen zur Einnahme dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
- Manchmal können Schüttelfrost, Kopfschmerz, Schwindel, Fieber, Erbrechen, allergische Reaktionen, Übelkeit, Gelenkschmerzen, Blutdruckabfall und leichte Rückenschmerzen vorkommen.
- Selten können normale Immunglobuline vom Menschen einen plötzlichen Blutdruckabfall verursachen und in Einzelfällen kann ein anaphylaktischer (allergischer) Schock auftreten, auch wenn der Patient bei früheren Anwendungen keine Reaktion gezeigt hat.
- Fälle vorübergehender aseptischer Meningitis (Hirnhautentzündung) und Einzelfälle von kurzfristiger Verminderung der roten Blutkörperchen (hämolytischer Anämie/ Hämolyse -Blutarmut), die sich wieder rückbildeten und auch seltene Fälle vorübergehender Hautreaktionen wurden bei der Gabe von normalem Immunglobulin vom Menschen beobachtet.
- Ein Anstieg von Serumkreatinin im Blut und/oder akutes Nierenversagen wurden beobachtet.
- Sehr selten sind thromboembolische Zwischenfälle (Bildung von Blutgerinnsel), welche Herzinfarkt, Schlaganfall, Lungenembolie und tiefe Venenthrombose auslösen können, berichtet worden.
Während der klinischen Studie KB034 wurden 756 Ig Vena Dosen an 33 erwachsene CIDP
Patienten verabreicht. Im Verlauf dieser Studie litt ein Patient einmal an Kopfschmerz.
Zusätzliche Nebenwirkungen bei Kindern und Jugendlichen
Es wird erwartet, dass sich Häufigkeit, Art und Schweregrad von unerwünschten Wirkungen in
Kindern und Jugendlichen nicht von denen in erwachsenen Patienten unterscheiden.
Informationen zur Virussicherheit finden Sie im Abschnitt 2 unter „Was sollten Sie vor der
Anwendung von Ig Vena besonders beachten (Virussicherheit)“.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen direkt anzeigen: in Deutschland über das Paul-Ehrlich-Institut, Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Pharmakovigilanz II, Paul-EhrlichStraße 51-59, D-63225 Langen, Tel: +49 6103 77 0, Fax: +49 6103 77 1234, Website: http://www.pei.de und in Österreich über das_ Bundesamt für Sicherheit im Gesundheitswesen, Traisengasse 5, 1200 WIEN, Fax: + 43 (0) 50 555 36207, Website: http://www.basg.gv.at.
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST Ig Vena AUFZUBEWAHREN?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen das Arzneimittel nach dem auf dem Etikett der Durchstechflasche und dem Umkarton nach „Verwendbar bis“ angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Im Kühlschrank lagern (2°C - 8°C).
Vor Gebrauch und innerhalb der Haltbarkeitsdauer kann das Produkt für maximal 6 aufeinander folgende Monate bei Raumtemperatur, maximal 25°C, gelagert werden. Nach dieser Zeitspanne muss das Produkt entsorgt werden. In keinem Fall darf das Produkt wieder in den Kühlschrank gestellt werden, wenn es einmal bei Raumtemperatur gelagert worden ist.
Vermerken Sie den Beginn der Raumtemperaturlagerung auf dem äußeren Karton.
Sobald die Durchstechflasche mit der Infusion geöffnet wurde, muss der Inhalt sofort verwendet werden.
Durchstechflasche im Umkarton aufbewahren.
Nicht einfrieren.
Verwenden Sie das Arzneimittel nicht, wenn die Lösung trüb ist, oder Farbveränderungen oder Ablagerungen aufweist.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN Was Ig Vena enthält
Der Wirkstoff ist normales Immunglobulin vom Menschen.
1 ml Infusionslösung enthält 50 mg normales Immunglobulin vom Menschen.
Die Lösung enthält 50 g/l menschlicher Proteine, die mindestens zu 95% IgG (Immunglobulin G) sind.
Verteilung der IgG Subklassen:
IgG1 62,1 %
IgG2 34,8 %
IgG3 2,5 %
IgG4 0,6 %
Der maximale IgA Gehalt beträgt 50 Mikrogramm/ml.
Hergestellt aus menschlichem Spenderplasma.
Die sonstigen Bestandteile sind Maltose und Wasser für Injektionszwecke.
Wie Ig Vena aussieht und Inhalt der Packung
Ig Vena ist eine Infusionslösung, die klar oder leicht opaleszierend, farblos oder leicht gelblich erscheint.
Ig Vena 2,5 g/50 ml Infusionslösung 50 ml Durchstechflasche + Aufhängevorrichtung Ig Vena 5 g/100 ml Infusionslösung 100 ml Durchstechflasche + Aufhängevorrichtung Ig Vena 10 g/200 ml Infusionslösung 200 ml Durchstechflasche + Aufhängevorrichtung
Pharmazeutischer Unternehmer und Hersteller:
Pharmazeutischer Unternehmer:
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca) Italien.
Hersteller: Kedrion S.p.A. - 55027 Bolognana, Gallicano (Lucca), Italien.
Dieses Arzneimittel ist in den Mitgliedstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
|
Österreich |
Ig Vena 50 g/l Infusionslösung |
|
Deutschland |
Ig Vena 50 g/l Infusionslösung |
|
Griechenland |
Ig VENA |
|
Italien |
IG VENA |
|
Polen |
Ig VENA |
|
Portugal |
Ig Vena |
AT: Z.Nr.: 2-00321 DE: PEI.H.03409.01.1
Diese Packungsbeilage wurde zuletzt überarbeitet im Januar 2015
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Anweisungen für eine korrekte Anwendung:
• Ig Vena sollte vor der Verabreichung auf Raum- oder Körpertemperatur erwärmt werden
• Vor Verabreichung soll eine Sichtprüfung der Infusionslösung auf ungelöste Partikel und Verfärbungen stattfinden. Lösungen, die trüb sind oder Ablagerungen aufweisen, dürfen nicht verwendet werden.
• Ig Vena sollte intravenös verabreicht werden mit einer initialen Infusionsgeschwindigkeit von 0,46 - 0,92 ml/kg/Stunde (10 - 20 Tropfen pro Minute) während der ersten 20 - 30 Minuten. Bei guter Verträglichkeit kann die Infusionsgeschwindigkeit stufenweise bis auf ein Maximum von 1,85 ml/kg/Stunde (40 Tropfen/Minute)erhöht werden.
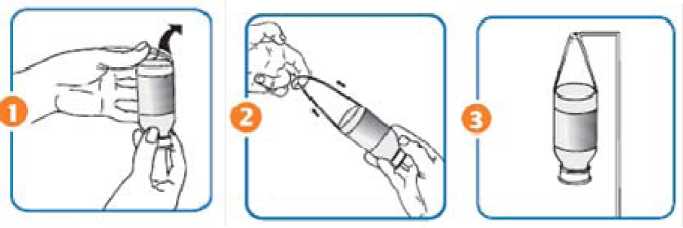
Anleitung zur Verwendung der Aufhängevorrichtung
1. Den integrierten Aufhängebügel am unteren Rand des Etikettes lösen und nach oben ziehen.
(Abb.A)
2. Falls notwendig, den Aufhängebügel durch Ziehen verlängern. (Abb.B)
3. Die Flasche mit dem Aufhängebügel am Infusionsständer anbringen. (Abb.C)
(Abb. A) (Abb. B) (Abb. C)
Besondere Vorsichtsmaßnahmen
Manche schwere Nebenwirkungen des Produktes können durch die Infusionsgeschwindigkeit bedingt sein.
Mögliche Komplikationen können oft vermieden werden:
- wenn sichergestellt wurde, dass der Patient auf normales Immunglobulin vom Menschen nicht sensibilisiert ist, indem man das Produkt zu Beginn sehr langsam infundiert (0,46 - 0,92 ml/kg/Stunde)
- wenn sichergestellt ist, dass der Patient über die Infusionsdauer sorgfältig auf etwaige Symptome überwacht wird. Insbesondere sollten Patienten, die das erste Mal normales Immunglobulin vom Menschen erhalten, oder bei denen ein Arzneimittelwechsel durchgeführt wurde oder welche eine längere Therapieunterbrechung seit der letzten Infusion hatten, sorgfältig für die Dauer der Erstinfusion und während der ersten Stunde nach der Erstinfusion überwacht werden, um mögliche Nebenwirkungen zu bemerken. Alle anderen Patienten sollten nach der Verabreichung mindestens 20 Minuten unter Beobachtung bleiben.
Bei allen Patienten erfordert die Gabe von IVlg:
- Adäquate Hydratation vor Beginn der IVIg-Infusion
- Überwachung der Urinausscheidung
- Überwachung des Serumkreatinin-Spiegels
- Vermeidung der gleichzeitigen Gabe von Schleifendiuretika.
Bei unerwünschter Reaktion muss entweder die Infusionsgeschwindigkeit reduziert werden oder die
Infusion abgebrochen werden.
Die erforderliche Behandlung richtet sich nach Art und Schwere der Nebenwirkung.
Bei einem Schock sind die aktuellen medizinischen Standardmaßnahmen für eine
Schockbehandlung anzuwenden.
Kinder und Jugendliche
Es sind keine zusätzlichen spezifischen Maßnahmen oder spezifische Überwachung von Kindern
und Jugendlichen notwendig. Dabei wird nicht erwartet, dass es Unterschiede zwischen
Erwachsenen und der pädiatrischen Population (0-18 Jahre) gibt.
Thromboembolie
Es gibt klinische Hinweise auf einen Zusammenhang zwischen intravenösen Immunglobulin (IVIg) Gaben und thromboembolischen Ereignissen wie Herzinfarkt, Hirndurchblutungsstörungen (inklusive Schlaganfall), Lungenembolie und tiefer Venenthrombose, dies ist möglicherweise auf eine relative Erhöhung der Blutviskosität durch Immunglobuline bei Risikopatienten zurückzuführen. Vorsicht ist angebracht bei der Verordnung und Anwendung von IVIg bei übergewichtigen Patienten und bei solchen mit vorbestehenden Risikofaktoren für thrombotische Ereignisse (wie fortgeschrittenes Alter, Bluthochdruck, Diabetes mellitus und Gefäßkrankheiten oder Thrombosen in der Anamnese; ebenso bei Patienten mit erworbener oder angeborener Thromboseneigung; bei Patienten mit lang andauernder Bettlägerigkeit; mit schwerem Volumenmangel; mit Krankheiten, die zu einer Erhöhung der Blutviskosität führen).
In Patienten mit erhöhtem Risiko für thromboembolische Ereignisse sollten Infusionen von IVIg Produkte mit der geringsten Infusionsrate und in der geringsten noch sinnvollen Dosis erfolgen.
Akutes Nierenversagen
Es gibt Berichte über Fälle von akutem Nierenversagen bei Patienten, die IVIg erhalten haben. In fast allen Fällen konnten Risikofaktoren identifiziert werden, wie vorbestehende Nierenleistungsschwäche, Diabetes mellitus, Volumenmangel, Übergewicht, gleichzeitige Gabe nierentoxischer Medikamente oder ein Lebensalter über 65 Jahre.
Bei Verschlechterung der Nierenfunktion sollte man den Abbruch der IVIg Behandlung in Erwägung ziehen.
Berichte von eingeschränkter Nierenfunktion und akutem Nierenversagen liegen für viele zugelassene Immunglobulinprodukte vor, welche unterschiedliche sonstige Bestandteile wie Saccharose, Glucose und Maltose beinhalten. Jene Präparate, die Saccharose als Stabilisator enthalten, sind jedoch in einem unverhältnismäßig hohen Anteil dafür verantwortlich. Daher sollte bei Risikopatienten die Verwendung von IVIg Produkten ohne derartige sonstige Bestandteile bedacht werden. Zusätzlich sollte bei Patienten mit bekanntem Risiko für ein akutes Nierenversagen das Präparat mit der geringstmöglichen Dosierung und Infusionsrate verabreicht werden.
Aseptisches Meningitis-Syndrom (AMS)
Es gibt Berichte über Fälle von aseptischem Meningitis-Syndrom in Patienten, die IVIg erhalten haben. Das Beenden der IVIg Behandlung brachte eine Besserung der AMS innerhalb weniger Tage ohne weitere Folgen. Die Erkrankung beginnt normalerweise innerhalb weniger Stunden bis 2 Tage nach der IVIg Therapie. Liquoruntersuchungen sind oft positiv für Pleozytose mit bis zu mehreren tausend Zellen pro mm3, vor allem der Granulozytenfamilie, und erhöhtem Proteingehalt mit bis zu mehreren hundert mg/dl.
AMS kann häufiger im Zusammenhang mit Hoch-Dosis (2 g/kg KG) IVIg Behandlungen auftreten. Hämolytische Anämie
IVIg-Produkte können Blutgruppen-Antikörper enthalten, welche als Hämolysine wirken und daher eine in vivo Anlagerung von Immunglobulinen an Erthrozyten hervorrufen können. Dies kann zu einem positiven Antiglobulin-Test (Coombs-Test) und, in seltenen Fällen, zur Hämolyse führen. Durch den vermehrten Abbau von roten Blutzellen kann es im Anschluß an eine IVIg Therapie zu einer hämolytischen Anämie kommen. IVIg Empfänger sollten daher genau auf klinische Anzeichen und Symptome einer Hämolyse beobachtet werden.
Dieses Arzneimittel beinhaltet 100 mg Maltose pro Milliliter als sonstigen Bestandteil. Maltose kann manche Blutzuckermesstests beeinflussen und zu fälschlich erhöhten Glucosewerten und damit zu einer unangemessenen Insulinverabreichung führen. Dies wiederum kann eine lebensbedrohlichen Hypoglykämie und gegebenenfalls den Tod auslösen. Zudem können Fälle einer echten Hypoglykämie unbemerkt bleiben, wenn der Grad der Unterzuckerung durch fälschlich erhöhte Blutzuckerwerte verschleiert bleibt. Für genaue Informationen siehe auch Abschnitt “Blutzuckermesstests”.
Dosierung
Der Beginn und die Überwachung einer Substitutionstherapie sollten unter Aufsicht eines Arztes mit Erfahrung in der Behandlung von Immundefekten stattfinden.
Dosierung und Dosisintervalle richten sich nach dem jeweiligen Anwendungsgebiet.
Bei Substitutionsbehandlungen kann eine individuelle Dosierung für jeden Patienten in Abhängigkeit von der pharmakokinetischen und klinischen Reaktion notwendig sein.
Folgende Dosierungsangaben können als Richtlinie gelten:
Substitutionsbehandlung bei _primären Immundefekten
Bei der Dosierung sollte ein IgG-Talspiegel von mindestens 5 - 6 g/l angestrebt werden (gemessen vor der nächsten Infusion). Nach Behandlungsbeginn werden 3 - 6 Monate benötigt, um ein Gleichgewicht einzustellen.
Die empfohlene Initialdosis beträgt einmalig 0,4 - 0,8 g/kg Körpergewicht (KG) gefolgt von mindestens 0,2 g/kg KG verabreicht alle 3 - 4 Wochen. Um einen gleichmäßigen Talspiegel von 5 - 6 g/l aufrechtzuerhalten, ist eine Erhaltungsdosis von 0,2 - 0,8 g/kg KG pro Monat erforderlich. Die Dosierungsintervalle können bei Vorliegen eines steady states 3 - 4 Wochen betragen.
Die Talspiegel sollten regelmäßig kontrolliert und im Zusammenhang mit der Infektionshäufigkeit bewertet werden. Es kann notwendig sein, die Dosierung zu erhöhen und einen höheren Talspiegel anzustreben, um die Infektionshäufigkeit zu vermindern.
Hypogammaglobulinämie und rezidivierende bakterielle Infektionen in Patienten mit chronischer lymphatischer Leukämie, welche nicht auf die Gabe von _ prophylaktischen Antibiotika angesprochen haben; Hypogammaglobulinämie und rezidivierende bakterielle Infektionen in Patienten in der Plateauphase des multiplen Myeloms, die nicht auf eine Pneumokokkenimmunisierung angesprochen haben; kongenitales AIDS mit rezidivierenden bakteriellen Infektionen:
Die empfohlene Dosis beträgt 0,2 - 0,4 g/kg KG alle 3 - 4 Wochen.
Hypogammaglobulinämie in Patienten nach allogener hämatopoetischer Stammzelltransplantation Die empfohlene Dosis beträgt 0,2-0,4 g/kg alle 3-4 Wochen. Die Talspiegel sollten über 5 g/l gehalten werden.
Primäre Immunthrombozytopenie (ITP):
Es gibt zwei unterschiedliche Behandlungsstrategien:
• 0,8 - 1,0 g/kg KG am 1. Tag; diese Dosis kann innerhalb von 3 Tagen wiederholt werden;
• 0,4 g/kg KG täglich für 2 - 5 Tage. Die Behandlung kann bei einem Rückfall wiederholt werden.
Guillain Barre Syndrom:
0,4 g/kg/Tag aufgeteilt auf fünf Tage.
Chronische Inflammatorische Demyelinisierende Polyneuropathie (CIDP):
Initialdosis: 2 g/kg verteilt auf 4 aufeinanderfolgenden Tagen. Es wird empfohlen die Initialdosis alle drei bis vier Wochen erneut zu geben, bis ein maximales Ansprechen erreicht wurde. Erhaltungsdosis: diese sollte vom behandelnden Arzt ermittelt werden. Es wird empfohlen nach Erreichen des maximalen Ansprechens die Dosis zu reduzieren und die Verabreichungsfrequenz anzupassen bis die geringst mögliche, wirksame Erhaltungsdosis definiert wurde.
Es konnte gezeigt werden, dass die Initialdosis in bis zu 7 aufeinanderfolgenden Behandlungen innerhalb von 6 Monaten gut vertragen wird.
Kawasaki Syndrom:
1,6 - 2,0 g/kg KG sollten auf mehrere Dosen verteilt über zwei bis fünf Tage gegeben werden; oder 2 g/kg KG als Einzeldosis. Die Patienten sollten gleichzeitig mit Acetylsalicylsäure (ASS) behandelt werden.
Die Dosierungsempfehlungen werden in folgender Tabelle zusammengefasst:
|
Indikation |
Dosierung |
Häufigkeit der Verabreichung |
|
Substitutionsbehandlung bei primären Immundefekten |
- Initialdosis: 0,4 - 0,8 g/kg - anschließend: 0,2 - 0,8 g/kg |
alle 3 - 4 Wochen, um den IgG-Talspiegel auf mindestens 5 - 6 g/l zu halten |
|
Substitutionsbehandlung bei sekundären Immundefekten |
0,2 - 0,4 g/kg |
alle 3 - 4 Wochen, um den IgG-Talspiegel auf mindestens 5 - 6 g/l zu halten |
|
Kongenitales AIDS |
0,2 - 0,4 g/kg |
alle 3 - 4 Wochen |
|
Hypogammaglobulinämie (<4 g/l) in Patienten nach allogener hämatopoetischer Stammzelltransplantation |
0,2 - 0,4 g/kg |
alle 3 - 4 Wochen um einen IgG Talspiegel von über 5 g/l zu erreichen |
|
Immunmodulation: Primäre Immunthrombozytopenie |
0,8 - 1 g/kg Oder |
am Tag 1, ggf. gefolgt von der gleichen Dosis innerhalb von 3 Tagen |
|
0,4 g/kg/Tag |
über 2 - 5 Tage | |
|
Guillain Barre Syndrom |
0,4 g/kg/Tag |
über 5 Tage |
|
Chronisch Inflammatorisch Demyelinisierende Polyneuropathie (CIDP)* |
Initialdosis 2 g/kg |
über 4 aufeinanderfolgenden Tage verteilt alle 3 - 4 Wochen |
|
Danach: Erhaltungsdosis |
Diese muss an die Patientenbedürfnisse angepasst werden, siehe oben | |
|
Kawasaki Syndrom |
1,6 - 2 g/kg oder |
auf mehrere Dosen verteilt über 2 - 5 Tage, zusammen mit Acetylsalicylsäure |
|
2 g/kg |
als Einzeldosis zusammen mit Acetylsalicylsäure |
*Die Dosis beruht auf der angewendeten Dosis in der klinischen Studie mit Ig Vena
Spezielle Patientengruppen
Die Erfahrung in Patienten, welche älter als 65 Jahre sind, ist begrenzt.
Kinder und Jugendliche
Art und Dauer der Anwendung bei Kinder und Jugendlichen (0-18 Jahre) unterscheiden sich nicht von jenen bei Erwachsenen, da die Dosierung für jede Indikation je nach Körpergewicht erfolgt und dem klinischen Befund der oben genannten Erkrankungen angepasst wird
CIDP
Wegen der Seltenheit der Krankheit und der dadurch insgesamt geringen Anzahl an Patienten sind nur limitierte Erfahrungen über die Verwendung von intravenösen Immunglobulinen in Kindern mit CIDP vorhanden. Daher sind nur Daten aus der Literatur verfügbar. Allerdings zeigen alle publizierten Daten einheitlich, dass IVIg Behandlungen gleichermaßen in Erwachsenen und Kindern wirksam sind, so wie es auch für andere bereits etablierte IVIg Indikationen der Fall ist
25