Influsplit Tetra
RSCA/W
Version:
RSCA/W
Version:
GlaxoSmithKline Artwork Information Panel
Item Number:
468249
E
i

Manufacturing Site:
GS K- B E L-Wa vre- B E WAV

Market or Pack Owner:
Germany-DEU
Market Trade Name: Influsplit Tetra
No. of Colours: 1
(does NOT indude Varnish, if applicable)
List Colours:
(indude sample in fields provided below; e.g. spot / spot-CMYK eq ui valent)

Technical Reference No(s).: BIO_DRW183
(do NOT indude the technical reference docfs] Version no[s].}
Artwork Copyright is the property of the GlaxoSmithKline Group of Companies
All suppliers providing a Service to GSK for printed components of any description must ensure that they have a licence for all fonts / Software used in conjunction with GSK artwork.
The distribution and use of fonts / Software without a licence constitutes an intellectual property infringement. GSK will not accept any liability for the breach of third party intellectual property rights by printed component suppliers.
The GSK certification / audit process requires suppliers to declare that they do not use unlicensed fonts / Software and may require the supplier to produce evidence of such licence to GSK.
ATTENTION • ATTENTION
To Ensure Accurate PDF Viewing and Printing: FOR SCREEN VIEWING: Use Adobe Acrobat 5 Professional or Adobe Acrobat Reader, Standard or Professional (higher than 5). Overprint Preview must be activated for accurate on screen viewing. FOR PRINTING: Use only Acrobat Professional Version 5 or higher. "Apply Overprint Preview" or "Simulate Overprinting" must be activated in the print settings for printing accurate hard copies.
TEXT SIZE CONTAINED IN THIS ARTWORK
Body text size: 9.0pt Leading: 10.0pt Horizontal Scale: 100% Smallest text size: 9.0pt Microtext: No
Page 1 of 2
Biologicals
Additional Information Panel Unfolded dimensions: 385x325mm
Folded dimensions: 130x55mm
2D Pharmacode value: 468249BWR
IMPORTANT
GSK Market is responsible for this product, its design and content.
Ensure the artwork is thoroughly checked, all the text proof-read and approved.
RSC GSK is responsible for site technical requirements and pre-press suitability.
GSK Market
is responsible to advise RSC in case changes required impact the followings:
Formulation Tablet embossing Storage conditions Shelf Life


Gebrauchsinformation Informationen für den Anwender
Influsplit Tetra® 2014/2015
Injektionssuspension in Fertigspritze
Influenza-Spaltimpfstoff (inaktiviert)
I I
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende Nebenwirkung melden. Hinweise zur Meldung von Nebenwirkungen, siehe Ende Abschnitt 4.
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie bzw. Ihr Kind mit diesem Impfstoff geimpft werden, denn sie enthält wichtige Informationen.
Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker.
Dieser Impfstoff wurde Ihnen bzw. Ihrem Kind persönlich verschrieben. Geben Sie ihn nicht an Dritte weiter.
Wenn Sie bzw. Ihr Kind Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht:
1. WAS IST INFLUSPLIT TETRA® UND WOFÜR WIRD ES ANGEWENDET?
2. WAS SOLLTEN SIE VOR DER ANWENDUNG VON INFLUSPLIT TETRA® BEACHTEN?
3. WIE IST INFLUSPLIT TETRA® ANZUWENDEN?
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
5. WIE IST INFLUSPLIT TETRA® AUFZUBEWAHREN?
6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN
1. WAS IST INFLUSPLIT TETRA® UND WOFÜR WIRD ES ANGEWENDET?
Influsplit Tetra® ist ein Impfstoff. Dieser Impfstoff wird empfohlen, um Sie bzw.
Ihr Kind vor der echten Virusgrippe (Influenza) zu schützen, insbesondere wenn ein erhöhtes Risiko für influenzabedingte Komplikationen besteht. Influsplit Tetra® sollte gemäß den offiziellen Empfehlungen angewendet werden.
Nach der Verabreichung von Influsplit Tetra® werden die natürlichen Abwehrmechanismen des Körpers einen Schutz vor einer Ansteckung mit der echten Virusgrippe aufbauen. Kein Bestandteil des Impfstoffes kann eine Virusgrippe verursachen.
Die echte Virusgrippe verbreitet sich sehr schnell, sie wird durch verschiedene Virustypen ausgelöst, die sich jedes Jahr ändern können. Deshalb sollten Sie bzw. Ihr Kind sich jedes Jahr impfen lassen. Die größte Gefahr einer Ansteckung mit der echten Virusgrippe besteht in der kalten Jahreszeit zwischen Oktober und März. Wenn Sie bzw. Ihr Kind nicht im Herbst geimpft wurden, kann eine Impfung auch noch bis zum Frühjahr ratsam sein, wenn für Sie bzw. Ihr Kind weiterhin Ansteckungsgefahr besteht. Ihr Arzt wird Sie beraten, wann die Impfung am besten durchgeführt wird.
Influsplit Tetra® schützt Sie bzw. Ihr Kind etwa 2-3 Wochen nach Verabreichung gegen die vier im Impfstoff enthaltenen Virusstämme (zwei Virus-A-Stämme und zwei Virus-B-Stämme, die im Impfstoff enthalten sind) oder diesen Stämmen ähnliche Varianten.
Da die Inkubationszeit einer Virusgrippe einige Tage beträgt, kann Influsplit Tetra® Sie bzw. Ihr Kind nicht vor einer echten Virusgrippe schützen, wenn Sie bzw. Ihr Kind sich zum Zeitpunkt der Impfung bereits angesteckt haben oder wenn die Erkrankung durch ein anderes Virus ausgelöst wurde.
Sie sollten auch beachten, dass viele Krankheitserreger arippeähnliche Erkrankungen (Erkältungskrankheiten) auslösen und Sie bzw. Ihr Kind durch Influsplit Tetra® nicht vor diesen Erkrankungen geschützt werden.
2. WAS SOLLTEN SIE BZW. IHR KIND VOR DER ANWENDUNG VON INFLUSPLIT TETRA® BEACHTEN?
Um sicher zu sein, dass Influsplit Tetra® für Sie bzw. Ihr Kind geeignet ist, ist es wichtig, dass Sie Ihren Arzt oder Apotheker darüber informieren, wenn einer der unten aufgeführten Punkte auf Sie bzw. Ihr Kind zutrifft. Fragen Sie Ihren Arzt oder Apotheker nach weiteren Erklärungen, wenn Sie etwas nicht verstehen.
Influsplit Tetra® darf nicht verabreicht werden,
wenn Sie bzw. Ihr Kind allergisch gegen die Wirkstoffe, gegen einen der in Abschnitt 6 genannten sonstigen Bestandteile oder gegen einen der in Spuren vorhandenen Bestandteile: z. B. von Eiern (Ovalbumin oder Hühnerproteine), Formaldehyd, Gentamicinsulfat oder Natriumdesoxycholat, dieses Impfstoffs sind, wenn Sie bzw. Ihr Kind an einer Erkrankung mit hohem Fieber oder an einer sonstigen akuten Erkrankung leiden. In diesem Fall sollte die Impfung verschoben werden, bis Sie bzw. Ihr Kind wieder gesund sind.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker bevor Sie oder Ihr Kind mit Influsplit Tetra® geimpft werden,
wenn Ihr Immunsystem oder das Ihres Kindes geschwächt ist (Immunsuppression).
wenn bei Ihnen bzw. Ihrem Kind aus irgendeinem Grund in den Tagen unmittelbar nach Gabe des Impfstoffs eine Blutuntersuchung durchgeführt werden soll. Bei einer kleinen Anzahl von Patienten zeigten sich bei einer Blutuntersuchung unmittelbar nach der Impfung falsch-positive Ergebnisse, wenn Sie bzw. Ihr Kind leicht bluten/blutet oder zu Blutergüssen neigen.
Ihr Arzt wird dann entscheiden, ob Sie bzw. Ihr Kind geimpft werden sollen.
Nach oder sogar vor einer Nadelinjektion kann es (meist bei Jugendlichen) zu einer Ohnmacht kommen. Informieren Sie daher den Arzt oder das medizinische Fachpersonal, wenn Sie bzw. Ihr Kind bei einer früheren Injektion schon einmal ohnmächtig geworden sind.
Wie bei allen anderen Impfstoffen auch kann es Vorkommen, dass nicht alle mit Influsplit Tetra® geimpften Personen vollständig geschützt sind.
Anwendung von Influsplit Tetra® zusammen mit anderen Arzneimitteln
• Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie bzw. Ihr Kind andere Arzneimittel anwenden, kürzlich andere Arneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden.
• Influsplit Tetra® kann zeitgleich mit anderen Impfstoffen in unterschiedliche Gliedmaßen verabreicht werden. Bei zeitgleicher Verabreichung kann es zu verstärkten Nebenwirkungen kommen.
Schwangerschaft, Stillzeit und Zeugungs-/Gebärfähigkeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Ihr Arzt wird entscheiden, ob Sie bzw. Ihr Kind mit Influsplit Tetra® geimpft werden sollen. Fragen Sie vor der Anwendung von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Der Impfstoff hat keine oder unwesentliche Auswirkungen auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen.
3. WIE IST INFLUSPLIT TETRA® ANZUWENDEN?
Dosierung
Erwachsene erhalten 1 x 0,5 ml.
Anwendung bei Kindern:
Kinder im Alter von 36 Monaten und älter erhalten 1 x 0,5 ml.
Kinder bis zum vollendeten 9. Lebensjahr, die noch nie gegen Grippe geimpft wurden, sollten frühestens 4 Wochen nach der ersten Impfung eine zweite Dosis erhalten.
Art der Anwendung
Ihr Arzt wird die entsprechende Dosis des Impfstoffes als Injektion in den Muskel verabreichen.
Wenn Sie weitere Fragen zur Anwendung des Impfstoffes haben, fragen Sie Ihren Arzt oder Apotheker.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann Influsplit Tetra® Nebenwirkungen verursachen, die aber nicht bei jedem auftreten müssen.
In klinischen Studien wurden die folgenden Nebenwirkungen beobachtet:
Sehr häufig (mehr als 1 in 10 Geimpften)
• Lokale Reaktionen: Schmerz
• Erschöpfung
• Muskelschmerzen (Myalgien)
Häufig (weniger als 1 in 10 Geimpften)
• Kopfschmerzen
• Übelkeit, Durchfall, Erbrechen, Magenschmerzen
• Gelenkschmerzen (Arthralgien)
• Fieber, Schüttelfrost,
• Lokale Reaktionen: Rötung, Schwellung
Selten (weniger als 1 in 100 Geimpften)
• Bluterguss, (Ekchymose), Juckreiz an der Injektionsstelle
• Schwindel
• Ausschlag
Außerdem traten Nebenwirkungen auf, die auch in klinischen Studien mit Influsplit SSW® (dem Grippeimpfstoff mit drei Virusstämmen) aufgetreten waren:
Häufig (weniger als 1 in 10 Geimpften)
• Verhärtung (Induration) an der Injektionsstelle
• Schweißausbruch
Die folgenden Nebenwirkungen wurden bei Kindern im Alter unter 6 Jahren berichtet:
Sehr häufig (mehr als 1 in 10 Geimpften)
• Reizbarkeit/ Aufgeregtheit
Häufig (weniger als 1 in 10 Geimpften)
• Appetitlosigkeit
• Schläfrigkeit
Diese Nebenwirkungen klingen gewöhnlich nach 1 bis 2 Tagen ohne Behandlung wieder folgenlos ab.
Während der breiten Anwendung von Influsplit SSW® (dem Grippeimpfstoff mit drei Virusstämmen) wurden zusätzlich die folgenden Nebenwirkungen beobachtet:
• allergische Reaktionen:
- in seltenen Fällen können diese zu einem medizinischen Notfall führen, wenn es zum Versagen des Blutkreislaufs kommt (Schock), der die ausreichende Versorgung in den verschiedenen Organen mit Blut aufrechterhält
- in sehr seltenen Fällen kann es zu Schwellungen, meistens im Bereich von Kopf, Hals oder Nacken einschließlich des Gesichts, der Lippen, der Zunge, der Kehle oder an anderen Körperstellen (Angioödeme) kommen
• Hautreaktionen, die sich nicht über den ganzen Körper ausbreiten können, einschließlich Hautjucken (Juckreiz, Nesselsucht) und Rötung (Erythema).
• Neurologische Störungen, die zu Nackensteife, Verwirrung, Taubheitsgefühl, Schmerz und Schwäche in den Gliedmaßen, Verlust des Gleichgewichts, Verlust der Reflexe, Lähmungserscheinungen an Teilen des Körpers oder am gesamten Körper (Encephalomyelitis, Neuritis, Guillain-Barre-Syndrom) führen können
• Vorübergehende Schwellung der Lymphdrüsen im Hals-, Achsel- oder Leistenbereich (vorübergehende Lymphadenopathie)
• Grippeähnliche Symptome, allgemeines Unwohlsein Meldung von Nebenwirkungen
Wenn Sie bzw. Ihr Kind Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-lnstitut, Paul-Ehrlich-Straße 51 - 59, 63225 Langen, Telefon: +49 6 10 37 70, Telefax: +49 61 03 77 12 34, Website: www.pei.de, anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST INFLUSPLIT TETRA® AUFZUBEWAHREN?
Bewahren Sie das Arzneimittel außerhalb der Sicht- und Reichweite von Kindern auf.
Das Verfalldatum des Impfstoffs ist auf der Faltschachtel nach „Verwendbar bis: "mit Monat und Jahr aufgedruckt. Nach Ablauf des angegebenen Monats darf der Impfstoff nicht mehr verwendet werden.
Im Kühlschrank lagern (2° bis 8°C).
Nicht einfrieren! Impfstoffe, die versehentlich falsch gelagert oder eingefroren wurden, sind zu verwerfen.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall.
Fragen Sie Ihren Apotheker wie Arzneimittel zu entsorgen sind, wenn Sie sie nicht mehr verwenden. Diese Maßnahmen helfen die Umwelt zu schützen.
6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN Was enthält Influsplit Tetra®?
Wirksame Bestandteile: Influenza Virus (inaktiviert, Spaltantigene) der folgenden Stämme* pro Dosis (0,5 ml):
A/California/7/2009 (H1 N1)pdm09 - entsprechender verwendeter Stamm: NIB-74xp, abgeleitet von: A/Christchurch/16/2010 15 Mikrogramm HA**
A/Texas/50/2012 (H3N2) - davon abgeleiteter verwendeter Stamm:
NYMC X-223A 15 Mikrogramm HA**
B/Massachusetts/02/2012 - davon abgeleiteter verwendeter Stamm:
NYMC BX-51B (Yamagata-Linie) 15 Mikrogramm HA**
B/Brisbane/60/2008 (Victoria-Linie) 15 Mikrogramm HA**
* gezüchtet in befruchteten Hühnereiern von gesunden Hühnerherden “Hämagglutinin
Dieser Impfstoff entspricht den Empfehlungen der WHO (Weltgesundheitsorganisation) für die nördliche Hemisphäre und der EU-Entscheidung für die Saison 2014/2015.
Sonstige Bestandteile sind:
Natriumchlorid, Natriummonohydrogenphosphat x 12H20, Kaliumdihydrogenphosphat, Kaliumchlorid, Magnesiumchlorid x 6H20,
RRR a - Tocopherolhydrogensuccinat, Polysorbat 80 (Tween 80), Octoxinol 10 (Triton X-100) sowie Wasser für Injektionszwecke
Wie sieht Influsplit Tetra® aus und welche Packungsgrößen gibt es?
Influsplit Tetra® ist eine Injektionssuspension in Fertigspritze (0,5 ml) mit oder ohne Kanüle. Packungsgrößen: 1 oder 10.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. Pharmazeutischer Unternehmer und Hersteller
PHARMAZEUTISCHER UNTERNEHMER GlaxoSmithKline GmbH & Co. KG
80700 München Service Tel.: 0800 1 22 33 55 Service Fax: 0800 1 22 33 66 e-mail: produkt.info@ask.com
GlaxoSmithKline Artwork Information Panel
1
Item Number:
468249
Manufacturing Site:
GS K- B E L-Wa vre- B E WAV
Market or Pack Owner:
Germany-DEU
Market Trade Name: Influsplit Tetra
HERSTELLER
GlaxoSmithKline Biologicals
NL der SmithKline Beecham Pharma GmbH & Co. KG Zirkusstr. 40, 01069 Dresden Telefon : 0049-351-4561 0 Telefax : 0049-351-4561 5211
Dieses Arzneimittel ist in den Mitgliedstaaten der Europäischen Union im Rahmen des Dezentralen Zulassungsverfahrens unter den folgenden Bezeichnungen zugelassen:
No. of Colours: 1
(does NOT indude Varnish, if applicable)
List Colours:
(indude sample in fields provided below; e.g. spot / spot-CMYK eq ui valent)
(D
00
(0
O
u
O
■o
-O
c
ATTENTION • ATTENTION
To Ensure Accurate PDF Viewing and Printing:
in
FOR SCREEN VIEWING: Use Adobe Acrobat 5 |
Professional or Adobe Acrobat Reader, Standard or 'S
Professional (higher than 5). Overprint Preview ■
must be activated for accurate on screen viewing. “
FOR PRINTING: Use only Acrobat Professional Version 5 or higher. "Apply Overprint Preview" or "Simulate Overprinting" must be activated in the print settings for printing accurate hard copies.
|
Mitgliedsland |
Handelsname |
|
Deutschland |
Influsplit Tetra |
|
Griechenland, Großbritannien, Italien, Österreich, Slowakische Republik, Spanien, Tschechische Republik |
Fluarix Tetra |
|
Frankreich |
FluarixTetra |
|
Belgien, Luxemburg |
a-RIX-Tetra |
Diese Packungsbeilage wurde zuletzt überarbeitet im April 2014.
K
Technical Reference No(s).: BIO_DRW183
(do NOT indude the technical reference docfs] Version no[s].)
Artwork Copyright is the property of the GlaxoSmithKline Group of Companies
All suppliers providing a Service to GSK for printed components of any description must ensure that they have a licence for all fonts / Software used in conjunction with GSK artwork.
The distribution and use of fonts / Software without a licence constitutes an intellectual property infringement. GSK will not accept any liability for the breach of third party intellectual property rights by printed component suppliers.
The GSK certification / audit process requires suppliers to declare that they do not use unlicensed fonts / Software and may require the supplier to produce evidence of such licence to GSK.
Die folgenden Hinweise sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Wie bei allen injizierbaren Impfstoffen sollten für den seltenen Fall einer anaphylaktischen Reaktion nach der Gabe des Impfstoffes entsprechende Möglichkeiten der medizinischen Behandlung und Überwachung stets sofort verfügbar sein (Adrenalin, Kortikosteroide, Antihistaminika).
Die Immunisierung mit Influsplit Tetra® sollte intramuskulär erfolgen.
Der Impfstoff (Influsplit Tetra®) sollte auf keinen Fall intravasal verabreicht werden.
Bei gleichzeitiger Verabreichung eines anderen Impfstoffes sollten verschiedene Injektionsstellen (kontralateral) gewählt werden.
Der Impfstoff sollte bei der Verabreichung Zimmertemperatur haben.
Vor Gebrauch ist die Spritze mit dem Impfstoff zu schütteln. Überprüfen Sie den Impfstoff optisch vor der Anwendung.
Anleitung für die Verabreichung des Impfstoffes in einer Fertiaspritze ohne Nadel
Um die Kanüle/Nadel an der Spritze anzubringen, folgen Sie der Anleitung unten. Allerdings kann sich die mitgelieferte Spritze von der in der Anleitung beschriebenen Spritze etwas unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Kanüle/Nadel ohne zu schrauben angebracht werden.
TEXT SIZE CONTAINED IN THIS ARTWORK
Body text size: 9.0pt Leading: 10.0pt Horizontal Scale: 100% Smallest text size: 9.0pt Microtext: No
Nadel
Page 2 of 2
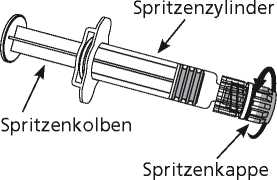
Abbildung 1
GSK Market is responsible for this product, its design and content.
Ensure the artwork is thoroughly checked, all the text proof-read and approved.
RSC GSK is responsible for site technical requirements and pre-press suitability.
Folded dimensions: 130x55mm
2D Pharmacode value: 468249BWR
GSK Market
is responsible to advise RSC in case changes required impact the followings:
Formulation Tablet embossing Storage conditions Shelf Life
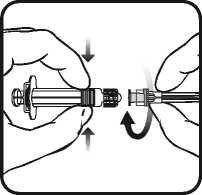
1. Halten Sie den Spritzenzylinder in einer Hand (vermeiden Sie, die Spritze am Kolben zu halten), drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab.
2. Um die Nadel an der Spritze anzubringen, drehen Sie die Nadel im Uhrzeigersinn in die Spritze bis sie fest sitzt (siehe Abbildung 1).
3. Entfernen Sie den Nadelschutz, der gelegentlich ein wenig fest sitzen kann.
4. Verabreichen Sie den Impfstoff.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist gemäß den lokalen Vorschriften zu entsorgen.
Sonstige Hinweise
Gemäß § 22 Infektionsschutzgesetz müssen alle Schutzimpfungen vom Impfarzt mit dem Impfdatum, Handelsnamen, der Chargen-Bezeichnung sowie der Angabe der Krankheit, gegen die geimpft wurde, in einen Impfausweis eingetragen werden.
Häufig unterbleiben indizierte Impfungen, weil bestimmte Situationen irrtümlicherweise als Impfhindernisse angesehen werden. Einzelheiten hierzu finden Sie in den jeweils aktuellen STIKO-Empfehlungen (Ständige Impfkommission am Robert-Koch-Institut, aktuell abrufbar über www.rki.de)
cn
■^r
CN
KO
■=3-