Influsplit Tetra
FACHINFORMATION
FACHINFORMATION

Influsplit Tetra® 2014/2015
▼ Arzneimittel unterliegt einer zu
sätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
1. BEZEICHNUNG DES ARZNEIMITTELS
Influsplit Tetra® 2014/2015
Injektionssuspension in Fertigspritze Influenza-Spaltimpfstoff (inaktiviert)
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Impfdosis (0,5 ml) enthält:
Wirkstoffe:
Gereinigte und durch Formaldehyd und Natriumdesoxycholat inaktivierte InfluenzaVirus Spaltantigene der folgenden Stämme*:
A/California/7/2009 (H1N1)pdm09-entsprechender verwendeter Stamm: NIB-74xp, abgeleitet von: A/Christchurch/16/2010
15 Mikrogramm HA**
A/Texas/50/2012 (H3N2)-davon abgeleiteter verwendeter Stamm: NYMC X-223A
15 Mikrogramm HA**
B/Massachusetts/02/2012-davon abgeleiteter verwendeter Stamm: NYMC BX-51B (Yamagata-Linie) 15 Mikrogramm HA**
B/Brisbane/60/2008 (Victoria-Linie)
15 Mikrogramm HA** 1 2 3 4
Der Einsatz von Influsplit Tetra® sollte auf Grundlage der jeweils aktuellen STIKO-Empfehlungen (STIKO = Ständige Impfkommission am Robert-Koch-Institut) erfolgen. Diese sind auf den Internetseiten des Robert-Koch-Institutes einzusehen: www.rki.de.
Es wird eine jährliche Neuimpfung mit dem vorliegenden Impfstoff empfohlen, da die Immunität im Jahr nach der Impfung abnimmt und da sich die im Umlauf befindlichen Influenzavirusstämme von Jahr zu Jahr ändern können.
4.2 Dosierung und Art der Anwendung
Dosierung
Erwachsene: 0,5 ml
Kinder:
Kinder im Alter ab 3 Jahre: 0,5 ml
Kinder bis zum vollendeten 9. Lebensjahr, die noch nie gegen Grippe geimpft wurden, sollten nach einem Zeitraum von mindestens 4 Wochen eine zweite Dosis bekommen.
Kinder unter 3 Jahren: Die Sicherheit und Wirksamkeit von Influsplit Tetra® bei Kindern unter 3 Jahren ist nicht bewiesen.
Art der Anwendung
Der Impfstoff wird intramuskulär verabreicht.
Notwendige Vorsichtsmaßnahmen zur Vorbereitung der Impfung sind zu treffen.
Hinweise zur Handhabung vor der Applikation des Impfstoffs, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe, gegen einen der in Abschnitt 6.1 genannten sonstigen Bestandteile oder gegen sonstige in Spuren vorhandene Bestandteile vom Ei (Ovalbumin, Hühnerprotein), Formaldehyd, Gentamicinsulfat und Natrium-desoxycholat.
Bei fieberhaften Erkrankungen und akuten Infektionen sollte die Impfung auf einen späteren Zeitpunkt verschoben werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Zur guten klinischen Praxis gehört es, vor der Impfung die medizinische Vorgeschichte (besonders hinsichtlich vorheriger Impfungen und des möglichen Auftretens unerwünschter Wirkungen) zu überprüfen und eine klinische Untersuchung durchzuführen.
Wie bei allen injizierbaren Impfstoffen sollten für den seltenen Fall einer anaphylaktischen Reaktion nach der Gabe des Impfstoffes entsprechende Möglichkeiten der medizinischen Behandlung und Überwachung stets sofort verfügbar sein (Adrenalin, Kortikosteroide, Antihistaminika).
Der Impferfolg kann bei Patienten mit endogener oder iatrogener Immunsuppression möglicherweise eingeschränkt sein.
Influsplit Tetra® schützt nicht gegen alle möglichen Stämme von Influenzaviren. Influsplit Tetra® soll Schutz bieten gegen die im Impfstoff enthaltenen Stämme und diesen Stämmen ähnliche Varianten.
Wie bei allen anderen Impfstoffen auch kann es vorkommen, dass nicht alle mit Influsplit Tetra® geimpften Personen vollständig geschützt sind.
Influsplit Tetra® darf auf keinen Fall intravasal verabreicht werden.
Wie bei anderen intramuskulär verabreichten Impfstoffen sollte Influsplit Tetra® bei Personen mit Thrombozytopenie oder einer Gerinnungsstörung nur vorsichtig verabreicht werden, da bei diesen Personen nach einer intramuskulären Verabreichung eine Blutung auftreten kann.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmaßen begleitet sein. Es ist wichtig, Maßnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Zu Interferenzen mit serologischen Tests, siehe Abschnitt 4.5.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zu sonstigen Wechselwirkungen durchgeführt. Bei gleichzeitiger Verabreichung eines anderen Impfstoffes sollten verschiedene Injektionsstellen (kontralateral) gewählt werden.
Nach der Grippeschutzimpfung wurden falsch positive Ergebnisse bei serologischen Tests beobachtet, die mittels ELISAMethode Antikörper gegen HIV1, Hepatitis C und insbesondere HTLV1 nachweisen. Die Western Blot-Technik widerlegt die falsch positiven ELISA Testergebnisse. Die vorübergehend falsch positiven Ergebnisse könnten auf die IgM-Immunantwort aufgrund der Impfung zurückzuführen sein.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Inaktivierte Influenza Impfstoffe können in allen Phasen der Schwangerschaft gegeben werden. Verglichen mit dem 1. Trimester sind für das 2. und 3. Trimester mehr Daten über die Sicherheit von Grippeimpfstoffen verfügbar. Auf jeden Fall zeigen die Daten nach weltweiter Anwendung von inaktivierten Influenza Impfstoffen keine gesundheitsgefährdenden Einflüsse auf die Schwangere oder das Baby.
Stillen
Influsplit Tetra® kann während der Stillzeit verabreicht werden.
Fertilität
Daten bezogen auf den Einfluss auf die Fertilität sind nicht verfügbar.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Der Impfstoff hat keine oder unwesentliche Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen.
Influsplit Tetra® 2014/2015

4.8 Nebenwirkungen
Klinische Studien - Zusammenfassung der Sicherheit
In zwei klinischen Studien wurde gesunden Erwachsenen von 18 Jahren und älter sowie gesunden Kindern von 3 bis 17 Jahren Influsplit Tetra® (mehr als 3000 Erwachsenen und 900 Kindern) oder der trivalente Influenza Impfstoff von GlaxoSmithKline - Influsplit SSW® (mehr als 1000 Erwachsenen und 900 Kindern) verabreicht. Bei den mit Influsplit Tetra® und Influsplit SSW® Geimpften wurden ähnliche Häufigkeiten des Auftretens der betreffenden Nebenwirkungen festgestellt.
Bei allen Altersgruppen war die am häufigsten berichtete lokale Nebenwirkung nach der Impfung Schmerz an der Impfstelle (36,4 % bis 40,9 %).
Bei den Erwachsenen ab 18 Jahren und älter waren die am häufigsten berichteten allgemeinen Nebenwirkungen nach der Impfung Erschöpfung (11,1 %), Kopfschmerz (9,2 %) und Muskelschmerzen (11,8 %).
Bei den 6 bis 17 Jahre alten Personen waren die am häufigsten berichteten allgemeinen Nebenwirkungen nach der Impfung Erschöpfung (12,6 %), Muskelschmerzen (10,9 %) und Kopfschmerzen (8,0 %).
Bei den 3 bis 5 Jahre alten Personen waren die am häufigsten berichteten allgemeinen Nebenwirkungen nach der Impfung Benommenheit (9,8 %) und Reizbarkeit (11,3 %).
Liste der Nebenwirkungen
Die für Influsplit Tetra® festgestellten Nebenwirkungen werden pro Impfstoffdosis gemäß den folgenden Häufigkeitskategorien aufgelistet:
Sehr häufig > 1/10
Häufig > 1/100 bis < 1/10
Gelegentlich > 1/1.000 bis < 1/100 Selten > 1/10.000 bis < 1/1.000
Sehr selten < 1/10.000
Stoffwechsel- und Ernährungsstörungen Häufig: Appetitlosigkeit1
Psychiatrische Störungen Sehr häufig: Reizbarkeit1
Störungen des Nervensystems Häufig: Benommenheit1, Kopfschmerzen Gelegentlich: Schwindel2
Magen-Darm-Störungen Häufig: Magen-Darm-Symptome (ein
schließlich Übelkeit, Erbrechen, Durchfall und/oder Unterleibsschmerz)
Haut- und subkutane Gewebsstörungen: Gelegentlich: Ausschlag3
Skelettmuskulatur- und Bindegewebsstö-rungen
Sehr häufig: Muskelschmerzen Häufig: Gelenkschmerzen
Allgemeine Nebenwirkungen und Nebenwirkungen an der Injektionsstelle
Gelegentlich: Hämatom an der Injektionsstelle2, Juckreiz an der Injektionsstelle
1 bei Personen unter 6 Jahren als abgefragtes Symptom angegeben
2 für erwachsene Personen angegeben
3 für 3 bis 17 Jahre alte Personen angegeben
4 sehr häufig bei 3 bis 17 Jahre alten Personen
Außerdem wurden in früheren Studien mit Influsplit SSW® die folgenden Nebenwirkungen angegeben:
Haut- und subkutane Gewebsstörungen: Häufig: Schweißausbruch
Allgemeine Störungen und Beschwerden an der Injektionsstelle
Häufig: Verhärtung an der Injektionsstelle
Daten nach der Markteinführung
Bisher gibt es keine weiteren Angaben zu Nebenwirkungen nach Applikation von Influsplit Tetra®. Da jedoch alle drei in Influsplit SSW® enthaltenen Grippestämme auch in Influsplit Tetra® enthalten sind, können die folgenden Nebenwirkungen, die nach der Markteinführung von Influsplit SSW® beobachtet worden sind, auch bei Patienten nach der Zulassung von Influsplit Tetra® auftreten.
Störungen des Blut- und Lymphsystems: Selten: vorübergehende Lymphadenopathie
Störungen des Immunsystems:
Selten: allergische Reaktionen (einschließlich anaphylaktische Reaktionen)
Störungen des Nervensystems Selten: Neuritis, akute disseminierte Enzephalomyelitis, Guillain-Barre-Syndrom*
* Nach der Impfung mit Influsplit SSW® gingen spontane Berichte über das Guillain-Barre-Syndrom ein; ein kausaler Zusammenhang zwischen der Impfung und dem Guillain-Barre-Syndrom ist jedoch nicht nachgewiesen worden.
Haut- und subkutane Gewebsstörungen: Selten: Nesselsucht, Juckreiz, Erythem, Angioödem
Allgemeine Störungen und Beschwerden an der Injektionsstelle
Selten: grippeähnliche Erkrankung, Unwohlsein
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Ver-hältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Straße 51 - 59, 63225 Langen, Telefon: +49 6 10 37 70, Telefax: +49 61 03 77 12 34, Website: www.pei.de, anzuzeigen.
4.9 Überdosierung
Eine unerwünschte Wirkung durch Überdosierung ist unwahrscheinlich.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: InfluenzaImpfstoff
ATC-Code: J07BB02
Wirkungsmechanismus Influsplit Tetra® bietet aktiven Impfschutz gegen vier Influenzavirusstämme (zwei A-Subtypen und zwei B-Typen), die im Impfstoff enthalten sind.
Influsplit Tetra® löst humorale Antikörper gegen Hämagglutinine aus. Diese Antikörper neutralisieren die Grippeviren.
Spezifische Werte von Hämagglutinations-hemmungs(HI)-Antikörpertitern nach der Impfung mit inaktivierten Influenzavirus-Impfstoffen konnten nicht mit dem Schutz gegen die Grippekrankheit korreliert werden, aber die HI-Antikörpertiter sind als Maß der Impfaktivität verwendet worden. Bei einigen Belastungs-Untersuchungen (Challenge-Un-tersuchungen) mit Menschen sind bei bis zu 50 % der Personen HI-Antikörpertiter von > 1:40 mit dem Schutz gegen Grippe-Erkrankungen in Zusammenhang gebracht worden.
Pharmakodynamische Wirkungen Immunogenität von Influsplit Tetra® versus Influsplit SSW®
Bei klinischen Untersuchungen an Erwachsenen (D-QIV-001 und D-QIV-008) sowie an Kindern im Alter von 3 bis 17 Jahren (D-QIV-003) wurde eingeschätzt, dass Influsplit Tetra® am Tag 21 (Erwachsene) und am Tag 28 (Kinder) beim geometrischen Mittelwert des HI-Antikörpertiters (GMT) und bei der HI-Serokonversionsrate (4-facher Anstieg beim reziproken Titer oder dem Wechsel von einem nicht feststellbaren [< 10] zu einem reziproken Titer von > 40) dem Influsplit SSW® nicht unterlegen war.
Bei allen Studien war die Immunantwort von Influsplit Tetra® auf die drei gemeinsamen Stämme nicht schlechter als die von Influsplit SSW®. Im Vergleich zu Influsplit SSW® löste Influsplit Tetra® eine bessere Immunantwort auf den zusätzlich im Influsplit Tetra® enthaltenen B-Stamm aus.
Erwachsene, 18 Jahre und älter In der klinischen Studie D-QIV-008 erhielten etwa 1800 Erwachsene im Alter von 18 Jahren und darüber eine einzelne Dosis Influsplit Tetra® und etwa 600 Personen eine einzelne Dosis Influsplit SSW®.
Siehe Tabelle 1 auf Seite 3
Die postvakzinalen Seroprotektionsraten (Tag 21, reziproker Titer > 40) für Influsplit Tetra® betrugen 91,3 % gegenüber A/ H1N1, 96,8 % gegenüber A/H3N2, 98,8 % gegenüber B (Victoria) und 91,8 % gegenüber B (Yamagata).
In der klinischen Studie D-QIV-001 (Impfstoffzusammensetzung wie in der Saison 2007 - 2008) betrugen die postvakzinalen Seroprotektionsraten für Influsplit Tetra®

Tabelle 1: GMT und Serokonversionsraten nach der Impfung
|
Erwachsene, 18 Jahre und älter |
Influsplit Tetra® N = 1809 |
Influsplit SSW®.1 N = 608 |
|
GMT (95 % Konfidenzintevall) | ||
|
A/H1N1 |
201,1 (188,1;215,1) |
218,4 (194,2;245,6) |
|
A/H3N2 |
314,7 (296,8;333,6) |
298,2 (268,4;331,3) |
|
B (Victoria)2 |
404,6 (386,6;423,4) |
393,8 (362,7;427,6) |
|
B (Yamagata)3 |
601,8 (573,3;631,6) |
386,6 (351,5;425,3) |
|
Serokonversionsrate (95 % Konfidenzintervall) | ||
|
A/H1N1 |
77,5 % (75,5;79,4) |
77,2 % (73,6;80,5) |
|
A/H3N2 |
71,5 % (69,3;73,5) |
65,8 % (61,9;69,6) |
|
B (Victoria) |
58,1 % (55,8;60,4) |
55,4 % (51,3;59,4) |
|
B (Yamagata) |
61,7 % (59,5;64,0) |
45,6 % (41,6;49,7) |
1 enthält A/H1N1, A/H3N2 und B (Victoria)
2 von der WHO empfohlener Stamm in der Saison 2010 - 2011
3 zusätzlicher B-Stamm in Influsplit Tetra®, empfohlen in der Saison 2008 - 2009
Tabelle 2: GMT und Serokonversionsraten nach der Impfung
|
Kinder im Alter von 3 bis 17 Jahren |
Influsplit Tetra® N = 791 |
Influsplit SSW®.1 N = 818 |
|
GMT (95 % Konfidenzintervall) | ||
|
A/H1N1 |
386,2 (357,3;417,4) |
433,2 (401,0;468,0) |
|
A/H3N2 |
228,8 (215,0;243,4) |
227,3 (213,3;242,3) |
|
B (Victoria)2 |
244,2 (227,5;262,1) |
245,6 (229,2;263,2) |
|
B (Yamagata)3 |
569,6 (533,6;608,1) |
224,7 (207,9;242,9) |
|
Serokonversionsrate (95 % Konfidenzintervall) | ||
|
A/H1N1 |
91,4 % (89,2;93,3) |
89,9 % (87,6;91,8) |
|
A/H3N2 |
72,3 % (69,0;75,4) |
70,7 % (67,4;73,8) |
|
B (Victoria) |
70,0 % (66,7;73,2) |
68,5 % (65,2;71,6) |
|
B (Yamagata) |
72,5 % (69,3;75,6) |
37,0 % (33,7;40,5) |
1 enthält A/H1N1, A/H3N2 und B (Victoria)
2 von der WHO empfohlener Stamm in der Saison 2010 - 2011
3 zusätzlicher B-Stamm in Influsplit Tetra®, empfohlen in der Saison 2008 - 2009
Tabelle 3: Erkrankungsrate und Wirksamkeit des Impfstoffs gegen die Erkrankung verbunden mit dem Beweis einer Influenza A oder B Infektion bei Erwachsenen im Alter von 18 bis 64 Jahren (gesamte geimpfte Kohorte)
|
Erkrankungsrate (n/N)1 |
Wirksamkeit (95 % KI2) | |||||
|
N |
n |
% |
% |
UG3 |
OG | |
|
Antigenetisch übereinstimmende, kulturbestätigte Influenza4 | ||||||
|
Influsplit SSW® |
5103 |
49 |
1,0 |
66,9 |
51,9 |
77,4 |
|
Placebo |
2549 |
74 |
2,9 |
- |
- |
- |
|
Alle kulturbestätigten Influenzafälle (übereinstimmend, nicht übereinstimmend und untypisiert)5 | ||||||
|
Influsplit SSW® |
5103 |
63 |
1,2 |
61,6 |
46,0 |
72,8 |
|
Placebo |
2549 |
82 |
3,2 |
- |
- |
- |
1 n/N: Anzahl der Fälle/Zahl der Probanden gesamt
2 KI: Konfidenzintervall
3 UG: Untere Grenze
4 Es gab keine mit dem Impfstoff übereinstimmenden, kulturbestätigten Fälle der Influenzastämme A/New Caledonia/20/1999 (H1N1) oder B/Malaysia/2506/2004 in der Influsplit SSW® oder Placebo Gruppe
5 Von den 22 zusätzlichen Fällen waren 18 nicht übereinstimmend und 4 untypisiert; 15 der
Influsplit Tetra® 2014/2015
92,3 % gegenüber A/H1N1,97,1 % gegenüber A/H3N2, 97,1 % gegenüber B (Victoria) und 98,1 % gegenüber B (Yamagata).
Kinder im Alter von 3 bis 17 Jahren In der klinischen Studie (D-QIV-003) erhielten etwa 900 Kinder zwischen 3 und 17 Jahren eine oder zwei Dosen Influsplit Tetra® bzw. Influsplit SSW®.
Siehe Tabelle 2
Die postvakzinalen Seroprotektionsraten für Influsplit Tetra® betrugen 96,6 % gegenüber A/H1N1,98,0 % gegenüber A/H3N2, 97,3 % gegenüber B (Victoria) and 99,2 % gegenüber B (Yamagata).
Wirksamkeit bei Erwachsenen im Alter von 18 - 64 Jahren
Bei einer klinischen Studie mit mehr als 7600 Probanden in Tschechien und Finnland wurde die Wirksamkeit von Influsplit SSW® bewertet, um kulturbestätigte Influenza A und/oder B Fälle bei antigenetisch übereinstimmenden Influenzavirusstämmen zu vermeiden.
Die Probanden wurden hinsichtlich grippeähnlicher Erkrankungen, die mittels Kultur bestätigt wurden, überwacht (siehe Ergebnisse in der nachfolgenden Tabelle). Die grippeähnliche Erkrankung wurde definiert als mindestens ein allgemeines Symptom (Fieber > 37,8 °C und/oder Muskelschmerzen) und mindestens ein Symptom der Atemwege (Husten und/oder Halsschmerzen).
Siehe Tabelle 3
In dieser Studie wurde auch die Immunoge-nität ausgewertet.
Tabelle 4: Postvakzinaler GMT und Serokonversionsraten
|
Erwachsene 18 - 64 Jahre |
Influsplit SSW®1 N = 291 |
|
GMT (95 % Konfidenzintervall) | |
|
A/H1N1 |
541,0 (451,0;649,0) |
|
A/H3N2 |
133,2 (114,6;154,7) |
|
B (Victoria) |
242,8 (210,7;279,7) |
|
Serokonversionsrate (95 % Konfidenzintervall) | |
|
A/H1N1 |
76,3 % (71,0;81,1) |
|
A/H3N2 |
73,9 % (68,4;78,8) |
|
B (Victoria) |
85,2 % (80,6;89,1) |
1 enthält A/H1N1, A/H3N2 und B (VictoriaLinie)
Die postvakzinalen Seroprotektionsraten betrugen 97,6 % gegenüber A/H1N1,
86,9 % gegenüber A/H3N2 und 96,2 % gegenüber B (Victoria).
Die Europäische Arzneimittelagentur hat die Pflicht zur Einreichung der Ergebnisse von Influsplit Tetra®-Studien mit einer oder mehreren Untergruppen der Kinderpopulation, die der Vorbeugung einer Grippeerkrankung durch die sich im Impfstoff befindlichen zwei Influenza-A-Virus-Subtypen und die zwei Influenza-B-Virus-Typen dienen, zurückgestellt
Influsplit Tetra® 2014/2015

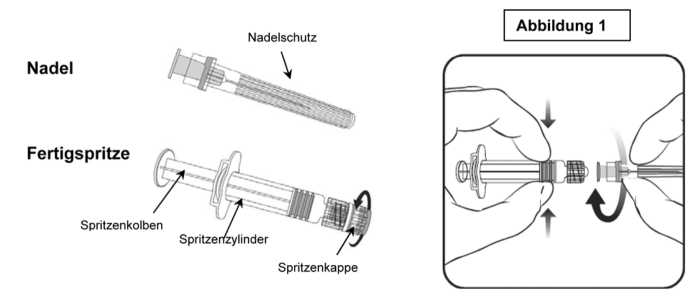
1. Halten Sie den Spritzenzylinder in einer Hand (vermeiden Sie, die Spritze am Kolben zu halten), drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab.
2. Um die Nadel an der Spritze anzubringen, drehen Sie die Nadel im Uhrzeigersinn in die Spritze bis sie fest sitzt (siehe Abbildung 1).
3. Entfernen Sie den Nadelschutz, der gelegentlich ein wenig fest sitzen kann.
4. Verabreichen Sie den Impfstoff.
(weitere Informationen über kinderärztliche Anwendung siehe Abschnitt 4.2).
5.2 Pharmakokinetische Eigenschaften
Für Impfstoffe nicht zutreffend
5.3 Präklinische Daten zur Sicherheit
Nichtklinische Daten weisen auf keine speziellen Gefahren für Menschen in konventionellen Studien hin, die in Bezug auf akute Toxizität, lokale Verträglichkeit, Toxizität bei wiederholter Gabe und reproduktive/Ent-wicklungstoxizität durchgeführt wurden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumchlorid, Natriummonohydrogenphosphat x 12H2O, Kaliumdihydrogen-phosphat, Kaliumchlorid, Magnesiumchlorid x 6H2O, RRR-a-Tocopherolhydrogen-succinat, Polysorbat 80 (Tween 80), Octoxi-nol 10 (Triton X-100) sowie Wasser für Injektionszwecke.
6.2 Inkompatibilitäten muss die Kanüle/Nadel ohne zu schrauben angebracht werden.
Da keine Daten aus Kompatibilitätsstudien vorliegen, darf der Impfstoff nicht mit anderen Arzneimitteln gemischt werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist gemäß den lokalen Vorschriften zu entsorgen.
6.3 Dauer der Haltbarkeit
7. INHABER DER ZULASSUNG
1 Jahr.
Das Verfallsdatum des Impfstoffes ist auf dem Etikett und der Verpackung angegeben.
GlaxoSmithKline GmbH & Co. KG 80700 München Service Tel.: 0800 1 22 33 55 Service Fax: 0800 1 22 33 66 e-mail: produkt.info@gsk.com
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Der Impfstoff ist im Kühlschrank bei + 2 °C bis + 8 °C zu lagern und darf nicht eingefroren werden.
Um den Impfstoff vor Lichteinflüssen zu schützen, ist er in der Originalverpackung aufzubewahren.
6.5 Art und Inhalt des Behältnisses
0,5 ml Suspension in Fertigspritze (Glasart Typ I) mit einem Kolbenstopfen (grauer Butylkautschuk) mit oder ohne Nadel - Packungsgrößen zu 1 oder 10.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise für die Handhabung
Der Impfstoff sollte bei der Verabreichung Zimmertemperatur haben. Vor Gebrauch ist die Spritze mit dem Impfstoff zu schütteln. Überprüfen Sie den Impfstoff optisch vor der Anwendung.
Anleitung für die Verabreichung des Impfstoffes in einer Fertigspritze ohne Nadel Um die Kanüle/Nadel an der Spritze anzubringen, folgen Sie der Anleitung rechts oben. Allerdings kann sich die mitgelieferte Spritze von der in der Anleitung beschriebenen Spritze etwas unterscheiden (d. h. ohne Schraubgewinde). In diesem Fall
8. ZULASSUNGSNUMMER(N)
PEI.H.11629.01.1
9. DATUM DER ERTEILUNG DER ZU-LASSUNG/VERLÄNGERUNG DER ZULASSUNG
04.03.2013
10. STAND DER INFORMATION
April 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
12. HINWEISE
Gemäß § 22 Infektionsschutzgesetz müssen alle Schutzimpfungen vom Impfarzt mit dem Impfdatum, Handelsnamen, der ChargenBezeichnung sowie der Angabe der Krankheit, gegen die geimpft wurde, in einen Impfausweis eingetragen werden.
Häufig unterbleiben indizierte Impfungen, weil bestimmte Situationen irrtümlicherweise als Impfhindernisse angesehen werden. Einzelheiten hierzu finden Sie in den jeweils aktuellen STIKO-Empfehlungen (Ständige Impfkommission am Robert-Koch-Institut, aktuell abrufbar über www.rki.de).
Zentrale Anforderung an: Rote Liste Service GmbH Fachinfo-Service Mainzer Landstraße 55 60329 Frankfurt
4
* vermehrt in embryonierten Hühnereiern von gesunden Hühnerherden ** Hämagglutinin
Dieser Impfstoff entspricht den Empfehlungen der WHO (Weltgesundheitsorganisation) für die nördliche Hemisphäre und der EU-Entscheidung für die Saison 2014/2015.
Sonstige Bestandteile:
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
Influsplit Tetra® kann Spuren von Eiern (wie Ovalbumin, Hühnerproteine), Formaldehyd, Gentamicinsulfat und Natriumdesoxycholat enthalten, die im Herstellungsprozess verwendet werden (siehe Abschnitt 4.3)
DARREICHUNGSFORM
Suspension zur Injektion in Fertigspritze. Die Suspension ist farblos bis leicht opaleszierend.
Sehr häufig: Schmerz an der Injektionsstelle, Erschöpfung
Häufig: Rötung an der Injektionsstelle4, Schwellung an der Injektionsstelle4, Schüttelfrost, Fieber