Ketof 1 Mg/5 Ml Sirup
Fachinformation (Zusammenfassung der Merkmale der Arzneimittel/SPC)
1. BEZEICHNUNG DER ARZNEIMITTEL
Ketof, 1 mg Hartkapseln Ketof 1 mg/5 ml Sirup
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Ketof, Hartkapseln
1 Hartkapsel enthält 1,38 mg Ketotifenhydrogenfumarat, entsprechend 1,0 mg Ketotifen.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
Ketof 1 mg/5 ml Sirup
5 ml Sirup (= 1 Messlöffel) enthalten 1,38 mg Ketotifenhydrogenfumarat, entsprechend 1,0 mg Ketotifen.
Sonstige Bestandteile mit bekannter Wirkung: 5 ml Sirup enthalten 100 mg Ethanol 96 % (2,4 Vol.-%), 1,67 mg Methyl-4-hydroxybenzoat (Ph.Eur.), 0,83 mg Propyl-4-hydroxybenzoat (Ph.Eur.), 3 g Sorbitol (Ph.Eur.).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Ketof, Hartkapseln Hartkapsel
Weiße Hartkapseln mit weißem Pulver
Ketof 1 mg/5 ml Sirup Sirup
Farbloser bis leicht strohfarbener, klarer Sirup
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Längerfristige Anwendung zur Vorbeugung von asthmatischen Beschwerden in Kombination mit anderen antientzündlichen Medikamenten bei Patienten mit allergischer Polysymptomatik.
Allergischer Schnupfen und allergische Hauterkrankungen im Sinne einer symptomatischen Behandlung, wenn eine Therapie mit nichtsedierenden oralen Antihistaminika, bei Rhinitis allergica auch lokalen Antihistaminika oder lokalen Glukokortikoiden, nicht indiziert ist.
Hinweis
Zur Behandlung des akuten Asthmaanfalls eignet sich Ketof nicht.
Aufgrund der Datenlage kann eine alleinige Behandlung des Asthma bronchiale mit Ketof nicht empfohlen werden. Mit einem Wirkungseintritt von Ketotifen ist erst nach 8-12 Wochen zu rechnen.
4.2 Dosierung und Art Art der Anwendung
Dosierung Ketof, Hartkapseln
Erwachsene, Jugendliche und Kinder ab 6 Jahre nehmen während der ersten 3-4 Tage der Behandlung abends je 1 Hartkapsel Ketof ein, danach morgens und abends je 1 Hartkapsel Ketof.
Falls notwendig, kann bei Erwachsenen und Kindern ab 10 Jahre die Dosis auf maximal 2 Hartkapseln Ketof morgens und abends erhöht werden.
Ketof 1 mg/5 ml Sirup
Ketof wird für die Anwendung bei Kindern unter 6 Monaten nicht empfohlen aufgrund nicht ausreichender Daten zur Unbedenklichkeit und Wirksamkeit.
Kleinkinder von 6 Monaten bis 3 Jahren erhalten morgens und abends je % Messlöffel zu 2,5 ml Ketof 1 mg/5 ml Sirup (entsprechend 0,5 mg Ketotifen).
Erwachsene, Jugendliche und Kinder ab 3 Jahre nehmen während der ersten 3-4 Tage der Behandlung abends je 1 Messlöffel zu 5 ml Ketof 1 mg/5 ml Sirup (entsprechend 1 mg Ketotifen) ein, danach morgens und abends je 1 Messlöffel zu 5 ml Ketof 1 mg/5 ml Sirup (entsprechend 1 mg Ketotifen).
Falls notwendig, kann bei Erwachsenen und Kindern ab 10 Jahre die Dosis auf maximal 2 Messlöffel zu 5 ml Ketof 1 mg/5 ml Sirup (entsprechend 2 mg Ketotifen) morgens und abends erhöht werden.
Besondere Dosierungsempfehlungen bei leber- oder niereninsuffizienten Patienten können wegen fehlender pharmakokinetischer Untersuchungen an diesem Patientenkollektiv nicht gegeben werden (siehe auch Abschnitt 5.2).
Art und Dauer der Anwendung Ketof, Hartkapseln
Die Hartkapseln sind mit Flüssigkeit einzunehmen.
Ketof 1 mg/5 ml Sirup
Der Sirup kann unverdünnt oder mit etwas Flüssigkeit (z. B. Tee oder Fruchtsaft) eingenommen werden. Die Packung enthält einen 5 ml Messlöffel mit Einteilungen bei 2,5 ml und 1,25 ml.
Da mit einem Wirkungseintritt erst nach einer Behandlungsdauer von 8-12 Wochen zu rechnen ist, sollte die Behandlung entsprechend lange durchgeführt werden. Eine Reduktion der Begleitmedikation sollte erst nach Ablauf dieses Zeitraums erwogen werden.
Ketof soll nicht abrupt abgesetzt werden, sondern allmählich über einen Zeitraum von 2-4 Wochen ausgeschlichen werden, da sich das Krankheitsbild sonst verschlechtern kann.
Eine besondere Begrenzung der Anwendungsdauer ist nicht vorgesehen.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
• Epilepsie.
• Patienten, die mit oralen Antidiabetika behandelt werden.
• Stillzeit.
Zusätzlich für Ketof® 1 mg/5 ml Sirup
Überempfindlichkeit gegen Methyl-4-hydroxybenzoat (Ph.Eur.) oder Propyl-4-hydroxybenzoat (Ph.Eur.).
Die Asthmatherapie sollte dem Schweregrad entsprechend stufenweise erfolgen. Der Erfolg der Therapie sollte durch regelmäßige ärztliche Untersuchungen und durch eine tägliche Selbstkontrolle (z. B. durch die Aufzeichnung des mit dem Peak-flow-Meter gemessenen Atemstoßes) überprüft werden. Im akuten Asthmaanfall sollte ein kurz wirkendes inhalatives Beta-Sympathomimetikum angewendet werden.
Ketof ist nicht wirksam bei der Verhinderung oder Behandlung von akuten Asthma-Anfällen.
Eine symptomatische und/oder prophylaktische Behandlung mit Antiasthmatika sollte niemals abrupt beendet werden, wenn eine Langzeit-Behandlung mit Ketof begonnen wurde. Dies gilt insbesondere bei systemischer Gabe von Kortikosteroiden, wegen einer möglichen Nebennierenrindeninsuffizienz bei steroidabhängigen Patienten. Bei solchen Fällen kann die Wiederherstellung einer normalen Hypophysen-Nebennieren-Funktion bis zu 1 Jahr dauern.
Bei Patienten, die Ketotifen gleichzeitig mit oralen Antidiabetika einnehmen, kann eine Thrombozytopenie auftreten. Die gleichzeitige Verabreichung dieser Arzneimittel sollte daher vermieden werden.
Krampfanfälle wurden sehr selten während einer Ketotifen-Therapie berichtet. Da Ketotifen die Krampfschwelle senken kann, sollte Ketotifen mit Vorsicht bei Patienten mit einer EpilepsieAnamnese eingesetzt werden (siehe Abschnitt 4.3).
Bei reduzierter Aufmerksamkeit, die möglicherweise durch die sedierende Wirkung von Ketotifen hervorgerufen wurde, sollte die Dosis reduziert werden.
Zusätzlich für Ketof 1 mg/5 ml Sirup Hinweis für Diabetiker
5 ml Sirup (= 1 Messlöffel) enthalten 3 g Sorbitol (eine Quelle für 0,75 g Fructose), entsprechend 0,25 BE. Sorbitol kann eine leicht laxierende Wirkung haben.
Patienten mit der seltenen hereditären Fructose-Intoleranz sollten Ketof 1 mg/5 ml Sirup nicht einnehmen.
Dieses Arzneimittel enthält 2,4 Vol.-% Alkohol (Ethanol).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Wirkung von Beruhigungsmitteln, Schlafmitteln, Antihistaminika, Antikoagulantien und Alkohol kann durch Ketof verstärkt werden.
Die gleichzeitige Verabreichung von oralen Antidiabetika und Ketof sollte vermieden werden (siehe Abschnitt 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung").
Ketotifen erhöht die Wirkung von Bronchodilatatoren. Deren Häufigkeit der Verwendung sollte reduziert werden, wenn sie zur gleichen Zeit wie Ketotifen verabreicht werden.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Obwohl Ketotifen bei Dosierungen, die von Muttertieren vertragen wurden, keine Auswirkungen auf die Schwangerschaft sowie peri- und postnatale Entwicklung hatte, wurde seine Sicherheit während der Schwangerschaft beim Menschen nicht nachgewiesen. Ketotifen sollte daher nur bei zwingender Indikation gegeben werden.
Stillzeit
Ketotifen tritt bei Ratten in die Muttermilch über. Es wird angenommen, dass dieses Arzneimittel auch in die Muttermilch beim Menschen übergeht. Mütter, die Ketotifen erhalten, sollten daher nicht stillen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Diese Arzneimittel können auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Der Patient sollte daher Vorsicht bei der Bedienung von Fahrzeugen oder Maschinen walten lassen.
Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol und Arzneimitteln, die ihrerseits das Reaktionsvermögen beeinträchtigen können.
4.8 Nebenwirkungen
Die Nebenwirkungen sind nach ihren Häufigkeiten gegliedert, beginnend mit den häufigsten.
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Infektionen und parasitäre Erkrankungen
Gelegentlich: Zystitis
Erkrankungen des Immunsystems
Sehr selten: Erythema multiforme, Stevens-Johnson-Syndrom, schwere Hautreaktion
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Gewichtszunahme
Psychiatrische Erkrankungen
Häufig: Erregung, Reizbarkeit, Schlaflosigkeit, Nervosität
Erkrankungen des Nervensystems
Gelegentlich: Schwindelgefühl
Selten: Sedierung
Sehr selten: Krampfanfälle
Nicht bekannt: Zentralnervöse Störungen, wie z. B. Unruhe, Aggressivität, Verwirrtheit, Schlafstörungen, Nervosität, bevorzugt bei Kindern
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Verschlimmerung des Asthma bronchiale (zu Therapiebeginn)
Erkrankungen des Gastrointestinaltrakts
Häufig: Mundtrockenheit, Übelkeit, Erbrechen (mit zunehmender Behandlungsdauer können diese Nebenwirkungen abklingen)
Leber- und Gallenerkrankungen
Sehr selten: Hepatitis, Anstieg der Leberenzyme
Erkrankungen der Haut und des Unterhautzellgewebes
Sehr selten: Schwere Hautreaktionen (Erythema multiforme, Stevens-Johnson-Syndrom) Nicht bekannt: Allergisch bedingte Exantheme, Urticaria
Erkrankungen der Nieren und Harnwege
Gelegentlich: Zystitis
Allgemeine Erkrankungen und Beschwerden
Sehr häufig: Müdigkeit
Häufig: Kopfschmerzen, Schwindel
Gelegentlich: Gewichtszunahme infolge Appetitsteigerung
Mit zunehmender Behandlungsdauer können diese Nebenwirkungen abklingen.
Zusätzlich für Ketof® 1 mg/5 ml Sirup Erkrankungen des Immunsystems
Nicht bekannt: Methyl-4-hydroxybenzoat (Ph.Eur.) und Propyl-4-hydroxybenzoat (Ph.Eur.) können Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen (selten Bronchospasmen).
Nicht bekannt: Aufgrund des Gehaltes an Sorbitol können bei Anwendung dieses Arzneimittels Magenbeschwerden (Magenverstimmung) und Durchfall auftreten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen- Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung Symptome der Intoxikation
Bisher ist die Einnahme von Einzeldosen bis zu 120 mg Ketotifen ohne letalen Ausgang bekannt geworden. Nach Einnahme extrem hoher Dosen können folgende Symptome auftreten:
Müdigkeit, Schläfrigkeit, Konfusion, Desorientierung, Brady- oder Tachykardie, Hypotension, Tachypnoe, Dyspnoe, Zyanose, Übererregbarkeit und Krämpfe (besonders bei Kindern), Koma.
Therapie von Intoxikationen
Entfernung aus dem Gastrointestinaltrakt durch
• Magenspülung
• medizinische Kohle
• salinische Laxanzien.
Ketotifen ist nicht dialysierbar.
Eine ggf. erforderliche symptomatische oder spezifische Behandlung sollte folgende Maßnahmen umfassen:
• Überwachung der Herz-Kreislauf- und Atemfunktionen
• bei anticholinergen Effekten Physostigmin
• bei Erregung oder Krämpfen kurzwirksame Barbiturate oder Benzodiazepine.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: andere Antihistaminika zur systemischen Anwendung ATC-Code: R06A X17
Ketotifen ist ein nicht bronchodilatorisch wirkendes Antihistaminikum, dass die Wirkungen gewisser endogener Stoffe, die als Entzündungsmediatoren bekannt sind, hemmt und dadurch eine antiallergische Wirkung ausübt.
Laborversuche haben eine Reihe von Eigenschaften von Ketotifen aufgezeigt, die zu seiner antiasthmatischen Wirkung beitragen können:
• Hemmung der Freisetzung allergischer Mediatoren wie Histamin und Leukotrienen
• Unterdrückung der Eosinophilenstimulation durch rekombinante humane Cytokine und dadurch Unterdrückung des Eindringens Eosinophiler in die Entzündungsstellen
• Hemmung der Entwicklung einer Hyperreaktivität der Luftwege, verbunden mit einer Thrombozytenaktivierung durch den PAF (Plättchen-aktivierenden Faktor) oder verursacht durch neurale Aktivierung als Folge der Anwendung von Sympathomimetika oder der Allergenexposition.
5.2 Pharmakokinetische Eigenschaften Resorption
Ketotifen wird nach oraler Verabreichung fast vollständig resorbiert. Die Bioverfügbarkeit beträgt etwa 50 %, aufgrund eines First-Pass Effekts von ca. 50 % in der Leber. Maximale Plasmakonzentrationen werden innerhalb von 2-4 Stunden erreicht.
Verteilung
Die Proteinbindung beträgt 75 %.
Biotransformation
Der Hauptmetabolit ist das praktisch inaktive Ketotifen-N-Glucuronid.
Das Metabolitenspektrum ist bei Kindern gleich wie bei Erwachsenen, aber die Clearance ist bei Kindern höher. Kinder über 3 Jahre benötigen daher die gleiche Dosierung wie Erwachsene.
Elimination
Ketotifen wird biphasisch mit einer kurzen Halbwertszeit von 3-5 Stunden und einer längeren von 21 Stunden eliminiert. Mit dem Urin werden innerhalb von 48 Stunden etwa 1 % der Wirksubstanz unverändert und 60-70 % als Metaboliten ausgeschieden.
Auswirkung auf Nahrungsmittel
Die Bioverfügbarkeit der einzelnen Darreichungsformen von Ketotifen wird durch Nahrungsaufnahme nicht beeinflusst.
5.3 Präklinische Daten zur Sicherheit Akute Toxizität
Studien zur akuten Toxizität von Ketotifen an Mäusen, Ratten und Kaninchen zeigten orale LD50-Werte über 300 mg/kg Körpergewicht sowie zwischen 5 und 20 mg/kg bei intravenöser Anwendung. Durch Überdosierung hervorgerufene unerwünschte Wirkungen waren Dyspnoe und motorische Erregung, gefolgt von Krämpfen und Benommenheit. Die toxischen Anzeichen traten rasch auf und verschwanden innerhalb von Stunden. Es gab keine Hinweise auf kumulative oder verzögerte Effekte. Aus anderen Studien an Ratten ergab sich ein oraler LD50-Wert von 161 mg/kg; dies zeigte, dass die Toxizität von Ketotifen Sirup (LD50 31,1 ml/kg) nur auf den Bestandteil
Sorbitol alleine zurückzuführen ist. Eine tägliche Gesamtdosis von 10 ml, die einem Kind von 30 kg Körpergewicht verabreicht wird, würde 0,33 ml/kg Ketotifen Sirup und 0,07 mg/kg Ketotifen-Base entsprechen. Ein ausreichend großer Sicherheitsabstand zur toxischen Dosis ist damit gewährleistet.
Die intrakutane Injektion bei Meerschweinchen erbrachte keine Hinweise auf ein hautreizendes Potential von Ketotifen.
Mutagenität
Ketotifen und/oder seine Metaboliten hatten kein gentoxisches Potential, wie bei In-vitro-Untersuchungen zur Induktion von Genmutationen bei Salmonella typhimurium, zu Chromosomenaberrationen bei V79 chinesischen Hamsterzellen oder zur primären DNA-Zerstörung bei Hepatozytenkulturen von Ratten untersucht wurde. In vivo (zytogenetische Analyse von Knochenmarkzellen des chinesischen Hamsters, Knochenmark-Mikronukleus-Test an Mäusen) wurde keine klastogene Aktivität beobachtet. Ebenso konnten im dominanten Letaltest keine mutagenen Effekte an Keimzellen von männlichen Mäusen gezeigt werden.
Karzinogenität
Es zeigte sich kein karzinogenes Potential an Ratten, die über 24 Monate pro Tag die maximal tolerierte Dosis von 71 mg/kg Ketotifen erhielten. Kein Beweis von tumorigenen Effekten konnte an Mäusen, die mit bis zu 88 mg/kg Körpergewicht für 74 Wochen behandelt wurden, erbracht werden.
Reproduktionstoxizität
Bei Ratten oder Kaninchen war kein embryotoxisches oder teratogenes Potential von Ketotifen nachweisbar. Bei männlichen Ratten, die 10 Wochen (= mehr als 1 spermatogener Zyklus) vor der Paarungszeit eine Dosis von 10 mg/kg/Tag erhielten, blieb die Fertilität unbeeinflusst.
Orale Dosen bis zu 50 mg/kg/Tag zeigten sowohl in der Fertilität von weiblichen Ratten als auch in der pränatalen Entwicklung, der Trächtigkeit und der Entwöhnung keinen Unterschied; es konnte jedoch eine nichtspezifische Toxizität an trächtigen Weibchen bei und über einer Dosis von 10 mg/kg beobachtet werden. Ebenso wurden während der Therapie keine Nebenwirkungen in der perinatalen Phase beobachtet. Aufgrund der mütterlichen Toxizität war eine geringe Verminderung des Überlebens des Wurfes und des Gewichts während der ersten postnatalen Tage bei der hohen Dosis von 50 mg/kg/Tag bemerkbar.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Ketof, Hartkapseln Gelatine
Magnesiumstearat (Ph.Eur.)
Maisstärke Mannitol (Ph.Eur.) hochdisperses Siliciumdioxid Titandioxid (E 171)
Ketof 1 mg/5 ml Sirup Citronensäure-Monohydrat Natriummonohydrogenphosphat-Dihydrat (Ph.Eur.) Ethanol 96 %
Methyl-4-hydroxybenzoat (Ph.Eur.) Propyl-4-hydroxybenzoat (Ph.Eur.)
Sorbitol (Ph.Eur.)
gereinigtes Wasser
Aromastoffe (Erdbeere, Contramarum)
Hinweis für Diabetiker
5 ml Sirup (= 1 Messlöffel) enthalten 3 g Sorbitol, entsprechend 0,25 BE. Ketof 1 mg/5 ml Sirup enthält 2,4 Vol.-% Alkohol (Ethanol).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Ketof, Hartkapseln 5 Jahre
Ketof 1 mg/5 ml Sirup 4 Jahre
Hinweis auf Haltbarkeit nach Anbruch Nach Anbruch 24 Monate verwendbar.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Ketof, Hartkapseln Nicht über 30 °C lagern.
Ketof 1 mg/5 ml Sirup Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Ketof, Hartkapseln
Packungen mit
20, 50 und 100 Hartkapseln
Ketof 1 mg/5 ml Sirup
Packungen mit
100 ml und 200 ml Sirup
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNGEN
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMERN
Ketof, Hartkapseln
12306.00. 00
Ketof 1 mg/5 ml Sirup
12306.00. 01
Ketof, Hartkapseln
11.03.1991 / 09.03.2005
Ketof 1 mg/5 ml Sirup
21.03.1991 / 09.03.2005
10. STAND DER INFORMATION
Juli 2015
11.VERKAUFSABGRENZUNG
Verschreibungspflichtig
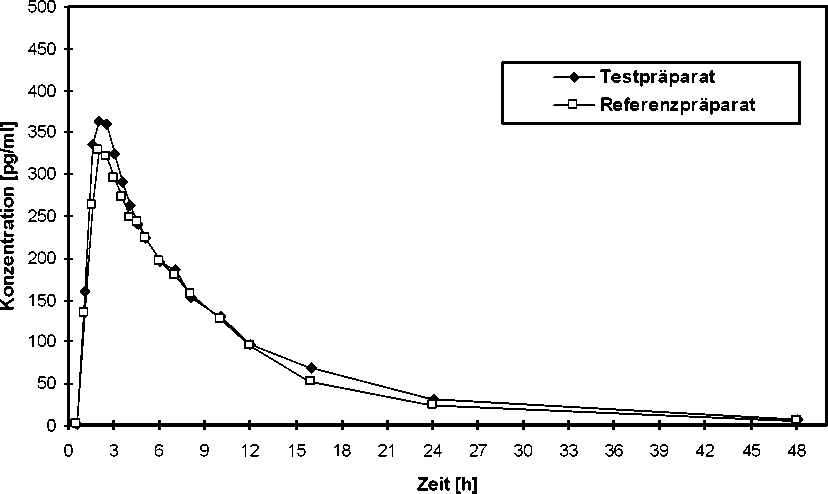
Zusätzliche Angaben der HEXAL AG zur Bioverfügbarkeit von Ketof®
Eine im Jahr 1998 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (offen, cross-over, randomisiert) an 24 gesunden (12 weiblichen und 12 männlichen) Probanden (18-41 Jahre) ergab nach Einmalgabe im Vergleich zum Referenzpräparat:
Testpräparat
Referenzpräparat
Cmax [pg/ml] 397,03 ± 245,73 375,50 ± 215,05
maximale Plasmakonzentration
tmax [h] 2,48 ± 0,95 2,40 ± 0,92
Zeitpunkt der maximalen
Plasmakonzentration
AUC0-t [pg/ml*h] 3185,2 ± 3010,7 2836,5 ± 2731,3
Fläche unter der
Konzentrations-Zeit-Kurve
Angabe der Werte als arithmetische Mittelwerte und Streubreite (Standardabweichung).
Mittlere Plasmaspiegelverläufe von Analyten nach Einmalgabe von Ketotifen 1 mg Kapseln (2 Kapseln zu je 1 mg Ketotifen) im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm: