Laynes
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
LaYnes®
0,02 mg/3 mg Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
- 24 rosafarbene Filmtabletten (wirkstoffhaltige Tabletten):
Eine Filmtablette enthält 0,02 mg Ethinylestradiol und 3 mg Drospirenon.
Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat 44 mg
- 4 weiße Placebo-Filmtabletten (ohne Wirkstoff):
Die Tablette enthält keinen Wirkstoff.
Sonstiger Bestandteil mit bekannter Wirkung: Lactose 89,5 mg Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette.
Die wirkstoffhaltige Tablette ist eine rosafarbene, runde Filmtablette mit 5,7 mm Durchmesser. Die Placebotablette ist eine weiße, runde Filmtablette mit 5,7 mm Durchmesser.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Orale Kontrazeption.
Bei der Entscheidung, LaYnes® zu verschreiben, sollten die aktuellen, individuellen Risikofaktoren der einzelnen Frauen, insbesondere im Hinblick auf venöse Thromboembolien (VTE), berücksichtigt werden. Auch sollte das Risiko für eine VTE bei Anwendung von LaYnes® mit dem anderer kombinierter hormonaler Kontrazeptiva (KHK) verglichen werden (siehe Abschnitte 4.3 und 4.4).
4.2 Dosierung und Art der Anwendung
Dosierung
Einnahme von LaYnes®
Die Tabletten müssen jeden Tag etwa zur
nachfolgenden Packung wird am Tag nach Einnahme der letzten Tablette aus der vorherigen Packung begonnen. Eine Abbruchblutung beginnt normalerweise 2-3 Tage nach Beginn der Placebo-Einnahme (letzte Reihe) und kann noch andauern, wenn bereits die nächste Packung angefangen wird.
Beginn der Einnahme von LaYnes®
• Keine vorangegangene Einnahme von
Wird eine Tablette mit einer Verspätung unter 12 Stunden eingenommen, ist der Empfängnisschutz nicht beeinträchtigt. Die Tabletteneinnahme sollte so bald wie möglich nachgeholt und die nächsten Tabletten zur gewohnten Zeit eingenommen werden.
Wurde die Einnahmezeit um mehr als 12 Stunden überschritten, kann der Empfängnisschutz verringert sein. Für das Vorgehen bei vergessener Einnahme gelten die folgenden zwei Grundregeln:
1. Die Tabletteneinnahme darf nie länger als
2. Es kann auch ein Abbruch der Einnahme
- Hohes Risiko für eine venöse Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4)
• Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE)
- Arterielle Thromboembolie - bestehende ATE, ATE in der Vorgeschichte (z. B. Myokardinfarkt) oder Erkrankung im Prodromalstadium (z. B. Angina pectoris)
- Zerebrovaskuläre Erkrankung - bestehender Schlaganfall, Schlaganfall oder prodromale Erkrankung (z. B. transitorische ischämische Attacke [TIA]) in der Vorgeschichte
- Bekannte erbliche oder erworbene Prädisposition für eine arterielle Thromboembolie, wie z. B. Hyperhomocysteinämie und Antiphospholipid-Antikörper (Anticardiolipin-Antikörper, Lupusantikoagulans)
- Migräne mit fokalen neurologischen Symptomen in der Vorgeschichte
- Hohes Risiko für eine arterielle Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4) oder eines schwerwiegenden Risikofaktors wie:
o Diabetes mellitus mit Gefäßveränderungen o schwere Hypertonie o schwere Dyslipoproteinämie
• Bestehende oder vorausgegangene Pankreatitis im Zusammenhang mit schwerer Hypertriglyceridämie
• Bestehende oder vorausgegangene schwere Lebererkrankung, solange sich die Leberwerte nicht wieder normalisiert haben
• Schwere Niereninsuffizienz oder akutes Nierenversagen
• Bestehende oder vorausgegangene Lebertumoren (benigne oder maligne)
• Bekannte oder vermutete, durch Sexualsteroide beeinflusste maligne Erkrankungen (z. B. der Genitalorgane oder der Brust)
• Diagnostisch nicht abgeklärte vaginale Blutungen
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 sonstigen genannten Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Warnhinweise
Die Eignung von LaYnes® sollte mit der Frau besprochen werden, falls eine der im Folgenden aufgeführten Erkrankungen oder Risikofaktoren vorliegt.
Bei einer Verschlechterung oder dem ersten Auftreten einer dieser Erkrankungen oder Risikofaktoren ist der Anwenderin anzuraten, sich an Ihren Arzt zu wenden, um zu entscheiden, ob die Anwendung von LaYnes® beendet werden sollte.
Zirkulationsstörungen
Risiko für eine venöse Thromboembolie (VTE)
Die Anwendung jedes kombinierten hormonalen Kontrazeptivums (KHK) erhöht das Risiko für eine venöse Thromboembolie (VTE) im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat oder Norethisteron enthalten, sind mit dem geringsten Risiko für eine VTE verbunden. Andere Arzneimittel, wie LaYnes®, können ein bis zu doppelt so hohes Risiko aufweisen. Die Entscheidung, ein Arzneimittel anzuwenden, das nicht zu denen mit dem geringsten VTE-Risiko gehört, sollte nur nach einem Gespräch mit der Frau getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht: das Risiko für eine VTE bei Anwendung von LaYnes®, wie ihre vorliegenden individuellen Risikofaktoren dieses Risiko beeinflussen, und dass ihr Risiko für VTE in ihrem allerersten Anwendungsjahr am höchsten ist. Es gibt zudem Hinweise, dass das Risiko
erhöht ist, wenn die Anwendung eines KHK nach einer Unterbrechung von 4 oder mehr Wochen wieder aufgenommen wird.
Ungefähr 2 von 10.000 Frauen, die kein KHK anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Bei einer einzelnen Frauen kann das Risiko jedoch in Abhängigkeit von ihren zugrunde liegenden Risikofaktoren bedeutend höher sein (siehe unten). Es wird geschätzt1, dass im Verlauf eines Jahres 9 bis 12 von 10.000 Frauen, die ein Desogestrel-haltiges KHK anwenden, eine VTE erleiden; im Vergleich hierzu kommt es pro Jahr bei ungefähr 61 von 10.000 Frauen, die ein Levonorgestrel-haltiges KHK anwenden, zu einer VTE.
In beiden Fällen ist die Anzahl an VTE pro Jahr geringer als die erwartete Anzahl während der Schwangerschaft oder in der Zeit nach der Geburt.
VTE verlaufen in 1-2 % der Fälle tödlich.
Diese Inzidenzen wurden aus der Gesamtheit der epidemiologischen Studiendaten abgeleitet, wobei relative Risiken der verschiedenen Arzneimittel im Vergleich zu Levonorgestrel-haltigen KHK verwendet wurden.
Anzahl an
VTE - Ereignissen
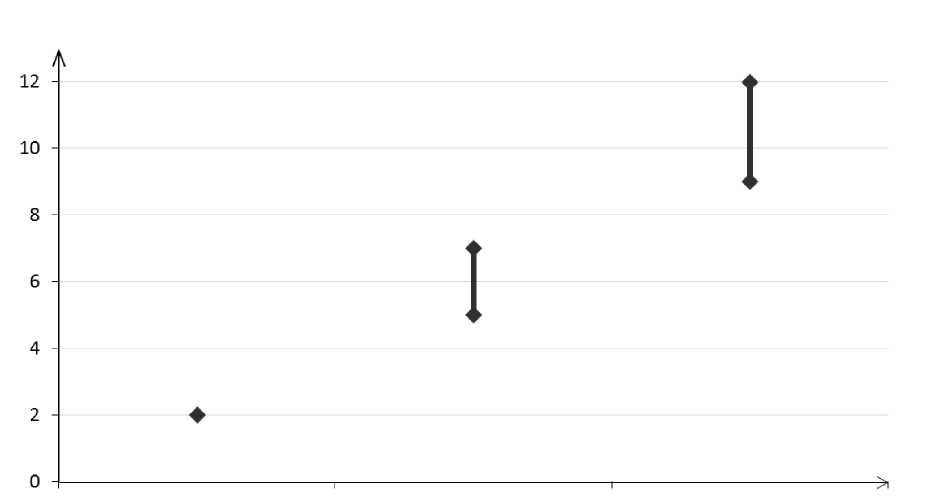
Nicht-KHK-Anwenderinnen (2 Ereignisse)
Levonorgestrel-enthaltende KHK (5-7 Ereignisse)
Drospirenon-enthaltende KHK (9-12 Ereignisse)
Äußerst selten wurde bei Anwenderinnen von KHK über eine Thrombose in anderen Blutgefäßen berichtet, wie z. B. in Venen und Arterien von Leber, Mesenterium, Nieren oder Retina.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von KHK kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, insbesondere wenn mehrere Risikofaktoren vorliegen (siehe Tabelle).
LaYnes® ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die insgesamt zu einem hohen Risiko für eine Venenthrombose führen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass des Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt- in diesem Fall muss ihr Gesamtrisiko für eine VTE in Betracht gezogen werden. Wenn das Nutzen/Risiko-Verhältnis als ungünstig erachtet wird, darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für VTE
|
Risikofaktor |
Anmerkung |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig, wenn weitere Risikofaktoren vorliegen. |
|
Längere Immobilisierung, größere Operationen, jede Operation an Beinen oder Hüfte, |
In diesen Fällen ist es ratsam, die Anwendung des Pflasters/der Tablette/des Rings (bei einer |
|
neurochirurgische Operation oder schweres Trauma Hinweis: Eine vorübergehende Immobilisierung einschließlich einer Flugreise von > 4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine VTE darstellen, insbesondere bei Frauen mit weiteren Risikofaktoren. |
geplanten Operation mindestens vier Wochen vorher) zu unterbrechen und erst zwei Wochen nach der kompletten Mobilisierung wieder aufzunehmen. Es ist eine andere Verhütungsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern. Eine antithrombotische Therapie muss erwogen werden, wenn LaYnes® nicht vorab abgesetzt wurde. |
|
Familiäre Vorbelastung (jede venöse Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, z. B. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Andere Erkrankungen, die mit einer VTE verknüpft sind. |
Krebs, systemischer Lupus erythematodes, hämolytisches urämisches Syndrom, chronisch entzündliche Darmerkrankung (Morbus Crohn oder Colitis ulcerosa) und Sichelzellkrankheit |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
Es besteht kein Konsens über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose.
Das erhöhte Risiko einer Thromboembolie in der Schwangerschaft und insbesondere während der 6-wöchigen Dauer des Wochenbetts muss berücksichtigt werden (Informationen zur „Schwangerschaft und Stillzeit“ siehe Abschnitt 4.6).
Symptome einer VTE (tiefe Beinvenenthrombose und Lungenembolie)
Beim Auftreten von Symptomen ist den Anwenderinnen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einer tiefen Beinvenenthrombose (TVT) können folgende Symptome auftreten:
- unilaterale Schwellung des Beins und/oder Fußes oder entlang einer Beinvene;
- Schmerz oder Druckschmerz im Bein, der möglicherweise nur beim Stehen oder Gehen bemerkt wird,
- Erwärmung des betroffenen Beins; gerötete oder entfärbte Haut am Bein.
Bei einer Lungenembolie (LE) können folgende Symptome auftreten:
- plötzliches Auftreten unerklärlicher Kurzatmigkeit oder schnellen Atmens;
- plötzlich auftretender Husten möglicherweise in Verbindung mit Hämoptyse;
- stechender Brustschmerz;
- starke Benommenheit oder Schwindelgefühl;
- schneller oder unregelmäßiger Herzschlag.
Einige dieser Symptome (z. B. „Kurzatmigkeit“, „Husten“) sind unspezifisch und können als häufiger vorkommende und weniger schwerwiegende Ereignisse fehlinterpretiert werden (z. B. als Atemwegsinfektionen).
Andere Anzeichen für einen Gefäßverschluss können plötzlicher Schmerz sowie Schwellung und leicht bläuliche Verfärbung einer Extremität sein.
Tritt der Gefäßverschluss im Auge auf, können die Symptome von einem schmerzlosen verschwommenen Sehen bis zu einem Verlust des Sehvermögens reichen. In manchen Fällen tritt der Verlust des Sehvermögens sehr plötzlich auf.
Risiko für eine arterielle Thromboembolie (ATE)
Epidemiologische Studien haben die Anwendung von KHK mit einem erhöhten Risiko für arterielle Thromboembolie (Myokardinfarkt) oder apoplektischen Insult (z. B. transitorische ischämische Attacke, Schlaganfall) in Verbindung gebracht. Arterielle thromboembolische Ereignisse können tödlich verlaufen.
Risikofaktoren für ATE
Das Risiko für arterielle thromboembolische Komplikationen oder einen apoplektischen Insult bei Anwenderinnen von KHK erhöht sich bei Frauen, die Risikofaktoren aufweisen (siehe Tabelle). LaYnes® ist kontraindiziert bei Frauen, die einen schwerwiegenden oder mehrere Risikofaktoren für eine ATE haben, die sie einem hohen Risiko für eine Arterienthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt- in diesem Fall muss ihr Gesamtrisiko betrachtet werden. Bei Vorliegen eines ungünstigen Nutzen/Risiko-Verhältnis darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für ATE
|
Risikofaktor |
Anmerkung |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
|
Rauchen |
Frauen ist anzuraten, nicht zu rauchen, wenn Sie ein KHK anwenden möchten. Frauen über 35 Jahren, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Verhütungsmethode anzuwenden. |
|
Hypertonie | |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig bei Frauen mit zusätzlichen Risikofaktoren. |
|
Familiäre Vorbelastung (jede arterielle Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, d. h. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Migräne |
Ein Anstieg der Häufigkeit oder des Schweregrads der Migräne während der Anwendung von KHK (die einem |
|
zerebrovaskulären Ereignis vorausgehen kann) kann ein Grund für ein sofortiges Absetzen sein. | |
|
Andere Erkrankungen, die mit unerwünschten Gefäßereignissen verknüpft sind. |
Diabetes mellitus, Hyperhomocysteinämie, Erkrankung der Herzklappen und Vorhofflimmern, Dyslipoproteinämie und systemischer Lupus erythematodes. |
Symptome einer ATE
Beim Auftreten von Symptomen ist den Frauen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einem apoplektischen Insult können folgende Symptome auftreten:
- plötzliche Taubheitsgefühl oder Schwäche in Gesicht, Arm oder Bein, besonders auf einer Köperseite;
- plötzliche Gehschwierigkeiten, Schwindelgefühl, Gleichgewichtsverlust oder Koordinationsstörungen;
- plötzliche Verwirrtheit, Sprech- oder Verständnisschwierigkeiten;
- plötzliche Sehstörungen in einem oder beiden Augen;
- plötzliche, schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
- Verlust des Bewusstseins oder Ohnmacht mit oder ohne Krampfanfall.
Vorübergehende Symptome deuten auf eine transitorische ischämische Attacke (TIA) handeln.
Bei einem Myokardinfarkt (MI) können folgende Symptome auftreten:
- Schmerz, Unbehagen, Druck, Schweregefühl, Enge- oder Völlegefühl in Brust, Arm oder unterhalb des Sternums;
- in den Rücken, Kiefer, Hals, Arm, Magen ausstrahlende Beschwerden;
- Völlegefühl, Indigestion oder Erstickungsgefühl;
- Schwitzen, Übelkeit, Erbrechen oder Schwindelgefühl;
- extreme Schwäche, Angst oder Kurzatmigkeit;
- schnelle oder unregelmäßige Herzschläge.
Auch die Möglichkeit einer Antikoagulantientherapie sollte dabei in Betracht gezogen werden. KOK-Anwenderinnen sollten speziell darauf hingewiesen werden, bei möglichen Anzeichen einer Thrombose ihren Arzt aufzusuchen. Bei Verdacht auf oder bestätigter Thrombose ist das KOK abzusetzen. Wegen der Teratogenität der antikoagulatorischen Therapie (Cumarine) sollten geeignete alternative Verhütungsmaßnahmen getroffen werden.
Tumoren
In einigen epidemiologischen Untersuchungen wurde über ein erhöhtes Zervixkarzinom-Risiko bei Langzeitanwendung von KOK (>5 Jahre) berichtet. Kontrovers diskutiert
Risiko kann auf eine frühzeitigere Diagnosestellung von Brustkrebs bei KOK-Anwenderinnen, die biologischen Wirkungen von KOK oder eine Kombination aus beidem zurückzuführen sein. Bei Frauen, die irgendwann einmal ein KOK angewendet haben, wird Brustkrebs tendenziell in einem weniger fortgeschrittenen klinischen Stadium diagnostiziert als bei Frauen, die noch nie ein KOK angewendet haben.
In seltenen Fällen wurde über benigne Lebertumoren und noch seltener über maligne Lebertumoren bei KOK-Anwenderinnen berichtet. In Einzelfällen führten diese Tumoren zu lebensbedrohlichen intraabdominellen Blutungen. Differenzialdiagnostisch sollte an einen Lebertumor gedacht werden, wenn bei Frauen unter der Anwendung von KOK starke Oberbauchschmerzen, eine Lebervergrößerung oder Anzeichen einer intraabdominellen Blutung auftreten.
Mit der Anwendung von höher dosierten KOK (50 ^g Ethinylestradiol) verringert sich das Risiko eines Endometrium- und Ovarialkarzinoms. Ob dies auch für niedriger dosierte
Obwohl KOK einen Einfluss auf die periphere Insulinresistenz und Glukosetoleranz haben können, liegen keine Hinweise für eine Notwendigkeit zur Änderung des Therapieschemas bei Diabetikerinnen vor, die niedrig dosierte KOK (< 0,05 mg Ethinylestradiol) anwenden. Diabetikerinnen müssen jedoch sorgfältig überwacht werden, insbesondere in der ersten Zeit der Anwendung eines KOK.
Bei KOK-Anwendung wurde über eine Verschlechterung endogener Depressionen,
__ Es ist möglich, dass es bei manchen Frauen während der Placebophase zu keiner Abbruchblutung kommt.
Wenn das KOK vorschriftsmäßig, wie unter Abschnitt 4.2 beschrieben, eingenommen wurde, ist eine Schwangerschaft unwahrscheinlich. Wenn die Einnahme des KOK jedoch vor der ersten ausgebliebenen Abbruchblutung nicht vorschriftsmäßig erfolgt ist oder bereits zum zweiten Mal die Abbruchblutung ausgeblieben ist, muss eine Schwangerschaft ausgeschlossen werden, bevor die Anwendung des KOK fortgesetzt wird.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Hinweis: Die Fachinformationen gleichzeitig
Die Hauptmetaboliten von Drospirenon im menschlichen Plasma entstehen ohne Beteiligung des Cytochrom-P450-Systems. Es ist daher unwahrscheinlich, dass Inhibitoren dieses Enzymsystems den Metabolismus von Drospirenon beeinflussen.
• Einfluss von LaYnes® auf andere Arzneimittel
Orale Kontrazeptiva können den Metabolismus bestimmter anderer Wirkstoffe beeinflussen. Dementsprechend können Plasma- und Gewebskonzentrationen entweder ansteigen (z. B. Ciclosporin) oder abfallen (z. B. Lamotrigin).
In-vitro-Hemmstudien und In-vivo-Studien
Gesundheit des Fötus oder des Neugeborenen zu ermöglichen. Bisher sind keine einschlägigen epidemiologischen Daten verfügbar.
Das erhöhte VTE-Risiko in der Zeit nach der Geburt sollte vor der erneuten Anwendung nach einer Anwendungspause bedacht werden (siehe Abschnitte 4.2 und 4.4).
Stillzeit
KOK können die Laktation beeinflussen, da sie die Menge der Muttermilch vermindern und ihre Zusammensetzung verändern können. Daher wird die Anwendung von KOK generell nicht empfohlen, solange eine Mutter ihr Kind nicht vollständig abgestillt hat. Geringe Mengen der kontrazeptiven Steroide und/oder ihrer Metaboliten können während der Anwendung von KOK in die Muttermilch übergehen und Auswirkungen auf das Kind haben.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Untersuchungen zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen wurden bei Anwenderinnen von KOK nicht beobachtet.
4.8 Nebenwirkungen
Die folgenden unerwünschten Arzneimittelwirkungen wurden während der Anwendung von LaYnes® berichtet.
Nachfolgende Tabelle listet unerwünschte Wirkungen nach MedDRA-Systemorganklassen (MedDRA SOC) auf. Die Häufigkeiten basieren auf Daten klinischer Studien. Zur Beschreibung einer bestimmten Reaktion und ihrer Synonyme und verwandten Störungen wurde der am besten geeignete MedDRA-Term gewählt.
Unerwünschte Arzneimittelwirkungen, die mit der Anwendung von LaYnes® als oralem Kontrazeptivum oder zur Behandlung von mittelschwerer Akne in Zusammenhang gebracht wurden, gemäß MedDRA-Systemorganklasse und MedDRA-Term:
|
Systemorganklasse (MedDRA Version 9.1 ) |
Häufig (>1/100 und <1/10) |
Gelegentlich (>1/1.000 und <1/100) |
Selten (>1/10.000 und <1/1.000) |
Unbekannt (lässt sich anhand der vorhandenen Daten nicht abschätzen) |
|
Infektionen und parasitäre Erkrankungen |
Candidosen | |||
|
Erkrankungen des Blutes und des Lymphsystems |
Anämie Thrombozythämie | |||
|
Erkrankungen des Immunsystems |
Allergische Reaktion |
Überempfindlichkeit | ||
|
Endokrine Erkrankungen |
Endokrine Erkrankung | |||
|
Stoffwechsel- und Ernährungsstörungen |
Zunahme des Appetits Anorexie Hyperkaliämie |
|
Hyponatriämie | ||||
|
Psychiatrische Erkrankungen |
Stimmungs schwankungen |
Depression Nervosität Somnolenz |
Anorgasmie Insomnie | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
Benommenheit Parästhesie |
Schwindel Tremor | |
|
Augen erkrankungen |
Konjunktivitis Trockene Augen Sehstörungen | |||
|
Herzerkrankungen |
Tachykardie | |||
|
Gefäß erkrankungen |
Migräne Varikose Hypertonie |
Phlebitis Gefäßstörung Epistaxis Synkope Arterielle Thromboembolie Venöse Thromboembolie | ||
|
Erkrankungen des Gastrointestinaltrakts |
Nausea |
Bauchschmerzen Erbrechen Dyspepsie Flatulenz Gastritis Diarrhö |
Vergrößertes Abdomen Gastrointestinale Erkrankung Völlegefühl Hiatus hernia Orale Candidose Obstipation Mundtrockenheit | |
|
Leber- und Gallenerkrankungen |
Gallenschmerzen Cholezystitis | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Akne Pruritus Hautausschlag |
Chloasma Ekzem Alopezie Akneartige Dermatitis Trockene Haut Erythema nodosum Hypertrichosis Hautbeschwerden Striae der Haut Kontaktdermatitis Lichtempfindliche Dermatitis |
Erythema multiforme | |
|
Skelettmuskel- und Bindegewebserkrankungen |
Rückenschmerzen Schmerzen in den Extremitäten Muskelkrämpfe | |||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Brustschmerzen Metrorrhagie* Amenorrhö |
Vaginale Candidose Unterleibs schmerzen Brustvergrößerung |
Dyspareunie Vulvovaginitis Postkoitale Blutung Abbruchblutung Zystische Brust |
|
Fibrozystische Brust Uterine/vaginale Blutungen* Fluor vaginalis Hitzewallungen Vaginitis Menstruationsstörungen Dysmenorrhö Hypomenorrhö Menorrhagie Vaginale Trockenheit Auffälliger PAP-Abstrich Abnahme der Libido |
Hyperplasie der Brust Neoplasmen der Brust Zervixpolypen Endometriumsatrophie Ovarialzysten Uterine Vergrößerung | |||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Asthenie Verstärktes Schwitzen, Ödeme (generalisiertes Ödem, peripheres Ödem, Gesichtsödem) |
Unwohlsein | ||
|
Laborwerte |
Gewichtszunahme |
Gewichtsabnahme | ||
|
*Unregelmäßige Blutungen lassen bei fortgesetzter Behandlung ü |
blicherweise nach | |||
Beschreibung ausgewählter Nebenwirkungen
Bei Anwenderinnen von KHK wurde ein erhöhtes Risiko für arterielle und venöse thrombotische und thromboembolische Ereignisse einschließlich Myokardinfarkt, Schlaganfall, transitorische ischämische Attacken, Venenthrombose und Lungenembolie beobachtet, die in Abschnitt 4.4 eingehender behandelt werden.
Bei Anwenderinnen von KOK wurde über die folgenden schweren unerwünschten
Die Diagnosehäufigkeit von Brustkrebs unter Anwenderinnen von oralen Kontrazeptiva ist geringfügig erhöht. Da bei Frauen unter 40 Jahren Brustkrebs
Patientinnen (18,6 % gegenüber 6,8 %) die Bewertung „abgeheilt“ oder „nahezu abgeheilt“ auf der ISGA-Skala (Investigator’s Static Global Assessment).
5.2 Pharmakokinetische Eigenschaften Drospirenon
Resorption
Oral angewendetes Drospirenon wird rasch
Auswirkungen einer Leberinsuffizienz
In einer Einzeldosisstudie nahm bei Probandinnen mit mäßiger Leberinsuffizienz die orale Clearance (CL/F) um ca. 50 % ab im Vergleich zu denen mit normaler Leberfunktion. Die beobachtete Abnahme der Drospirenon-Clearance bei Probandinnen mit
Schädigungen an den Versuchstieren, die als speziesspezifische Effekte bewertet wurden. Bei höherer Exposition als bei Anwenderinnen von LaYnes® wurden Veränderungen in der Differenzierung der Sexualorgane in Rattenfeten, nicht aber in Feten von Affen beobachtet.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
|
Wirkstoffhaltige Filmtabletten (rosafarben): | |
|
• Tablettenkern: | |
|
o |
Lactose-Monohydrat |
|
o |
Vorverkleisterte Stärke (Mais) |
|
o |
Povidon K30 |
|
o |
Croscarmellose-Natrium |
|
o |
Polysorbat 80 |
|
o |
Magnesiumstearat (Ph. Eur.) [pflanzlich] |
• T ablettenüberzug:
o Poly(vinylalkohol) o Titandioxid (E171) o Macrogol 3350 o Talkum
o Eisen(III)-hydroxid-oxid x H2O (E172) o Eisen(III)-oxid (E172) o Eisen(n,III)-oxid (E172)
Placebo-Filmtabletten (weiß):
• Tablettenkern:
o Lactose o Povidon K30
o Magnesiumstearat (Ph. Eur.) [pflanzlich]
• T ablettenüberzug:
o Poly(vinylalkohol) o Titandioxid (E171) o Macrogol 3350 o Talkum
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Klare bis leicht opake, transparente PVC/PVdC/Aluminium-Blisterpackung. Jede Blisterpackung enthält 24 wirkstoffhaltige, rosafarben Filmtabletten und 4 weiße Placebo-Filmtabletten.
Packungsgrößen:
1 x 28 Filmtabletten 3 x 28 Filmtabletten 6 x 28 Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterialien ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
TEVA GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMER
85342.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 28. Januar 2013
10. STAND DER INFORMATION
April 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
22/22
Mittelwert der Spannweite 5-7 pro 10.000 Frauenjahre, auf der Grundlage eines relativen Risikos für Levonorgestrel-haltige KHK versus Nichtanwendung von ungefähr 2,3 bis 3,6