Levosert 20 Mikrogramm/24 Stunden Intrauterines Wirkstofffreisetzungssystem
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Levosert 20 Mikrogramm/24 Stunden intrauterines Wirkstofffreisetzungssystem
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Der Wirkstoff ist Levonorgestrel.
Das intrauterine Wirkstofffreisetzungssystem enthält 52 mg Levonorgestrel. Die initiale Levonorgestrelfreisetzung beträgt ca. 20 Mikrogramm pro Tag und verringert sich nach Ablauf von 3 Jahren auf ca. 12 Mikrogramm pro Tag.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Intrauterines Wirkstofffreisetzungssystem (IUS)
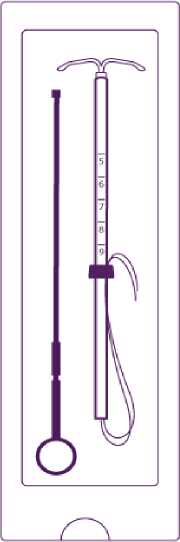
Das Produkt besteht aus einer Insertionsvorrichtung und Levonorgestrel IUS, das sich an der Spitze der Insertionsvorrichtung befindet. Die Insertionsvorrichtung setzt sich zusammen aus Insertionsröhrchen, Kolben, Marker, Schaft und Schieber. Das Arzneimittel besteht aus einem weißen bzw. fast weißen Hormon-Elastomer-Kern, der an einem T-förmigen Körper befestigt ist und von einer opaken Membran umschlossen ist, welche die Freisetzung von Levonorgestrel reguliert. An dem einen Ende des vertikalen Schafts des T-förmigen Körpers befindet sich eine Öse, am anderen Ende zwei horizontale Arme. An der Öse sind Rückholfäden befestigt.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Kontrazeption für eine Anwendungsdauer von bis zu 3 Jahren.
Behandlung der Hypermenorrhoe über maximal drei Jahre. Levosert ist besonders geeignet für Frauen mit starken Menstruationsblutungen, die eine (reversible) Kontrazeption benötigen.
4.2 Dosierung und Art der Anwendung
Behandlungsbeginn
Bei Frauen im gebärfähigen Alter wird Levosert innerhalb von sieben Tagen nach Beginn der Menstruation in das Cavum uteri eingelegt. Es kann zu jedem beliebigen Zeitpunkt des Zyklus durch ein neues System ersetzt werden.
Post partum Insertion: Um das Risiko einer Perforation zu verringern, sollten postpartale Insertionen bis zur vollständigen Rückbildung des Uterus aufgeschoben werden. Keine Insertion früher als sechs Wochen postpartal vornehmen. Falls die Patientin unter signifikanten postpartalen Blutungen und/oder Schmerzen leidet, sollte vor einer Insertion eine Infektion oder andere Ursachen ausgeschlossen werden. Levosert kann auch sofort nach einem Abort im ersten Trimester eingelegt werden.
Levosert ist in den Anwendungsgebieten Kontrazeption und Hypermenorrhoe drei Jahre wirksam. Daher sollte es nach 3jähriger Liegedauer entfernt werden.
Falls die Patientin wünscht, diese Methode fortzusetzen, kann sofort ein neues System eingesetzt werden. In diesem Fall ist kein zusätzlicher Kontrazeptionsschutz erforderlich.
Kinder und Jugendliche
Levosert wurde nicht bei Patientinnen unter 16 Jahren untersucht. Die Anwendung von Levosert vor der Menarche ist nicht angezeigt.
Patientinnen mit eingeschränkter Leberfunktion
Levosert ist bei Patientinnen mit Lebertumor oder einer anderen akuten oder schweren Lebererkrankung kontraindiziert (siehe Abschnitt 4.3).
Anweisung für den Gebrauch und die Handhabung
Levosert ist in einer sterilen Verpackung erhältlich, die erst zum Zeitpunkt der Insertion geöffnet werden sollte. Das ausgepackte Produkt sollte unter aseptischen Vorsichtsmaßnahmen gehandhabt werden. Falls die Versiegelung der sterilen Verpackung zerstört ist, sollte das Produkt entsorgt werden (siehe Abschnitt 6.6 für Anweisungen zur Beseitigung).
Wie Levosert einzulegen ist
Es wird dringend empfohlen, dass die Insertion von Levosert nur von Ärzten durchgeführt wird, die in der Insertion von Levonorgestrel IUS erfahren sind und/oder ausreichend für eine Insertion von Levonorgestrel IUS geschult wurden.
Im Falle einer schwierig verlaufenden Insertion und/oder außergewöhnlichen Schmerzen oder Blutungen während oder nach der Insertion sehen Sie bitte im Abschnitt 4.4 nach.
• Levosert wird nach vorausgehender Sterilisation mit Ethylenoxid steril geliefert. Nicht resterilisieren. Nur zum einmaligen Gebrauch bestimmt. Nicht benutzen, falls die Innenverpackung beschädigt oder geöffnet ist. Vor dem auf der Verpackung angegebenen Monat einlegen.
• Levosert wird mittels der beigefügten Insertionsvorrichtung (Abbildung 1) unter sorgfältiger Befolgung der Insertionsanleitung in das Cavum uteri eingelegt.
Die nachstehende Insertionsanleitung ist auch dem Behältnis mit dem IUS beigefügt.
Bitte lesen Sie die nachfolgende Gebrauchsanleitung sorgfältig durch, da die Insertionsvorrichtung sich in ihrer Art möglicherweise von anderen IUDs, die Sie vorher benutzt haben, unterscheiden kann.
("a) ZylindlermitLevünorgestre
(b) LateraleArme
0 Rückholfäden
0 Knöpfchen
0 Marker
Insertions
rchrchen
0 Skala
0 Verdickung
f'h';. Erste Einkerbung
Kolben
0 Zweite Einkerbung
0 Ring
Abbildung 1
Anwendungsbedingungen
1. Bei Frauen im gebärfähigen Alter wird Levosert innerhalb von sieben Tagen nach Beginn der Menstruation eingelegt. Es kann zu jedem beliebigen Zeitpunkt des Zyklus durch ein neues System ersetzt werden.
2. Es wird dringend empfohlen, dass die Insertion von Levosert nur von Ärzten durchgeführt wird, die ausreichend geschult wurden und diese Anleitung vor dem Einlegen von Levosert sorgfältig gelesen haben.
3. Levosert wird in einer sterilen Verpackung geliefert, die erst zum Zeitpunkt der Insertion geöffnet werden sollte. Das ausgepackte Produkt sollte unter aseptischen Vorsichtsmaßnahmen gehandhabt werden. Das Produkt nicht benutzen, falls die Innenverpackung beschädigt oder geöffnet ist.
4. Bestimmen Sie mittels einer gynäkologischen Untersuchung die Lage (Anteversion, Retroversion) und Größe des Uterus. Schließen Sie eine Schwangerschaft und Kontraindikationen aus.
5. Führen Sie ein Spekulum ein, benutzen Sie eine geeignete antiseptische Lösung, um Vagina und Zervix zu reinigen.
6. Benutzen Sie Zervixdilatatoren, falls eine Zervixstenose festgestellt wird. Setzen Sie keine Gewalt ein, um einen etwaigen Widerstand zu überwinden.
7. Ergreifen Sie die Zervix mit einer Kugelzange und üben Sie einen leichten Zug aus, um Zervikalkanal und Cavum uteri zu strecken und auszurichten.
8. Bestimmen Sie die Länge des Uterus mittels Hysterometrie. Brechen Sie die Untersuchung ab, falls die Uteruslänge < 5,5 cm ist.
Führen Sie den Kolben und das IUD in das Insertionsröhrchen ein
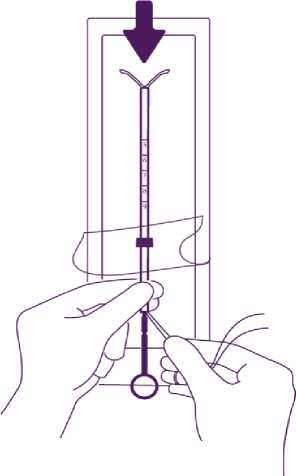
Öffnen Sie die abziehbare Deckelfolie zu etwa 1/3 und führen Sie den Kolben in das Insertionsröhrchen ein. Ziehen Sie die Rückholfäden aus dem Marker. Ziehen sie an den Fäden, um das IUD in das Röhrchen einzuziehen. Die Arme des IUD müssen in einer horizontalen Ebene verbleiben, parallel zur flachen Seite des Markers.
Stellen Sie den unteren Rand des Markers auf den mit der Sonde gemessenen Wert ein
Positionieren Sie den blauen Marker derart, dass der untere Rand des Markers auf den mittels Hysterometrie bestimmten Wert zeigt. Die flache Seite des Markers muss stets parallel zu den Armen verbleiben. Das macht es den Armen später möglich, sich im Cavum uteri korrekt zu entfalten.
Justieren Sie die Position des IUD im Insertionsröhrchen
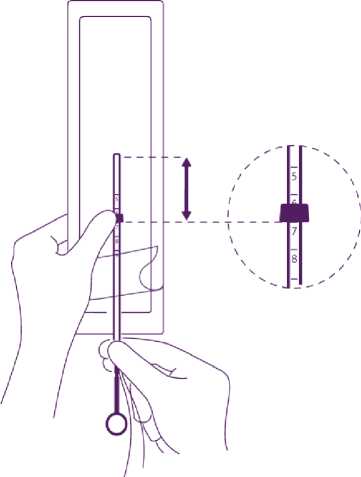
Halten Sie den Kolben fest, während Sie an den Fäden ziehen und das Röhrchen verschieben, um die Position des IUD zu justieren.
Die Knöpfchen der lateralen Arme müssen sich eng gegenüber liegen, leicht oberhalb des oberen Rands des Insertionsröhrchens (siehe vergrößerte Darstellung 1) und das distale Ende des Röhrchens muss mit der ersten Einkerbung des Kolbens übereinstimmen (siehe vergrößerte Darstellung 2). Falls das Röhrchen nicht mit der ersten Einkerbung des Kolbens übereinstimmt, müssen Sie die Fäden strammer ziehen.
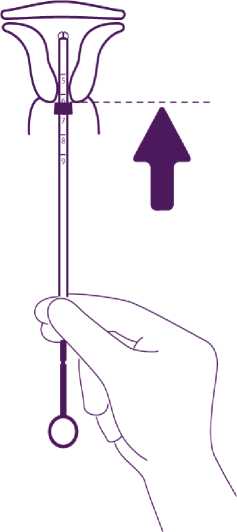
Führen Sie das System in den Zervikalkanal soweit ein, bis der blaue Marker die Portio berührt.
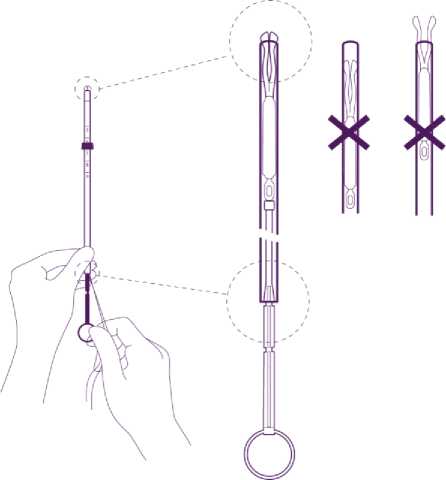
Entnehmen Sie das gesamte System der Blisterpackung, halten Sie dabei Kolben und Röhrchen in der korrekt justierten Position fest.
Führen Sie das anwendungsbereite System in den Zervikalkanal soweit ein, bis der blaue Marker die Portio berührt.
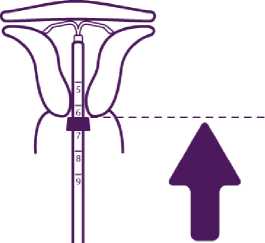
Entfalten Sie die Arme des intrauterinen Systems
Halten Sie den Kolben fest, lassen Sie die Fäden los und ziehen Sie das Insertionsröhrchen nach hinten, bis sein hinteres Ende mit der zweiten Einkerbung am Kolben übereinstimmt.
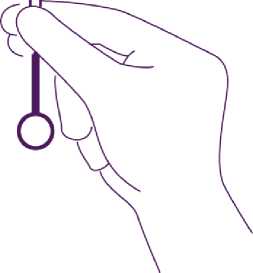
Drücken Sie das IUD gegen den Fundus
Zur Positionierung des IUD im Cavum uteri schieben Sie das Insertionsröhrchen zusammen mit dem Kolben vor, bis der blaue Marker erneut die Portio berührt. Levosert ist dann korrekt im Cavum uteri platziert.
Setzen Sie das IUD aus dem Röhrchen in das Cavum uteri frei
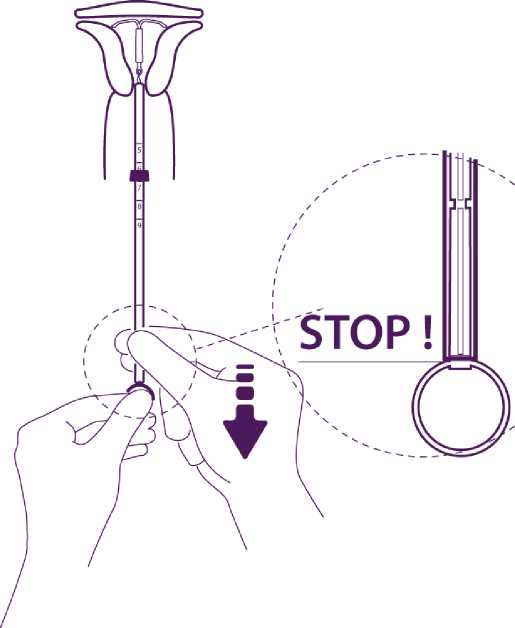
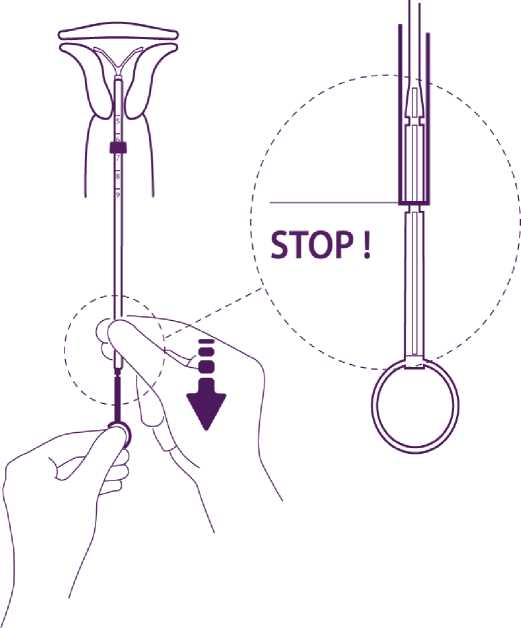
Ohne den Kolben zu bewegen, ziehen Sie das Insertionsröhrchen zurück bis zum Ring am Ende des Kolbens.
Das Passieren der Verdickung am Kolben
macht sich durch einen leichten Widerstand
\
bemerkbar. Ziehen Sie trotzdem das Röhrchen bis zum Ring am Kolben zurück. Levosert ist dann vollständig aus dem Insertionsröhrchen freigesetzt.
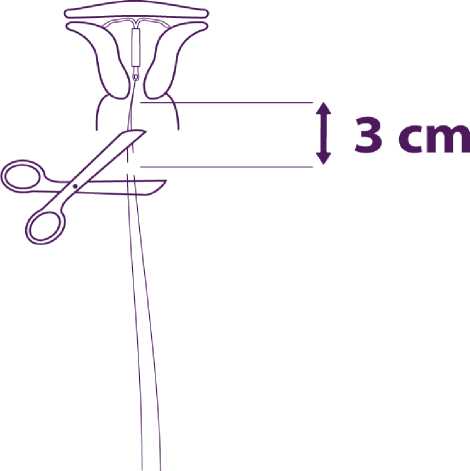
Entfernen Sie nacheinander die Teile der Insertionsvorrichtung und schneiden Sie die Fäden ab
Entfernen Sie nacheinander zuerst den Kolben und dann das Insertionsröhrchen. Schneiden Sie die Fäden ca. 3 cm außerhalb der Zervix ab.
WICHTIG!
Wenn die Insertion schwierig ist und/oder außergewöhnliche Schmerzen oder Blutungen während oder nach der Insertion auftreten, sollten sofort eine körperliche Untersuchung und ein Ultraschall durchgeführt werden, um eine Perforation des Corpus uteri oder der Zervix auszuschließen. Falls erforderlich, entfernen Sie das System und legen ein neues, steriles System ein.
Bitte melden Sie unserer Pharmakovigilanzabteilung jeden Fall einer Uterusperforation oder von Schwierigkeiten bei der Insertion.
Die Anschrift lautet:
Allergan Ltd., Ist Floor, Marlow International, Parkway, Marlow, Buckinghamshire SL7 1YL, Vereinigtes Königreich Telefon: +44 (0)1628 494026 E-Mail: uk_medinfo@allergan.com
Wie Levosert zu entfernen ist
Levosert wird durch sanftes Ziehen an den Rückholfäden mit einer Zange entfernt. Wenn die Fäden nicht sichtbar sind und sich das Pessar im Cavum uteri befindet, kann es mit Hilfe einer schmalen Zange entfernt werden. Dies kann eine Dilatation des Zervikalkanals erforderlich machen.
Ist eine Schwangerschaft nicht erwünscht, sollte bei Frauen im gebärfähigen Alter die Entfernung während der Menstruation vorgenommen werden, sofern ein Menstruationszyklus zu bestehen scheint. Wenn das System in der Mitte eines Zyklus entfernt wird und die Anwenderin innerhalb der letzten Woche Geschlechtsverkehr hatte, besteht ein Schwangerschaftsrisiko, es sei denn, unmittelbar nach dem Entfernen wird ein neues System eingelegt.
Nach dem Entfernen von Levosert sollte das Pessar auf seine Intaktheit untersucht werden. Bei schwierigem Entfernen wurde vereinzelt ein Verschieben des Hormonzylinders über die horizontalen Arme berichtet, so dass diese im Zylinder verborgen waren. In diesem Fall sind keine weiteren Maßnahmen erforderlich, solange die Vollständigkeit des IUS sichergestellt ist. Die Knöpfchen an den horizontalen Armen verhindern normalerweise eine komplette Loslösung des Zylinders vom T-Körper.
4.3 Gegenanzeigen
• Vermutete oder bestätigte Schwangerschaft
• Bestehende oder rezidivierende entzündliche Beckenerkrankung (PID)
• Infektionen des unteren Genitaltrakts
• Postpartale Endometritis
• Septischer Abort in den letzten 3 Monaten
• Zervizitis, Zervixdysplasie
• Verdacht oder Nachweis auf maligne Erkrankungen des Corpus oder der Zervix uteri
• Lebertumore oder andere akute oder schwere Lebererkrankungen
• Angeborene oder erworbene Fehlbildung des Uterus einschließlich Uterusmyome, wenn sie das Cavum uteri verformen
• Irreguläre uterine Blutungen unbekannter Genese
• Erkrankungen oder Zustände, die mit einem erhöhten Infektionsrisiko verbunden sind
• Vorliegen oder Verdacht auf hormonabhängige Tumoren wie z. B. Mammakarzinom (siehe Abschnitt 4.4)
• Akute maligne Bluterkrankungen oder Leukämien, ausgenommen falls in Remission
• Kürzlich durchgemachte trophoblastische Zellerkrankung bei anhaltend erhöhtem hCG Spiegel
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Medizinische Untersuchung
Vor der Insertion sollte eine vollständige Eigen- und Familienanamnese der Patientin erfolgen. Die körperliche Untersuchung sollte sich an deren Ergebnis sowie den Gegenanzeigen und Warnhinweisen für den Gebrauch orientieren. Puls und Blutdruck sollten gemessen und eine bimanuelle gynäkologische Untersuchung zur Bestimmung der Lage des Uterus durchgeführt werden. Die Patientin sollte sechs Wochen nach der Insertion nachuntersucht werden, weitere Untersuchungen sollten nach klinischem Bedarf und nicht routinemäßig, sondern zugeschnitten auf die jeweilige Patientin, erfolgen. Vor der Insertion sollte eine Schwangerschaft ausgeschlossen und eine etwaige Genitalinfektion erfolgreich behandelt werden. Die Frauen sollten darüber informiert werden, dass Levosert nicht gegen HIV (AIDS) und andere sexuell übertragbare Krankheiten schützt (siehe den nachfolgenden Abschnitt über Infektionen des kleinen Beckens).
Den Frauen sollte empfohlen werden, an den altersgemäßen Zervix- und BrustkrebsVorsorgeuntersuchungen teilzunehmen.
Bedingungen, unter denen Levosert mit Vorsicht angewendet werden kann
Levosert ist mit Vorsicht nach Konsultation eines Facharztes anzuwenden oder gegebenenfalls zu entfernen, wenn eine der folgenden Erkrankungen vorliegt oder zum ersten Mal unter der Behandlung auftritt:
- Migräne, fokale Migräne mit asymmetrischem Sehverlust oder andere Symptome, die auf eine transitorische zerebrale Ischämie hinweisen
- außergewöhnlich starke oder außergewöhnlich häufige Kopfschmerzen
- Gelbsucht
- deutliche Blutdrucksteigerung
- maligne Bluterkrankungen oder Leukämien in Remission
- chronische Kortikosteroidtherapie
- anamnestisch bekannte symptomatische funktionelle Ovarialzysten
- aktive oder zurückliegende schwere arterielle Erkrankungen wie z. B. Schlaganfall oder Herzinfarkt
- akute venöse Thromboembolien.
Levosert sollte mit besonderer Vorsicht angewendet werden bei Frauen mit angeborenen Herzkrankheiten oder Herzklappenfehler, die zu einer bakteriellen Endokarditis führen können.
Irreguläre Blutungen können manche Symptome oder Anzeichen für endometriale Polypen oder ein Endometriumkarzinim verbergen. In Verdachtsfällen ist eine diagnostische Abklärung in Erwägung zu ziehen.
Levosert ist nicht die Methode der ersten Wahl bei jungen nulliparen Frauen.
Generell sollten Frauen, die Levosert benutzen, aufgefordert werden, mit dem Rauchen aufzuhören.
Allgemeine Information: Insertion und Entfernen können mit leichten Schmerzen und Blutungen einhergehen. Wenn die Insertion schwierig ist und/oder außergewöhnliche Schmerzen oder Blutungen während oder nach der Insertion auftreten, sollten sofort eine körperliche Untersuchung und ein Ultraschall durchgeführt werden, um eine Perforation des Corpus uteri oder der Zervix auszuschließen (sieh auch „Perforation“).
Bei der Durchführung kann infolge einer vasovagalen Reaktion eine Ohnmacht eintreten oder bei Epileptikerinnen ein Anfall ausgelöst werden. Im Falle einer sich abzeichnenden vasovagalen Attacke muss die Insertion erforderlichenfalls aufgegeben oder das System entfernt werden. Die Patientin sollte in Rückenlage verharren, den Kopf tiefer gelagert und die Beine, falls erforderlich, senkrecht nach oben gestreckt, um den zerebralen Blutfluss wieder herzustellen. Die Atemwege müssen frei gehalten werden, ein Rachentubus sollte stets zur Hand sein. Eine persistierende Bradykardie kann durch Gabe von i.v. Atropin kontrolliert werden. Sofern Sauerstoff zur Verfügung steht, kann dieser zugeführt werden.
Perforation: In seltenen Fällen können bei intrauteriner Kontrazeption Perforation oder Penetration des Corpus uteri oder der Zervix auftreten, am häufigsten während der Insertion. Dies kann einhergehen mit starken Schmerzen und fortgesetzten Blutungen. Falls der Verdacht einer Perforation besteht, ist das System schnellstmöglich zu entfernen. Das Risiko einer Perforation kann bei postpartaler Insertion (siehe Abschnitt 4.2), bei stillenden Frauen sowie bei Frauen mit fixiertem retrovertierten Uterus erhöht sein.
Infektionen des kleine Beckens: Bei Anwenderinnen von Kupfer-Intrauterinpessaren (IUDs) ist die Häufigkeit entzündlicher Beckenerkrankungen im ersten Monat nach der Insertion am höchsten und nimmt danach ab.
Bekannte Risikofaktoren für entzündliche Beckenerkrankungen sind wechselnde Sexualpartner, häufiger Geschlechtsverkehr und jugendliches Alter. Eine Beckenentzündung kann schwerwiegende Folgen haben, da sie die Fertilität beeinträchtigen und das Risiko für eine ektopische Schwangerschaft erhöhen kann. Wie bei anderen gynäkologischen oder operativen Maßnahmen kann nach einer IUS Insertion eine schwere Infektion oder Sepsis (einschließlich einer Sepsis mit Streptokokken der Gruppe A) auftreten, obgleich dies äußerst selten auftritt.
Wenn bei Frauen, die Levosert anwenden, Symptome und Anzeichen einer Beckenentzündung auftreten, sind, selbst bei nur schwachen Symptomen, bakteriologische Untersuchungen und eine Beobachtung der Patientin angezeigt, und es sollte eine geeignete Antibiotika-Therapie begonnen werden. Es besteht keine Notwendigkeit, Levosert zu entfernen, außer die Symptome verschwinden nicht innerhalb von 72 Stunden oder die Anwenderin möchte Levosert entfernt haben. Wenn bei einer Anwenderin eine rezidivierende Endometritis oder eine entzündliche Beckenerkrankung auftritt oder bei schwerwiegendem Verlauf einer akuten Infektion, muss Levosert entfernt werden.
Komplikationen, die zu einem Versagen führen
Expulsion: Zu den Symptomen einer partiellen oder kompletten Expulsion jedes IUS gehören Blutungen und Schmerzen. Ein System kann jedoch auch aus dem Cavum uteri ausgestoßen werden, ohne dass es die Patientin merkt, und damit zum Verlust der kontrazeptiven Wirkung führen. Bei einer partiellen Expulsion kann die Wirksamkeit von Levonorgestrel vermindert sein. Da das Pessar die Menstruationsblutung vermindert, kann eine verstärkte Menstruationsblutung ein Hinweis auf eine Expulsion sein. Ein disloziertes Levosert sollte entfernt und durch ein neues ersetzt werden. Der Patientin sollte erklärt werden, wie sie das Vorhandensein der Rückholfäden von Levosert überprüft und dass sie unverzüglich ihren Arzt aufsuchen sollte, falls sie die Rückholfäden nicht mehr erfühlen kann.
Nicht auffindbare Rückholfäden: Sind bei einer Nachkontrolle die Rückholfäden an der Zervix nicht sichtbar, ist zuerst eine Schwangerschaft auszuschließen. Die Rückholfäden können sich in den Uterus
oder in den Zervikalkanal zurückgezogen haben und bei der nächsten Menstruation wieder sichtbar werden. Sind sie nicht auffindbar, können sie möglicherweise abgerissen sein oder das Pessar wurde möglicherweise ausgestoßen oder, in seltenen Fällen, es hat die Uteruswand durchdrungen und befindet sich extrauterin. Eine Ultraschalluntersuchung sollte zur Lokalisierung des Pessars durchgeführt werden, und bis dahin sollte zu alternativen Methoden der Kontrazeption geraten werden. Im Falle, dass eine Ultraschalluntersuchung das Pessar nicht lokalisieren kann und keine Anzeichen für eine Expulsion festgestellt wurden, sollte eine röntgenologische Abdomenleeraufnahme gemacht werden, um ein extrauterines Pessar auszuschließen.
Blutungsunregelm äßigkeiten
Irreguläre Blutungen: Levosert führt nach 3 bis 6 Monaten Behandlung zu einem signifikanten Rückgang des menstruellen Blutverlustes. Erhöhter Menstruationsfluss oder unerwartete Blutungen können ein Hinweis auf eine Expulsion sein. Im Falle einer anhaltenden Menorrhagie sollte die Patienten nochmals untersucht werden. Mittels einer Ultraschalluntersuchung sollte eine Beurteilung des Cavum uteri erfolgen. Eine Endometriumbiopsie sollte ebenfalls in Erwägung gezogen werden.
Risiko bei _prämenopausalen Frauen
Da während der ersten Behandlungsmonate bei prämenopausalen Frauen unregelmäßige Blutungen/Schmierblutungen auftreten können, wird empfohlen, pathologische Veränderungen des Endometriums vor der Insertion von Levosert auszuschließen.
Wann sind Frauen im gebärfähigen Alter auf eine Schwangerschaft hin zu untersuchen: Die Möglichkeit einer Schwangerschaft sollte in Betracht gezogen werden, falls innerhalb von sechs Wochen nach Beginn der letzten Menstruation keine Blutung einsetzt, und eine Expulsion sollte ausgeschlossen werden. Wiederholte Schwangerschaftstests sind bei amenorrhoischen Frauen nicht erforderlich, es sei denn, die Tests sind aufgrund anderer Symptome indiziert. Oligo- und/oder Amenorrhoe stellt sich bei etwa 20 % der Anwenderinnen im gebärfähigen Alter nach und nach ein.
Behandlungsempfehlung bei Menorrhagie: Levosert führt gewöhnlich innerhalb von 3 bis 6 Monaten Behandlung zu einem signifikanten Rückgang des menstruellen Blutverlustes. Falls in diesem Zeitrahmen kein signifikanter Rückgang des Blutverlustes erreicht wird, sollten alternative Behandlungen in Betracht gezogen werden.
Andere Risiken während der Anwendung
Ektopische Schwangerschaft: Frauen mit vorausgegangener ektopischer Schwangerschaft, Operation der Tuben oder Infektionen des kleinen Beckens sind besonders gefährdet für eine ektopische Schwangerschaft. Das absolute Risiko für eine ektopische Schwangerschaft bei Anwenderinnen von Levonorgestrel IUS ist gering. Wenn eine Frau jedoch unter Anwendung von Levosert in situ schwanger wird, ist die relative Wahrscheinlichkeit für eine ektopischen Schwangerschaft erhöht. Bei Unterleibsschmerzen ist die Möglichkeit einer ektopischen Schwangerschaft in Betracht zu ziehen -insbesondere in Verbindung mit ausgebliebenen Regelblutungen oder wenn bei einer amenorrhoischen Frau wieder eine Blutung auftritt. Die Rate ektopischer Schwangerschaften beträgt bei Levonorgestrel IUS-Anwenderinnen 0,06 pro 100 Frauenjahre. Diese Rate liegt unter der Rate von 0,3-0,5 pro 100 Frauenjahren bei Frauen, die nicht verhüten. Der entsprechende Wert für Kupfer-IUS beträgt 0,12 pro 100 Frauenjahre. Frauen mit einer anamnestischen ektopischen Schwangerschaft haben ein erhöhtes Risiko für eine weitere ektopische Schwangerschaft.
Ovarialzysten: Bei Frauen im gebärfähigen Alter kommt es normalerweise zu ovulatorischen Zyklen mit Follikelruptur. Manchmal ist die Atresie der Follikel verzögert und die Follikulogenese dauert an. Solche vergrößerten Follikel sind klinisch nicht von Ovarialzysten zu unterscheiden. Daten aus klinischen Studien zufolge wurden Ovarialzysten als unerwünschte Arzneimittelwirkung bei ca. 7 % der Anwenderinnen von Levosert gemeldet, jedoch haben einige publizierte Studien eine höhere Inzidenz von Ovarialzysten berichtet (was durch Faktoren wie Häufigkeit und Beurteilungskriterien der Ultraschalluntersuchungen oder Patientenpopulation beeinflusst worden sein kann). Die meisten dieser Follikel verursachen keine Beschwerden, sie können jedoch in einigen Fällen von Schmerzen im kleinen Becken oder Dyspareunie begleitet sein.
In den meisten Fällen bilden sich die Ovarialzysten im Laufe eines zwei- bis dreimonatigen Beobachtungszeitraums spontan zurück. Sollte dies nicht der Fall sein, können fortlaufende Ultraschallkontrollen sowie andere diagnostische/therapeutische Maßnahmen angezeigt sein. In seltenen Fällen kann ein chirurgischer Eingriff erforderlich sein.
Brustkrebs:
Risiko bei prämenopausalen Frauen
Für Frauen, die derzeit kombinierte orale Kontrazeptiva (KOK) anwenden (hauptsächlich Estrogen-Gestagen Präparate), hat eine Metaanalyse 54 epidemiologischer Studien ein leicht erhöhtes relatives Brustkrebsrisiko (RR = 1,24) ergeben. Innerhalb von 10 Jahren nach Absetzen der KOK geht das erhöhte Risiko allmählich wieder auf das Grundrisiko zurück. Da Brustkrebs bei Frauen unter 40 Jahren relativ selten auftritt, ist die Anzahl zusätzlicher Brustkrebsfälle bei momentanen oder ehemaligen KOK-Anwenderinnen klein im Vergleich zum Gesamtrisiko für Brustkrebs.
Das Brustkrebsrisiko bei Anwenderinnen von ausschließlich Gestagen-haltigen Kontrazeptiva (POPs, Implantate und Injektabilia), zu denen auch Levosert zählt, liegt möglicherweise in der gleichen Größenordnung wie bei Anwenderinnen von KOK. Für reine Gestagen Kontrazeptiva beruht die Evidenz jedoch auf wesentlich geringeren Anwenderinnenzahlen und ist daher weniger aussagekräftig als die für KOK.
Allgemeine Information
Glucosetoleranz: Niedrig dosiertes Levonorgestrel kann die Glucosetoleranz beeinflussen, deshalb sollte bei Diabetikerinnen, die Levosert anwenden, der Blutzuckerspiegel überwacht werden.
Postkoitale Kontrazeption: Levosert ist nicht zur postkoitalen Kontrazeption geeignet.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Der Metabolismus von Gestagenen kann durch die gleichzeitige Anwendung von Substanzen verstärkt werden, die Arzneimittel-metabolisierende Enzyme, vor allem die Cytochrom-P450 Enzyme, induzieren; zu diesen Substanzen gehören Antikonvulsiva (z. B. Phenobarbital, Phenytoin, Carbamazepin) und Antiinfektiva (z. B. Griseofulvin, Rifampicin, Rifabutin, Nevirapin, Efavirenz). Andererseits können Wirkstoffe, die bekanntermaßen Arzneimittel-metabolisierende Enzyme hemmen (z. B. Itraconazol, Ketoconazol), die Serumkonzentration von Levonorgestrel erhöhen. Der Einfluss dieser Arzneimittel auf die kontrazeptive Wirksamkeit von Levosert ist nicht bekannt, aufgrund des lokalen Wirkmechanismus wird aber nicht angenommen, dass dieser von großer Bedeutung ist.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft: Levosert ist während einer bestehenden oder vermuteten Schwangerschaft nicht anzuwenden. Kommt es während der Anwendung von Levosert in situ versehentlich zu einer Schwangerschaft (siehe Abschnitt 5: Pharmakologische Eigenschaften), so ist eine ektopische Schwangerschaft auszuschließen (siehe Abschnitt 4.4), das System zu entfernen sowie ein Abbruch der Schwangerschaft in Betracht zu ziehen, da ein hohes Risiko für Schwangerschaftskomplikationen (Abort, Infektion und Sepsis) besteht. Das Entfernen von Levosert oder die Untersuchung des Uterus kann zu einem spontanen Abort führen. Sollten diese Untersuchungen nicht möglich sein oder seitens der Anwenderin der Wunsch nach Fortsetzung der Schwangerschaft bestehen, sollte sie über die Risiken informiert werden. Der Verlauf einer solchen Schwangerschaft sollte engmaschig überwacht werden. Die Patientin sollte angewiesen werden, alle Symptome einer möglichen Schwangerschaftskomplikation, wie mit Fieber einhergehende Bauchkrämpfe, zu berichten.
Lokale Exposition mit Levonorgestrel:
Aufgrund der intrauterinen Anwendung und der lokalen Hormonexposition sollte das mögliche Auftreten virilisierender Effekte beim Fetus in Erwägung gezogen werden. Klinische Erfahrungen über den Verlauf von Schwangerschaften unter Anwendung von Levonorgestrel IUS in situ sind aufgrund der hohen kontrazeptiven Wirksamkeit begrenzt, aber die Patientin sollte darüber informiert werden, dass in den Fällen, in denen die Schwangerschaft mit liegendem IUS ausgetragen wurde, bis heute keine Hinweise auf Missbildungen vorliegen, die durch ein Levonorgestrel-haltiges IUS in situ verursacht wurde.
Stillzeit: Levonorgestrel tritt nach Anwendung von Levonorgestrel IUS nur in sehr geringen Mengen in die Muttermilch über. Da keine Risiken für den Säugling zu erwarten sind, kann das Stillen während der Anwendung von Levosert fortgesetzt werden. In seltenen Fällen ist über Gebärmutterblutungen bei Frauen berichtet worden, die Levonorgestrel IUS während der Stillzeit angewendet haben.
Fertilität: Die Anwendung eines Levonorgestrel IUS hat nach Entfernung des IUS keinen Einfluss auf die weibliche Fertilität.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Levosert hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Unerwünschte Wirkungen treten häufiger während der ersten Monate nach dem Einlegen auf und klingen bei längerer Anwendung ab.
Zu den sehr häufigen unerwünschten Wirkungen (bei über 10 % der Anwenderinnen) gehören Uterus-/Vaginalblutungen, einschließlich Schmierblutungen, Oligomenorrhoe, Amenorrhoe (siehe Abschnitt 5.1) und gutartige Ovarialzysten.
Die ermittelte Häufigkeit des Auftretens von gutartigen Ovarialzysten hängt vom angewandten diagnostischen Verfahren ab, und in klinischen Studien wurden bei 12 % der Patientinnen, die Levonorgestrel IUS angewendet haben, vergrößerte Follikel diagnostiziert. Die meisten der Follikel verursachen keine Beschwerden und bilden sich innerhalb von 3 Monaten zurück.
In der nachfolgenden Tabelle werden die Häufigkeiten der Nebenwirkungen nach MedDRA SOCs aufgeführt. Die Häufigkeiten basieren auf Daten aus klinischen Studien.
|
Organsystem |
Nebenwirkun |
gen | |||
|
Sehr häufig: >1/10 |
Häufig: >1/100, <1/10 |
Gelegentlich: >1/1.000, <1/100 |
Selten: >1/10.000, <1/1.000 | ||
|
Erkrankungen des Immunsystems |
Überempfindlic h- keitsreaktionen einschließlich Hautausschlag, Urtikaria und Angioödem | ||||
|
Psychiatrische Erkrankungen |
Depressive Stimmung Nervosität Verminderte Libido | ||||
|
Erkrankungen des Nervensystems |
Kopfschmerz en |
Migräne | |||
|
Erkrankungen des Gastrointestinaltrakts |
Bauch schmerzen Übelkeit |
Abdominale Distension | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Akne |
Alopezie Hirsutismus Pruritus Ekzem Chloasma/Hyp er- pigmentierung der Haut |
Hautausschlag Urtikaria | ||
|
Skelettmuskulatur-, Bindegewebs-und Knochenerkrankungen |
Rücken schmerzen | ||||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Uterus-/Vaginal-blutungen einschließlic h Schmierblutungen, Oligomenorrhoe, Amenorrhoe Gutartige Ovarialzyste n |
Becken schmerzen Dys menorrhoe Genital ausfluss Vulvo vaginitis Brust spannen Brust schmerzen |
Entzündliche Beckenerkran kung Endometritis Zervizitis Normaler Papanicolaou- Abstrich, Klasse II |
Uterus perforation | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungs ort |
Expulsion des Intrauterin pessars |
Ödem | |||
|
Untersuchungen |
Gewichts zunahme | ||||
Infektionen und parasitäre Erkrankungen
Nach einer IUS Insertion wurden Fälle von Sepsis (einschließlich einer Sepsis mit Streptokokken der Gruppe A) berichtet (siehe Abschnitt 4.4).
Schwangerschaft, Wochenbett undperinatale Erkrankungen
Wenn eine Frau unter Anwendung von Levosert in situ schwanger wird, ist das relative Risiko einer ektopischen Schwangerschaft erhöht (siehe „Besondere Wamhinweise und Vorsichtsmaßnahmen für die Anwendung“ und „Fertilität, Schwangerschaft und Stillzeit“).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Bei Anwenderinnen von Levonorgestrel IUS wurde über Fälle von Brustkrebs berichtet (Häufigkeit nicht bekannt, siehe Abschnitt 4.4).
Die folgenden Nebenwirkungen sind in Verbindung mit der Insertion oder der Entfernung von Levosert beobachtet worden: Schmerzen, Blutungen, vasovagale Reaktionen mit Schwindel oder Synkope während der Insertion (siehe Abschnitt 4.4). Bei Patientinnen mit Epilepsie kann auch ein Krampfanfall ausgelöst werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Nicht zutreffend.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Intrauterine Kontrazeptiva. Plastik-IUP mit Gestagen ATC-Code: G02BA03
Levonorgestrel ist ein Gestagen, das in der Gynäkologie in verschiedener Weise eingesetzt wird: als die Gestagen-Komponente in oralen Kontrazeptiva sowie bei der Hormonersatztherapie oder als Einzelsubstanz zur Kontrazeption in der Minipille und subdermalen Implantaten. Levonorgestrel kann ebenfalls direkt in das Cavum uteri eingesetzt werden in Form eines IUS. Dies ermöglicht eine sehr niedrige Tagesdosierung, da das Hormon direkt im Zielorgan freigesetzt wird. Der kontrazeptive Wirkmechanismus des Levonorgestrel IUS beruht hauptsächlich auf hormonellen Wirkungen, die die folgenden Veränderungen erzeugen:
- Verhinderung der Endometriumproliferation
- Viskositätserhöhung des Zervixschleims, wodurch die Passage der Spermien verhindert wird
- bei einigen Frauen, Unterdrückung der Ovulation.
Vom Vorhandensein des Systems im Uterus wäre ebenfalls zu erwarten, dass davon ein geringer Beitrag zur kontrazeptiven Wirkung ausgeht.
Nach Insertion unter Befolgung der Insertionsanleitung beträgt die Versagerrate von Levosert ca. 0,19 % (95 % CI: 0,05 % - 0,75 %) pro Jahr. Die Versagerrate kann im Falle einer Expulsion von Levosert oder einer Perforation zunehmen.
Levonorgestrel IUS ist möglicherweise bei Patientinnen mit starken Menstruationsblutungen zur Kontrazeption besonders geeignet und kann zur Behandlung der idiopathischen Menorrhagie erfolgreich eingesetzt werden.
Nach dreimonatiger Anwendung war der menstruelle Blutverlust bei menorrhagischen Frauen um 88 % zurückgegangen. Eine Menorrhagie, die durch submuköse Myome verursacht wird, spricht weniger gut auf die Behandlung an. Die Verminderung des Blutverlustes führt zu einem Anstieg des Hämoglobingehalts bei Patientinnen mit Menorrhagie.
Bei idiopathischer Menorrhagie ist die Verhinderung der Endometriumproliferation der wahrscheinliche Wirkmechanismus von Levonorgestrel IUS, der zur Verringerung des Blutverlustes führt.
Blutungsmuster:
Bei allen Anwenderinnen von Levonorgestrel IUS kommt es zu verschiedenartigen Änderungen im Blutungsverhalten (häufige, verlängerte oder starke Blutungen, Schmierblutungen, Oligomenorrhoe, Amenorrhoe). Bei Frauen im gebärfähigen Alter geht während der ersten sechs Monate die durchschnittliche Anzahl Tage pro Monat mit Schmierblutungen allmählich von neun auf vier Tage zurück. Der Prozentsatz der Frauen mit verlängerten Blutungen (länger als acht Tage) nimmt während der ersten drei Monate der Anwendung von 20 % auf 3 % ab. In klinischen Studien entwickelten 17 % der Frauen im ersten Jahr der Anwendung eine Amenorrhoe von wenigstens dreimonatiger Dauer.
5.2 Pharmakokinetische Eigenschaften
Die initiale Freisetzung von Levonorgestrel aus Levosert beträgt 20 Mikrogramm/24 Stunden, sie erfolgt direkt lokal in das Cavum uteri. Aufgrund der geringen Plasmakonzentration sind nur geringe Wirkungen auf den Metabolismus zu verzeichnen. Geschätzte in vivo Abgaberaten zu verschiedenen Zeitpunkten auf der Grundlage von ex vivo Restgehaltsdaten ausgewählter ausgestoßener oder entfernter Systeme von Frauen, die Levosert zur Kontrazeption anwendeten, sind nachfolgend gelistet.
|
Zeitpunkt |
Geschätzte durchschnittliche in vivo Freisetzungsrate [Mikrogramm/24 Stunden] |
|
Nach initialer Insertion |
18,6 |
|
1 Jahr nach Insertion |
16,3 |
|
2 Jahre nach Insertion |
14,3 |
|
3 Jahre nach Insertion |
12,6 |
|
Durchschnitt über 3 Jahre |
15,6 |
Die Pharmakokinetik des Wirkstoffs Levonorgestrel ist extensiv untersucht und in der Literatur berichtet worden. In einer Studie mit nicht-übergewichtigen Frauen, die Levosert zur Kontrazeption anwendeten, betrug die mittlere Plasmakonzentration von Levonorgestrel sieben Tage nach Insertion 310 ± 140 pg/ml bzw. 192 ± 36 pg/ml, 178 ± 38 pg/ml sowie 139 ± 42 pg/ml nach jeweils 56 Wochen bzw. 24 und 36 Monaten.
Eine Halbwertszeit von 20 Stunden wird als bester Näherungswert betrachtet, wenngleich einige Studien Werte von nur 9 Stunden und andere wiederum von 80 Stunden berichtet haben. Eine andere wichtige Erkenntnis, obgleich eine, die in Übereinstimmung mit den Erfahrungen bei anderen synthetischen Steroiden steht, waren deutliche interindividuelle Unterschiede der metabolischen Clearance-Raten, selbst dann, wenn eine intravenöse Verabreichung erfolgte. Levonorgestrel wird extensiv an Proteine gebunden (hauptsächlich an das sexualhormonbindende Globulin [SHBG]) und extensiv zu einer großen Zahl von inaktiven Metaboliten verstoffwechselt.
5.3 Präklinische Daten zur Sicherheit
Präklinische Daten lassen, abgesehen von den Informationen, die bereits in anderen Abschnitten der SmPC enthalten sind, keine besonderen Gefahren für den Menschen erkennen. Diese Daten basieren auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität, karzinogenem Potential sowie Reproduktionstoxizität und Entwicklung.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Polydimethylsiloxan Elastomer Polydimethylsiloxan Insertionsröhrchen Polyethylen T-Körper mit 20-24 % Bariumsulfat Polypropylen Rückholfaden Ciaftalan-Kupfer
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
In der Originalverpackung aufbewahren. Beutel im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Levosert IUS mit der Insertionsvorrichtung ist einzeln in eine thermogeformte Blisterpackung (Polyester) mit abziehbarer Deckelfolie (TYVEK-Polyethylen) verpackt.
Packungsgrößen: 1 x 1
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Da sich das Insertionsverfahren von dem für andere Intrauterinpessare verwendeten unterscheidet, kommt einer Schulung zur fachgerechten Insertionstechnik besondere Bedeutung zu. Spezielle Anweisungen zur Insertion sind in der Packung enthalten.
Levosert ist in einer sterilen Verpackung erhältlich, die erst zum Zeitpunkt der Insertion geöffnet werden sollte. Jedes System ist unter Einhaltung aseptischer Vorsichtsmaßnahmen zu handhaben.
Falls die Versiegelung der sterilen Verpackung zerstört ist, ist das darin befindliche System gemäß den lokalen Anforderungen an die Handhabung biogefährlichen Abfalls zu beseitigen. Entsprechend sind ein entferntes Levosert und eine benutzte Insertionsvorrichtung auf dieselbe Weise zu beseitigen. Der Umkarton und die innere Blisterpackung können als Haushaltsabfall entsorgt werden.
7. INHABER DER ZULASSUNG
Allergan Pharmaceuticals International Limited Clonshaugh Industrial Estate Coolock, Dublin 17 Irland
8. ZULASSUNGSNUMMER
91463.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
20.07.2015
10. STAND DER INFORMATION
März 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig