Lisvy 60 Mikrogramm/24 Stunden + 13 Mikrogramm/24Stunden Transdermales Pflaster
FACHINFORMATION
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
1. BEZEICHNUNG DES ARZNEIMITTELS
Lisvy 60 Mikrogramm/24 Stunden + 13 Mikrogramm/24 Stunden transdermales Pflaster
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jedes 11 cm2 große transdermale Pflaster enthält 2,10 mg Gestoden und 0,55 mg Ethinylestradiol. Jedes transdermale Pflaster setzt 60 Mikrogramm Gestoden und 13 Mikrogramm Ethinylestradiol (entspricht oralen Dosen von 20 Mikrogramm) über 24 Stunden frei.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Transdermales Pflaster
Dünnes transdermales Matrixpflaster bestehend aus fünf Lagen.
Das Pflaster ist rund, transparent und hat eine Größe von 11 cm2. Auf seiner klebenden Seite ist das Pflaster durch eine zweiteilige, quadratische, glänzende, klare Abziehfolie bedeckt.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Hormonale Kontrazeption bei Frauen.
Lisvy ist für Frauen im gebärfähigen Alter bestimmt. Die Sicherheit und Wirksamkeit ist bei Frauen im Alter von 18 bis 45 Jahren erwiesen.
Bei der Entscheidung, Lisvy zu verschreiben, sollten die gegenwärtig vorliegenden, individuellen Risikofaktoren der jeweiligen Frau, insbesondere im Hinblick auf venöse Thromboembolien (VTE), berücksichtigt werden. Auch sollte das Risiko für eine VTE bei Anwendung von Lisvy mit dem anderer kombinierter hormonaler Kontrazeptiva (KHK) verglichen werden (siehe Abschnitte 4.3 und 4.4).
4.2 Dosierung und Art der Anwendung
Dosierung
Lisvy wird in einem Zyklus von 28 Tagen (4 Wochen) angewendet:
Über drei aufeinanderfolgende Wochen (21 Tage) wird jede Woche ein neues Pflaster aufgeklebt und das gebrauchte Pflaster entfernt. Die vierte Woche ist pflasterfrei. Eine Entzugsblutung setzt üblicherweise in dieser Zeit ein. Eine Woche nach Entfernen des letzten Pflasters wird ein neuer Zyklus von 4 Wochen durch Aufkleben eines neuen Pflasters begonnen (am gleichen Wochentag wie bisher, dem „Pflasterwechseltag“), unabhängig davon, ob die übliche Entzugsblutung noch andauert oder bereits aufgehört hat. Siehe Abschnitt 4.4 „Reduzierte Zykluskontrolle“, wenn die übliche Entzugsblutung nicht einsetzt. Das genaue Schema für das Aufkleben/Entfernen der Pflaster siehe „Pflasterwechseltag“ im Abschnitt „Wie Lisvy angewendet wird“.
Beginn der erstmaligen Anwendung von Lisvy
- Keine vorangegangene Anwendung von hormonalen Kontrazeptiva (im letzten Monat)
Das Pflaster muss am ersten Tag des natürlichen Zyklus der Frau (d. h. am ersten Tag ihrer Menstruationsblutung) aufgeklebt werden. Ein Anwendungsbeginn an den Tagen 2 - 5 ist möglich, jedoch ist in diesem Fall während der ersten 7 Tage, an denen das erste Pflaster getragen wird, die Verwendung einer Barrieremethode erforderlich.
- Wechsel von einem kombinierten hormonalen Kontrazeptivum (kombiniertes orales Kontrazeptivum (KOK), Vaginalring oder ein anderes transdermales Pflaster)
Das Pflaster sollte vorzugsweise einen Tag nach der letzten wirkstoffhaltigen Tablette des bisherigen KOK, spätestens jedoch am Tag nach dem üblichen tablettenfreien Intervall bzw. dem Intervall mit hormonfreien Tabletten des KOK aufgeklebt werden.
Bei Umstellung von einem Vaginalring oder von einem anderen transdermalen Pflaster sollte das Pflaster vorzugsweise am Tag der Entfernung des letzten Vaginalrings bzw. des letzten Pflasters einer Zykluspackung aufgeklebt werden, spätestens jedoch zum Zeitpunkt, an dem die nächste Anwendung fällig gewesen wäre.
- Wechsel von einem Gestagenmonopräparat („Minipille“, Injektionspräparat, Implantat) oder einem gestagenfreisetzenden Intrauterinpessar (IUP)
Die Umstellung von dem Gestagenmonopräparat kann an jedem beliebigen Tag erfolgen (von einem Implantat oder IUP am Tag der Entfernung, oder von einem Injektionspräparat zum Zeitpunkt, an dem die nächste Injektion fällig wäre). In all diesen Fällen sollte die Anwenderin angewiesen werden, während der ersten 7 Tage, an denen das Pflaster getragen wird, zusätzlich eine Barrieremethode anzuwenden.
- Nach einem Abort im ersten Trimester
Es kann sofort mit der Anwendung begonnen werden. In diesem Fall sind keine zusätzlichen empfängnisverhütenden Maßnahmen erforderlich.
- Nach einer Geburt oder einem Abort im zweiten Trimester
Den Frauen sollte empfohlen werden, mit der Anwendung an den Tagen 21 bis 28 nach einer Geburt oder nach einem Abort im zweiten Trimester zu beginnen. Bei einem späteren Anwendungsbeginn sollte während der ersten 7 Tage, an denen das Pflaster getragen wird, zusätzlich eine Barrieremethode angewendet werden. Wenn jedoch bereits Geschlechtsverkehr stattgefunden hat, muss vor dem Beginn der Anwendung von Lisvy eine Schwangerschaft ausgeschlossen oder die erste Menstruationsblutung abgewartet werden.
Zur Anwendung bei stillenden Frauen siehe Abschnitt 4.6.
Wie Lisvy angewendet wird
Lisvy wird in Zyklen von 28 Tagen (4 Wochen) angewendet (1 Pflaster pro Woche in den ersten 3 Wochen, gefolgt von einem 7-tägigen pflasterfreien Intervall). Es darf immer nur 1 Pflaster getragen werden. Jeder weitere Zyklus beginnt unmittelbar nach einem pflasterfreien Intervall des vorherigen Zyklus, unabhängig davon, ob die übliche Entzugsblutung noch andauert oder bereits aufgehört hat.
- Pflasterwechseltag
Jedes neue Pflaster wird am selben Wochentag aufgeklebt. Dieser Tag wird als „Pflasterwechseltag“ bezeichnet. Wenn beispielsweise das erste Pflaster an einem Sonntag aufgeklebt wird, müssen alle weiteren Pflaster ebenfalls an einem Sonntag aufgeklebt werden. Es darf immer nur ein Pflaster getragen werden.
Tag 1: Aufkleben des 1. Pflasters (Hinweise für Frauen, die zum ersten Mal Lisvy anwenden, siehe Abschnitt „Beginn der erstmaligen Anwendung von Lisvy“)
1. Pflaster
2. Pflaster
3. Pflaster Kein Pflaster
Tag 8: Entfernen des 1. Pflasters und unmittelbar danach Aufkleben des
2. Pflasters
Tag 15: Entfernen des 2. Pflasters und unmittelbar danach Aufkleben des
3. Pflasters
Tag 22: Entfernen des 3. Pflasters (kein Pflaster an den Tagen 22 - 28).
Das Entfernen des Pflasters wird am selben Wochentag („Pflasterwechseltag“) vorgenommen. Der Pflasterwechsel kann zu jeder Tageszeit am „Pflasterwechseltag“ vorgenommen werden. Die weiteren Zyklen beginnen am selben „Pflasterwechseltag“ nach Ablauf des 7-tägigen pflasterfreien Intervalls (Tage 22 - 28).
- Pflasterfreie Tage
Von Tag 22 (nach Entfernen des 3. Pflasters) bis Tag 28 („Woche 4“) wird kein Pflaster getragen.
Das pflasterfreie Intervall zwischen den Zyklen darf unter keinen Umständen länger als 7 Tage sein.
Bei mehr als sieben pflasterfreien Tagen, IST DIE ANWENDERIN MÖGLICHERWEISE NICHT VOR EINER SCHWANGERSCHAFT GESCHÜTZT. Sobald die Anwenderin bemerkt, dass der Starttermin für einen neuen Zyklus versäumt wurde, muss ein neuer Zyklus durch Aufkleben eines neuen Pflasters begonnen werden und während der nächsten 7 Tage eine zusätzliche Verhütungsmethode (z. B. Kondome, Spermizide oder Diaphragma) angewendet werden. Wie bei KOK steigt das Risiko eines Eisprungs mit jedem Tag, der über den empfohlenen arzneimittelfreien Zeitraum hinausgeht.
Fand während eines solchen verlängerten pflasterfreien Intervalls Geschlechtsverkehr statt, muss mit der Möglichkeit einer Schwangerschaft gerechnet werden. Siehe auch Abschnitt „Verhalten bei abgelöstem, versäumtem oder nicht ersetztem Pflaster“.
Art der Anwendung
Zur transdermalen Anwendung.
Wo das Pflaster aufgeklebt wird
Das Pflaster sollte nur auf eine der folgenden Anwendungsstellen aufgeklebt werden (siehe Abbildung unten): Bauch, Gesäß oder Außenseite der Oberarme.
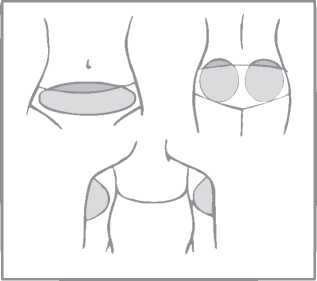
Bereiche, von denen das Pflaster weggerieben werden könnte (z. B. durch den Bund eines Kleidungsstücks), sollten nicht gewählt werden.
Das Pflaster sollte auf saubere, trockene, intakte, gesunde und vorzugsweise unbehaarte Haut aufgeklebt werden.
Lisvy soll nicht auf fettige, gerötete, gereizte, durch eine Schnittwunde oder auf andere Weise verletzte Haut aufgeklebt werden.
Das Pflaster darf nicht auf die Brüste geklebt werden.
Damit die Klebefähigkeit von Lisvy nicht beeinträchtigt wird, sollten auf den Hautbereich, auf den das Pflaster aufgeklebt ist oder werden soll, weder Make-up, noch Cremes, Lotionen, Puder oder andere topische Produkte aufgetragen werden.
Die Applikationsstellen sollten gewechselt werden. Dies kann durch Benutzen verschiedener Stellen des gleichen Anwendungsbereiches erfolgen. So kann die Anwenderin z. B. von der linken zur rechten Bauchseite oder von der linken zur rechten Gesäßhälfte oder vom linken zum rechten Oberarm wechseln.
Die Anwenderin kann auch jede Woche eine andere Applikationsstelle wählen (z. B. in der einen Woche die Außenseite des Oberarms, in der nächsten Woche den Bauch).
Die Anwenderin sollte ihr Pflaster täglich visuell überprüfen, um die anhaltende, richtige Haftung zu gewährleisten._
Bitte beachten
- Es darfjeweils nur 1 Pflaster getragen werden.
- Wenn das Pflaster ordnungsgemäß aufgeklebt ist, kann damit wie gewohnt gebadet und geduscht werden.
- Das transparente Pflaster besitzt einen UV-/Sonnenschutz; es kann daher der Sonne ausgesetzt werden und muss nicht mit einem Kleidungsstück bedeckt werden.
Im Falle einer Hautreizung
Sollte das Pflaster eine unangenehme Hautreizung an der Klebestelle verursachen, sollte es abgenommen und ein neues Pflaster an einer anderen Stelle aufgeklebt werden. Das neue Pflaster wird bis zum nächsten planmäßigen „Pflasterwechseltag“ getragen.
Wie das Pflaster für die Anwendung vorzubereiten ist
Lisvy befindet sich in einer Schachtel, die eine Packungsbeilage sowie 3 oder 9 oder 18 versiegelte Beutel mit je einem Lisvy transdermalen Pflaster enthält.
Das Pflaster ist rund und transparent:
Auf seiner klebenden Seite ist das Pflaster durch eine zweiteilige, quadratische, glänzende, klare Abziehfolie bedeckt. Diese Folie schützt die klebende Seite des Pflasters, die die Wirkstoffe enthält. Sie sorgt außerdem dafür, dass die Klebefläche bis zur Anwendung funktionsfähig bleibt.
Auf der Rückseite ist das Pflaster von einem milchig weißen, quadratischen Trennblatt bedeckt, das das Festkleben des Pflasters im Beutel verhindert.

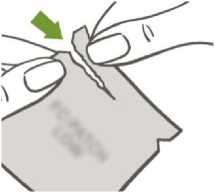
Der Beutel wird entlang der Oberkante mit den Fingern aufgerissen. Die Kerben erleichtern das Aufreißen des Beutels.
Beim Öffnen des Beutels darf keine Schere benutzt und das Pflaster nicht zerschnitten, beschädigt oder in sonstiger Weise verändert werden, da die kontrazeptive Wirkung dadurch beeinträchtigt werden könnte.
Das runde Verhütungspflaster befindet sich zwischen einer zweiteiligen, quadratischen, glänzenden, klaren Abziehfolie und einem milchig weißen, quadratischen Trennblatt. Es ist wichtig, dass das Pflaster zusammen mit der klaren Abziehfolie und dem milchig weißen, quadratischen Trennblatt aus dem Beutel genommen wird. Der Beutel sollte nicht weggeworfen, sondern für die Entsorgung des gebrauchten Pflasters aufgehoben werden.
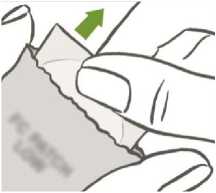
Das Pflaster ist sofort nach dem Öffnen des Beutels wie folgt aufzukleben:
Zuerst wird das einteilige, milchig weiße, quadratische Trennblatt von der Außenseite des Pflasters abgezogen.
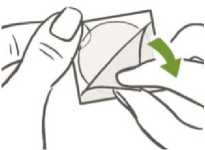
Nach dem Abziehen vom Pflaster sollte das milchig weiße, quadratische Trennblatt, das verhindert, dass das Pflaster im Beutel kleben bleibt, entsorgt werden.
Anschließend wird eine Hälfte der zweiteiligen, quadratischen, glänzenden, klaren Abziehfolie von der (klebenden) Unterseite des kreisförmigen transparenten Pflasters abgezogen. (Die klebende Seite enthält die Wirkstoffe.) Die klebende Fläche des Pflasters darf dabei nicht berührt werden, damit die Haftfähigkeit nicht beeinträchtigt wird.
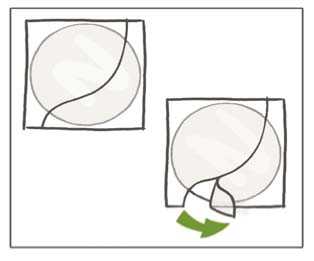
Während das Pflaster am, noch durch die zweite Hälfte der Abziehfolie bedeckten, Rand gehalten wird, wird das Pflaster dort auf der Haut positioniert, wo es getragen werden soll.
Die eine Hälfte des Pflasters wird nun vorsichtig auf die Applikationsstelle geklebt und die zweite Hälfte der Abziehfolie entfernt.
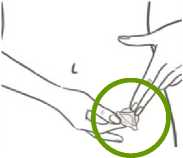
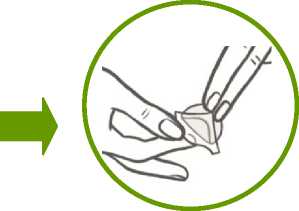
Mit der Handinnenfläche wird das Pflaster 30 Sekunden lang fest angedrückt, sodass die Ränder gut haften.
Hinweis: Der Beutel sollte nicht weggeworfen werden, da er später zur Entsorgung des gebrauchten Pflasters benötigt wird.
Entsorgung der Pflaster Siehe Abschnitt 6.6.
Verhalten bei abgelöstem, versäumtem oder nicht ersetztem Pflaster
Das Verhalten bei Abweichungen von der Anwendung der Pflaster basiert auf der folgenden Regel: Damit als Grundlage der kontrazeptiven Wirksamkeit die Hypothalamus-Hypophysen-Ovar-Achse ausreichend supprimiert wird, muss das Pflaster mindestens 7 Tage in Folge korrekt aufgeklebt sein.
- Wenn sich ein Pflaster teilweise oder ganz abgelöst hat
seit weniger als 1 Tag (bis zu 24 Stunden)
Die Anwenderin sollte versuchen, das Pflaster an derselben Stelle wieder festzukleben oder es sofort durch ein neues ersetzen. Zusätzliche Verhütungsmaßnahmen sind nicht erforderlich. Der „Pflasterwechseltag“ der Anwenderin bleibt der gleiche.
seit mehr als 1 Tag (24 Stunden oder länger),
oder wenn sich die Anwenderin nicht sicher ist, wie lange das Pflaster abgelöst war:
DIE ANWENDERIN IST MÖGLICHERWEISE NICHT VOR EINER SCHWANGERSCHAFT GESCHÜTZT. Sie sollte den aktuellen Verhütungszyklus beenden und durch Aufkleben eines neuen Pflasters sofort einen neuen Zyklus beginnen. Es gibt nun einen neuen „Tag 1“ und einen neuen „Pflasterwechseltag“. In der ersten Woche des neuen Zyklus muss eine zusätzliche Verhütungsmethode (z. B. Kondome, Spermizide oder Diaphragma) angewendet werden.
Ein Pflaster sollte nicht wieder aufgeklebt werden, wenn es nicht mehr richtig haftet, wenn es an sich selbst oder an einer anderen Fläche klebt, anderes Material an ihm klebt oder wenn es sich bereits früher gelöst hat oder abgefallen ist. Kann ein Pflaster nicht wieder aufgeklebt werden, sollte sofort ein neues Pflaster aufgeklebt werden. Zusätzliche andere Klebstoffe oder Verbände sollten nicht verwendet werden, um Lisvy zu fixieren.
- Wenn die Anwenderin den Pflasterwechsel vergessen hat Zu Beginn eines Pflaster-Zyklus (Woche 1/Tag 1):
DIE ANWENDERIN IST MÖGLICHERWEISE NICHT VOR EINER SCHWANGERSCHAFT GESCHÜTZT. Sie sollte das erste Pflaster ihres neuen Zyklus anbringen, sobald sie sich daran erinnert. Jetzt gilt ein neuer „Pflasterwechseltag“ und ein neuer „Tag 1“. In der ersten Woche des neuen Zyklus muss eine zusätzliche Verhütungsmethode (z. B. Kondome, Spermizide oder Diaphragma) angewendet werden.
In der Mitte eines Pflaster-Zyklus (Woche 2/Tag 8 oder Woche 3/Tag 15):
- für 1 oder 2 Tage (bis zu 48 Stunden):
Es sollte sofort ein neues Pflaster aufgeklebt werden, das am gewohnten „Pflasterwechseltag“ durch das nächste Pflaster ersetzt wird. Zusätzliche Verhütungsmaßnahmen sind nicht erforderlich.
- für mehr als 2 Tage (48 Stunden oder länger):
DIE ANWENDERIN IST MÖGLICHERWEISE NICHT VOR EINER SCHWANGERSCHAFT GESCHÜTZT. Sie sollte den aktuellen Verhütungszyklus beenden und sofort einen neuen Zyklus von 4 Wochen durch Aufkleben eines neuen Pflasters beginnen. Jetzt gilt ein neuer „Pflasterwechseltag“ und ein neuer „Tag 1“. Für eine Woche sind zusätzliche Verhütungsmaßnahmen erforderlich.
Am Ende des Pflaster-Zyklus (Woche 4/Tag 22):
Wenn die Anwenderin das Entfernen des Pflasters am Tag 22 vergessen hat, sollte sie es entfernen, sobald sie sich daran erinnert (spätestens am Tag 28). Der nächste Zyklus muss dann mit dem Aufkleben eines neuen Pflasters (am Tag nach Tag 28, dem gewohnten „Pflasterwechseltag“) begonnen werden, niemals später. Zusätzliche Verhütungsmaßnahmen sind nicht erforderlich.
- Konsequenzen abgelöster, versäumter oder nicht ersetzter Pflaster und erforderliche Maßnahmen:
Tabelle 1: Konsequenzen abgelöster, versäumter oder nicht ersetzter Pflaster und erforderliche Maßnahmen
|
Abgelöstes |
Zeitrahmen |
Folgen für die |
Erforderliche Maßnahmena |
|
Pflastera |
Zuverlässigkeit der | ||
|
Kontrazeption3 |
|
Pflaster abgelöst |
< 24 Stunden |
Wirksamkeit der Kontrazeption nicht beeinträchtigt |
- Sofort neues Pflaster aufkleben - Zusätzliche Verhütungsmaßnahmen nicht erforderlich - „Pflasterwechseltag“ unverändert |
|
> 24 Stunden |
Wirksamkeit der Kontrazeption beeinträchtigt |
- Sofort durch Aufkleben eines neuen Pflasters einen neuen Zyklus von 4 Wochen beginnen - In den nächsten 7 Tagen zusätzliche Verhütungsmaßnahmen anwendenb - Neuen „Pflasterwechseltag“ notieren | |
|
Pflaster nicht rechtzeitig ersetzta |
Zeitrahmen |
Folgen für die Zuverlässigkeit der Kontrazeptiona |
Erforderliche Maßnahmena |
|
1. Pflaster (Woche 1, Tag 1) nicht rechtzeitig aufgeklebt |
Pflasterfreies Intervalld > 7 Tage |
Wirksamkeit der Kontrazeption beeinträchtigt |
- Sofort durch Aufkleben eines neuen Pflasters einen neuen Zyklus von 4 Wochen beginnen - In den nächsten 7 Tagen zusätzliche Verhütungsmaßnahmen anwendenb - Neuen „Pflasterwechseltag“ notieren |
|
1. oder 2. Pflaster (Woche 1/2 oder 2/3) nicht rechtzeitig ersetzt |
< 48 Stunden |
Wirksamkeit der Kontrazeption nicht beeinträchtigt |
- Sofort neues Pflaster aufkleben - Keine zusätzlichen Verhütungsmaßnahmen erforderlich - „Pflasterwechseltag“ unverändert |
|
> 48 Stunden |
Wirksamkeit der Kontrazeption beeinträchtigt |
- Sofort durch Aufkleben eines neuen Pflasters einen neuen Zyklus von 4 Wochen beginnen - An den nächsten 7 Tagen zusätzliche Verhütungsmaßnahmen anwendenb - Neuen „Pflasterwechseltag“ notieren | |
|
3. Pflaster (Woche 3/4) nicht rechtzeitig entfernt |
Wirksamkeit der Kontrazeption nicht beeinträchtigt0 |
- Pflaster entfernen - Nächsten Zyklus von 4 Wochen am gewohnten „Pflasterwechseltag“ beginnen | |
|
a Gilt für alle Zy |
klen. | ||
Verhütungsmethoden mit Ausnahme der Kalendermethode und der Temperaturmethode. c Vorausgesetzt, dass das 3. Pflaster spätestens am regulären Tag 1 des neuen Pflaster-Zyklus durch ein neues Pflaster ersetzt wurde. d Zeit seit dem Entfernen des letzten Pflasters des vorherigen Zyklus.
Die nächste Packung sollte rechtzeitig verschrieben werden, d. h. vor der Verwendung des letzten Pflasters der Packung, um sicherzustellen, dass die Anwenderin noch Pflaster vorrätig hat.
Verlegung des „Pflasterwechseltags“
Wenn die Anwenderin ihren „Pflasterwechseltag“ auf einen anderen Wochentag verlegen möchte, sollte sie ihren aktuellen Zyklus beenden und das dritte Pflaster am entsprechenden Tag entfernen. Während der pflasterfreien Woche kann der „Pflasterwechseltag“ durch früheres Aufkleben eines neuen Pflasters auf den gewünschten Wochentag verlegt werden. Auf keinen Fall darf das pflasterfreie Intervall 7 Tage überschreiten.
Zusätzliche Informationen für besondere Anwendergruppen
Geschlecht
Lisvy ist nur bei Frauen indiziert.
Ältere Frauen
Nicht zutreffend. Lisvy ist nach der Menopause nicht indiziert.
Body-Mass-Index
Es liegen nur begrenzte Daten zur kontrazeptiven Wirksamkeit bei Frauen mit einem Body-Mass-Index > 30 kg/m2 vor.
Niereninsuffizienz
Zur Anwendung von Lisvy bei Frauen mit eingeschränkter Nierenfunktion liegen keine Studien vor. Bei Frauen mit eingeschränkter Nierenfunktion ist kein erhöhtes Risiko zu erwarten (siehe Abschnitt 5.2).
Leberinsuffizienz
Zur Anwendung von Lisvy bei Frauen mit eingeschränkter Leberfunktion liegen keine Studien vor. Lisvy ist bei Frauen mit bestehender oder vorausgegangener schwerer Lebererkrankung kontraindiziert, solange sich die Leberfunktionswerte nicht normalisiert haben. Siehe auch Abschnitt 4.3.
Ethnische Gruppen
Die Pharmakokinetik von Ethinylestradiol in Kombination mit einem anderen Progestin wurde bei kaukasischen, chinesischen und japanischen Frauen untersucht und zeigte keine klinisch signifikanten Unterschiede. Die Pharmakokinetik von Lisvy wurde nicht speziell bei Frauen verschiedener ethnischer Gruppen untersucht. Es sind keine polymorphen Enzyme bekannt, die in großem Ausmaß zur Metabolisierung von Gestoden beitragen. Die verfügbaren Daten von kaukasischen, schwarzen und hispanischen Frauen zeigen keine relevanten Unterschiede in der Pharmakokinetik von Lisvy zwischen verschiedenen ethnischen Gruppen. Für asiatische Frauen liegen nur sehr begrenzte Daten vor.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit bei Jugendlichen im Alter unter 18 Jahren ist nicht erwiesen. Es gibt keine relevante Anwendung von Lisvy bei Kindern und Jugendlichen vor der Menarche.
4.3 Gegenanzeigen
Kombinierte hormonale Kontrazeptiva (KHK) dürfen unter den folgenden Bedingungen nicht angewendet werden. Wenn eine dieser Erkrankungen während der Anwendung von Lisvy zum ersten Mal auftritt, muss das Pflaster sofort entfernt werden.
- Vorliegen einer oder Risiko für eine venöse Thromboembolie (VTE)
- Venöse Thromboembolie - bestehende VTE (unter Therapie mit Antikoagulanzien) oder VTE in der Vorgeschichte (z. B. tiefe Venenthrombose [TVT] oder Lungenembolie [LE])
- Bekannte erbliche oder erworbene Prädisposition für eine venöse Thromboembolie, wie z. B. APC-Resistenz (einschließlich Faktor-V-Leiden-Mutation), Antithrombin-III-Mangel, Protein-C-Mangel oder Protein-S-Mangel
- Größere Operationen mit längerer Immobilisierung (siehe Abschnitt 4.4)
- Hohes Risiko für eine venöse Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4)
- Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE)
- Arterielle Thromboembolie - bestehende arterielle Thromboembolie, arterielle Thromboembolie in der Vorgeschichte (z. B. Myokardinfarkt) oder Prodrome (z. B. Angina pectoris)
- Zerebrovaskuläre Erkrankung - bestehender Schlaganfall, Schlaganfall in der Vorgeschichte oder Prodrome (z. B. transitorische ischämische Attacke [TIA]) in der Vorgeschichte
- Bekannte erbliche oder erworbene Prädisposition für eine arterielle Thromboembolie, wie z. B. Hyperhomocysteinämie und Antiphospholipid-Antikörper (Anticardiolipin-Antikörper, Lupus-Antikoagulans)
- Migräne mit fokalen neurologischen Symptomen in der Vorgeschichte
- Hohes Risiko für eine arterielle Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4) oder eines schwerwiegenden Risikofaktors wie:
- Diabetes mellitus mit Gefäßschädigung
- Schwere Hypertonie
- Schwere Dyslipoproteinämie
- Bestehende oder vorausgegangene schwere Lebererkrankung, solange sich die Leberfunktionswerte nicht normalisiert haben
- Bestehende oder vorausgegangene Lebertumoren (benigne oder maligne)
- Bekannte oder vermutete sexualhormonabhängige maligne Tumoren (z. B. der Genitalorgane oder der Brust)
- Diagnostisch nicht abgeklärte vaginale Blutungen
- Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Warnhinweise
Die Eignung von Lisvy sollte mit der Frau besprochen werden, falls eine der im Folgenden aufgeführten Erkrankungen oder Risikofaktoren vorliegt. Bei einer Verschlechterung oder dem ersten Auftreten einer dieser Erkrankungen oder Risikofaktoren ist der Anwenderin anzuraten, sich an ihren Arzt zu wenden, um zu entscheiden, ob die Anwendung von Lisvy beendet werden sollte.
- Kreislauferkrankungen
Risiko für eine venöse Thromboembolie (VTE)
Die Anwendung jedes kombinierten hormonalen Kontrazeptivums (KHK) erhöht das Risiko für eine venöse Thromboembolie (VTE) im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat oder Norethisteron enthalten, sind mit dem geringsten Risiko für eine VTE verbunden. Es ist noch nicht bekannt, in wie weit das Risiko mit Lisvy mit den Produkten niedrigeren Risikos verglichen werden kann. Die Entscheidung, ein Arzneimittel anzuwenden, das nicht zu denen mit dem geringsten VTE-Risiko gehört, sollte nur nach einem Gespräch mit der Frau getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht: das Risiko für eine VTE bei Anwendung von KHK, wie ihre vorliegenden individuellen Risikofaktoren dieses Risiko beeinflussen, und dass ihr Risiko für VTE in ihrem allerersten Anwendungsjahr am höchsten ist. Es gibt zudem Hinweise, dass das Risiko erhöht ist, wenn die Anwendung eines KHK nach einer Unterbrechung von 4 oder mehr Wochen wieder aufgenommen wird.
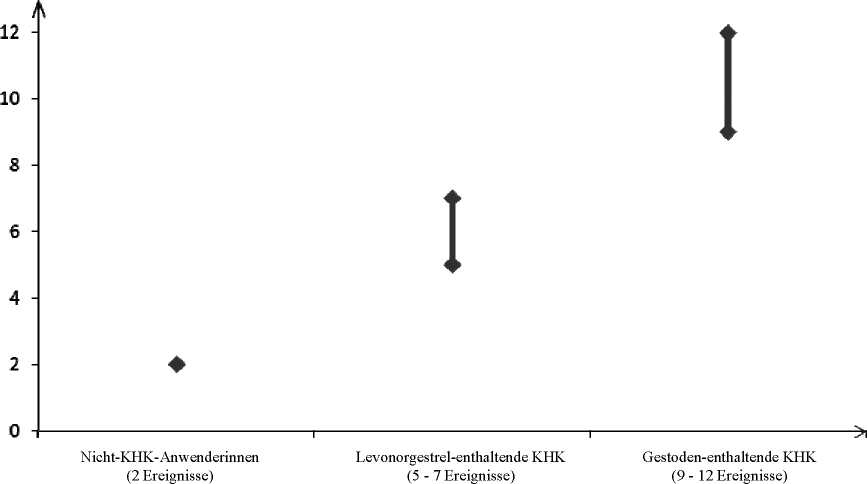
Ungefähr 2 von 10.000 Frauen, die kein KHK anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Jedoch kann bei einer einzelnen Frau das Risiko in Abhängigkeit von ihren zugrunde liegenden Risikofaktoren bedeutend höher sein (siehe unten).
Es wird geschätzt1, dass im Verlauf eines Jahres 9 bis 12 von 10.000 Frauen, die ein Gestoden-haltiges KHK anwenden, eine VTE erleiden; im Vergleich hierzu kommt es pro Jahr bei ungefähr 62 von 10.000 Frauen, die ein Levonorgestrel-haltiges KHK anwenden, zu einer VTE.
In beiden Fällen ist die Anzahl an VTE pro Jahr geringer als die erwartete Anzahl während der Schwangerschaft oder in der Zeit nach der Geburt.
Es ist noch nichts bekannt über das Risiko für eine VTE bei Anwendung von Lisvy im Vergleich zur Anwendung von niedrig dosierten Levonorgestrel-haltigen KHK und Gestoden-haltigen KOK.
VTE verlaufen in 1 - 2 % der Fälle tödlich.
Jährliche Anzahl an VTE-Ereignissen pro 10.000 Frauen
Anzahl an VTE-Ereignissen
Äußerst selten wurde bei Anwenderinnen von KHK über eine Thrombose in anderen Blutgefäßen berichtet, wie z. B. in Venen und Arterien von Leber, Mesenterium, Nieren oder Retina.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von KHK kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, insbesondere wenn mehrere Risikofaktoren vorliegen (siehe Tabelle).
Lisvy ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die sie insgesamt einem hohen Risiko für eine Venenthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt. In diesem Fall muss ihr Gesamtrisiko für eine VTE in Betracht gezogen werden.
Wenn das Nutzen/Risiko-Verhältnis als ungünstig erachtet wird, darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle 2: Risikofaktoren für VTE
|
Risikofaktor |
Anmerkung |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig, wenn weitere Risikofaktoren vorliegen. |
|
Längere Immobilisierung, größere Operationen, jede Operation an Beinen oder Hüfte, neurochirurgische Operation oder schweres Trauma Hinweis: Eine vorübergehende Immobilisierung einschließlich einer Flugreise von > 4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine VTE darstellen, insbesondere bei Frauen mit weiteren Risikofaktoren. |
In diesen Fällen ist es ratsam, die Anwendung des Pflasters (bei einer geplanten Operation mindestens vier Wochen vorher) zu unterbrechen und erst zwei Wochen nach der kompletten Mobilisierung wieder aufzunehmen. Es ist eine andere Verhütungsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern. Eine antithrombotische Therapie muss erwogen werden, wenn Lisvy nicht vorab abgesetzt wurde. |
|
Familiäre Vorbelastung (jede venöse Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, z. B. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Andere Erkrankungen, die mit einer VTE verknüpft sind. |
Krebs, systemischer Lupus erythematodes, hämolytischurämisches Syndrom, chronisch entzündliche Darmerkrankung (Morbus Crohn oder Colitis ulcerosa) und Sichelzellkrankheit |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
Es besteht kein Konsens über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose.
Das erhöhte Risiko einer Thromboembolie in der Schwangerschaft und insbesondere während der 6-wöchigen Dauer des Wochenbetts muss berücksichtigt werden (Informationen zur „Schwangerschaft und Stillzeit“ siehe Abschnitt 4.6).
Symptome einer VTE (tiefe Beinvenenthrombose und Lungenembolie)
Beim Auftreten von Symptomen ist den Anwenderinnen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einer tiefen Beinvenenthrombose (TVT) können folgende Symptome auftreten:
- unilaterale Schwellung des Beins und/oder Fußes oder entlang einer Beinvene;
- Schmerz oder Druckschmerz im Bein, der möglicherweise nur beim Stehen oder Gehen bemerkt wird;
- Erwärmung des betroffenen Beins; gerötete oder entfärbte Haut am Bein.
Bei einer Lungenembolie (LE) können folgende Symptome auftreten:
- plötzliches Auftreten unerklärlicher Kurzatmigkeit oder schnellen Atmens;
- plötzlich auftretender Husten möglicherweise in Verbindung mit Hämoptyse;
- stechender Brustschmerz;
- starke Benommenheit oder Schwindelgefühl;
- schneller oder unregelmäßiger Herzschlag.
Einige dieser Symptome (z. B. „Kurzatmigkeit“, „Husten“) sind unspezifisch und können als häufiger vorkommende oder weniger schwerwiegende Ereignisse fehlinterpretiert werden (z. B. als Atemwegsinfektionen).
Andere Anzeichen für einen Gefäßverschluss können plötzlicher Schmerz sowie Schwellung und leicht bläuliche Verfärbung einer Extremität sein.
Tritt der Gefäßverschluss im Auge auf, können die Symptome von einem schmerzlosen verschwommenen Sehen bis zu einem Verlust des Sehvermögens reichen. In manchen Fällen tritt der Verlust des Sehvermögens sehr plötzlich auf.
Risiko für eine arterielle Thromboembolie (ATE)
Epidemiologische Studien haben die Anwendung von KHK mit einem erhöhten Risiko für arterielle Thromboembolie (Myokardinfarkt) oder apoplektischen Insult (z. B. transitorische ischämische Attacke, Schlaganfall) in Verbindung gebracht. Arterielle thromboembolische Ereignisse können tödlich verlaufen.
Risikofaktoren für ATE
Das Risiko für arterielle thromboembolische Komplikationen oder einen apoplektischen Insult bei Anwenderinnen von KHK erhöht sich bei Frauen, die Risikofaktoren aufweisen (siehe Tabelle). Lisvy ist kontraindiziert bei Frauen, die einen schwerwiegenden oder mehrere Risikofaktoren für eine ATE haben, die sie einem hohen Risiko für eine Arterienthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt - in diesem Fall muss ihr Gesamtrisiko betrachtet werden. Bei Vorliegen eines ungünstigen Nutzen/Risiko-Verhältnisses darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle 3: Risikofaktoren für ATE
|
Risikofaktor |
Anmerkung |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
|
Rauchen |
Frauen ist anzuraten, nicht zu rauchen, wenn Sie ein KHK anwenden möchten. Frauen über 35 Jahren, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Verhütungsmethode anzuwenden. |
|
Hypertonie | |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig bei Frauen mit zusätzlichen Risikofaktoren. |
|
Familiäre Vorbelastung (jede arterielle Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, d. h. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Migräne |
Ein Anstieg der Häufigkeit oder des Schweregrads der Migräne während der Anwendung von KHK (die einem zerebrovaskulären Ereignis vorausgehen kann) kann ein Grund für ein sofortiges Absetzen sein. |
|
Andere Erkrankungen, die mit unerwünschten Gefäßereignissen verknüpft sind. |
Diabetes mellitus, Hyperhomocysteinämie, Erkrankung der Herzklappen und Vorhofflimmern, Dyslipoproteinämie und systemischer Lupus erythematodes. |
Symptome einer ATE
Beim Auftreten von Symptomen ist den Frauen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einem apoplektischen Insult können folgende Symptome auftreten:
- plötzliches Taubheitsgefühl oder Schwäche in Gesicht, Arm oder Bein, besonders auf einer Körperseite;
- plötzliche Gehschwierigkeiten, Schwindelgefühl, Gleichgewichtsverlust oder Koordinationsstörungen;
- plötzliche Verwirrtheit, Sprech- oder Verständnisschwierigkeiten;
- plötzliche Sehstörungen in einem oder beiden Augen;
- plötzliche, schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
- Verlust des Bewusstseins oder Ohnmacht mit oder ohne Krampfanfall.
Vorübergehende Symptome deuten auf eine transitorische ischämische Attacke (TIA) hin.
Bei einem Myokardinfarkt. (MI) können folgende Symptome auftreten:
- Schmerz, Unbehagen, Druck, Schweregefühl, Enge- oder Völlegefühl in Brust, Arm oder unterhalb des Sternums;
- in den Rücken, Kiefer, Hals, Arm, Magen ausstrahlende Beschwerden;
- Völlegefühl, Indigestion oder Erstickungsgefühl;
- Schwitzen, Übelkeit, Erbrechen oder Schwindelgefühl;
- extreme Schwäche, Angst oder Kurzatmigkeit;
- schnelle oder unregelmäßige Herzschläge.
- Tumoren
In einigen epidemiologischen Studien wurde über ein erhöhtes Zervixkarzinom-Risiko bei Langzeitanwendung von KOK (> 5 Jahre) berichtet; weiterhin gibt es aber kontroverse Auffassungen darüber, in welchem Ausmaß dieses Ergebnis den schwer fassbaren Auswirkungen des Sexualverhaltens und anderer Faktoren, wie eine Infektion mit dem humanen Papillomavirus (HPV), beeinflusst wird.
Eine Metaanalyse von 54 epidemiologischen Studien hat ein leicht erhöhtes Brustkrebsrisiko (RR = 1,24) bei Frauen ergeben, die aktuell KOK anwenden. Das erhöhte Risiko geht innerhalb von 10 Jahren nach dem Absetzen von KOK allmählich wieder zurück. Da Brustkrebs bei Frauen unter 40 Jahren selten auftritt, ist die Anzahl zusätzlicher Brustkrebserkrankungen bei Anwenderinnen von KOK oder solchen, die früher KOK eingenommen haben, gering im Vergleich zum Gesamtrisiko an Brustkrebs zu erkranken. Ein Kausalzusammenhang wurde mit diesen Studien nicht bewiesen. Das beobachtete erhöhte Risiko kann an einer früheren Diagnose des Brustkrebses bei KOK-Anwenderinnen, den biologischen Wirkungen von KOK oder einer Kombination beider Faktoren liegen. Brustkrebs, der bei Frauen diagnostiziert wird, die irgendwann einmal ein KOK angewendet haben, scheint klinisch weniger weit fortgeschritten zu sein als Krebs bei Frauen, die noch nie ein KOK angewendet haben.
In seltenen Fällen sind bei Anwenderinnen von KOK gutartige und noch seltener bösartige Lebertumoren beobachtet worden. In Einzelfällen führten diese Tumoren zu lebensbedrohlichen intraabdominellen Blutungen. Wenn starke Oberbauchbeschwerden, eine Lebervergrößerung oder Anzeichen einer intraabdominellen Blutung bei Frauen auftreten, die KOK einnehmen, sollte ein Lebertumor in die differentialdiagnostischen Überlegungen einbezogen werden.
Mit der Anwendung höher dosierter KOK (50 Mikrogramm Ethinylestradiol) verringert sich das Risiko eines Endometrium- und Ovarialkarzinoms. Ob dies auch für niedriger dosierte KOK gilt, muss noch nachgewiesen werden.
- Sonstige Erkrankungen
Wenn wiederholt persistierende Hautreizungen auftreten (z. B. persistierendes Erythem oder anhaltender Pruritus an der Stelle, wo das Pflaster aufgeklebt wurde), obwohl die Applikationsstelle den Anweisungen entsprechend gewechselt wurde, sollte eine Beendigung der transdermalen Behandlung in Betracht gezogen werden.
Frauen mit einer Hypertriglyzeridämie oder einer diesbezüglich positiven Familienanamnese können ein erhöhtes Risiko für die Entwicklung einer Pankreatitis haben, wenn sie kombinierte hormonale Kontrazeptiva einnehmen.
Obwohl bei vielen Frauen, die kombinierte hormonale Kontrazeptiva einnehmen, ein geringer Blutdruckanstieg berichtet wurde, sind klinisch relevante Blutdruckerhöhungen selten. Kommt es unter Anwendung von Lisvy zu einer klinisch signifikanten Blutdruckerhöhung (nach wiederholter Messung), ist es ratsam, dass der Arzt Lisvy absetzt und die Hypertonie behandelt. Wenn es angemessen erscheint, kann die Anwendung von Lisvy wieder begonnen werden, sobald sich die Blutdruckwerte unter der antihypertensiven Therapie normalisiert haben.
Die folgenden Erkrankungen können Berichten zufolge sowohl in der Schwangerschaft als auch unter Anwendung von kombinierten hormonalen Kontrazeptiva auftreten bzw. sich verschlechtern. Jedoch konnte ein Zusammenhang mit der Anwendung von kombinierten hormonalen Kontrazeptiva nicht bewiesen werden: cholestatischer Ikterus und/oder Pruritus; Gallensteine; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Sydenham Chorea; Herpes gestationis; Otosklerose-bedingte Schwerhörigkeit.
Bei Frauen mit hereditärem Angioödem können exogen zugeführte Estrogene die Symptome eines Angioödems auslösen oder verschlimmern.
Akute oder chronische Leberfunktionsstörungen können einen Abbruch der Anwendung von Lisvy erforderlich machen, bis sich die Leberfunktionswerte wieder normalisiert haben. Auch beim Auftreten eines Rezidivs eines in einer vorausgegangenen Schwangerschaft oder während einer früheren Anwendung von steroidalen Geschlechtshormonen aufgetretenen cholestatischen Ikterus und/oder eines cholestasebedingten Pruritus sollte Lisvy abgesetzt werden.
Obwohl kombinierte hormonale Kontrazeptiva einen Einfluss auf die periphere Insulinresistenz und Glucosetoleranz haben können, liegen keine Hinweise auf die Notwendigkeit einer Änderung des Therapieregimes bei Diabetikerinnen vor, die niedrig dosierte kombinierte hormonale Kontrazeptiva anwenden (mit < 50 Mikrogramm Ethinylestradiol). Diabetikerinnen müssen jedoch während der Anwendung von kombinierten hormonalen Kontrazeptiva sorgfältig überwacht werden.
Bei Anwendung von kombinierten hormonalen Kontrazeptiva wurde über eine Verschlechterung endogener Depressionen, Epilepsie, Morbus Crohn und Colitis ulcerosa berichtet.
Chloasmen können gelegentlich auftreten, insbesondere bei Frauen mit Chloasma gravidarum in der Anamnese. Frauen mit dieser Veranlagung sollten sich während der Anwendung von kombinierten hormonalen Kontrazeptiva nicht direkt der Sonne oder ultraviolettem Licht aussetzen.
Besondere Aufmerksamkeit sollte der Interaktion von kombinierten hormonalen Kontrazeptiva mit Lamotrigin gewidmet werden (siehe Abschnitt 4.5).
Ärztliche Untersuchung/Beratung
Vor der Einleitung oder Wiederaufnahme der Behandlung mit Lisvy muss eine vollständige Anamnese (inklusive Familienanamnese) erhoben und eine Schwangerschaft ausgeschlossen werden. Der Blutdruck sollte gemessen und eine körperliche Untersuchung durchgeführt werden, die sich an den Gegenanzeigen (siehe Abschnitt 4.3) und Warnhinweisen (siehe Abschnitt 4.4) orientiert. Es ist wichtig, die Frau auf die Informationen zu venösen und arteriellen Thrombosen hinzuweisen, einschließlich des Risikos von Lisvy im Vergleich zu anderen KHK, die Symptome einer VTE und ATE, die bekannten Risikofaktoren und darauf, was im Falle einer vermuteten Thrombose zu tun ist.
Die Anwenderin ist zudem anzuweisen, die Packungsbeilage sorgfältig zu lesen und die darin gegebenen Ratschläge zu befolgen. Die Häufigkeit und Art der Untersuchungen sollte den gängigen Untersuchungsleitlinien entsprechen und individuell auf die Frau abgestimmt werden.
Die Anwenderinnen sind darüber aufzuklären, dass hormonale Kontrazeptiva nicht vor HlV-Infektionen (AIDS) und anderen sexuell übertragbaren Krankheiten schützen.
Verminderte Wirksamkeit
Die Wirksamkeit von Lisvy kann reduziert sein, wenn beispielsweise
- ein Pflaster nicht rechtzeitig aufgeklebt wird
- ein Pflaster sich ablöst
- ein Pflasterwechsel vergessen wird (siehe „Verhalten bei abgelöstem, versäumtem oder nicht ersetztem Pflaster“ in Abschnitt 4.2)
- gleichzeitig bestimmte Arzneimittel angewendet werden (siehe Abschnitt 4.5).
Reduzierte Zykluskontrolle
Unter allen kombinierten hormonalen Kontrazeptiva können irreguläre Blutungen (Schmier- oder Durchbruchblutungen) auftreten, insbesondere in den ersten Monaten der Anwendung. In solchen Fällen sollte die Anwendung von Lisvy fortgesetzt werden. Die Abklärung jeglicher irregulärer Blutungen ist nur nach einem Anpassungsintervall von drei Zyklen einer Lisvy Anwendung sinnvoll. Der Anteil der Lisvy Anwenderinnen, die intrazyklische Blutungen nach dieser Anpassungszeit haben, beträgt zwischen 7 - 12 %.
Lediglich eine Minderheit von Anwenderinnen, im Bereich von 1 % pro Zyklus, waren amenorrhöisch.
Wenn die Blutungsunregelmäßigkeiten fortbestehen oder nach regelmäßigen Zyklen unter Anwendung von Lisvy auftreten, sollten nicht-hormonale Ursachen in Betracht gezogen und entsprechende diagnostische Maßnahmen eingeleitet werden, um eine Schwangerschaft oder Tumorerkrankungen auszuschließen. Diese können auch eine Kürettage beinhalten.
Bei einigen Frauen kann die Entzugsblutung während des pflasterfreien Intervalls ausbleiben. Wenn Lisvy entsprechend den Anweisungen in Abschnitt 4.2 angewendet wurde, ist die Wahrscheinlichkeit einer Schwangerschaft gering. Wurde Lisvy allerdings vor der ersten ausgebliebenen Entzugsblutung nicht vorschriftsgemäß angewendet oder sind zwei Entzugsblutungen nacheinander ausgeblieben, muss vor der weiteren Anwendung eine Schwangerschaft ausgeschlossen werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Hinweis: Die Fachinformation von gleichzeitig angewendeten Arzneimitteln sollte konsultiert werden, um mögliche Wechselwirkungen zu identifizieren.
Einfluss anderer Arzneimittel auf Lisvy
Wechselwirkungen mit Arzneimitteln, die mikrosomale Enzyme induzieren, können auftreten. Dies kann eine erhöhte Clearance von Sexualhormonen zur Folge haben und zu Durchbruchblutungen und/oder kontrazeptivem Versagen führen.
In der Literatur wurden die folgenden Wechselwirkungen berichtet:
Substanzen, die die Clearance von kombinierten hormonalen Kontrazeptiva erhöhen (verminderte Wirksamkeit von kombinierten hormonalen Kontrazeptiva durch Enzyminduktion) z. B.:
Barbiturate, Bosentan, Carbamazepin, Phenytoin, Primidon, Rifampicin, Rifabutin und Arzneimittel zur Behandlung einer HIV-Infektion, wie Ritonavir, Nevirapin und Efavirenz, und möglicherweise auch Felbamat, Griseofulvin, Oxcarbazepin, Topiramat, Eslicarbazepin, Modafinil und Produkte, die das pflanzliche Heilmittel Johanniskraut (Hypericum perforatum) enthalten.
Handhabung
Die Enzyminduktion kann bereits nach wenigen Behandlungstagen beobachtet werden. Eine maximale Enzyminduktion kann im Allgemeinen innerhalb von einigen Wochen beobachtet werden. Nach Behandlungsende kann die Enzyminduktion ca. 4 Wochen erhalten bleiben.
Kurzzeitbehandlung
Frauen, die mit einem enzyminduzierenden Arzneimittel behandelt werden, sollten vorübergehend zusätzlich zum KOK eine Barrieremethode oder eine andere Verhütungsmethode anwenden. Die Barrieremethode muss während der gesamten Zeit der Behandlung mit der Begleitmedikation und noch 28 Tage nach deren Absetzen angewendet werden. Falls die Arzneimittelbehandlung über das dritte Pflaster des Anwendungszyklus hinausgeht, sollte mit dem nächsten Pflaster ohne das übliche pflasterfreie Intervall begonnen werden.
Langzeitbehandlung
Bei Frauen unter längerfristiger Behandlung mit enzyminduzierenden Wirkstoffen wird die Anwendung einer anderen zuverlässigen, nicht-hormonalen Verhütungsmethode empfohlen.
Substanzen mit unterschiedlicher Wirkung auf die Clearance von kombinierten hormonalen Kontrazeptiva:
Bei gleichzeitiger Verabreichung mit KOK können viele Kombinationen von HIV-Proteasehemmern und nicht-nukleosidischen Reverse Transkriptase-Hemmern inklusive Kombinationen mit HCV-Hemmern die Plasmakonzentrationen von Estrogenen oder Progestagenen erhöhen oder erniedrigen. Die Auswirkungen solcher Veränderungen können in manchen Fällen klinisch relevant sein.
Daher sollte die Fachinformation von gleichzeitig verabreichten HIV/HCV-Arzneimitteln zu Rate gezogen werden, um potentielle Wechselwirkungen und etwaige damit in Zusammenhang stehende Empfehlungen festzustellen. Im Zweifelsfall sollten Frauen, die unter einer Therapie mit Proteasehemmern oder nicht-nukleosidischen Reverse-Transkriptase-Hemmern stehen, immer eine zusätzliche Barrieremethode zur Verhütung anwenden.
Substanzen, die die Wirkstoffkonzentrationen von kombinierten hormonalen Kontrazeptiva erhöhen (Enzyminhibitoren):
Für Etoricoxib wurde gezeigt, dass es die Plasmakonzentrationen von Ethinylestradiol erhöht (50 bis 60 %), wenn gleichzeitig triphasische orale hormonale Kontrazeptiva genommen werden. Es wird vermutet, dass Etoricoxib die Ethinylestradiol-Konzentrationen erhöht, indem durch Hemmung der Sulfotransferaseaktivität der Ethinylestradiol-Stoffwechsel gehemmt wird.
Wirkungen kombinierter hormonaler Kontrazeptive auf andere Arzneimittel
Kombinierte hormonale Kontrazeptiva können den Metabolismus bestimmter anderer Wirkstoffe beeinflussen. Dementsprechend können die Plasma- und Gewebekonzentrationen entweder zunehmen (z. B. Ciclosporin) oder abnehmen (z. B. Lamotrigin).
Besondere Aufmerksamkeit sollte auf die Interaktion von kombinierten hormonalen Kontrazeptiva mit Lamotrigin gerichtet werden. Die gleichzeitige Anwendung wird wegen des Risikos reduzierter Konzentrationen und Wirksamkeit von Lamotrigin nicht empfohlen (siehe Abschnitt 4.4). Der Anwendungsbeginn von kombinierten hormonalen Kontrazeptiva sollte während der Titration von Lamotrigin vermieden werden. Bei Anwenderinnen, die bereits mit Lamotrigin behandelt werden, ist eine klinische Überwachung und Anpassung der Dosierung von Lamotrigin während des Anwendungsbeginns von kombinierten hormonalen Kontrazeptiva und nach deren Absetzen erforderlich.
Sonstige Wechselwirkungen
Laboruntersuchungen
Die Anwendung von kontrazeptiven Steroiden kann die Ergebnisse bestimmter Labortests beeinflussen, einschließlich der biochemischen Parameter der Leber-, Schilddrüsen-, Nebennieren-und Nierenfunktion sowie der Plasmaspiegel von (Carrier-)Proteinen, z. B. des corticosteroidbindenden Globulins und der Lipid-/Lipoprotein-Fraktionen, der Parameter des Kohlenhydratstoffwechsels sowie die Gerinnungs- und Fibrinolyseparameter. Im Allgemeinen bleiben diese Veränderungen jedoch innerhalb des Normbereichs.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Lisvy ist während der Schwangerschaft nicht indiziert. Tritt während der Anwendung von Lisvy eine Schwangerschaft ein, muss das Pflaster entfernt und die weitere Anwendung beendet werden. Umfangreiche epidemiologische Studien haben jedoch gezeigt, dass die Kinder von Frauen, die vor der Schwangerschaft kombinierte hormonale Kontrazeptiva angewendet haben, kein erhöhtes Risiko für angeborene Fehlbildungen aufweisen und dass teratogene Wirkungen auch dann nicht zu befürchten sind, wenn versehentlich während der Frühschwangerschaft kombinierte hormonale Kontrazeptiva angewendet wurden.
Das erhöhte VTE-Risiko in der Zeit nach der Geburt sollte vor der erneuten Anwendung nach einer Anwendungspause bedacht werden (siehe Abschnitte 4.2 und 4.4).
Stillzeit
Kombinierte hormonale Kontrazeptiva können die Laktation beeinflussen, indem sie die Menge der Muttermilch reduzieren und die Zusammensetzung verändern. Die Anwendung kombinierter hormonaler Kontrazeptiva sollte daher grundsätzlich bis zum vollständigen Abstillen des Kindes nicht empfohlen werden. Kleine Mengen der kontrazeptiven Steroide und/oder ihrer Metaboliten können in die Muttermilch übergehen.
Fertilität
Die Anwendung von Lisvy hat keinen Einfluss auf die künftige Fruchtbarkeit. Nach dem Absetzen von Lisvy erreichen die Frauen wieder ihre normale Fruchtbarkeit.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Es wurden keine Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen bei Anwenderinnen von kombinierten hormonalen Kontrazeptiva beobachtet.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die am häufigsten beobachteten Nebenwirkungen von Lisvy sind Reaktionen am Verabreichungsort (Hautausschlag, Juckreiz, Reizungen, Rötung, und Überempfindlichkeit). Sie treten bei 20,9 % der Anwenderinnen auf. Seltene, schwerwiegende Nebenwirkungen sind arterielle und venöse Thromboembolien.
Tabellarische Zusammenfassung der Nebenwirkungen
Die Inzidenzen der unerwünschten Wirkungen, die in klinischen Studien der Phasen 2 und 3 mit Lisvy (n = 3.5731) berichtet wurden, sind in der folgenden Tabelle zusammengefasst. Innerhalb der Häufigkeitskategorien sind die Nebenwirkungen nach absteigendem Schweregrad angeordnet. Die Häufigkeiten sind definiert als: Sehr häufig (> 1/10), häufig (> 1/100, < 1/10), gelegentlich (> 1/1.000, < 1/100) und selten (> 1/10.000, < 1/1.000).
Tabelle 4: Zusammenfassung der Nebenwirkungen
|
Systemorganklasse (MedDRA) |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
|
Psychiatrische Erkrankungen |
Emotionale Labilität |
Depression/de- pressive Verstimmung, Verminderung bzw. Verlust der Libido | ||
|
Erkrankungen des |
Migräne |
|
Nervensystems | ||||
|
Gefäßerkrankungen |
Venöse und arterielle thromboembo-lische Ereignisse* | |||
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Reaktionen am Verabreichungsort | |||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Blutungen aus dem Genitaltrakt**, Schmerzen der Brüste |
Unerwünschte Ereignisse wurden in klinischen Studien unter Verwendung des MedDRA-Wörterbuchs (Version 18.1) codiert. Der bevorzugte MedDRA Begriff wird verwendet, um eine bestimmte Reaktion und ihre Synonyme und verwandten Erkrankungen zu beschreiben. Verschiedene MedDRA Begriffe, die das gleiche medizinische Phänomen repräsentieren, werden zusammen als einzelne Nebenwirkungen gruppiert, um Verdünnung oder Verschleierung der eigentlichen Nebenwirkung zu vermeiden.
* - Geschätzte Häufigkeit aufgrund epidemiologischer Studien, die sich auf eine Gruppe
kombinierter oraler Kontrazeptiva bezogen. Die Häufigkeit befand sich an der Grenze zu „Sehr selten“.
- Der Begriff „Venöse und arterielle thromboembolische Ereignisse“ fasst die folgenden Ereignisse zusammen:
Verschluss einer peripheren tiefen Vene, Thrombose und Embolie/Verschluss eines Lungengefäßes, Thrombose, Embolie und Infarkt/Herzinfarkt/Hirninfarkt und nicht als hämorrhagisch klassifizierter Schlaganfall.
** Umfasst die medizinischen Entitäten Blutung aus dem weiblichen Genitaltrakt und unregelmäßige Uterusblutung.
Beschreibung ausgewählter Nebenwirkungen
Nebenwirkungen mit sehr geringer Häufigkeit oder mit verzögertem Einsetzen von Symptomen, die in
Zusammenhang mit der Gruppe der kombinierten hormonalen Kontrazeptiva, einschließlich der KOK,
berücksichtigt werden müssen, sind nachfolgend aufgelistet (siehe auch Abschnitte 4.3 und 4.4):
Kreislauferkrankungen
- Bei Anwenderinnen von KHK wurde ein erhöhtes Risiko für arterielle und venöse thrombotische und thromboembolische Ereignisse einschließlich Myokardinfarkt, Schlaganfall, transitorische ischämische Attacken, Venenthrombose und Lungenembolie beobachtet, die in Abschnitt 4.4 eingehender behandelt werden.
Tumoren
- Die Diagnosehäufigkeit von Brustkrebs unter Anwenderinnen von kombinierten hormonalen
Kontrazeptiva ist geringfügig erhöht. Da bei Frauen unter 40 Jahren Brustkrebs selten auftritt, ist das zusätzliche Risiko im Verhältnis zum Gesamtrisiko, an Brustkrebs zu erkranken, gering. Eine Kausalität mit der Anwendung von kombinierten hormonalen Kontrazeptiva ist nicht bekannt.
- Lebertumoren (benigne und maligne)
Sonstige Erkrankungen
- Erythema nodosum, Erythema multiforme
- Frauen mit Hypertriglyzeridämie (erhöhtes Risiko für die Entwicklung einer Pankreatitis bei Einnahme von kombinierten oralen Kontrazeptiva)
- Hypertonie
- Auftreten oder Verschlechterung von Erkrankungen, für die ein Zusammenhang mit der Einnahme von kombinierten oralen Kontrazeptiva nicht eindeutig nachgewiesen ist: cholestatischer Ikterus und/oder Pruritus, Gallensteinbildung, Porphyrie, systemischer Lupus erythematodes, hämolytisch-urämisches Syndrom, Sydenham Chorea, Herpes gestationis, Otosklerose-bedingte Schwerhörigkeit
- Bei Frauen mit hereditärem Angioödem können exogen zugeführte Estrogene die Symptome eines Angioödems auslösen oder verschlimmern
- Leberfunktionsstörungen
- Veränderungen der Glucosetoleranz oder Einfluss auf die periphere Insulinresistenz
- Verschlimmerung von Morbus Crohn, Colitis ulcerosa
- Verschlimmerung von Epilepsie
- Chloasma
- Überempfindlichkeit (einschließlich Symptomen wie Hautausschlag, Urtikaria)
Wechselwirkungen
Wechselwirkungen anderer Arzneimittel (Enzyminduktoren) mit kombinierten hormonalen Kontrazeptiva können Durchbruchblutungen und/oder ein Versagen der kontrazeptiven Wirksamkeit zur Folge haben (siehe Abschnitt 4.5).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Ausgehend von den mit kombinierten oralen Kontrazeptiva gesammelten allgemeinen Erfahrungen können möglicherweise folgende Symptome auftreten: Übelkeit, Erbrechen und, bei jungen Mädchen, leichte vaginale Blutungen. Es gibt kein Antidot und die weitere Behandlung sollte symptomatisch erfolgen. Die zusätzlich oder unsachgemäß angewendeten Pflaster müssen von der Haut abgezogen werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Sexualhormone und Modulatoren des Genitalsystems, Gestagene und Estrogene, fixe Kombinationen, ATC-Code: G03AA10
Wirkmechanismus
Die kontrazeptive Wirkung von kombinierten hormonalen Kontrazeptiva basiert auf dem Zusammenspiel verschiedener Faktoren, als deren wichtigste die Ovulationshemmung und die Veränderung des Zervixsekrets anzusehen sind.
Klinische Wirksamkeit und Sicherheit
In klinischen Studien, die mit Lisvy in der Europäischen Union, Lateinamerika und Australien durchgeführt wurden, wurden die folgenden Pearl-Indices berechnet:
Pearl-Index (18 - 35 Jahre alt, Body-Mass-Index < 30 kg/m2)
Methodenversagen: 0,82 (oberes 95 %-Konfidenzlimit: 1,55).
Methodenversagen + Anwendungsfehler: 1,19 (oberes 95 %-Konfidenzlimit: 2,00).
Die folgenden Pearl-Indices wurden für die Europäische Bevölkerung berechnet:
Pearl-Index (18 - 35 Jahre alt, Body-Mass-Index < 30 kg/m2)
Methodenversagen: 0,40 (oberes 95 %-Konfidenzlimit: 1,18).
Methodenversagen + Anwendungsfehler: 0,76 (oberes 95 %-Konfidenzlimit: 1,66).
In klinischen Studien, die mit Lisvy in den USA durchgeführt wurden, wurden die folgenden Pearl-Indices berechnet:
Pearl-Index (18 - 35 Jahre alt, keine Restriktionen bzgl. des Body-Mass-Index) Methodenversagen: 2,91 (oberes 95 %-Konfidenzlimit: 4,41).
Methodenversagen + Anwendungsfehler: 3,92 (oberes 95 %-Konfidenzlimit: 5,53).
Bei unsachgemäßer Anwendung von Lisvy erhöht sich die Versagerquote.
In einer klinischen Studie wurde bei 49 Frauen nach 13 Behandlungszyklen die Histologie des Endometriums untersucht. Es wurden keine abnormen Befunde festgestellt.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach dermaler Anwendung von Lisvy werden Ethinylestradiol und Gestoden gut durch die Haut resorbiert. Die durchschnittliche Freisetzung von Ethinylestradiol und Gestoden im Laufe der 7-tägigen Applikationsphase führt zu derselben systemischen Exposition (AUC) während des Steady-State wie bei täglicher Verabreichung eines kombinierten oralen Kontrazeptivums mit 0,02 mg Ethinylestradiol und 0,06 mg Gestoden.
Die Serumkonzentrationen von Ethinylestradiol und Gestoden wurden in der 3. Woche verschiedener Behandlungszyklen (Zyklus 1 bis Zyklus 7) bestimmt. Mittlere maximale Serumkonzentrationen von Ethinylestradiol im Bereich von 36 - 51 ng/l wurden etwa einen Tag nach dem Aufkleben des Pflasters erreicht. Danach sanken die Serumkonzentrationen auf mittlere Minimalwerte im Bereich von 15 - 23 ng/l am Ende des 1-wöchigen Intervalls. Die durchschnittliche Konzentration in Woche 3 lag im Bereich von 22 - 33 ng/l.
Die mittleren maximalen Serumkonzentrationen von Gesamt-Gestoden im Bereich von 4,7 - 7,5 Mikrogramm/l wurden etwa 1 - 1,5 Tage nach dem Aufkleben des Pflasters erreicht. Danach sanken die Serumkonzentrationen auf mittlere Minimalwerte im Bereich von 2,6 - 4,0 Mikrogramm/l am Ende des 1-wöchigen Intervalls. In Woche 3 lag die durchschnittliche Konzentration im Bereich von 3,6 - 5,7 Mikrogramm/l.
Einfluss von Körpergewicht und Body-Mass-Index
Die Serumkonzentrationen von Ethinylestradiol und Gestoden während der Anwendung von Lisvy hängen vom Körpergewicht bzw. vom Body-Mass-Index (BMI) der Frau ab. Bei adipösen Frauen mit einem BMI von > 35 kg/m2 liegen die durchschnittlichen Serumkonzentrationen von Ethinylestradiol und Gestoden um 24 % bzw. 30 % unter denen von Frauen mit einem BMI im Normbereich von < 30 kg/m2. Es liegen nur begrenzte Daten zur kontrazeptiven Wirksamkeit bei Frauen mit einem Body-Mass-Index > 30 kg/m2 vor.
Einfluss von Hitze, Feuchtigkeit, körperlicher Anstrengung und Applikationsstelle Nach Applikation von Lisvy wurde die Pharmakokinetik von Ethinylestradiol und Gestoden unter besonderen Bedingungen wie Hitze, Feuchtigkeit und körperlicher Anstrengung untersucht, d. h. in der Sauna, im Whirlpool, beim Schwimmen und bei unterschiedlichen körperlichen Anstrengungen im Vergleich zu normaler Aktivität. Im Allgemeinen wurde unter diesen spezifischen Bedingungen Bioäquivalenz bezüglich der Parameter Cmax und AUC von Ethinylestradiol und Gestoden nachgewiesen. Die Ergebnisse zeigen, dass unter den oben beschriebenen spezifischen Bedingungen, wie man sie in einem Fitnessstudio, einer Sauna, im Whirlpool, beim Schwimmen oder bei unterschiedlichen körperlichen Anstrengungen vorfindet, im Vergleich zu normalen Aktivitäten des Alltags kein klinisch relevanter Unterschied hinsichtlich der Exposition gegenüber Ethinylestradiol und Gestoden zu beobachten ist.
In einer formalen PK-Studie (Nicht-Kompartiment-Analyse), in der drei verschiedene Applikationsstellen getestet wurden, war die mittlere systemische Exposition gegenüber Gestoden und Ethinylestradiol im Vergleich zum Gesäß oder Abdomen um 24 % bzw. 31 % höher, wenn das Pflaster auf dem äußeren Oberarm aufgebracht wurde. Der Bereich der Expositionsdaten für alle drei Applikationsstellen ist weitestgehend überlappend. In einer Populations-PK-Analyse (Meta-Analyse) war das geometrische Mittel der Exposition gegenüber Ethinylestradiol (AUC (0 - 168) und Cmax nach der Applikation auf dem Arm oder Gesäß im Vergleich zur Applikation auf dem Bauch 41 % höher. Für das Gesamt-Gestoden betrugen die entsprechenden Unterschiede der mittleren AUC (0 - 168) und der Cmax-Werte 26 % bzw. 22 %. Es gibt keinen Hinweis darauf, dass die mittleren Expositionsunterschiede Auswirkungen auf die Sicherheit oder Wirksamkeit von Lisvy haben.
Vergleich von Lisvy mit anderen kombinierten hormonalen Kontrazeptiva
In einer Studie zur relativen Bioverfügbarkeit wurden die Steady-State-Serumkonzentrationen und die pharmakokinetischen Parameter von Ethinylestradiol und Gestoden nach Applikation von Lisvy mit denen eines kombinierten oralen Kontrazeptivums mit einem Hormongehalt von 0,020 mg Ethinylestradiol und 0,075 mg Gestoden verglichen. Die mittleren Cmax-Werte von Ethinylestradiol und Gestoden im Steady-State waren nach Anwendung von Lisvy im Allgemeinen um 30 - 40 % niedriger als bei dem kombinierten oralen Kontrazeptivum. Die Exposition (AUC und Cav) gegenüber Ethinylestradiol war bei beiden Arten der Anwendung vergleichbar, wohingegen die Exposition gegenüber Gestoden (ungebundene Konzentration) nach Anwendung von Lisvy um 18 % niedriger war. Daraus ergaben sich Schätzwerte für die durchschnittliche Exposition und Dosis unter Lisvy, die der täglichen oralen Einnahme von 0,020 mg Ethinylestradiol und 0,060 mg Gestoden entsprachen.
Die interindividuelle Variabilität (% CV) bezüglich der wichtigen pharmakokinetischen Parameter wie Cmax und AUC war nach Applikation von Lisvy für Ethinylestradiol geringer, für Gestoden jedoch höher als bei oraler Einnahme.
Verteilung
Ethinylestradiol wird stark, aber unspezifisch, an Serumalbumin (ca. 98 %), aber nicht an SHBG gebunden. Gestoden wird stark sowohl an Serumalbumin als auch an SHBG gebunden. Nur etwa 1 % der Gesamtserumkonzentrationen liegen als freies Steroid vor, 40 - 80 % sind an SHBG gebunden.
Ethinylestradiol induziert einen starken Anstieg der SHBG-Konzentration im Serum, wohingegen die Verabreichung von Gestoden zu einer leichten Abnahme der SHBG-Konzentration führt. Nach wiederholter dermaler Applikation von Lisvy liegen die mittleren Steady-State-Serumkonzentrationen von SHBG im Bereich von 201 - 237 nmol/l.
Nach intravenöser Verabreichung von Ethinylestradiol wurde ein scheinbares Verteilungsvolumen von 3 - 9 l/kg festgestellt. Das entsprechende scheinbare Verteilungsvolumen von Gestoden beträgt ca.
0,7 l/kg.
Biotransformation
Ethinylestradiol (EE) wird hauptsächlich durch aromatische Hydroxylierung metabolisiert, aber es wird eine Vielzahl hydroxylierter und methylierter Metaboliten gebildet, die teils als freie Metaboliten, teils als Glucuronsäure- und Sulfatkonjugate vorliegen. Der Hauptabbauweg von Ethinylestradiol ist die CYP450-abhängige 2-Hydroxylierung und Bildung von 2-Hydroxy-Ethinylestradiol. Die 2-Hydroxylierung von EE wird durch die CYP2C, CYP2E und CYP3A Genfamilie katalysiert. Die metabolische Clearance liegt im Bereich von 2 - 7 ml/min/kg.
Gestoden wird vollständig zu allgemein mehr polaren Metaboliten metabolisiert. Der Metabolismus von Gestoden ist gekennzeichnet durch Hydroxylierung an einigen Positionen des steroidalen Nukleus und durch Reduktion der 3-Keto-Gruppe und der A-4-Doppelbindung. Aktive Metaboliten sind nicht beschrieben. Neben CYP3A4 könnte eine Reihe weiterer Cytochrom-P450-Enzyme zum Abbau von Gestoden beitragen, allerdings in geringerem Umfang.
In zwei Studien, in denen die Wirkung von CYP3A4-Inhibitoren (Ketoconazol, Erythromycin) untersucht wurde, waren die Steady-State-Serumspiegel von Ethinylestradiol durch keinen der beiden
Inhibitoren beeinflusst. Für Gestoden führte die gleichzeitige Verabreichung der Inhibitoren zu einem Anstieg der AUC (0 - 168) von 11 % bzw. 34 % für Ketoconazol bzw. Erythromycin. Dieser kleine Anstieg, der zu einer Exposition im Bereich der vermarkteten kombinierten oralen Kontrazeptiva führt, wird als klinisch nicht relevant angesehen.
In einer Studie, die die Wirkung von Lisvy auf die einmalige Gabe von Midazolam - einem SubstratModell für Substanzen, die über CYP3A4 metabolisiert werden - untersuchte, wurde kein klinisch relevanter Anstieg der Plasmakonzentrationen von Midazolam beobachtet. Die gleichzeitige Verabreichung von Midazolam führte zu einem geringfügigen Anstieg von 7 % bzw. 14 % für AUC (0-tlast) bzw. Cmax von Midazolam.
Elimination
Ethinylestradiol wird in nicht nennenswertem Umfang in unveränderter Form ausgeschieden. Die Elimination der Metaboliten von Ethinylestradiol erfolgt im Verhältnis 4:6 über die Nieren bzw. die Galle. Nach intravenöser Verabreichung wurde die Abnahme der Serumkonzentration durch mindestens zwei Dispositionsphasen mit einer terminalen Halbwertszeit von ca. 16 Stunden gemessen, woraus sich ergibt, dass die Konzentrationen im Allgemeinen zwei Tage nach dem Entfernen des Pflasters nicht mehr quantifizierbar sind.
Gestoden wird nicht in unveränderter Form ausgeschieden. Seine Metaboliten werden im Verhältnis von ca. 6:4 über die Nieren bzw. die Galle eliminiert. Nach dem Entfernen des Pflasters sinken die Gestoden-Gesamtkonzentrationen im Serum langsamer als die von Ethinylestradiol ab. Die mittlere terminale Halbwertszeit beträgt rund 26 Stunden.
Linearität/Nicht-Linearität
Die Pharmakokinetik von Ethinylestradiol ist im Dosierungsbereich von 0,020 mg bis 0,100 mg linear. Eine klinisch relevante Veränderung in der Pharmakokinetik von Ethinylestradiol in Abhängigkeit von der Zeit wurde nicht beobachtet.
Die Pharmakokinetik von Gestoden hängt von der SHBG-Konzentration ab, welche selbst wiederum von Estrogenen, Androgenen sowie von Gestoden beeinflusst wird. Nach wiederholter dermaler Applikation von Lisvy stiegen die SHBG-Konzentrationen auf das 3- bis 4-Fache im Vergleich zu den typischen Ausgangswerten. Dementsprechend unterscheiden sich die Steady-State-Serumspiegel von Gestoden von denen nach einmaliger Verabreichung. Diese SHBG-abhängigen Veränderungen sind der Grund dafür, dass die Pharmakokinetik von Gestoden nicht-linear über die Zeit ist. Zudem wurde aufgrund von drei Studien zur Pharmakokinetik von Lisvy über einen Zeitraum von drei Zyklen geschätzt, dass die Pharmakokinetik von ungebundenem Gestoden konzentrationsabhängig ist. Die Pharmakokinetik von Gestoden gilt daher als nicht-linear bezüglich Zeit und Konzentration.
Spezielle Patientengruppen
Geschlecht
Lisvy ist nur bei Frauen indiziert.
Ältere Frauen
Lisvy ist nach der Menopause nicht indiziert.
Body-Mass-Index
Es liegen nur begrenzte Daten zur kontrazeptiven Wirksamkeit bei Frauen mit einem Body-Mass-Index > 30 kg/m2 vor.
Niereninsuffizienz
Zur Anwendung von Lisvy bei Patientinnen mit eingeschränkter Nierenfunktion liegen keine Studien vor. Da Ethinylestradiol und Gestoden vor der Elimination vollständig zu inaktiven Metaboliten abgebaut werden und zudem ein zweiter Ausscheidungsweg über die Leber zur Verfügung steht, ist bei Frauen mit eingeschränkter Nierenfunktion kein erhöhtes Risiko zu erwarten.
Leberinsuffizienz
Studien zur Anwendung von Lisvy bei Frauen mit eingeschränkter Leberfunktion wurden nicht durchgeführt. Bei Frauen mit bestehender oder vorausgegangener schwerer Lebererkrankung ist Lisvy kontraindiziert, solange sich die Leberfunktionswerte nicht normalisiert haben. Siehe auch Abschnitt 4.3.
Ethnische Gruppen
Die Pharmakokinetik von Ethinylestradiol wurde in Kombination mit einem anderen Gestagen bei kaukasischen, chinesischen und japanischen Frauen untersucht. Dabei wurden keine klinisch signifikanten Unterschiede gefunden. Spezielle Studien zur Pharmakokinetik von Lisvy bei Frauen unterschiedlicher ethnischer Abstammung wurden nicht durchgeführt. Polymorphe Enzyme, die in nennenswertem Ausmass zum Abbau von Gestoden beitragen, sind nicht bekannt. Die verfügbaren Daten von kaukasischen, schwarzen und hispanischen Frauen enthalten keinen Hinweis auf relevante Unterschiede in der Pharmakokinetik von Lisvy zwischen den verschiedenen ethnischen Gruppen. Für asiatische Frauen liegen nur sehr begrenzte Daten vor.
Raucherstatus
Es gibt keine Hinweise darauf, dass Rauchen einen Einfluss auf die Pharmakokinetik von Ethinylestradiol und Gestoden hat.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit bei Jugendlichen im Alter unter 18 Jahren ist nicht erwiesen. Es gibt keine relevante Anwendung von Lisvy für Kinder und Jugendliche vor der Menarche.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Toxizität bei wiederholter Gabe, Reproduktionstoxizität, Genotoxizität, lokaler Verträglichkeit und zum kanzerogenen Potenzial lassen die präklinischen Daten der Wirkstoffe keine besonderen Gefahren für den Menschen erkennen.
Jedoch sollte bedacht werden, dass Sexualsteroide das Wachstum bestimmter hormonabhängiger Gewebe und Tumoren fördern können. Biokompatibilitätsstudien mit dem Pflaster und seinen Materialien ergaben keine besonderen Risiken beim Menschen im Zusammenhang mit der lokalen und systemischen Sicherheit des Pflasters.
Beurteilung der Risiken für die Umwelt (Environmental Risk Assessment IERAI)
Die Wirkstoffe Ethinylestradiol und Gestoden stellen ein Risiko für die Umwelt, vor allem für Fische dar. Darüber hinaus sind Gestoden und Ethinylestradiol in der Umwelt persistent. Alle gebrauchten oder nicht benutzten Pflaster sind gemäß den örtlichen Anforderungen zu entsorgen. Im Zweifel sollte der Apotheker zu Rate gezogen werden (siehe Abschnitt 6.6).
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Abdeckfolie
Polyethylen (geringer Dichte)
Klebstoffschicht
Bestandteile des Klebers
Hydrierter Kolophoniumpentaerythritolester
Polybuten
Polyisobutylen
Pentaerythrityltetrakis[3 -(3,5-di-tert-butyl-4-hydroxyphenyl)propionat] Bemotrizinol
Trennfolie
Poly(ethylenterephthalat)
Wirkstoffhaltige Klebematrix
Bestandteile des Klebers
Hydrierter Kolophoniumpentaerythritolester
Polybuten
Polyisobutylen
Pentaerythrityltetrakis[3 -(3,5-di-tert-butyl-4-hydroxyphenyl)propionat]
Abziehfolie
Poly(ethylenterephthalat), silikonisiert
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Pflaster in der Originalverpackung aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Primärpackmittel
Ein Beutel besteht aus vier Schichten: einer Folie aus Polyethylen geringer Dichte (innerste Schicht), einer Aluminiumfolie, einer Papierschicht und einer Polyethylenterephthalat-Folie.
Ein Trennblatt aus silikonisiertem Polyethylenterephthalat verhindert das Ankleben des transdermalen Pflasters im Beutel.
Sekundärpackmittel
Die Beutel sind beschriftet und zusammen mit einer Packungsbeilage (einschließlich Erinnerungskarte und Erinnerungsaufkleber) in einer Faltschachtel verpackt.
Jede Faltschachtel enthält 3, 9 oder 18 Lisvy transdermale Pflaster in einzelnen Beuteln.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Das Pflaster sollte sofort nach der Entnahme aus dem Beutel aufgeklebt werden.
Damit die Klebefähigkeit von Lisvy nicht beeinträchtigt wird, sollte auf den Hautbereich, auf den das Pflaster aufgeklebt ist oder werden soll, weder Make-up, noch Cremes, Lotionen, Puder oder andere topisch anzuwendenden Produkte aufgetragen werden.
Die Wirkstoffe Ethinylestradiol und Gestoden stellen ein Risiko für die Umwelt, vor allem für Fische dar. Darüber hinaus sind Gestoden und Ethinylestradiol in der Umwelt persistent. Die gebrauchten Pflaster sollten daher nicht in der Toilette heruntergespült oder über sonstige Abwassersysteme entsorgt werden, sondern unter Beachtung der folgenden Hinweise sorgfältig beseitigt werden.
Der ursprüngliche Beutel sollte aufbewahrt werden, um das Pflaster nach dem Gebrauch darin zu entsorgen. Das gebrauchte Pflaster wird, mit der klebenden Seite nach innen, auf die Hälfte zusammengefaltet, in den ursprünglichen Beutel geschoben und dieser durch Falten der offenen Seite geschlossen.
Auf dem Beutel befindet sich ein zweiseitiger Aufkleber. Die erste Seite des Aufklebers wird angehoben und dient zum Verschließen der offenen Seite des Beutels. Unter der ersten Seite finden sich auf der zweiten Seite Hinweise für die Entsorgung.
Das Pflaster sollte sicher und für Kinder und Haustiere unzugänglich entsorgt werden.
Alle gebrauchten oder nicht benutzten Pflaster sind gemäß den örtlichen Anforderungen zu entsorgen. Im Zweifel sollte ein Apotheker zu Rate gezogen werden.
7. INHABER DER ZULASSUNG
Gedeon Richter Plc.
Gyömröi ut 19-21.
1103 Budapest Ungarn
Örtlicher Vertreter
Gedeon Richter Pharma GmbH
Eiler Straße 3W
51107 Köln
Tel.: 0221 888 90444
Fax: 01803433366
E-Mail: service@gedeonrichter.de
8. ZULASSUNGSNUMMER(N)
88394.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 3. Juni 2014.
10. STAND DER INFORMATION
05.2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
26/26
Diese Inzidenzen wurden aus der Gesamtheit der epidemiologischen Studiendaten abgeleitet, wobei relative Risiken der verschiedenen Arzneimittel im Vergleich zu Levonorgestrel-haltigen KHK verwendet wurden.
Mittelwert der Spannweite 5-7 pro 10.000 Frauenjahre, auf der Grundlage eines relativen Risikos für Levonorgestrel-haltige KHK versus Nichtanwendung von ungefähr 2,3 bis 3,6