Magnesium Verla I.v./I.m.
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Magnesium Verla® i.v./i.m.,
3.15 mmol Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Magnesiumbis(hydrogen-L-glutamat) 4 H2O 1 Ampulle zu 10 ml Injektionslösung enthält:
Magnesiumbis(hydrogen-L-glutamat) 4 H2O (berechnet wasserfrei) 1000 mg
Magnesiumgehalt:
3.15 mmol/6,3 mval/77 mg
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Nachgewiesener Magnesiummangel, wenn er Ursache für Störungen der Muskeltätigkeit (neuromuskuläre Störungen, Wadenkrämpfe) ist und eine orale Therapie nicht möglich ist.
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung
Die Dosierung richtet sich nach dem Grad des Magnesiumdefizits. Bei erniedrigtem SerumMagnesium-Spiegel - chronischer Magnesiummangel - ist eine Therapie über 4 Wochen zu empfehlen. Allgemein gelten folgende Dosierungsrichtlinien:
Der Inhalt einer Ampulle zu 10 ml wird in 1- bis 2-tägigem Abstand tief intramuskulär oder intravenös injiziert.
Art der Anwendung
Die intravenöse Injektion muss sehr langsam am liegenden Patienten (die ersten 3 ml in 3 Minuten) erfolgen. Es empfiehlt sich, die Patienten nach der Injektion noch 10-20 Minuten ruhen zu lassen. Es können gelegentlich Sensationen auftreten, wie sie von der CalciumInjektion bekannt sind.
Kinder und Jugendliche
Es liegen keine Daten vor.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
AV-Block oder sonstige kardiale Überleitungsstörungen, schwere Niereninsuffizienz, Anu-rie, Exsikkose, Myasthenia gravis, Infektsteindiathese (Calcium-Magnesium-Ammonium-Phosphatsteine).
Vorsichtige Dosierung ist erforderlich bei Patienten mit renaler Funktionseinschränkung. Der Serum-Magnesiumspiegel dieser Patienten ist zu überwachen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Warnhinweise:
Keine
Vorsichtsmaßnahmen für die Anwendung:
Bei Nierenfunktionsstörungen soll eine hochdosierte Daueranwendung vermieden werden.
Müdigkeitserscheinungen können darauf hinweisen, dass bereits ein erhöhter SerumMagnesium-Spiegel erreicht ist. In diesem Fall ist ebenfalls die Dosis zu reduzieren bzw. die Medikation vorübergehend abzusetzen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Wirkung von Magnesium Verla® i.v./i.m. wird durch die gleichzeitige parenterale Gabe von Calciumsalzen vermindert oder aufgehoben. Muskelrelaxantien vom Curaretyp verstärken die Magnesiumwirkung. Die gleichzeitige Gabe von Aminoglycosid-Antibiotika sollte vermieden werden. Magnesium Verla® i.v./i.m. sollte nicht gleichzeitig mit Barbituraten, Narkotika oder Hypnotika, wegen des Risikos der Atemdepression, gegeben werden.
Eine Anwendung von Magnesium Verla® i.v./i.m. bei gleichzeitiger Herzglycosid-Behandlung kann die Herzglycosid-Wirkung vermindern.
Fertilität, Schwangerschaft und Stillzeit
4.6
Für Magnesium liegen keine Hinweise für ein Fehlbildungsrisiko vor. Magnesium Verla® i.v./i.m. kann in der Schwangerschaft und Stillzeit angewendet werden. Wird Magnesium hochdosiert parenteral kurz vor der Geburt verabreicht, sollte das Neugeborene während der ersten 24 - 48 Lebensstunden auf Anzeichen von Toxizität (neurologische Depression mit Atemdepression, Muskelschwäche, Verlust von Reflexen) überwacht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Magnesium Verla® i.v./i.m. hat bei bestimmungsgemäßem Gebrauch keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei der parenteralen Anwendung von Magnesium Verla® i.v./i.m. kann es zu Bradykardie, Überleitungsstörungen und peripheren Gefäßerweiterungen kommen.
Bei intravenöser Applikation von Magnesium Verla® i.v./i.m. kann ein Wärmegefühl und Flush auftreten. Eine zu schnelle Injektion von Magnesium Verla® i.v./i.m. kann zu Übelkeit, Erbrechen, Kopfschmerzen, Kribbeln, Schwitzen, vereinzelt starkem Schwindelgefühl, Mundtrockenheit, Agitiertheit, Erregung und Tremor führen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome der Intoxikation
Bei der oralen Magnesium-Therapie und intakter Nierenfunktion treten auch bei Überdosierung keine Intoxikationserscheinungen auf. Es können allerdings Durchfälle auftreten, die sich durch Reduzierung der Tagesdosis beheben lassen.
Nur bei schwerer Niereninsuffizienz mit Anurie kann es sowohl bei der oralen als auch parenteralen Therapie zur Kumulation von Magnesium und zu Intoxikationserscheinungen kommen.
Pharmakologische und toxische Effekte erhöhter Magnesium-Plasmaspiegel:
|
Mg-Plasma- Konzentration mmol/l |
Symptome und unerwünschte Wirkungen |
|
> 1,5 |
Blutdruckabfall, Brechreiz, Erbrechen |
|
> 2,5 |
ZNS-Depression |
|
> 3,5 |
Hyporeflexie, EKG-Veränderungen |
|
> 5,0 |
Beginnende Atemdepression |
|
> 5,5 |
Koma |
|
> 7,0 |
Herzstillstand, Atemlähmung |
b) Therapie von Intoxikationen
Calcium-Injektion i.v.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mineralstoffpräparate, Magnesiumpräparate
ATC-Code: A12CC14
Magnesium Verla® i.v./i.m.
- wirkt antitetanisch durch Herabsetzung der neuromuskulären Erregbarkeit der Nerven-endplatten, beseitigt daher Wadenkrämpfe und tetanische Beschwerden,
- hat eine kontraktionshemmende und spasmolytische Wirkung auf den Tonus der glatten Muskulatur,
- kontrolliert die Elektrolytverschiebungen durch Regulation der Zellmembranpermeabilität und Aktivierung der Na-K-ATPase der Ionenpumpe (beteiligt an der Wiederherstellung des Ruhemembranpotentials),
- verhindert die adrenerge Überstimulation,
- spielt die entscheidende Rolle bei der Energiebereitstellung und -übertragung, da es an allen ATP-abhängigen enzymatischen Reaktionen beteiligt ist,
- verhindert einen stressbedingten intrazellulären Magnesiummangel und eine CalciumAkkumulation in der Zelle und damit eine permanente Überlastung des Organismus.
5.2 Pharmakokinetische Eigenschaften
Verteilung
Magnesium wird aktiv über die Zellmembran nach den Gesetzen der Michaelis-Menten-Kinetik in die Zelle aufgenommen. Influx und Efflux sind gekoppelt und werden bestimmt durch ein energieabhängiges Transportsystem.
Die Verteilung des Magnesiums im Organismus ist wie folgt:
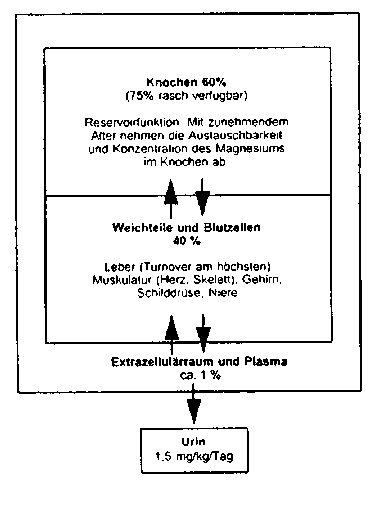
Blut-Liquor-Schranke
Magnesium wird entgegen einem elektrochemischen Gradienten durch ein Carriersystem über die Liquorschranke befördert. Die Liquor-Magnesium-Konzentration wird innerhalb sehr enger Grenzen aufrechterhalten und durch das aktive Magnesium-Transport-System reguliert.
Plazentaschranke
Für Magnesium besteht ein aktives Transportsystem, das die Passage über die Plazentaschranke reguliert. Die fetale Plasma-Magnesium-Konzentration ist höher als die maternale Magnesium-Konzentration. Der Transportprozess erfolgt gegen einen Konzentrationsgradienten.
Muttermilch
Die Magnesiumkonzentration der Muttermilch präeklamptischer Patientinnen nach MgSO4-Infusionen ist in den ersten 24 Stunden post partum signifikant erhöht. Es besteht eine direkte Korrelation zwischen Serum-Magnesium und Magnesium-Konzentration der Muttermilch.
5.3 Präklinische Daten zur Sicherheit
Außer den bereits an anderer Stelle der Fachinformation gemachten Angaben liegen keine weiteren sicherheitsrelevanten Informationen vor.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich
6.5 Art und Inhalt des Behältnisses
Ampullen im Umkarton:
5 Ampullen 10 Ampullen 50 Ampullen
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Verla-Pharm Arzneimittel GmbH & Co. KG
Hauptstraße 98 D-82327 Tutzing
Postfach 1261 D-82324 Tutzing
Telefon: 08158/257-0 Telefax: 08158/257-254
8. ZULASSUNGSNUMMER
6182797.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 16.10.2002
Datum der letzten Verlängerung der Zulassung: 16.10.2002
10. STAND DER INFORMATION
04/2016
Verkaufsabgrenzung: Apothekenpflichtig
Seite: 7 von 7