Mictonorm Ft
FACHINFORMATION
(ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS / SPC)
1. BEZEICHNUNG DES ARZNEIMITTELS
Mictonorm® FT 15 mg Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Filmtablette enthält 15 mg Propiverinhydrochlorid, entsprechend 13,64 mg Propiverin.
Sonstiger Bestandteil mit bekannter Wirkung:
Jede Filmtablette enthält 100,7 mg Lactose-Monohydrat.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette
Weiße, runde, bikonvexe Filmtabletten.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur symptomatischen Behandlung von Harninkontinenz und/oder erhöhter Miktionsfrequenz und Harndrang bei Patienten mit überaktiver Blase oder neurogener Detrusorhyperaktivität durch Rückenmarkschädigungen.
4.2 Dosierung und Art der Anwendung
Filmtabletten zum Einnehmen
Empfohlene Tagesdosen:
Erwachsene:
Als Standarddosis wird eine Filmtablette (= 15 mg Propiverinhydrochlorid) zweimal täglich empfohlen; eine Steigerung auf dreimal täglich ist möglich. Einige Patienten können bereits auf eine Dosis von 15 mg täglich ansprechen.
Bei neurogener Detrusorhyperaktivität wird eine Dosierung von einer Filmtablette dreimal täglich empfohlen. Die maximal empfohlene Tagesdosis ist 45 mg.
Kinder:
Aufgrund mangelnder Daten sollte Mictonorm FT nicht an Kinder verabreicht werden.
Ältere:
Im Allgemeinen gibt es kein spezielles Dosierungsregime für Ältere (siehe Abschnitt 5.2.).
Die Anwendung sollte bei Patienten mit folgenden Erkrankungen mit Vorsicht und unter sorgfältiger ärztlicher Kontrolle möglicher Nebenwirkungen erfolgen (siehe Abschnitte 4.4, 4.5):
Anwendung bei Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit einer leichten oder mittelschweren Einschränkung der Nierenfunktion ist keine Dosisanpassung erforderlich, diese sollten jedoch mit Vorsicht behandelt werden. Bei Patienten mit schwerer Nierenfunktionseinschränkung (Kreatinin-Clearance < 30 ml/min) beträgt die maximale tägliche Dosis 30 mg.
Anwendung bei Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit einer leichten Einschränkung der Leberfunktion besteht keine Notwendigkeit der Dosisanpassung, die Behandlung sollte jedoch mit Vorsicht erfolgen. Es wurden keine Studien durchgeführt, um die Anwendung von Propiverin bei Patienten mit mittelschwerer oder schwerer Einschränkung der Leberfunktion zu untersuchen. Die Anwendung ist deshalb bei diesen Patienten kontraindiziert.
Die gleichzeitige Einnahme von Propiverin mit einer fettreichen Mahlzeit erhöht die Bioverfügbarkeit von Propiverin. Die Einnahme sollte deshalb vor den Mahlzeiten erfolgen. Dies ist besonders für Patienten mit Einschränkung der Leber- oder Nierenfunktion von Bedeutung (siehe Abschnitt 5.2).
4.3 Gegenanzeigen
Das Arzneimittel ist kontraindiziert
- bei Patienten mit Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile sowie
- bei Patienten mit einer der folgenden Erkrankungen:
- Darmobstruktion
- ausgeprägte obstruktive Blasenentleerungsstörungen mit vorhersehbarem Harnverhalt
- Myasthenia gravis
- Darmatonie
- schwere Colitis ulcerosa
- toxisches Megacolon
- unbehandeltes Engwinkelglaukom
- moderate oder ausgeprägte Leberfunktionsstörung
- Tachyarrhythmien.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Das Arzneimittel sollte mit Vorsicht angewendet werden bei Patienten mit:
- autonomer Neuropathie
- Nierenfunktionsstörungen (siehe Abschnitt 4.2)
- Leberfunktionsstörungen (siehe Abschnitt 4.2).
Die Symptome folgender Erkrankungen können sich nach Verabreichung des Arzneimittels verstärken:
- schwere kongestive Herzinsuffizienz (NYHA IV)
- Prostatavergrößerung
- Hiatushernie mit Refluxoesophagitis
- Arrhythmie
- Tachykardie.
Wie auch andere Anticholinergika induziert Propiverin eine Mydriasis. Daher kann bei prädisponierten Personen mit engem Kammerwinkel der vorderen Augenkammer ein erhöhtes Risiko bestehen, dass Glaukomanfälle induziert werden.
Es wurde berichtet, dass Wirkstoffe dieser Klasse, einschließlich Propiverin, akute Engwinkelglaukomanfälle induzieren oder verstärken können.
Pollakisurie und Nykturie infolge von Nierenerkrankungen oder dekompensierter Herzinsuffizienz sowie organische Blasenerkrankungen (z. B. Harnwegsinfektionen, Malignome) sollten vor der Behandlung ausgeschlossen werden.
Dieses Produkt enthält Lactose-Monohydrat.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Aufgrund der hohen Wirkstärke sollte Mictonorm FT an Kinder unter 12 Jahren und einem Gewicht unter 35 kg nicht verabreicht werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wirkungsverstärkung durch gleichzeitige Verabreichung von tricyclischen Antidepressiva (z. B. Imipramin), Tranquilizern (z. B. Benzodiazepine), Anticholinergika (bei systemischer Applikation), Amantadin, Neuroleptika (z. B. Phenothiazine) und Beta-Adrenozeptor-Agonisten (Be-ta-Sympathikomimetika).
Wirkungsabschwächung durch gleichzeitige Verabreichung von Cholinergika.
Blutdrucksenkung bei Patienten unter Isoniazidbehandlung.
Die Wirkung von Prokinetika wie Metoclopramid kann verringert werden.
Pharmakokinetische Wechselwirkungen mit anderen Wirkstoffen, die durch Cytochrom P450 3A4 (CYP 3A4) verstoffwechselt werden, sind möglich. Ein sehr ausgeprägter Konzentrationsanstieg wird für solche Wirkstoffe jedoch nicht erwartet, da die Wirkungen von Propiverin im Vergleich zu klassischen Enzyminhibitoren (z. B. Ketoconazol oder Grapefruit-Saft) gering sind. Propiverin gilt als schwacher Hemmer der mikrosomalen Monooxygenase (CYP 3A4). Pharmakokinetische Untersuchungen bei Patienten, die gleichzeitig starke CYP 3A4-Hemmer wie Azol-Antimykotika (z. B. Ke-toconazol, Itraconazol) oder Makrolid-Antibiotika (z. B. Erythromycin, Clarithromycin) erhalten, sind nicht durchgeführt worden.
Patienten, die eine gleichzeitige Behandlung mit Methimazol und mit Arzneimitteln erhalten, die starke CYP 3A4-Hemmer sind:
Bei Patienten, die Arzneimittel einnehmen, die wirksame Hemmer der flavinhaltigen Monooxygenase (FMO) sind, wie z. B. Methimazol, und gleichzeitig mit starken CYP 3A4-Hemmern behandelt werden, sollte die Behandlung mit einer Tagesdosis von 15 mg Propiverin beginnen. Die Dosierung kann danach erhöht werden. Vorsicht ist jedoch geboten und Ärzte sollten diese Patienten sorgfältig bezüglich auftretender Nebenwirkungen überwachen (siehe Abschnitt 5.2).
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität
Es gibt keine humanen Daten von Propiverin bezüglich des Effekts auf die Fertilität. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die Fruchtbarkeit.
Schwangerschaft
Es liegen keine Erfahrungen mit der Anwendung von Propiverin bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Die Anwendung von Mictonorm FT während der Schwangerschaft wird nicht empfohlen.
Stillzeit
Es ist nicht bekannt, ob Propiverin oder dessen Metabolite in die humane Muttermilch übergehen. Die zur Verfügung stehenden pharmakodynamischen / toxikologischen Daten von Tieren zeigten, dass Propiverin oder Metabolite in die Milch übergehen (für Details siehe Abschnitt 5.3).
Ein Risiko für das Neugeborene / Säugling kann nicht ausgeschlossen werden.
Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Propiverin verzichtet werden soll. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zur Verkehrstüchtigkeit und zur Fähigkeit zum Bedienen von Maschinen durchgeführt.
Propiverin kann zu Benommenheit und Verschwommensehen führen. Dadurch kann unter Einnahme dieses Arzneimittels die Fähigkeit des Patienten zum Ausführen von Tätigkeiten, die mentale Aufmerksamkeit erfordern, wie etwa das Führen von Kraftfahrzeugen, das Bedienen von Maschinen oder das Ausführen gefährlicher Arbeiten, eingeschränkt sein.
Sedativa können die von Propiverin verursachte Benommenheit verstärken.
4.8 Nebenwirkungen
Innerhalb jeder Systemorganklasse werden die folgenden Häufigkeiten zur Bewertung der Nebenwirkungen zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Alle Nebenwirkungen sind vorübergehend und klingen nach einer Dosisreduzierung oder bei Beendigung der Therapie nach maximal 1-4 Tagen ab.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeit
Psychiatrische Erkrankungen
Sehr selten: Verwirrtheit, Unruhe
Nicht bekannt: Halluzinationen
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen
Gelegentlich: Tremor, Schwindel, Geschmacksstörungen
Nicht bekannt: Sprachstörung
Augenerkrankungen
Häufig: Akkommodationsstörungen, Sehstörungen
Herzerkrankungen
Selten: Tachykardie
Sehr selten: Palpitationen
Gefäßerkrankungen
Gelegentlich: Blutdrucksenkung mit Benommenheit, Erröten
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Mundtrockenheit
Häufig: Obstipation, Bauchschmerzen und Dyspepsie
Gelegentlich: Übelkeit/Erbrechen
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Juckreiz
Selten: Ausschlag
Erkrankungen der Nieren und Harnwege
Gelegentlich: Harnverhalt, Blasen- und Harnröhrensymptome
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Müdigkeit und Erschöpfung
Bei einer Langzeittherapie sollten die Leberenzyme kontrolliert werden, da in seltenen Fällen reversible Leberenzymveränderungen auftreten können.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome
Eine Überdosierung mit dem Muscarinrezeptor-Antagonisten Propiverin kann zu schweren anticholi-nergen Nebenwirkungen führen. Es können periphere Symptome und zentralnervöse Störungen auftreten, wie z. B.:
- starke Mundtrockenheit
- Bradykardie, im weiteren Verlauf Tachykardie möglich
- Mydriasis und Akkommodationsstörungen
- Harnverhalt, Hemmung der Darmmotilität
- Unruhe, Verwirrtheit, Halluzinationen, Konfabulation
- Schwindel, Übelkeit, Sprachstörungen und Muskelschwäche
Behandlung
- Im Falle einer Überdosierung mit Propiverinhydrochlorid sollte Aktivkohle als Suspension in ausreichend Wasser verabreicht werden.
- Eine Magenspülung ist nur unter Intubationsschutz und Verwendung eines eingeölten Schlauches (trockene Schleimhäute), wenn innerhalb einer Stunde nach Aufnahme von Propiverin durchführbar, in Erwägung zu ziehen. Erbrechen darf nicht induziert werden.
- Forcierte Diurese oder Hämodialyse sind zur Beschleunigung der Elimination nicht effektiv wirksam.
- Bei schweren zentralen anticholinergen Nebenwirkungen (z. B. Halluzinationen, ausgeprägte Erregungszustände) kann Physostigmin als Antidot verabreicht werden.
- Bei Krampfanfällen oder ausgeprägten Erregungszuständen: Behandlung mit Benzodiazepinen
- Bei Atemdepression: Behandlung durch künstliche Beatmung
- Bei Harnverhalt: Behandlung durch Katheterisierung
- Bei Mydriasis: Behandlung mit Pilocarpin-Augentropfen und/oder Abdunkeln des Patientenzimmers
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
ATC-Code G04B D06
Pharmakotherapeutische Gruppe:
Urologika, Mittel bei häufiger Blasenentleerung und Harninkontinenz Wirkmechanismus
Muskulotrope Spasmolyse durch Hemmung des Calcium-Einstroms und Modulation des intrazellulären Calciums in der glatten Muskulatur der Harnblase.
Hemmung der efferenten Bahnen des Nervus pelvicus durch anticholinerge Wirkung. Pharmakodynamische Wirkungen
Am Tier bewirkt Propiverinhydrochlorid eine dosisabhängige Abnahme des intravesikalen Drucks und eine Erhöhung der Blasenkapazität. Der Effekt beruht auf der Summe der pharmakologischen Eigenschaften von Propiverin und drei aktiven Harnmetaboliten, wie an isolierten Detrusorstreifen von Mensch und Tier gezeigt werden konnte.
5.2 Pharmakokinetische Eigenschaften
Allgemeine Eigenschaften der aktiven Substanz
Propiverin wird fast vollständig aus dem Magen-Darm-Trakt resorbiert. Es unterliegt einem extensiven First-Pass-Metabolismus. Wirkungen an den Zellen der glatten Muskulatur der Harnblase sind durch den Wirkstoff sowie durch drei aktive Metaboliten bedingt, die schnell in den Urin ausgeschieden werden.
Resorption
Bioäquivalenz zwischen Mictonorm FT und dem Referenz-Arzneimittel Mictonorm wurde durch eine geeignete Bioverfügbarkeitsstudie nachgewiesen.
Nach oraler Gabe von Mictonorm wird Propiverin schnell aus dem Gastrointestinaltrakt resorbiert und erreicht maximale Plasmakonzentrationen nach 2,3 Stunden.
Die mittlere absolute Bioverfügbarkeit von Mictonorm beträgt 40,5 % (arithmetischer Mittelwert aus AUCo-ofp.o.) / AUC0.®(i.v.)).
Durch Nahrungsaufnahme wird die Bioverfügbarkeit von Propiverin erhöht (mittlerer Anstieg um das 1,3-fache), jedoch ohne signifikanten Einfluss auf die maximale Plasmakonzentration von Propiverin oder seines Hauptmetaboliten Propiverin-N-Oxid. Es ist unwahrscheinlich, dass dieser Unterschied in der Bioverfügbarkeit klinische Bedeutung hat. Eine Dosisanpassung in Bezug auf die Nahrungsaufnahme könnte jedoch für Patienten mit eingeschränkter Leber- und/oder Nierenfunktion notwendig sein. Deshalb sollte Propiverin von allen Patienten vor dem Essen eingenommen werden.
Verteilung
Nach Gabe von Mictonorm t. i. d. wird ein Steady state (Fließgleichgewicht) nach 4 bis 5 Tagen auf einem höheren Konzentrationsniveau als nach einer Einzelgabe erreicht (CMittelwert = 61 ng/ml).
Das Verteilungsvolumen wurde bei 21 gesunden Probanden nach intravenöser Gabe von Propiverin-hydrochlorid bestimmt und lag zwischen 125 und 473 l (Mittelwert 279 l), was darauf hindeutet, dass eine große Menge des verfügbaren Propiverins in periphere Kompartimente verteilt wird. Die Plasmaprotein-Bindung beträgt 90 - 95 % für die Stammverbindung und etwa 60 % für den Hauptmetaboliten.
Plasmakonzentrationen von Propiverin bei 16 gesunden Probanden nach einmaliger und wiederholter Gabe von
Mictonorm (t. i. d. über 6 Tage):
Einzeldosis

Zeit (h)
Mehrfachdosis
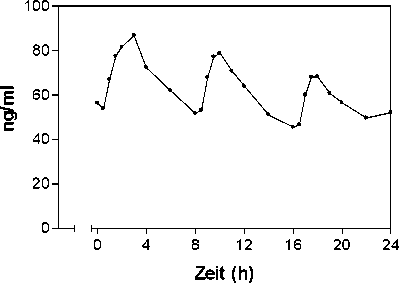
Steady-state-Eigenschaften von Propiverin nach wiederholter Gabe von Mictonorm an 16 gesunde Probanden
(t. i. d. über 6 Tage):
|
Dosierungs intervall [h] |
AUC0-X [ng-h/ml] |
CV [%] |
PTF [%] |
CV [%] |
CMittelwert [ng/ml] |
CV [%] |
|
0 - 8 |
515 |
35 |
57 |
16 |
64 |
36 |
|
8 - 16 |
460 |
33 |
70 |
25 |
57 |
33 |
|
16 - 24 |
421 |
36 |
52 |
39 |
52 |
36 |
|
CV: Variationskoeffizient PTF: Maximum-Minimum-Streuung | ||||||
Biotransformation
Propiverin wird extensiv durch intestinale und hepatische Enzyme metabolisiert. Der Hauptabbauweg schließt die Oxidation des Piperidyl-N ein und wird durch CYP 3A4 und die Flavin-Monooxygenasen (FMO) 1 und 3 vermittelt und führt zur Bildung des weit weniger aktiven N-Oxids, dessen Plasmakonzentration die der Ausgangssubstanz deutlich übersteigt. Vier Metaboliten wurden im Urin nachgewiesen, drei davon sind pharmakologisch aktiv und können zur therapeutischen Wirksamkeit von Mictonorm beitragen.
In vitro ist eine geringfügige Hemmung von CYP 3A4 und CYP 2D6 messbar, die bei Konzentrationen auftritt, die die therapeutischen Plasmakonzentrationen um das 10- bis 100-fache übersteigen (siehe Abschnitt 4.5).
Elimination
Nach oraler Gabe von 30 mg 14C-Propiverinhydrochlorid an gesunde Probanden wurden innerhalb von 12 Tagen 60 % der Radioaktivität im Urin und 21 % der Radioaktivität in den Faeces gefunden. Weniger als 1 % einer oralen Gabe wird unverändert mit dem Urin ausgeschieden. Die mittlere totale Clearance nach einmaliger Gabe von 30 mg beträgt 371 ml/min (191 - 870 ml/min).
Im Rahmen von drei Studien, in die insgesamt 37 gesunde Probanden eingeschlossen waren, wurden mittlere Eliminationshalbwertzeiten von 14,1 bzw. 20,1 bzw. 22,1 Stunden ermittelt.
Linearität/Nichtlinearität
Die pharmakokinetischen Parameter von Propiverin und Propiverin-N-Oxid nach oraler Gabe von 10 -30 mg Propiverinhydrochlorid stehen in einem linearen Zusammenhang mit der Dosis.
Während des Steady state sind keine Veränderungen in der Pharmakokinetik im Vergleich zur Einzelgabe zu sehen.
Eigenschaften bei Patienten
Nierenfunktionseinschränkung
Aus einer Single-Dose-Studie an 12 Patienten mit einer Kreatininclearance < 30 ml/min wurde ge-schlussfolgert, dass eine schwere Nierenfunktionseinschränkung die Eliminierung von Propiverin und seinem Hauptmetaboliten Propiverin-N-Oxid nicht wesentlich ändert. Eine Dosisanpassung ist nicht notwendig, wenn die Gesamt-Tagesdosis 30 mg Propiverinhydrochlorid (z.B. Mictonorm FT 2 mal täglich) nicht überschreitet. Soll eine höhere Dosis (z.B. 45 mg) gegeben werden, ist eine vorsichtige Titration der Dosis unter Berücksichtigung der anticholinergen Wirkungen als Marker für die Verträglichkeit zu empfehlen.
Leberinsuffizienz:
Verglichen mit 12 gesunden Kontrollpersonen war die Steady-state-Pharmakokinetik ähnlich der von 12 Patienten mit milder bis moderater Leberfunktionseinschränkung durch eine Fettleber. Für schwere Leberfunktionseinschränkungen liegen keine Daten vor.
Alter:
Der Vergleich von Tal-Plasmakonzentrationen während des Steady state (Mictonorm t. i. d. über 28 Tage) zeigt keinen Unterschied zwischen älteren Patienten (60 - 85 Jahre; Mittelwert 68) und jungen gesunden Probanden. Das Verhältnis der Muttersubstanz zum Metaboliten bleibt bei älteren Patienten unverändert, was darauf hindeutet, dass die metabolische Umsetzung von Propiverin in seinen Hauptmetaboliten Propiverin-N-Oxid nicht altersabhängig oder nicht limitierend bei der Gesamtausscheidung ist.
Glaukom-Patienten:
Wie in zwei Placebo-kontrollierten Studien gezeigt werden konnte, erhöht Mictonorm t. i. d. über 7 Tage nicht den Augeninnendruck bei Patienten mit Weitwinkelglaukom und bei Patienten mit behandeltem (kontrolliertem) Engwinkelglaukom.
5.3 Präklinische Daten zur Sicherheit
In Langzeituntersuchungen mit oraler Gabe an zwei Säugetierarten waren die wichtigsten behandlungsbezogenen Effekte Veränderungen in der Leber (einschließlich Erhöhung der Leberenzyme). Diese waren durch Leberhypertrophie und -verfettung gekennzeichnet. Die Verfettung war nach Abbruch der Behandlung reversibel.
Es wurden keine Effekte auf die Fruchtbarkeit und das Fortpflanzungsverhalten in Studien mit männlichen und weiblichen Ratten beobachtet.
In Untersuchungen an Tieren kam es bei hochdosierter oraler Verabreichung des Wirkstoffes an trächtige Weibchen zu einer verzögerten Skelettentwicklung bei den Nachkommen.
Bei laktierenden Säugetieren wurde Propiverin in die Milch ausgeschieden.
Es wurde kein Hinweis auf Mutagenität gefunden. Eine Karzinogenitätsstudie an Mäusen zeigte im hohen Dosisbereich eine erhöhte Inzidenz an hepatozellulären Adenomen und Karzinomen bei männlichen Tieren. In einer Karzinogenitätsstudie an Ratten traten im hohen Dosisbereich bei männlichen Tieren hepatozelluläre Adenome, Nierenadenome und Harnblasenpapillome auf, während bei weiblichen Tieren im hohen Dosisbereich Endometriumpolypen auftraten. Die Tumoren wurden jedoch alle als artspezifisch und daher nicht als klinisch relevant eingeschätzt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Tablettenkern:
- Lactose-Monohydrat
- Cellulosepulver
- Magnesiumstearat (Ph.Eur.) [pflanzlich]
Filmüberzug:
- Hypromellose
- Mikrokristalline Cellulose
- Stearinsäure
- Talkum
- Titandioxid
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Dieses Arzneimittel erfordert keine besonderen Lagerungsbedingungen.
6.5 Art und Inhalt des Behältnisses
PVC/PVDC/Aluminium-Blisterpackungen in Faltschachteln mit 14, 20, 28, 30, 49, 50, 56, 60, 84, 98, 100, 112, 168, 252 bzw. 300 Filmtabletten sowie Klinikpackungen zu 500 und zu 280 (10x28) Filmtabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
APOGEPHA Arzneimittel GmbH
Kyffhäuserstr. 27
01309 Dresden
Tel.: 03 51 / 3 36 33
Fax: 03 51/ 3 36 34 40
www .apogepha.de
8. ZULASSUNGSNUMMER
94635.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
21.09.2016
10. STAND DER INFORMATION
September 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 10 von 10