Misodel 200 Mikrogramm Vaginales Wirkstofffreisetzungssystem
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
MISODEL 200 Mikrogramm vaginales Wirkstofffreisetzungssystem.
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG MISODEL enthält 200 Mikrogramm Misoprostol.
Misoprostol wird in vivo mit einer mittleren Rate von ca. 7 Mikrogramm pro Stunde über einen Zeitraum von 24 Stunden freigesetzt. Die Wirkstofffreisetzung hält so lange an, wie sich MISODEL in der Vagina befindet.
Sonstiger Bestandteil mit bekannter Wirkung: 0,13 mg Butylhydroxyanisol pro Dosis (siehe Abschnitt 4.4).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Vaginales Wirkstofffreisetzungssystem.
Das Polymer-Insert ist in einer Rückholvorrichtung, bestehend aus einem inerten Polyestergewebebeutel mit Rückholband, enthalten. Das Polymer-Insert hat eine rechteckige Form mit abgerundeten Ecken. Es ist von gelbbrauner Farbe, halbdurchsichtig, nicht biologisch abbaubar und misst ca. 30 mm x 10 mm x 0,8 mm (LxBxH). MISODEL quillt auf, wenn es mit Feuchtigkeit in Berührung kommt.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
MISODEL wird zur Einleitung der Wehen bei Frauen mit unreifer Zervix ab der 37. Schwangerschaftswoche eingesetzt, wenn eine Geburtseinleitung klinisch indiziert ist.
4.2 Dosierung und Art der Anwendung
Dosierung
MISODEL 200 Mikrogramm ist eine Formulierung mit einer kontrollierten Freisetzung, die ca. 7 Mikrogramm Misoprostol pro Stunde über einen Zeitraum von 24 Stunden freisetzt.
Die empfohlene Höchstdosis beträgt ein MISODEL vaginales Wirkstofffreisetzungssystem (200 Mikrogramm).
Entfernen Sie MISODEL
- bei Einsetzen aktiver Wehentätigkeit (fortschreitende Zervixdilatation auf 4 cm bei beliebiger Häufigkeit der Kontraktionen oder rhythmische, feste und intensive Uteruskontraktionen, die eine fortschreitende Veränderung der Zervix zur Folge haben und mit einer Häufigkeit von 3 oder mehr Kontraktionen innerhalb von 10 Minuten auftreten und 45 Sekunden oder länger andauern),
- wenn die Uteruskontraktionen lange anhalten oder übermäßig stark sind,
- bei Anzeichen einer fetalen Komplikation oder
- 24 Stunden, nachdem es eingeführt wurde.
Falls MISODEL herausfällt, wird es nicht wieder eingesetzt.
Wenn nach Entfernung des vaginalen Wirkstofffreisetzungssystems Oxytocin angewendet werden soll, wird eine Wartezeit von mindestens 30 Minuten empfohlen (siehe Abschnitt 4.5).
Kinder und Jugendliche:
Die Sicherheit und Wirksamkeit von MISODEL bei schwangeren Frauen unter 18 Jahren ist nicht bekannt. Hierzu liegen keine Daten vor.
Art der Anwendung
MISODEL sollte nur von in der Geburtshilfe geschultem Personal im Krankenhaus bei kontinuierlicher Überwachung von Fetus und Uterus eingesetzt werden. Vor der Anwendung von MISODEL ist der Zustand der Zervix sorgfältig zu untersuchen. Nach dem Einführen müssen Uterusaktivität und Zustand des Fetus sorgfältig überwacht werden.
MISODEL ist einzeln in Aluminiumbeuteln verpackt und muss im Gefrierschrank aufbewahrt werden. Das Auftauen vor der Anwendung ist nicht erforderlich.
Auf einer Seite des Aluminiumbeutels befindet sich eine Markierung zum Aufreißen der Verpackung. Öffnen Sie die Verpackung an der Markierung entlang der Oberseite des Beutels. Verwenden Sie dafür keine Schere oder andere scharfe Gegenstände, die die Rückholvorrichtung beschädigen könnten.
MISODEL wird tief in das hintere Scheidengewölbe eingeführt (Abb. a). Um sicherzustellen, dass MISODEL in situ verbleibt, sollte es um 90o gedreht werden, damit es quer im hinteren Scheidengewölbe liegt (Abb. b). Gegebenenfalls kann ein wasserlösliches Gleitmittel verwendet werden, um das Einführen zu erleichtern.
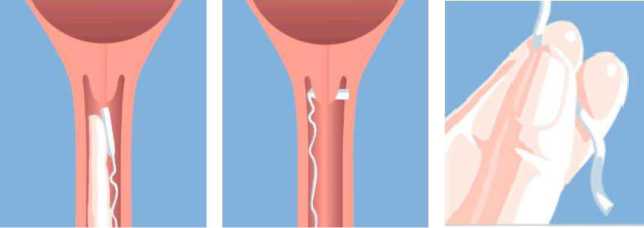
Abb. a.
Abb. b.
Abb. c.
Nachdem das vaginale Wirkstofffreisetzungssystem eingeführt wurde, kann das Rückholband mit einer Schere soweit gekürzt werden, dass außerhalb der Vagina genügend Band zur Entfernung verbleibt.
Nach dem Einführen sollte die Patientin 30 Minuten liegen, danach darf sie aufstehen. Es ist darauf zu achten, dass MISODEL nicht versehentlich beim Gang zur Toilette oder bei den vaginalen Untersuchungen entfernt wird.
Entfernung
MISODEL wird durch vorsichtiges Ziehen am Band der Rückholvorrichtung entfernt (Abb. c).
Das vaginale Wirkstofffreisetzungssystem sollte NIEMALS aus der Rückholvorrichtung genommen werden.
MISODEL ist eine Formulierung mit einer kontrollierten Freisetzung. MISODEL quillt auf, wenn es mit Feuchtigkeit in Berührung kommt, und setzt Wirkstoff frei. Nach dem Einführen quillt MISODEL auf das 2-3fache seiner ursprünglichen Größe auf und wird formbar. Bei der Entfernung ist darauf zu achten, dass das vollständige Produkt (Insert und Rückholvorrichtung) aus der Vagina entfernt wird.
4.3 Gegenanzeigen
MISODEL ist kontraindiziert:
• bei Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
• nach dem Einsetzen der Wehen,
• bei Verdacht oder Hinweisen auf fetale Komplikationen vor der Einleitung (z. B. Non-StressTest oder Stress-Test, mekoniumhaltiges Fruchtwasser oder die Diagnose oder Anamnese eines non-reassuring fetal status),
• bei Verabreichung von Oxytocin und/oder anderen Wehen induzierenden Wirkstoffen (siehe Abschnitt 4.4),
• bei Verdacht oder Hinweisen auf uterine Vernarbungen infolge einer vorausgegangenen Uterusoder Zervixoperation, z. B. Kaiserschnitt,
• bei Vorliegen einer Uterusfehlbildung (z. B. Uterus bicornis),
• bei Placenta praevia oder ungeklärten Vaginalblutungen ab der 25. Schwangerschaftswoche während der vorliegenden Schwangerschaft,
• bei fetaler Lageanomalie,
• bei Anzeichen und Symptomen von Chorioamnionitis, außer wenn zuvor eine adäquate Therapie eingeleitet wurde,
• vor Ende der 36. Schwangerschaftswoche.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
MISODEL kann eine exzessive uterine Stimulation auslösen, wenn es nach Einsetzen der Wehen in situ belassen wird (siehe Abschnitt 4.9).
Wenn die Uteruskontraktionen lange anhalten oder übermäßig stark sind oder wenn Anzeichen für Komplikationen bei der Mutter oder dem Ungeborenen bestehen, ist das vaginale Wirkstofffreisetzungssystem zu entfernen. Sollten die übermäßig starken Uteruskontraktionen nach Entfernung des Arzneimittels fortbestehen, ist eine tokolytische Behandlung in Erwägung zu ziehen.
Bei Frauen mit Präeklampsie sollten Anzeichen oder Verdacht auf fetale Komplikationen ausgeschlossen werden (siehe Abschnitt 4.3). Schwangere Frauen mit schwerer Präeklampsie, die sich durch hämolytische Anämie, erhöhte Leberwerte, geringe Blutplättchenzahl (HELLP-Syndrom), andere Endorgan-Beschwerden oder ZNS-Befunde, die über leichte Kopfschmerzen hinausgehen, äußert, wurden in der Phase III-Zulassungsstudie (Miso-Obs-303, die EXPEDITE-Studie) nicht untersucht.
MISODEL wurde nicht bei Frauen mit einem Blasensprung, der mehr als 48 Stunden vor der Anwendung von MISODEL stattfand, untersucht.
Bei Frauen mit positivem B-Streptokokken-Status, die prophylaktisch mit Antibiotika behandelt werden, ist der Zeitpunkt der Antibiotikatherapie sorgsam abzuwägen, um einen angemessenen Schutz zu erzielen. Im Rahmen der Phase III-Zulassungsstudie (Miso-Obs-303; die EXPEDITEStudie) betrug die kürzeste beobachtete Dauer bis zur Entbindung 2,95 Stunden.
MISODEL muss vor einer Oxytocin-Gabe entfernt werden. Nach der Entfernung von MISODEL sollte eine Wartezeit von mindestens 30 Minuten eingehalten werden, bevor eine Behandlung mit Oxytocin begonnen wird (siehe Abschnitte 4.2, 4.3 und 4.5).
MISODEL wurde nur bei Einlingsschwangerschaften mit Schädellage untersucht. Es wurden keine Untersuchungen bei Mehrlingsschwangerschaften vorgenommen. MISODEL wurde nicht bei Frauen mit mehr als 3 vorausgegangenen vaginalen Entbindungen nach der 25. Schwangerschaftswoche untersucht.
MISODEL sollte nur angewendet werden, wenn die Einleitung der Wehen klinisch indiziert ist.
Bei Patientinnen mit modifiziertem Bishop-Score (mBS) > 4 sollte MISODEL mit Vorsicht angewendet werden.
Eine zweite MISODEL-Dosis wird nicht empfohlen, da die Wirkung einer zweiten Dosis nicht untersucht wurde.
Bei Patientinnen mit Weheneinleitung (physiologisch oder pharmakologisch) wurde ein erhöhtes Risiko für postpartale disseminierte intravasale Gerinnung beschrieben.
Butylhydroxyanisol wird als Antioxidans in dem vernetzten Hydrogelpolymer eingesetzt. Im Endprodukt ist es nur in Spuren nachweisbar. Butylhydroxyanisol kann örtlich begrenzt Hautreizungen (z.B. Kontaktdermatitis), Reizungen der Augen und der Schleimhäute hervorrufen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Mit MISODEL wurden keine Interaktionsstudien durchgeführt.
Die gleichzeitige Anwendung von Oxytocin oder anderen Arzneimitteln zur Weheninduktion ist aufgrund des Risikos einer gesteigerten uterotonischen Wirkung kontraindiziert (siehe Abschnitt 4.2,
4.3 und 4.4).
Bei Bedarf erhielten die Teilnehmerinnen in den klinischen Studien nach Entfernung von MISODEL andere Arzneimittel, die Prostaglandin enthalten. Eine nachteilige Wirkung wurde nicht beobachtet. Nach der Entfernung von MISODEL wurde eine Wartezeit von einer Stunde eingehalten, bevor diese Produkte angewendet werden durften.
4.6 Fertilität, Schwangerschaft und Stillzeit Fertilität
Studien zur Fertilität und zur frühen embryonalen Entwicklung in Ratten ergaben Hinweise auf eine potenziell unerwünschte Wirkung von Misoprostol auf die Implantation. Für die indizierte klinische Anwendung ist dies jedoch nicht relevant (siehe Abschnitt 5.3).
Schwangerschaft
MISODEL wurde bei schwangeren Frauen ab der 37. Schwangerschaftswoche untersucht.
MISODEL sollte vor der 37. Schwangerschaftswoche nicht angewendet werden (siehe Abschnitt 4.3).
Stillen
Es wurden keine Studien zur Untersuchung der Menge von Misoprostol im Kolostrum oder der Muttermilch nach der Anwendung von MISODEL durchgeführt.
Nach oraler Gabe in Tablettenform wurde Misoprostolsäure in der Muttermilch nachgewiesen.
Nach der Entfernung von MISODEL beträgt die mediane Plasmahalbwertszeit von Misoprostolsäure ca. 40 Minuten. Nach fünf Halbwertszeiten, ca. 3 Stunden, sind die maternalen Plasmaspiegel von Misoprostolsäure vernachlässigbar. Es wird angenommen, dass nur sehr geringe Mengen Misoprostolsäure für kurze Zeit in das Kolostrum und die Muttermilch übergehen. Deshalb könnte gestillt werden. Im Rahmen des klinischen Entwicklungsprogramms fielen unter MISODEL keine Auswirkungen auf die gestillten Neugeborenen auf.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Erfahrungen aus klinischen Studien
Zusammenfassung des Sicherheitsprofils
Das Nebenwirkungsprofil in Tabelle 1 beruht auf fünf klinischen Studien, im Rahmen derer MISODEL bei 874 schwangeren Frauen mit termingerechter Entbindung angewendet wurde. Die häufigsten unerwünschten Wirkungen waren abnorme Uteruskontraktionen, Veränderungen der fetalen Herzfrequenz und abnorme Wehentätigkeit, die sich auf den Fetus auswirkte.
Tabelle 1 In klinischen Studien beobachtete Nebenwirkungen
|
Systemorganklasse |
Häufig (> 1/100,< 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
|
Erkrankungen des Nervensystems |
Hypoxisch-ischämische Enzephalopathie* | |
|
Herzerkrankungen |
Veränderung der fetalen Herzfrequenz* | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Respiratorische Depression des Neugeborenen* Atemnotsyndrom des Neugeborenen* Vorübergehende Tachypnoe des Neugeborenen* | |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit Erbrechen | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Hautausschlag | |
|
Schwangerschaft, Wochenbett und perinatale Erkrankungen |
Abnorme Wehentätigkeit mit Auswirkungen auf den Fetus** Mekonium im Fruchtwasser Abnorme Uteruskontraktionen*** |
Antepartale Blutung Fetale Azidose* Postpartale Blutung Vorzeitige Plazentaablösung Uterine Hypertonie |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Genitalpruritus |
|
Systemorganklasse |
Häufig (> 1/100,< 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
|
Untersuchungen |
niedriger Apgar* erhöhter Blutdruck | |
|
Verletzungen, Vergiftungen und durch Eingriffe bedingte Komplikationen |
Uterusruptur |
In der Tabelle aufgeführt sind unerwünschte Wirkungen, die in folgenden Studien beobachtet wurden: Miso-Obs-002, Miso-Obs-003, Miso-Obs-204, Miso-Obs-205 und Miso-Obs-303 (die EXPEDITEStudie)
♦Nebenwirkungen beim Neugeborenen
‘Veränderungen der fetalen Herzfrequenz wurden als abnorme fetale Herzfrequenz, fetale Bradykardie, fetale Tachykardie, Fehlen der normalen Variabilität aus ungeklärter Ursache, verminderte fetale Herzfrequenz, verlangsamte fetale Herzfrequenz, frühe, späte oder variable Dezelerationen sowie verlängerte Dezelerationen beschrieben.
‘‘Abnorme Wehentätigkeit mit Auswirkungen auf den Fetus wurde als uterine Tachysystole oder uterine Hypertonie mit Veränderung der fetalen Herzfrequenz berichtet.
‘‘‘Abnorme Uteruskontraktionen wurden in Form uteriner Tachysystolen beobachtet.
In der MISODEL-Zulassungsstudie (Miso-Obs-303: die EXPEDITE-Studie) wurden die Neugeborenen bis zu einem Monat nach der Entbindung im Hinblick auf einen Krankenhausaufenthalt oder Besuch in der Notaufnahme nachverfolgt. Nach der Entlassung aus dem Krankenhaus wurden keine Nebenwirkungen gemeldet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Es liegen keine Erfahrungen zu mehr als einer Anwendung MISODEL vor. Das Risiko einer Überdosierung wird durch die kontrollierte Freisetzung und die Möglichkeit, MISODEL zu entfernen und dadurch die Freisetzung von Misoprostol zu beenden, eingeschränkt. Bleibt MISODEL nach Einsetzen der Wehentätigkeit versehentlich in situ, können Symptome einer Prostaglandin-Überdosierung (uterine Hyperstimulation) auftreten. In diesem Fall ist MISODEL zu entfernen und es sind die üblichen Maßnahmen zu ergreifen.
5 PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere Gynäkologika, Wehen fördernde Mittel, Prostaglandine, ATC-Code: G02AD06
Wirkmechanismus:
Misoprostol ist ein synthetisches Prostaglandin Ej-Analogon (PGEj), eine natürlicherweise im Körper vorkommende, wehenfördernde Verbindung. Prostaglandine vom Typ E und F steigern in vitro die Kollagenase-Aktivität in den uterinen Zervixfibroblasten von Kaninchen und fördern in vivo die Reifung der Zervix sowie die Uteruskontraktionen. Diese pharmakodynamischen Effekte gelten als ursächlicher Wirkmechanismus, der für die klinische Wirkung von MISODEL verantwortlich ist.
PGE-Analoga besitzen daneben noch einige andere Wirkungen. Dazu zählen u. a. die Entspannung der Bronchial- und Trachealmuskulatur, die Förderung der Schleimproduktion und die Verminderung der Säure- und Pepsinsekretion im Magen, die Steigerung der renalen Blutzirkulation und der Anstieg der Menge an im Blut zirkulierendem adrenokortikotropen Hormon (ACTH) und Prolaktin. Aufgrund der kurzen Behandlungsdauer wird diesen pharmakodynamischen Effekten keine klinische Bedeutung zugemessen.
Klinische Wirksamkeit und Sicherheit
Die Zulassungsstudie der Phase III (Miso-Obs-303: die EXPEDITE-Studie) war eine doppelblinde, randomisierte Multicenterstudie, die in den USA mit 1358 schwangeren Frauen durchgeführt wurde. Im Rahmen der Studie wurden Sicherheit und Wirksamkeit von MISODEL mit dem vaginalen Wirkstofffreisetzungssystem mit 10 mg Dinoproston (PROPESS) verglichen. Erst- und Mehrgebärende mit unreifer Zervix (modifizierter Bishop Score < 4) erhielten über 24 Stunden randomisiert eine Behandlung entweder mit MISODEL oder PROPESS. Der co-primäre Endpunkt für die Wirksamkeit in der Studie war die Zeitdauer bis zur vaginalen Entbindung, und der co-primäre Endpunkt für die Sicherheit war die Anzahl der Kaiserschnitte.
Tabelle 2 hebt die wichtigsten primären und sekundären Datenendpunkte dieser Studie hervor.
Tabelle 2 Miso-Obs-303: Die Ergebnisse der wichtigsten Endpunkte der EXPEDITE-Studie
|
MISODEL 200 pg (n = 678) |
PROPESS 10 mg (n = 680) |
p-Wert | |
|
Mediane Dauer bis zur vaginalen Entbindung des Neugeborenen (Stunden)* Nullipara Multipara |
21,5 h** 29,2 h (n = 441) 13,4 h (n = 237) |
32,8 h** 43.1 h (n = 451) 20.1 h (n = 229) |
p < 0,001 p < 0,001 p < 0,001 |
|
Kaiserschnitt-Inzidenz (n %) Nullipara Multipara |
176 (26,0 %) 152 (34,5 %) 24 (10,1 %) |
184 (27,1 %) 168 (37,3 %) 16 (7,0 %) |
p = 0,646 p = 0,386 p = 0,226 |
|
Mediane Dauer bis zur Entbindung des Neugeborenen* (vaginal oder per Kaiserschnitt) (h) |
18,3 h* |
27,3 h* |
p < 0,001 |
|
Mediane Dauer bis zum Einsetzen aktiver Wehentätigkeit (Stunden)* |
12,1 h** |
18,6 h** |
p < 0,001 |
|
Gesamtanzahl der Patientinnen, die vor der Entbindung Oxytocin erhielten [n (%)] |
324 (48,1 %) (n = 674) |
497 (74,1 %) (n = 671) |
p < 0,001 |
* Patientinnen mit Kaiserschnitt-Entbindung, Patientinnen, die vor der Entbindung entlassen wurden oder Patientinnen, die ihre Einwilligung während des ersten Krankenhausaufenthaltes widerriefen, wurden zensiert, indem die längste Zeit von der Verabreichung des Prüfpräparats bis zum Kaiserschnitt oder bis Einsetzen der Wehen und Entlassung nach Entbindung genommen wurde (Schätzung nach Kaplan-Meier)
** Zusammenfassung der medianen Zeit bis zur vaginalen Entbindung (nur Patientinnen, die vaginal entbunden haben): MISODEL 200 jag: 16,6 h; PROPESS 10 mg: 25,1 h ‘Zusammenfassung der medianen Zeit bis zur Entbindung: MISODEL 200 pg: 18,2 h;
PROPESS 10 mg: 27,2 h
‘‘Zusammenfassung der medianen Zeit bis zum Einsetzen aktiver Wehentätigkeit: MISODEL 200 pg: 12,0 h; PROPESS 10 mg: 18,0 h
Kinder und Jugendliche
Die europäische Arzneimittelagentur verzichtet auf die Verpflichtung zur Einreichung von klinischen Studienergebnissen zu MISODEL für die Untergruppe Kinder und Jugendliche für die zugelassene Indikation Geburtseinleitung (siehe Abschnitt 4.2 bezüglich Angaben zur Anwendung bei Kindern und Jugendlichen).
5.2 Pharmakokinetische Eigenschaften
Misoprostol ist ein Ester, der schnell in den aktiven Metaboliten Misoprostolsäure umgewandelt wird. Im Plasma ist nur Misoprostolsäure nachweisbar. Die Säure wird vor der urinären Ausscheidung weiter in die inaktiven Metaboliten Dinor- und Tetranorsäure umgewandelt.
Bei Frauen, die nicht schwanger sind, kommt es bei Anwendung des vaginalen Wirkstofffreisetzungssystems MISODEL in vivo zu einer durchschnittlichen kontrollierten Freisetzungsrate von ca. 7 Mikrogramm pro Stunde über einen Zeitraum von 24 Stunden. In einer Studie mit 24 Schwangeren mit termingerechter Entbindung wurde eine mediane Cmax von 45,8 pg/ml mit einer medianen Tmax von 4 Stunden beobachtet. Die mediane terminale Halbwertszeit betrug (nach Entfernung des Inserts) ungefähr 40 Minuten.
Die Serumeiweißbindung von Misoprostolsäure liegt unter 90 % und ist bei Anwendung therapeutischer Dosen unabhängig von der Konzentration.
5.3 Präklinische Daten zur Sicherheit
Die aktive Substanz in MISODEL, Misoprostol, ließ in konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und Karzinogenität kein besonderes Risiko für Menschen erkennen.
Bei Ratten wurde bei Dosen bis zu 10 mg Misoprostol/kg/Tag keine teratogene Wirkung beobachtet. Bei Kaninchen wurde bei einer Dosis von 1 mg/kg/Tag eine erhöhte Anzahl von Feten mit zusätzlichen Rippen beobachtet, die wahrscheinlich in Zusammenhang mit maternaler Toxizität in diesem Dosisbereich steht. Bei für Mäusefeten nahezu letalen Dosen traten verschiedene Missbildungen des Fetus auf. Es gibt Belege für eine potenziell unerwünschte Wirkung von Misoprostol auf Implantationen, und NOAEL (No Observed Adverse Effect Level) lag in einer Studie zur Fertilität und der frühen embryonalen Entwicklung von Ratten bei 0,4 mg/kg/Tag. Die oben erwähnten Befunde bei Ratten und Mäusen sind bezogen auf MISODEL unbedenklich, da die Anwendung des Arzneimittels vor der 37. Schwangerschaftswoche kontraindiziert ist.
In peri- und postnatalen Toxizitätsstudien mit Ratten wurde für oral verabreichtes Misoprostol eine No-Effect-Dosis von 1,0 mg/kg/Tag hinsichtlich der Wirkungen auf Reproduktionsparameter bestimmt. Durch Vergleich der Exposition von Ratten mit humanen Kinetikstudien wurde ein Sicherheitsfaktor von 20 für MISODEL festgelegt bei Gabe von 200 Mikrogramm Misoprostol in Form einer Miniaturversion des MISODEL vaginalen Wirkstofffreisetzungssystems.
Anzeichen einer lokalen Reizung in der Vagina oder an der Zervix traten nach Verabreichung von MISODEL an trächtigen Ratten nicht auf.
Konventionelle in vitro- und in vivo-Untersuchungen und veröffentlichte Daten zur Toxizität zeigten keine Risiken für Menschen auf eine systemische Toxizität durch das Hydrogelpolymer, das Rückholsystem aus Polyester und die Hilfsstoffe. Die Hydrogelpolymere und das Rückholsystem aus Polyester bestehen aus inerten Substanzen mit guter lokaler Verträglichkeit.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Quervernetztes Hydrogelpolymer (bestehend aus Macrogol 8000, Hexan- 1,2,6-triol und 4,4'-Methylendicyclohexyldiisocyanat)
Butylhydroxyanisol (Ph.Eur.)
Polyester-Rückholsystem (gewirktes Polyester-Garn)
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Gefrierschrank lagern (-10 °C bis -25 °C). Auftauen vor der Anwendung ist nicht erforderlich.
6.5 Art und Inhalt des Behältnisses
1 x 200 Mikrogramm vaginales Wirkstofffreisetzungssystem 5 x 200 Mikrogramm vaginales Wirkstofffreisetzungssystem 5 x 200 Mikrogramm vaginales Wirkstofffreisetzungssystem (Multipack).
Jedes vaginale Wirkstofffreisetzungssystem ist einzeln in einem Beutel aus Trockenmittel enthaltender Aluminium-Verbundfolie versiegelt und in einem Karton verpackt.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
MISODEL sollte erst kurz vor dem Einführen aus dem Gefrierschrank und aus dem Beutel aus Aluminium-Verbundfolie genommen werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen. Nach dem Entfernen von MISODEL wird das Arzneimittel im Ganzen entsorgt.
7. INHABER DER ZULASSUNG
FERRING Arzneimittel GmbH Fabrikstraße 7 D-24103 Kiel Tel.: 0431/ 5852-0 Fax.: 0431/5852-74
8. ZULASSUNGSNUMMER
87587.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
09.01.2014
10. STAND DER INFORMATION
Januar 2014
11. VERKAUFSABGRENZUNG V erschreibungspflichtig
Sollten Sie weitere service@ferring.de
Fragen haben, wenden Sie sich bitte an folgende e-mail Adresse: info-
Seite 10 von 10