Muse 1000 Mikrogramm
FACHINFORMATION
(Zusammensetzung der Merkmale des Arzneimittels / SPC)
1. Bezeichnung der Arzneimittel
MUSE® 250 mikrogramm, Stäbchen zur Anwendung in der Harnröhre MUSE® 500 mikrogramm, Stäbchen zur Anwendung in der Harnröhre MUSE® 1000 mikrogramm, Stäbchen zur Anwendung in der Harnröhre
2. Qualitative und quantitative Zusammensetzung
Wirkstoff
Alprostadil:
250 ^g, 500 ^g, 1000 ^g
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1
3. Darreichungsform
Stäbchen zur Anwendung in der Harnröhre
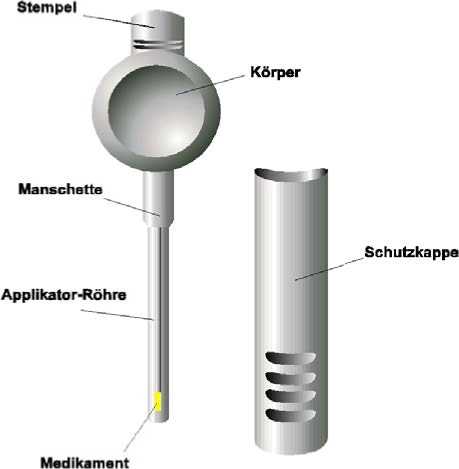
MUSE ist ein steriles, transurethrales Einmalsystem zur Verabreichung von Alprostadil in die männliche Harnröhre. Das in der Spitze des Polypropylenapplikators enthaltene Stäbchen zur Anwendung in der Harnröhre (1,4 mm Durchmesser, Länge 3 mm oder 6mm) enthält Alprostadil suspendiert in Macrogol.
4. Klinische Angaben
4.1 Anwendungsgebiete
- Behandlung der primär organisch bedingten erektilen Dysfunktion
- Hilfsmittel für den Test zur Diagnose und Behandlung der erektilen Dysfunktion
4.2 Dosierung und Art der Anwendung
Erwachsene
Therapie der erektilen Dysfunktion Behandlungsbeginn:
Der behandelnde Arzt (oder entsprechend ausgebildetes medizinisches Personal) sollte den Patienten in der korrekten Anwendung von MUSE unterweisen. Die empfohlene Anfangsdosis beträgt 500 ^g. Die Dosierung kann, unter ärztlicher Aufsicht, stufenweise erhöht ( bis zu 1000 ^g) oder bis auf 250 ^g verringert werden, bis der Patient eine zufriedenstellende Reaktion auf die Dosistitrierung zeigt. Nachdem sich der Arzt davon überzeugt hat, dass der Patient die korrekte Anwendung des Verfahrens beherrscht, kann die gewählte Dosis für die Anwendung in häuslicher Umgebung verschrieben werden.
Es ist wichtig, dass der Patient vor der Verabreichung Wasser lässt, weil eine feuchte Harnröhre die Anwendung von MUSE erleichtert und für das Auflösen des Medikamentes notwendig ist.
Zur Verabreichung von MUSE ist die Schutzkappe des MUSE -Applikators zu entfernen, der Penis zur vollen Länge hochzuziehen und die Applikator-Röhre in die Harnröhre einzuführen. Anschließend wird der Applikator-Stempel hinuntergedrückt, damit das Medikament aus dem Applikator freigesetzt wird, danach wird der Applikator aus der Harnröhre zurückgezogen (den Applikator vor der Entfernung aus der Harnröhre vorsichtig rütteln, um die Medikamentenabgabe zu gewährleisten). Der Penis soll dann wenigstens 10 Sekunden zwischen den Händen gerollt werden, damit das Medikament gleichmäßig an der Harnröhrenwand verteilt wird. Wenn der Patient ein Brennen verspürt, kann es hilfreich sein, den Penis weitere 30 - 60 Sekunden bzw. bis das Brennen verschwindet zwischen den Händen zu rollen. Die Erektion tritt innerhalb von 5 - 10 Minuten nach der Verabreichung ein und dauert ca. 30 - 60 Minuten an. Nach der Verabreichung von MUSE ist es wichtig, dass der Patient ca. 10 Minuten sitzt oder - besser noch - steht oder geht, während sich die Erektion entwickelt. Für weitere Informationen siehe auch Gebrauchsinformation. Es wird empfohlen, im Laufe der häuslichen Anwendung eine regelmäßige Überprüfung der Wirksamkeit und Unbedenklichkeit vorzunehmen.
Es werden höchstens 2 Dosen pro 24 Stunden und höchstens 7 Dosen innerhalb von 7 Tagen empfohlen. Die verschriebene Dosis sollte nicht erhöht werden.
Als Hilfsmittel bei Tests zur Diagnose und Therapie der erektilen Dysfunktion
MUSE kann als Hilfsmittel bei der Prüfung der vaskulären Funktion des Penis mit der Doppler-Duplex-Ultraschallmethode verwendet werden. Es hat sich gezeigt, dass eine MUSE Dosis von 500 ^g eine vergleichbare Wirkung auf die arterielle Dilatation des Penis und die systolische Spitzenflussgeschwindigkeit hat wie eine Injektion von 10 ^g Alprostadil in den Schwellkörper. Nach der Anwendung von MUSE sollte der Patient solange in der Praxis bleiben, bis sich die Erektion zurückgebildet hat.
Ältere Patienten:
Es ist keine Dosisanpassung erforderlich.
4.3 Gegenanzeigen
MUSE ist bei folgenden Patienten kontraindiziert:
- Patienten mit bekannter Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile von MUSE 250, 500, 1000 mikrogramm.
- Patienten mit einer anatomischen Deformation des Penis, wie zum Beispiel Harnröhrenstriktur, schwere Hypospadie, starke Krümmung, Balanitis, akute oder chronische Urethritis, Angulation, kavernöse Fibrose oder Peyronie-Krankheit.
- Patienten mit Zuständen, die sie für das Auftreten eines Priapismus prädisponieren,wie Sichelzellenanämie oder entsprechende Erbanlage, Thrombozythämie, Polyzythämie, multiples Myelom, Leukämie; Neigung zu Venenthrombosen oder mit rezidivierendem Priapismus in der Vorgeschichte.
- Patienten, für die eine sexuelle Aktivität nicht ratsam oder kontraindiziert ist, wie zum Beispiel Männer mit instabilem kardiovaskulärem oder zerebrovaskulärem Zustand.
MUSE ist für Frauen und Kinder kontraindiziert.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Zugrunde liegende, behandelbare medizinische Ursachen der erektilen Dysfunktion sollten vor der Behandlung mit MUSE diagnostiziert und behandelt werden.
Schmerzhafte Erektionen treten eher bei Patienten mit anatomischen Penisdeformationen (wie Angulation, Phimose, kavernöse Fibrose, Peyronie-Krankheit oder Plaques) auf.
Wenn MUSE falsch eingeführt wird, können Abschürfungen der Harnröhrenschleimhaut und geringfügige Harnröhrenblutungen entstehen. Bei Patienten mit hämatogenen Infektionserkrankungen könnte sich dadurch das Risiko einer Übertragung dieser Krankheiten auf ihren Partner erhöhen.
Bei Patienten, die mit Antikoagulanzien behandelt werden oder an einer Gerinnungsstörung leiden, kann das Risiko einer Harnröhrenblutung erhöht sein.
Nach der Gabe von MUSE kann es zu Priapismus (eine länger als 6 Stunden anhaltende Erektion) kommen. Die Behandlung des Priapismus sollte innerhalb von 6 Stunden erfolgen (siehe auch Abschnitt 4.9; Überdosierung). Die Patienten sind darauf hinzuweisen, dass sie jede Erektion, die länger als 4 Stunden anhält, unverzüglich ihrem behandelnden Arzt melden oder - falls dieser nicht verfügbar ist - medizinische Hilfe in Anspruch nehmen. Die Behandlung des Priapismus sollte entsprechend der gängigen medizinischen Praxis erfolgen.
In klinischen Prüfungen mit MUSE wurde selten über Priapismus (steife Erektion > 6 Stunden) in < 0,1 % der Patienten bzw. über verlängerte Erektion (steife Erektion > 4 bis < 6 Stunden) in 0,3 % der Patienten berichtet. Um das Risiko so gering wie möglich zu halten, ist die niedrigste wirksame Dosis zu wählen. Beim Auftreten eines Priapismus kann eine Dosisverringerung oder das Absetzen der Therapie notwendig sein.
Nach der Gabe von MUSE kann es zu peniler Fibrose (wie Angulation, kavernöse Fibrose, Fibroseknötchen und Peyronie-Krankheit) kommen. Mit zunehmender Anwendungsdauer können Fibrosen häufiger auftreten. Zur Feststellung erster Anzeichen einer penilen Fibrose oder Peyronie-Krankheit werden regelmäßige Nachuntersuchungen der Patienten (einschließlich einer sorgfältigen Penisuntersuchung) dringend empfohlen. Bei Patienten, die eine Penisangulation, kavernöse Fibrose oder Peyronie-Krankheit entwickeln, sollte die Behandlung mit MUSE abgesetzt werden.
Bei Patienten, die bereits transitorische ischämische Attacken erlitten haben oder an instabilen kardiovaskulären Erkrankungen leiden, ist bei der Anwendung von MUSE Vorsicht geboten.
MUSE ist nicht für eine gleichzeitige Anwendung mit anderen Mitteln zur Behandlung der erektilen Dysfunktion vorgesehen (siehe auch Abschnitt 4.5).
Bei Patienten mit psychischen Störungen oder Suchtproblemen in der Anamnese ist die Möglichkeit eines Missbrauchs von MUSE in Erwägung zu ziehen.
Sexuelle Stimulation und Geschlechtsverkehr können bei Patienten mit koronarer Herzerkrankung, kongestiver Herzinsuffizienz oder Lungenerkrankung zu einem koronaren oder pulmonalen Ereignis führen. Wenn diese Patienten MUSE anwenden, sollten sie Vorsicht bei ihren sexuellen Aktivitäten walten lassen.
Die Patienten und ihre Partnerinnen/Partner sollten darüber informiert werden, dass MUSE keinen Schutz gegen die Übertragung sexuell übertragbarer Krankheiten bietet. Sie sollten über die Schutzmaßnahmen gegen die Verbreitung sexuell übertragbarer Erreger einschließlich des humanen Immundefizienz-Virus (HIV) beraten werden. MUSE greift Kondome nicht an. Wenn die Partnerin im gebärfähigen Alter ist, wird eine angemessene Kontrazeption empfohlen, weil nach der Anwendung von MUSE in der Samenflüssigkeit außer dem natürlicherweise vorkommenden PGE1 zusätzliche geringe Mengen von Alprostadil enthalten sein können.
Zur Anwendung von MUSE bei Patienten mit Penisimplantaten liegen nur einige Fallberichte aus der Literatur vor. Es können keine Schlüsse hinsichtlich der Unbedenklichkeit und Wirksamkeit dieser Kombination gezogen werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Systemische Wechselwirkungen sind aufgrund der niedrigen Alprostadil-Spiegel im peripheren Venenkreislauf unwahrscheinlich. Medikamente, die die Erektion beeinträchtigen, können jedoch das Ansprechen auf MUSE verringern. Abschwellende Medikamente und Appetitzügler können die Wirkung von MUSE herabsetzen. Bei Patienten, die unter einer Antikoagulanzientherapie stehen oder an Gerinnungsstörungen leiden, kann das Risiko einer Harnröhrenblutung erhöht sein.
Die Auswirkungen einer Kombination von MUSE mit anderen zur Behandlung der erektilen Dysfunktion verwendeten Medikamenten (z. B. Sildenafil) oder Wirkstoffen, die eine Erektion induzieren (z.B. Papaverin) wurden nicht ausreichend untersucht. Es können daher keine Schlüsse hinsichtlich der Unbedenklichkeit und Wirksamkeit dieser Kombinationen gezogen werden.
Sympathomimetika können die Wirkung von Alprostadil herabsetzen. Alprostadil kann die Wirkung von Antihypertensiva, Antikoagulanzien und Thrombozytenaggregationshemmern verstärken.Es liegen keine ausreichenden Erfahrungen mit der gleichzeitigen Anwendung von MUSE und vasoaktiven Substanzen vor. Möglicherweise erhöht diese Kombination die Gefahr des Auftretens hypotensiver Symptome; dies kann bei älteren Patienten häufiger auftreten.
4.6 Fertilität, Schwangerschaft und Stillzeit
Durch MUSE können kleine Mengen Alprostadil zu dem im Samen natürlich vorkommenden PGE1 hinzukommen.
MUSE ist kontraindiziert bei einer bestehenden oder möglichen Schwangerschaft der Partnerin, es sei denn, es wird ein Kondom benutzt, um eine Reizung der Scheide und ein Risiko für den Fetus zu vermeiden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nach Verabreichung von MUSE sollten die Patienten gewarnt werden, Auto zu fahren oder riskante Aufgaben durchzuführen, bei welchen aufgrund von Blutdruckabfall oder Synkope nach der Verabreichung des Medikaments eine Verletzungsgefahr bestehen könnte.
4.8 Nebenwirkungen
Die häufigste nach einer Behandlung mit MUSE gemeldete Nebenwirkung war Penisschmerz. In den meisten Fällen wurde dieser Schmerz als leicht bis mittelstark beschrieben.
Penile Fibrose, einschließlich Winkelbildung, fibrotische Knötchen und Peyronie-Krankheit, wurden insgesamt bei 3% der Patienten in klinischen Prüfungen berichtet.
Die während der Behandlung mit MUSE aufgetretenen Nebenwirkungen sind in der nachstehenden Tabelle aufgeführt. Häufigkeit: Sehr häufig (> 1/10); Häufig (>1/100 bis < 1/10); Gelegentlich (>1/1000 bis <1/100); Selten (>1/10000 bis <1/1000); Sehr selten (< 1/10000); Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Gliederung nach Organsystemen |
Häufigkeit |
Nebenwirkung |
|
Infektionen und parasitäre Erkrankungen |
gelegentlich |
Schnupfen |
|
Störungen des Nervensystems |
häufig |
Kopfschmerzen, Schwindelgefühl |
|
gelegentlich |
Synkope, Präsynkope, Hypästhesie, Hyperästhesie | |
|
Funktionsstörungen der Gefäße |
häufig |
symptomatische Hypotonie, Hämatome |
|
gelegentlich |
Venenerkrankungen, periphere Gefäßkrankheit, Vasodilatation | |
|
Erkrankungen des Gastrointestinaltrakts |
gelegentlich |
Übelkeit |
|
Funktionsstörungen der Haut und des Unterhautzellgewebes |
gelegentlich |
Geschwollene Beine, Erythem, Hyperhydrose, Exanthem, Pruritus, skrotales Erythem |
|
sehr selten |
Urtikaria |
|
Funktionsstörungen des Bewegungsapparates, des Bindegewebes und der Knochen |
häufig |
Muskelkrämpfe |
|
gelegentlich |
Schmerz in den Beinen | |
|
Funktionsstörungen der Nieren und der ableitenden Harnwege |
sehr häufig |
Brennen in der Harnröhre |
|
häufig |
Geringe Harnröhrenblutung | |
|
gelegentlich |
Dysurie, Pollakisurie, Miktionsdrang, urethrale Blutungen | |
|
selten |
Harnwegsinfektionen | |
|
Funktionsstörungen der Fortpflanzungsorgane |
sehr häufig |
Penisschmerz |
|
häufig |
Hodenschmerz, Brennen/ Jucken in der Scheide (bei der Partnerin), verstärkte Erektionen, Peyronie-Krankheit | |
|
gelegentlich |
Schmerz im Perineum, Priapismus, erektile Dysfunktion, Ejakulationsstörungen, Balanitis, schmerzhafte Erektionen, Phimose, skrotale Erkrankungen, skrotales Erythem, Hodenerkrankung, Hodenschwellung, Hodenödem, Hodentumor, Schmerzen im Becken | |
|
selten |
Penile Fibrose | |
|
Untersuchungen |
gelegentlich |
Blutdruckabfall, erhöhte Herzfrequenz, erhöhter Blut-Kreatinin-Spiegel |
Bei ca. 6 % der Partnerinnen von aktiv behandelten Patienten wurde über Brennen/Jucken in der Scheide berichtet. Dies kann eine Folge der Wiederaufnahme des Geschlechtsverkehrs oder der Anwendung von MUSE sein.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz,
Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es liegen keine Berichte über eine Überdosierung von MUSE vor.
Bei einer Überdosierung von Alprostadil können symptomatische Hypotonie, anhaltender Penisschmerz und
in seltenen Fällen Priapismus auftreten. Die Patienten sollten bis zum Abklingen der systemischen oder
lokalen Symptome ärztlich beobachtet werden.
Der Patient sollte angewiesen werden, bei einer vier Stunden oder länger anhaltenden Erektion ärztliche Hilfe
zu suchen. Die folgenden Maßnahmen können getroffen werden:
• Der Patient sollte auf dem Rücken oder auf der Seite liegen und einen Eisbeutel für die Dauer von 2 Minuten abwechselnd auf eine der beiden Innenseiten der Oberschenkel legen (dies kann eine reflektorische Öffnung der Venenklappen bewirken). Falls nach 10 Minuten kein Erfolg dieser Therapie beobachtet werden kann, ist die Behandlung abzusetzen.
• Wenn die oben genannte Behandlung erfolglos ist und eine steife Erektion länger als sechs Stunden besteht, sollte eine Penisaspiration durchgeführt werden. Eine Butterfly-Kanüle (Kaliber 19 - 21) wird unter aseptischen Bedingungen in das Corpus cavernosum eingeführt und 20 - 50 ml Blut aspiriert. Dies kann eine Erschlaffung des Penis bewirken. Falls notwendig, kann der Vorgang auf der anderen Seite des Penis wiederholt werden.
• Wenn auch diese Behandlung erfolglos bleibt, wird die intrakavernöse Injektion eines a-adrenergen Präparates empfohlen. Auch wenn die gewöhnliche Kontraindikation gegen die Injektion eines Vasokonstriktors in den Penis bei der Therapie des Priapismus nicht zutrifft, ist bei diesem Verfahren Vorsicht geboten und eine kontinuierliche Blutdruck- und Pulsmessung sollte erfolgen. Bei Patienten mit koronarer Herzerkrankung, unkontrollierter Hypertonie oder zerebraler Ischämie und bei Patienten, die unter einer MAO-Hemmer-Therapie stehen, ist äußerste Vorsicht geboten. Im letztgenannten Fall sollte die Ausrüstung zur Beherrschung einer hypertensiven Krise vorhanden sein.
• Es sollte eine Phenylephrin-Lösung (200 gg/ml) vorbereitet werden, und 0,5 - 1 ml dieser Lösung sind alle 5 - 10 Minuten zu injizieren. Als Alternative kann eine Adrenalin-Lösung (20 gg/ml) angewendet werden. Falls notwendig, kann danach nochmals Blut durch dieselbe Butterfly-Kanüle aspiriert werden. Die Höchstdosis an Phenylephrin beträgt 1 mg und von Adrenalin 100 gg (5 ml der Lösung).
• Als Alternative kann ferner Metaraminol angewendet werden. Es sollte jedoch beachtet werden, dass über hypertensive Krisen mit tödlichem Ausgang berichtet worden ist. Wenn auch diese Therapie den Priapismus nicht behebt, soll der Patient sofort zur chirurgischen Behandlung überwiesen werden.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mittel bei erektiler Dysfunktion ATC-Code: G04B E01
Alprostadil ist chemisch identisch mit Prostaglandin E1, dessen Wirkungen die Vasodilatation der Blutgefäße im erektilen Gewebe der Corpora cavernosa und die Erhöhung der arteriellen Durchblutung der Corpora cavernosa mit einschließen und demgemäß die Erektion des Penis bewirken.
5.2 Pharmakokinetische Eigenschaften
Nach Verabreichung von MUSE werden ca. 80 % des Alprostadil innerhalb von 10 Minuten durch die Harnröhrenschleimhaut resorbiert. Die Halbwertszeit beträgt < 10 Minuten und die peripheren venösen Plasmakonzentrationen sind niedrig bis nicht nachweisbar. Alprostadil wird schnell metabolisiert, sowohl lokal als auch im Kapillarbett der Lunge. Die Metaboliten werden mit dem Urin (90 % innerhalb von 24 Stunden) und mit den Faeces ausgeschieden. Eine Geweberetention von Alprostadil oder seiner Metabolite ist nicht nachgewiesen worden.
5.3 Präklinische Daten zur Sicherheit
Bei Ratten wurde nach hohen Prostaglandin E1-Dosen eine erhöhte Zahl fetaler Resorptionen festgestellt, was vermutlich auf Stress der Muttertiere beruhte. Hohe Alprostadil-Konzentrationen (400 ^g/ml) hatten keine Wirkungen auf die Motilität oder Lebensfähigkeit menschlicher Spermien in vitro. Bei Kaninchen wurde nach der höchsten untersuchten intravaginalen Dosis von 4 mg keine Schädigung der Feten und keine Wirkung auf die Fortpflanzungsfunktion beobachtet.
Bei der Mehrzahl der in vitro und in vivo Untersuchungen zur Gentoxizität von Alprostadil erhielt man negative Ergebnisse. Dabei handelte es sich um einen Mutagenitätstest an Bakterien (Ames-Test mit Salmonella typhi-murium), die unplanmäßige DNA-Synthese bei primären Rattenhepatozyten, den HPRT-Genmutationstest an Ovarialzellen des chinesischen Hamsters, den alkalischen Elutions-Test, den Schwesterchromatidaustausch-Test (alle in vitro Tests) sowie den Mikronukleustest bei Maus und Ratte (in vivo Tests).
In zwei weiteren in vitro-Untersuchungen, dem Maus-Lymphom-Vorwärtsmutationstest und dem Chromosomenaberrations-Test an Ovarialzellen des chinesischen Hamsters, ergaben sich mit Alprostadil grenzwertig positive bzw. positive Ergebnisse hinsichtlich einer Chromosomenschädigung.
Im Hinblick auf die Vielzahl negativer Ergebnisse und das Fehlen von Hinweisen auf Gentoxizität
bei zwei in vivo Tests ist es zweifelhaft, ob den positiven Befunden in den beiden letztgenannten in vitro
Untersuchungen eine relevante biologische Bedeutung zukommt.
Insgesamt ist das Risiko einer genotoxischen Wirkung beim Menschen nach den vorliegenden Erkenntnissen nicht vollständig auszuschließen.
6. Pharmazeutische Angaben 6.1 Liste der sonstigen Bestandteile
Macrogol 1450
6.2 Inkompatibilitäten
Keine bekannt.
6.3 Dauer der Haltbarkeit
MUSE 250 mikrogramm: 18 Monate
MUSE 500 mikrogramm und MUSE 1000 mikrogramm: 2 Jahre
Nach Öffnung des Folienbeutels sollte, aus mikrobiologischen Gründen, das Produkt unmittelbar verwendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank bei 2° C - 8° C aufbewahren. Im Originalbehältnis aufbewahren.
Die ungeöffneten Folienbeutel können von den Patienten vor der Anwendung maximal 14 Tage lang bei Raumtemperatur (< 30°C) aufbewahrt werden.
6.5 Art und Inhalt des Behältnisses
MUSE ist in Packungen mit 1, 2, 3, 6 und 10 Folienbeuteln, die jeweils ein Applikatorsystem enthalten, erhältlich.
Die Beutel bestehen aus Aluminium-Verbundfolie und die Applikationen aus strahlenresistentem Polypropylen.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7.
MEDA Pharma GmbH & Co. KG Benzstraße 1 61352 Bad Homburg Tel. 06172 / 888 - 01 Fax: 06172 / 888 - 2740
MUSE 250 ^g MUSE 500 ^g MUSE 1000 ^g
44802.01.00
44802.02.00
44802.03.00
9.
MUSE 250 ^g MUSE 500 ^g MUSE 1000 ^g
22.02.1999 / 25.11.2002
22.02.1999 / 25.11.2002
22.02.1999 / 25.11.2002
Stand der Information Oktober 2013 Verkaufsabgrenzung Verschreibungspflichtig
Seite 8