Natil-N 5Mg
Fachinformation
1. Bezeichnung der Arzneimittel
Natil®-N 5 mg Natil®-N 10 mg
2. Qualitative und quantitative Zusammensetzung
1 Hartkapsel Natil-N® 5 mg enthält 5,9 mg Flunarizindihydrochlorid, entsprechend 5 mg Flunarizin.
1 Hartkapsel Natil-N® 10 mg enthält 11,8 mg Flunarizindihydrochlorid, entsprechend 10 mg Flunarizin.
Sonstige Bestandteile:
Natil-N® 5 mg: Lactose-Monohydrat, Azorubin (E 122)
Natil-N® 10 mg: Lactose-Monohydrat
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform Hartkapsel
Natil-N® 5 mg: rote Hartkapseln Natil-N® 10 mg: weiße Hartkapseln
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Prophylaxe bei diagnostisch abgeklärter Migräne mit oder ohne Aura bei Patienten mit häufigen und/oder schweren Migräneanfällen.
Zur symptomatischen Behandlung von fachärztlich abgeklärtem vestibulärem Schwindel infolge von anhaltenden Funktionsstörungen des Gleichgewichtsapparates (Vestibularapparates).
4.2 Dosierung, Art und Dauer der Anwendung
1. Zur Prophylaxe von Vasospasmen bei Migräneanfällen:
Anfangsdosis
bei Patienten unter 65 Jahren: 10 mg Flunarizin
(= Natil®-N 5 mg 2 Hartkapseln bzw. Natil-N 10 mg 1 Hartkapsel) am Abend verabreichen
bei Patienten über 65 Jahren: 5 mg Flunarizin
(= 1 Natil®-N 5 mg Hartkapsel) abends verabreichen
Erhaltungsdosis
Spricht der Patient auf die Behandlung an und ist die Weiterbehandlung erforderlich, sollte die Tagesdosis reduziert werden, indem der Patient Flunarizin nur jeden 2. Tag einnimmt oder der Patient 5 Tage Flunarizin einnimmt mit 2 darauffolgenden behandlungsfreien Tagen.
Die angegebenen Tagesdosen sind nicht zu überschreiten.
2. Zur symptomatischen Behandlung vestibulären Schwindels:
Es gelten die gleichen Dosierungsrichtlinien wie zur Prophylaxe von Vasospasmen bei Migräneanfällen.
Art und Dauer der Anwendung
Die Anfangsdosis sollte nicht länger verabreicht werden als dies zur Symptomlinderung notwendig ist (üblicherweise nicht länger als 2 Monate).
Ist nach 1 Monat der Behandlung eines chronischen vestibulären Schwindels oder nach 2 Monaten der Behandlung eines paroxysmalen Schwindels kein wesentlicher therapeutischer Nutzen erkennbar, ist der Patient als Non-Responder anzusehen und die Behandlung mit Flunarizin zu beenden.
Sollten während der Behandlung depressive Verstimmungen, extrapyramidale Symptome oder andere schwerwiegende Nebenwirkungen auftreten, ist die Behandlung mit Flunarizin zu beenden.
Lässt während der Behandlung der therapeutische Effekt nach, ist die Behandlung mit Flunarizin abzubrechen.
Selbst wenn die prophylaktische Weiterbehandlung erfolgreich und gut vertragen wurde, sollte die Behandlung spätestens nach 6 Monaten beendet werden und nur bei Rückkehr der behandelten Symptome wieder eingesetzt werden.
4.3 Gegenanzeigen
Natil®-N 5 mg und 10 mg dürfen nicht angewendet werden
- bei bekannter Überempfindlichkeit gegen den Wirkstoff, Azorubin (Natil®-N 5 mg) oder einen der sonstigen Bestandteile
- bei Patienten mit Morbus-Parkinson sowie in der Vorgeschichte aufgetretenen Störungen des extrapyramidalen Systems (siehe Nebenwirkungen)
- und aus der Vorgeschichte bekannten depressiven Syndromen (siehe Nebenwirkungen).
Wegen unzureichender Erfahrungen ist die Anwendung von Flunarizin bei Kindern auszuschließen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
In seltenen Fällen kann die aufgetretene Müdigkeit während der Behandlung mit Flunarizin ständig weiter zunehmen. In diesen Fällen ist die Behandlung mit Flunarizin abzubrechen.
Die Patienten sind aufzufordern, in regelmäßigen Zeitabständen zur Untersuchung zu erscheinen, damit extrapyramidale und depressive Symptome frühzeitig erkannt und die Behandlung rechtzeitig abgebrochen werden kann.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Natil®-N 5 mg / Natil®-N 10 mg nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei gleichzeitiger Einnahme mit Alkohol, Schlafmitteln oder anderen Beruhigungsmitteln (Tranquilizer) kann die sedierende Wirkung von Flunarizin verstärkt werden.
Bei gleichzeitiger Anwendung von Arzneimitteln gegen Krampfanfälle (Antikonvulsiva) kann die Verstoffwechselung von Flunarizin beschleunigt sein.
Interaktionen mit Beta-Rezeptorenblockern wurden nicht beobachtet. Berichte über weitere Interaktionen liegen nicht vor.
4.6 Schwangerschaft und Stillzeit
Da bisher darüber keine Erfahrungen beim Menschen vorliegen, ist während der Schwangerschaft der Nutzen einer Behandlung gegen die möglichen Risiken sorgfältig abzuwägen.
Eine Anwendung in der Stillzeit sollte unterbleiben, da der Wirkstoff in die Muttermilch übergeht und die möglichen Auswirkungen auf den Säugling nicht bekannt sind.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Besonders zu Beginn der Behandlung kann durch die auftretende Schläfrigkeit auch bei bestimmungsgemäßem Gebrauch von Natil®-N 5 mg und 10 mg das Reaktionsvermögen so weit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis <1/10)
(> 1/1.000 bis <1/100)
(> 1/10.000 bis <1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Sehr häufig treten, im Allgemeinen vorübergehend, Benommenheit und/oder Müdigkeit sowie Gewichtszunahme mit oder ohne erhöhten Appetit auf.
Während der Langzeitbehandlung traten folgende schwerwiegende Nebenwirkungen auf:
- depressive Verstimmungen, insbesondere bei Frauen mit Depression in der Vorgeschichte;
- Störungen der unwillkürlichen Bewegungsabläufe (extrapyramidal-motorische Symptome) wie verlangsamter Bewegungsablauf (Bradykinesie), Erhöhung der Muskelspannung (Rigidität), Zittern (Tremor), Störung im Gesichts- und Mundbereich (orofaziale Dyskinesie) und Bewegungsarmut (Akinesie) sowie die Unfähigkeit sitzen zu bleiben, verknüpft mit quälend erlebter Unruhe (Akathisie), die bevorzugt bei älteren Patienten beobachtet wurden.
Gelegentlich wurden gastrointestinale Nebenwirkungen wie Sodbrennen, Übelkeit, Magenschmerzen und zentralnervöse Nebenwirkungen wie Schlaflosigkeit, Angstzustände sowie Kopfschmerzen und Asthenie (allgemeine Schwäche) berichtet.
Darüber hinaus wurde sehr selten von einer Absonderung milchiger Flüssigkeit aus der Brust (Galaktorrhöe) - insbesondere wurde dies bei Frauen beobachtet, die gleichzeitig orale Kontrazeptiva einnahmen - Mundtrockenheit, Muskelschmerzen und Hautrötung berichtet.
Azorubin (Natil®-N 5 mg) kann allergische Reaktionen hervorrufen.
4.9 Überdosierung
Es wurde von einigen wenigen Fällen akuter Überdosierung nach Einnahme von bis zu 600 mg Flunarizin berichtet.
a) Symptome einer Überdosierung
Aufgrund der pharmakologischen Eigenschaften sind Sedierung und Asthenie zu erwarten. Beobachtete Symptome bei Überdosierungen äußern sich in Verstärkung der zentralnervösen Symptome (siehe Nebenwirkungen) wie Müdigkeit, Asthenie sowie Tremor, Agitation und Tachykardie.
b) Therapiemaßnahmen bei Überdosierung Es ist kein spezifisches Antidot bekannt.
Es gelten die allgemein üblichen Behandlungsrichtlinien für Intoxikationen wie induziertes Erbrechen und/oder Magenspülung, die Verabreichung von Aktivkohle und andere unterstützende Maßnahmen.
Flunarizin ist nicht dialysierbar (hohe Gewebsbindung, Plasmaeiweißbindung liegt über 90 %).
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antivertiginosa ATC-Code: N07CA03
Flunarizin ist ein difluoriertes Derivat von Piperazin.
Der präzise Wirkmechanismus von Flunarizin auf biochemischer Ebene sowie seine Rezeptorenspezifität und -affinität sind bislang nicht definitiv geklärt worden.
In verschiedenen pharmakologischen Tiermodellen wurde gezeigt, dass Flunarizin den stimulierten transmembranösen Einstrom von Calciumionen ins Zellinnere, insbesondere in die Muskelzellen der glatten Gefäßmuskulatur, hemmen kann. Flunarizin gehört zu den Calciumantagonisten der Klasse IV nach WHO-Definition.
Durch diesen Mechanismus lässt sich möglicherweise die Reduzierung der experimentell induzierten Vasokonstriktion erklären. Der Umfang der Hemmung des Calciumeinstroms war abhängig vom Gefäßursprung, Art des angewendeten Stimulus und Tierspezies.
Es kann angenommen werden, dass Flunarizin beim Menschen unter pathologischen Bedingungen, die mit vermehrtem Einstrom von Calciumionen einhergehen, einen spasmolytischen Effekt an der Gefäßwand zeigen kann, der u. U. von klinischer Bedeutung sein könnte.
Hinsichtlich des Wirkungsmechanismus von Flunarizin auf die vestibulären Funktionen wurden aufgrund tierexperimenteller klinischer Untersuchungsergebnisse zahlreiche Hypothesen in Betracht gezogen.
Neben den calciumantagonistischen zeigte Flunarizin tierexperimentell antihistaminische, antikonvulsive und antiarrhythmische Eigenschaften, deren klinische Relevanz bislang nicht bekannt ist.
5.2 Pharmakokinetische Eigenschaften
Maximale Plasmakonzentrationen von Flunarizin werden 2 - 4 Stunden nach oraler Gabe erreicht. Die Plasmaspiegel von Flunarizin sind durch eine hohe Variabilität gekennzeichnet. Im steady-state, der nach 5 - 6 Wochen erreicht wird, liegen die Plasmaspiegel in einem Bereich zwischen 39 und 115 ng/ml.
Das Verteilungsvolumen beträgt 43,2 l/kg. Flunarizin ist zu mehr als 90 % an Plasmaproteine gebunden. Der Wirkstoff unterliegt einem hohen First-pass-effekt.
Die Metabolisierungswege wurden beim Menschen nicht untersucht. Im Tierversuch ergaben sich als wesentliche metabolische Abbauwege die oxydative N-Dealkylierung, die aromatische Hydroxylierung sowie Glukuronidierung.
Die Eliminationswege sind beim Menschen nicht bekannt. Im Tierversuch wurden 40 % - 80 % einer Dosis biliär ausgeschieden; unverändertes Flunarizin fand sich bis 0,1 % im Urin. Die Pharmakokinetik bei Patienten mit Funktionsstörungen der Leber und Nieren wurde beim Menschen nicht untersucht.
Die Eliminationshalbwertszeit liegt beim Menschen bei etwa 18 Tagen.
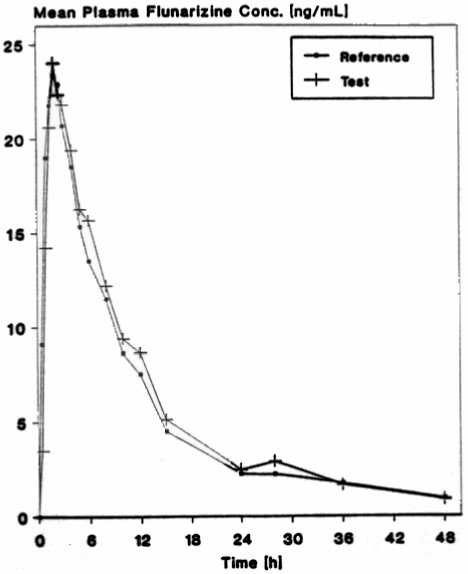
Bioverfügbarkeit
Eine im Jahr 1993 durchgeführte Bioverfügbarkeitsuntersuchung an 18 Probanden ergab im Vergleich zum Referenzpräparat:
Testpräparat
Referenzpräparat
maximale Plasmakonzentration
(Cmax):ng/ml
25,9 ± 10,7
25,4 ± 5,95
Zeitpunkt der maximalen Plasmakonzentration
(tmax):h
2,5
Fläche unter der Konzentrations-ZeitKurve
(AUC):ng-h/ml
287,9 ± 163,5
269,2 ± 118,8
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Die mittlere orale LD50 lag bei den untersuchten Spezies Maus, Ratte, Meerschweinchen oberhalb 250 mg/kg.
Überdosierungserscheinungen waren hauptsächlich zentralnervösen Ursprungs (z. B. Ptose, Ataxie, Sedierung, Tremor, Krämpfe).
b) Chronische Toxizität / Subchronische Toxizität
Chronische Toxizitätsuntersuchungen wurden an Ratten über 3, 6, 12 und 18 Monate, an Hunden über 3 und 12 Monate durchgeführt. In Untersuchungen mit hoher Dosierung wurden beim Hund Veränderungen der Gingiva, bei der Ratte Missbildungen der Schneidezähne, Veränderungen an der Leber und der Lunge beobachtet.
c) Mutagenes und tumorerzeugendes Potential
Ausreichende Mutagenitätsuntersuchungen ergaben keine Hinweise auf mutagene Wirkungen für Flunarizin.
Aus Langzeituntersuchungen an Maus und Ratte ergaben sich keine Hinweise auf primäre tumorerzeugende Eigenschaften von Flunarizin.
d) Reproduktionstoxizität
Hinweise auf eine Beeinflussung der Fertilität ergaben sich erst im für Elterntiere (Ratte) toxischen Dosisbereich. Weder bei Ratten noch bei Kaninchen wurden spezielle teratogene Effekte beobachtet. Im maternaltoxischen Dosisbereich zeigten sich embryoletale Wirkungen bei Kaninchen ab einer Dosis von 10 mg/kg KG, bei Ratten ab 40 mg/kg KG.
Fetoletale Wirkungen und eine verminderte Überlebensrate der Jungtiere fanden sich bei Ratten nach Verabreichung von 40 mg/kg KG während der Spätträchtigkeit und der Laktation. Flunarizin/Metabolite gehen in geringer Konzentration durch die Plazenta auf die Embryo/Feten über. Bei Hunden wurden hohe Konzentrationen in der Muttermilch nachgewiesen.
6. Pharmazeutische Angaben 6.1. Liste der sonstigen Bestandteile
Natil®-N 5 mg:
Lactose-Monohydrat, Maisquellstärke, Talkum, Magnesiumstearat (Ph.Eur.), Hartkapselhülle: Gelatine, gereinigtes Wasser, Chinolingelb (E 104), Azorubin (E 122), Titandioxid (E 171)
Natil®-N 10 mg:
Lactose-Monohydrat, Maisquellstärke, Talkum, Magnesiumstearat (Ph.Eur.), Hartkapselhülle: Gelatine, gereinigtes Wasser, Titandioxid (E 171)
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit 42 Monate
6.3 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
PVC/Aluminium-Blisterpackungen
Packungen zu 20 (N1), 50 (N2) und 100 (N3) Hartkapseln
6.6 Besondere Vorsichtsmaßnahme für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Hormosan Pharma GmbH Wilhelmshöher Str. 106 60389 Frankfurt/M
Telefon: 0 69 47 87 3-0 / Telefax: 0 69 47 87 3-16 www.hormosan.de / info@hormosan.de
8. Zulassungsnummer:
Natil®-N 5 mg: 10140.01.00 Natil®-N 10 mg: 10140.00.00
9. Datum der Zulassungen/ Verlängerung der Zulassungen 26.07.2000
10. Stand der Information
Dezember 2007
11. Verkaufsabgrenzung Verschreibungspflichtig