Natriumchlorid Mallinckrodt 9 Mg/Ml Injektionslösung In Fertigspritze
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Natriumchlorid Mallinckrodt 9 mg/ml Injektionslösung in Fertigspritze
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml enthält 9 mg Natriumchlorid, entsprechend 0,154 mmol Na+ und 0,154 mmol Cl-. Jede Spritze zu 50 ml enthält 7,7 mmol (entsprechend 177 mg) Natrium.
Jede Spritze zu 125 ml enthält 19,3 mmol (entsprechend 443 mg) Natrium.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung in Fertigspritze
Sterile, nicht-pyrogene, klare, farb- und geruchlose wässrige Lösung pH-Wert: 4,5-7,0
Theoretische Osmolarität: 308 mOsm/l
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Dieses Arzneimittel ist ein Diagnostikum.
Natriumchlorid Mallinckrodt wird für das Einspülen kompatibler Kontrastmittel über eine Verweilkanüle angewendet.
4.2 Dosierung und Art der Anwendung
Dosierung
Erwachsene
Das Volumen der Natriumchlorid-Spüllösung sollte auf individueller Basis bestimmt werden, auch auf Grundlage des Bildgebungsverfahrens, des Orts des Gefäßzugangs, der Länge der Schlauchverbindung zwischen dem Injektor und dem Gefäßzugang.
Die Infusionsgeschwindigkeit und Spülvolumina sollten bei jedem Patienten auch individuell auf Basis von Körpergewicht, Flüssigkeitsstatus und Begleiterkrankungen gewählt werden.
Das typische Volumen der Natriumchlorid-Spüllösung nach Kontrastmittelgabe bei Erwachsenen liegt bei 10 bis 60 ml je Injektion mit einer Geschwindigkeit von nicht mehr als 10 ml/Sek.
Bestimmte Injektoren gestatten eine zusätzliche Infusion von Natriumchlorid Mallinckrodt, um den Gefäßzugang durchgängig zu halten. Zu diesem Zweck werden typischerweise Infusionsgeschwindigkeiten im Bereich von 0,5 bis 1 ml pro Minute gewählt.
Kinder und Jugendliche
Natriumchlorid Mallinckrodt wird nicht empfohlen für Kinder und Jugendliche bis 18 Jahre, da nicht genügend Daten zur Sicherheit und Wirksamkeit vorliegen.
Art der Anwendung
Intravenöse oder intraarterielle Anwendung.
• Spritze zu 50 ml: zur manuellen Anwendung oder Anwendung mit Injektor;
• Spritze zu 125 ml: zur Anwendung mit Injektor.
Anwendung mit einem Injektor:
Vor Anwendung des Arzneimittels mit einem Injektor muss durch den Hersteller des Medizinproduktes nachgewiesen sein, dass das System für den zweckmäßigen Gebrauch der Fertigspritze geeignet ist. Jeder zusätzliche Gebrauchshinweis des Herstellers eines solchen Injektors sollte streng beachtet werden.
4.3 Gegenanzeigen
Keine bekannt.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Luftembolie
Vor der Injektion sämtliche Luft aus der Spritze und den angeschlossenen Schläuchen entfernen, um einen Luftembolus und das damit verbundene Risiko eines Schlaganfalls, einer Organischämie und/oder -infarzierung und des Todes zu vermeiden.
Flüssigkeitsüberladung
Natriumchlorid Mallinckrodt sollte bei Patienten mit Stauungsinsuffizienz, schwerer Niereninsuffizienz sowie bei Vorliegen von klinischen Zuständen mit Ödemen, Natriumretention, Hypernatriämie oder -chlorämie nur sehr vorsichtig angewendet werden, wenn überhaupt.
Bei der Beurteilung der Frage, ob die Anwendung von Natriumchlorid Mallinckrodt vertretbar ist, sollten Alter, Körpergewicht, Flüssigkeitsstatus und etwaige Begleiterkrankungen jedes Patienten sowie das geplante radiologische Verfahren berücksichtigt werden.
Extravasation
Im Fall einer Extravasation von physiologischer Natriumchloridlösung kann es zu einer mechanischen Kompression neurovaskulärer Strukturen kommen. Vor der Anwendung von Natriumchlorid Mallinckrodt muss die Durchgängigkeit des intravaskulären Zugangs sichergestellt werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Natriumchlorid Mallinckrodt bei Kindern und Jugendlichen bis 18 Jahre sind nicht erwiesen.
Ältere Patienten
Die Dosis für ältere Patienten sollte generell vorsichtig gewählt werden, wobei üblicherweise am unteren Ende des Dosisbereichs begonnen wird, um der größeren Häufigkeit einer beeinträchtigten Leber-, Nieren- oder Herzfunktion sowie von Begleiterkrankungen oder Begleitmedikationen in dieser Patientengruppe Rechnung zu tragen.
Besonderer Warnhinweis
Dieses Arzneimittel enthält 0,154 mmol (oder 9 mg) Natrium pro ml.
Für Dosen bis zu 6,5 ml
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg), d. h., es ist nahezu „natriumfrei“.
Für Dosen über 6,5 ml
Dies ist bei Patienten unter kochsalzarmer Diät zu berücksichtigen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Natriumchlorid Mallinckrodt bei Schwangeren vor. Aus Vorsichtsgründen soll eine Anwendung von Natriumchlorid Mallinckrodt während der Schwangerschaft vermieden werden. Röntgenuntersuchungen, die bei schwangeren Frauen durchgeführt werden, schließen auch eine Strahlenbelastung beim ungeborenen Kind ein. Nur erforderliche Untersuchungen sollten während der Schwangerschaft durchgeführt werden, wenn der Nutzen eindeutig das Risiko für die Mutter und das ungeborene Kind überwiegt.
Stillzeit
Natriumchlorid wird in die Muttermilch ausgeschieden, bei Anwendung therapeutischer Dosen von Natriumchlorid Mallinckrodt sind jedoch keine Auswirkungen auf gestillte Neugeborene/Kinder zu erwarten.
Fertilität
Es sind keine Studien verfügbar. Keine Wirkungen sind zu erwarten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Natriumchlorid Mallinckrodt hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Die Verabreichungstechnik kann zu Reaktionen führen, darunter Infektion an der Injektionsstelle, eine von der Injektionsstelle ausgehende Venenthrombose oder Phlebitis, Extravasation.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: Sehr häufig (>1/10)
Häufig (>1/100, <1/10)
Gelegentlich (>1/1.000, <1/100)
Selten (>1/10.000, <1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Gefäßerkrankungen:
Nicht bekannt Venenthrombose; Phlebitis
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Nicht bekannt Infektion an der Injektionsstelle; Extravasation
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Die Anwendung von Natriumchlorid Mallinckrodt kann mit dem Risiko einer Überdosierung verbunden sein, die sich in Form von Elektrolytstörungen und/oder Flüssigkeitsüberladung äußert, vor allem bei Patienten mit beeinträchtigter Nieren- oder Herzfunktion. Sollte ein derartiges Ereignis auftreten, muss die Infusion beendet, der Patient erneut untersucht und eine geeignete korrektive Maßnahme eingeleitet werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lösungs- und Verdünnungsmittel, inkl. Spüllösungen ATC-Code: V07AB
Natrium ist das primäre Kation im extrazellulären Raum und reguliert zusammen mit verschiedenen Anionen dessen Größe. Natrium und Kalium sind die wichtigsten Mediatoren der bioelektrischen Prozesse im Körper. Der Natriumgehalt und der Flüssigkeitshaushalt des Körpers sind eng aneinander gekoppelt. Jegliche Abweichung von der physiologischen Natriumkonzentration im Plasma beeinflusst gleichzeitig den Flüssigkeitsstatus des Körpers. Ein Anstieg des Natriumgehalts des Körpers geht auch mit einer Verminderung des Gehaltes an freiem Wasser im Körper unabhängig von der Serumosmolalität einher.
5.2 Pharmakokinetische Eigenschaften
Eine 0,9-%-Natriumchloridlösung besitzt die gleiche Osmolarität wie Plasma. Die Anwendung dieser Lösung führt primär zu einer Auffüllung des Interstitiums, was etwa 2/3 des gesamten extrazellulären Raums ausmacht. Nur 1/3 des angewendeten Volumens verbleibt im intravaskulären Raum. Die Lösung verfügt daher über eine kurzzeitige hämodynamische Wirkung.
Der Natriumgehalt des Körpers beläuft sich insgesamt auf etwa 80 mmol/kg, bei rund 97 % handelt es sich um extrazelluläres und bei etwa 3 % um intrazelluläres Natrium. Der tägliche Umsatz liegt bei rund 100-180 mmol (entspricht 1,5-2,5 mmol/kg Körpergewicht). Im Wesentlichen sind die Nieren für die Regulation der Natrium- und Flüssigkeitsbilanz verantwortlich, in Zusammenarbeit mit den Hormonkontrollmechanismen, dem Renin-Angiotensin-Aldosteron-System, dem antidiuretischen Hormon und dem natriuretischen Hormon.
5.3 Präklinische Daten zur Sicherheit
Außer den bereits in anderen Abschnitten der Zusammenfassung der Merkmale des Arzneimittels beschriebenen Daten liegen keine weiteren präklinischen Daten vor, die für den Verschreibenden relevant sind.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Bei der Mischung mit anderen Arzneimitteln ist auf mögliche Inkompatibilitäten zu achten.
6.3 Dauer der Haltbarkeit
3 Jahre
Nach der Anwendung die restliche Lösung verwerfen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht einfrieren.
Die Lösung ist zu verwerfen, wenn sie Verfärbungen oder Partikel aufweist.
6.5 Art und Inhalt des Behältnisses
Natriumchlorid Mallinckrodt ist als Fertigspritze (Polypropylen) mit Spitzenkappe und Kolben (Naturkautschuk) erhältlich.
Packungsgrößen:
Fertigspritzen:
1 x 50 ml und 10 x 50 ml
1 x 125 ml und 10 x 125 ml
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Fertigspritzen:
Die Außenseite der Spritze ist nicht steril.
Die Spritze visuell auf Undichtigkeit überprüfen. Die Spritze darf bei Undichtigkeit nicht verwendet werden.
Anwendung der Fertigspritze (50 ml), manuelle Anwendung und Anwendung mit Injektor:
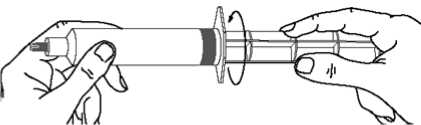

Nachdem die Kolbenstange in den Spritzenkolben geschraubt wurde, muss die Kolbenstange nochmals um eine halbe Umdrehung gedreht werden, sodass der blaue Kolben frei
rotiert._
Vor der Anwendung der Spritze die blaue Spitzenkappe abdrehen und entsorgen. Die Spritze kann nun an die Nadel oder das Infusionsbesteck angeschlossen werden.
Anwendung der Fertigspritze (125 ml) mit einem Injektor:
|
CT |
Spritze in den Adapter einsetzen. Um die blaue Spitzenkappe von der Spritze zu entfernen, diese hineindrücken und abdrehen, dann verwerfen. Der Bereich unter der Kappe ist steril. Bei der weiteren Handhabung ist daher vorsichtig vorzugehen. |
|
Anschließend Kappe von der Luer-Locknut-Staubabdeckung abdrehen und Originalitätsversiegelung brechen. Kappe entsorgen. Mit der Staubabdeckung den Luer-Adapter bis zum Anschlag auf die Spritze aufschrauben. Staubabdeckung erst entfernen und entsorgen, wenn der Anschluss der sterilen Schlauchverbindung unmittelbar bevorsteht. |
Nur zur einmaligen Anwendung. Spritze und nicht verwendete Lösung nach der Anwendung verwerfen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Luftembolie
Vor der Injektion sämtliche Luft aus der Spritze und der Schlauchverbindung entfernen, um einen Luftembolus und das damit verbundene Risiko eines Schlaganfalls, einer Organischämie und/oder -infarzierung und des Todes zu vermeiden.
7. INHABER DER ZULASSUNG
Mallinckrodt Deutschland GmbH Josef-Dietzgen-Str. 1 53773 Hennef Deutschland
8. ZULASSUNGSNUMMER
85569.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
23.04.2015
10. STAND DER INFORMATION
03/2015