Nifehexal 60Mg Uno
Fachinformation
1. BEZEICHNUNG DER ARZNEIMITTEL
NifeHEXAL® 30 mg uno, Retardtabletten NifeHEXAL® 60 mg uno, Retardtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
NifeHEXAL 30 mg uno 1 Retardtablette enthält 30 mg Nifedipin.
NifeHEXAL 60 mg uno 1 Retardtablette enthält 60 mg Nifedipin.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
NifeHEXAL 30 mg uno
Grau-rosa Retardtabletten, die auf einer Seite mit „30" gekennzeichnet sind. NifeHEXAL 60 mg uno
Rot-braune Retardtabletten, die auf einer Seite mit mit „60" gekennzeichnet sind.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Essentielle Hypertonie
4.2 Dosierung und Art der Anwendung Dosierung
Die Behandlung soll möglichst individuell nach dem Schweregrad der Erkrankung und dem Ansprechen des Patienten durchgeführt werden.
In Abhängigkeit vom jeweiligen Krankheitsbild sollte die Richtdosis einschleichend erreicht werden.
Soweit nicht anders verordnet gelten die folgenden Dosierungsangaben für Erwachsene:
1-mal täglich 1 Retardtablette NifeHEXAL 30 mg uno (1-mal täglich 30 mg Nifedipin) bis 1-mal täglich 1 Retardtablette NifeHEXAL 60 mg uno (1-mal täglich 60 mg Nifedipin).
Im Allgemeinen sollte mit einer Tagesdosis von 30 mg Nifedipin begonnen werden. In Abhängigkeit vom Schweregrad der Erkrankung und dem Ansprechen des Patienten kann die Tagesdosis stufenweise bis auf 60 mg Nifedipin erhöht werden; in diesem Fall ist vorzugsweise auf die stärkere Darreichungsform überzugehen.
Patienten mit schwerer zerebrovaskulärer Erkrankung sollten mit einer niedrigen Dosis behandelt werden.
Bei der gleichzeitigen Gabe von Mitteln, die das Cytochrom P450 3A4-System hemmen oder induzieren, kann es erforderlich sein, die Nifedipin-Dosis anzupassen oder gegebenenfalls ganz auf die Anwendung von Nifedipin zu verzichten (siehe Abschnitt 4.5).
Zusätzliche Informationen zu bestimmten Patientengruppen Kinder und Jugendliche
Wirksamkeit und Unbedenklichkeit von Nifedipin bei Kindern und Jugendlichen unter 18 Jahren wurden nicht untersucht. Derzeit verfügbare Daten zur Anwendung von Nifedipin bei Hypertonie werden in Abschnitt 5.1 beschrieben.
Ältere Patienten
Die Pharmakokinetik von NifeHEXAL uno ist bei älteren Menschen verändert, so dass geringere Erhaltungsdosen Nifedipin erforderlich sein können als bei jüngeren Patienten.
Patienten mit eingeschränkter Leberfunktion
Patienten mit eingeschränkter Leberfunktion sollten sorgfältig überwacht werden; gegebenenfalls kann in schweren Fällen eine Dosisreduktion erforderlich sein.
Patienten mit eingeschränkter Nierenfunktion
Ausgehend von den pharmakokinetischen Daten ist bei Patienten mit eingeschränkter Nierenfunktion keine Dosisanpassung notwendig (siehe Abschnitt 5.1).
Art der Anwendung
In der Regel wird NifeHEXAL uno unabhängig von den Mahlzeiten unzerkaut mit ausreichend Flüssigkeit (z. B. 1 Glas Wasser) eingenommen.
NifeHEXAL uno darf nicht mit Grapefruitsaft eingenommen werden (siehe Abschnitt 4.5).
Die Retardtabletten sollten in 24-stündigem Abstand eingenommen werden, d. h. immer zu derselben Tageszeit, vorzugsweise 1/2 Stunde vor dem Frühstück.
Gleichzeitige Nahrungsaufnahme kann zu einer verzögerten, jedoch nicht verminderten Resorption führen.
Nach Einnahme von NifeHEXAL uno unmittelbar im Anschluss an eine fettreiche Mahlzeit, kann es zu erhöhten maximalen Plasmakonzentrationen kommen.
Um eine lang andauernde Wirkung zu gewährleisten und um erhöhte maximale Plasmakonzentrationen zu vermeiden, sind die NifeHEXAL uno Retardtabletten unbedingt ungeteilt und unzerkaut einzunehmen.
Die Dauer der Behandlung bestimmt der behandelnde Arzt.
4.3 Gegenanzeigen
Nifedipin darf nicht angewendet werden bei
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Herz-Kreislauf-Schock
• höhergradiger Aortenstenose
• instabiler Angina pectoris
• akutem Myokardinfarkt (innerhalb der ersten 4 Wochen)
• gleichzeitiger Anwendung mit Rifampicin (siehe Abschnitt 4.5), in der Schwangerschaft vor der 20. Woche und in der Stillzeit (siehe Abschnitt 4.6).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei
• Patienten mit sehr niedrigem Blutdruck (schwerer Hypotension mit weniger als 90 mmHg systolisch), bei manifestem Herzversagen und bei schwerer Aortenstenose.
• dekompensierter Herzinsuffizienz
• Dialysepatienten mit maligner Hypertonie und Hypovolämie (ein deutlicher Blutdruckabfall durch Vasodilatation kann entstehen)
• Schwangerschaft (siehe Abschnitt 4.3 und 4.6).
Patienten mit eingeschränkter Leberfunktion sollten sorgfältig überwacht werden. In schweren Fällen kann eine Dosisverringerung erforderlich sein.
Nifedipin wird über das Cytochrom P450 3A4-System metabolisiert. Daher können Wirkstoffe, von denen bekannt ist, dass sie dieses Enzymsystem beeinflussen, den First-Pass-Metabolismus oder die Ausscheidung von Nifedipin verändern (siehe Abschnitt 4.5).
Die Plasmaspiegel von Nifedipin können z. B. durch folgende Arzneimittel, die als Inhibitoren dieses Enzymsystems bekannt sind, erhöht werden:
• Makrolid-Antibiotika (z. B. Erythromycin)
• Anti-HIV-Arzneimittel, Proteaseinhibitoren (z. B. Ritonavir)
• Antimykotika vom Imidazol-Typ (z. B. Ketoconazol)
• Antidepressiva (Nefazodon und Fluoxetin)
• Quinupristin / Dalfopristin
• Valproinsäure
• Cimetidin
Wenn NifeHEXAL uno gleichzeitig mit einem dieser Arzneimittel angewendet wird, sollte der Blutdruck überwacht werden und, falls erforderlich, eine Verringerung der Nifedipin-Dosis in Betracht gezogen werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten NifeHEXAL uno nicht einnehmen.
Zur Anwendung bei besonderen Patientengruppen, siehe Abschnitt 4.2.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Arzneimittel, die Nifedipin beeinflussen
Nifedipin wird über das Cytochrom P450 3A4-System metabolisiert. Daher kann die gleichzeitige Anwendung von Arzneimitteln, die dieses System induzieren oder hemmen, grundsätzlich zu Wechselwirkungen dieser Arzneimittel mit Nifedipin führen.
Sowohl das Ausmaß wie auch die Dauer der Interaktionen sollten in Betracht gezogen werden, wenn NifeHEXAL uno zusammen mit den nachfolgend aufgeführten Arzneimitteln verabreicht werden soll.
Arzneimittel, die das Cytochrom P450 3A4-System hemmen
Bei gleichzeitiger Anwendung von Nifedipin und den nachfolgend aufgeführten Wirkstoffen, die als schwache oder mittelmäßige Inhibitoren dieses Enzymsystems bekannt sind, sollte der Blutdruck überwacht und gegebenenfalls die Nifedipin-Dosis angepasst werden (siehe Abschnitt 4.4):
• Makrolid-Antibiotika (z. B. Erythromycin)
• Fluoxetin
• Nefazodon
• Anti-HIV-Arzneimittel, Protease-Inhibitoren (z. B. Ritonavir)
• Antimykotika vom Imidazol-Typ (z. B. Ketoconazol)
Trizyklische Antidepressiva, Vasodilatatoren Der antihypertensive Effekt kann verstärkt werden.
Quinupristin / Dalfopristin
Die gleichzeitige Anwendung von Quinupristin / Dalfopristin und Nifedipin kann erhöhte Plasmakonzentrationen von Nifedipin bewirken.
Valproinsäure
Bei gleichzeitiger Anwendung von Nifedipin mit Valproinsäure ist aufgrund von Erfahrungen mit Nimodipin eine Erhöhung der Plasmakonzentration und damit eine verstärkte Wirkung von Nifedipin zu erwarten.
Cimetidin
Cimetidin kann zu einer Erhöhung des Nifedipin-Plasmaspiegels und somit zu einer verstärkten Nifedipin-Wirkung führen.
Arzneimittel, die das Cytochrom P450 3A4-System induzieren Antiepileptika (z. B. Phenobarbital, Phenytoin, Carbamazepin)
Bei gleichzeitiger Anwendung von Phenytoin und Nifedipin wird die Bioverfügbarkeit von Nifedipin vermindert und so seine Wirksamkeit geschwächt. Wenn beide Präparate gleichzeitig angewendet werden, sollte die klinische Reaktion auf Nifedipin beobachtet und gegebenenfalls eine Steigerung der Nifedipin-Dosis erwogen werden. Eine Dosisanpassung nach Beendigung der PhenytoinTherapie kann erforderlich sein.
Formale Studien zur Untersuchung möglicher Interaktionen zwischen Nifedipin und Carbamazepin oder Phenobarbital wurden nicht durchgeführt. Nach Erfahrungen mit dem strukturell ähnlichen Calciumantagonisten Nimodipin kann jedoch nicht ausgeschlossen werden, dass die gleichzeitige Anwendung von Carbamazepin oder Phenobarbital aufgrund deren enzyminduzierender Wirkung zu verringerten Plasmakonzentrationen und damit zu einer abgeschwächten Wirkung von Nifedipin führen kann.
Rifampicin
Aufgrund seiner enzyminduzierenden Wirkung beschleunigt Rifampicin die Metabolisierung von Nifedipin. Rifampicin darf nicht gleichzeitig mit NifeHEXAL 30/60 mg uno angewendet werden, da keine wirksamen Plasmaspiegel von Nifedipin erreicht werden (siehe Abschnitt 4.3).
Wirkungen von Nifedipin auf andere Arzneimittel
Blutdrucksenkende Arzneimittel
Durch Nifedipin kann der blutdrucksenkende Effekt von gleichzeitig verabreichten Antihypertensiva verstärkt werden wie z. B.:
• Diuretika
• Beta-Rezeptorenblocker
• ACE-Inhibitoren
• Angiotensin(AT 1)-Rezeptorantagonisten
• andere Calciumantagonisten
• Alpha-Rezeptorenblocker
• PDE-5-Inhibitoren
• Alpha-Methyldopa
Beta-Rezeptorenblocker
Bei gleichzeitiger Behandlung mit Beta-Rezeptorenblockern wurde in Einzelfällen das Auftreten bzw. eine Verschlechterung einer Herzinsuffizienz beobachtet. Die Patienten sollten deshalb sorgfältig überwacht werden.
Digoxin, Theophyllin
Nifedipin kann eine Erhöhung des Digoxin- und Theophyllin-Plasmaspiegels bewirken. Der Patient soll auf Symptome einer Digoxin-Überdosierung überwacht und der Plasmaspiegel kontrolliert werden. Gegebenenfalls ist die Glykosiddosis zu verringern.
Vincristin
Nifedipin vermindert die Ausscheidung von Vincristin, wodurch die Nebenwirkungen von Vincristin zunehmen können. Eine Dosisverminderung von Vincristin sollte daher in Betracht gezogen werden.
Cephalosporine
Bei gleichzeitiger Gabe von Cephalosporinen (z. B. Cefixim) und Nifedipin wurden erhöhte Cephalosporin-Plasmaspiegel beobachtet.
Chinidin
In Einzelfällen bewirkt Nifedipin einen Abfall des Chinidin-Plasmaspiegels bzw. das Absetzen von Nifedipin einen deutlichen Anstieg des Chinidin-Plasmaspiegels, so dass bei kombinierter Therapie die Kontrolle des Chinidin-Plasmaspiegels empfohlen wird. In anderen Fällen wurde über einen Anstieg der Nifedipin-Plasmakonzentration infolge von Chinidin berichtet. Bei der gleichzeitigen Anwendung der beiden Arzneimittel wird deshalb empfohlen, den Blutdruck sorgfältig zu überwachen und gegebenenfalls die Nifedipin-Dosis zu verringern.
Tacrolimus
Die gleichzeitige Anwendung von Tacrolimus und Nifedipin kann zu erhöhten Tacrolimus-Plasmaspiegeln führen, so dass die Tacrolimus-Dosis im Einzelfall reduziert werden sollte. Eine regelmäßige Plasmaspiegelkontrolle von Tacrolimus wird empfohlen.
Einfluß von anderen Arzneimitteln auf Nifedipin
Cisaprid
Die gleichzeitige Anwendung von Cisaprid und Nifedipin kann erhöhte Plasmakonzentrationen von Nifedipin bewirken.
Diltiazem
Diltiazem senkt die Clearance von Nifedipin und daher erhöht sich der Nifedipin-Plasmaspiegel. Deshalb sollte die Kombination beider Arzneimittel nur unter Vorsicht angewendet werden. Eine Reduzierung der Nifedipin-Dosis ist erforderlich.
Andere Arten von Wechselwirkungen
Die spektrophotometrische Bestimmung von Vanillinmandelsäure im Urin kann unter Nifedipin zu falsch erhöhten Werten führen; die Bestimmung mittels HPLC bleibt unbeeinflusst.
Interaktionen mit Nahrungsmitteln und Getränken
Grapefruitsaft
Durch Grapefruitsaft wird das Cytochrom P450 3A4-System gehemmt. Aufgrund eines verringerten First-Pass-Metabolismus und einer verlangsamten Ausscheidung kann der Blutspiegel von Nifedipin erhöht und die Wirkungsdauer verlängert sein, wodurch die blutdrucksenkende Wirkung verstärkt sein kann. Dieser Effekt hält über mindestens 3 Tage nach der letzten Einnahme von Grapefruitsaft an. Im zeitlichen Zusammenhang mit der NifedipinBehandlung ist deshalb der Genuss von Grapefruit bzw. Grapefruitsaft zu vermeiden (siehe Abschnitt 4.2).
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
NifeHEXAL uno ist in der Schwangerschaft vor der 20. Woche kontraindiziert.
Erfahrungen aus geeigneten und kontrollierten klinischen Studien mit Schwangeren liegen nicht vor. Tierexperimentelle Untersuchungen ergaben Hinweise auf eine embryotoxische, plazentotoxische und fetotoxische Wirkung infolge der Nifedipineinwirkung während oder nach der Organogenese (siehe Abschnitt 5.3).
Aus der klinischen Erfahrung ist kein spezifisches pränatales Risiko erkennbar, obwohl über eine Zunahme von Fällen mit perinataler Asphyxie, Kaiserschnittentbindung sowie Frühreife und intrauterine Wachstumsverzögerung berichtet wurde. Es ist unklar, ob diese Beobachtungen auf den zugrunde liegenden Bluthochdruck, seine Behandlung oder auf einen spezifischen Effekt des Wirkstoffs zurückzuführen sind.
Der derzeitige Erkenntnisstand ist nicht geeignet, schädliche Arzneimittelwirkungen auf das Ungeborene und den Säugling auszuschließen. Daher sollte jegliche Anwendung von Nifedipin ab der 20. Schwangerschaftswoche erst nach sehr sorgfältiger individueller Nutzen-Risiko-Bewertung erfolgen und nur dann in Betracht gezogen werden, wenn alle anderen Behandlungsmöglichkeiten nicht in Frage kommen oder sich als ineffektiv erwiesen haben.
Wenn NifeHEXAL uno zusammen mit intravenös verabreichtem Magnesiumsulfat angewendet wird, muss der Blutdruck sorgfältig überwacht werden, da ein übermäßiger, sowohl die Mutter wie auch den Fetus, schädigender Blutdruckabfall auftreten kann.
Stillzeit
Während der Stillzeit darf Nifedipin nicht angewendet werden, da der Wirkstoff aus Nifedipin in die Muttermilch übergeht und nur unzureichende Erfahrungen mit einer Anwendung in der Stillperiode vorliegen. Ist eine Behandlung mit Nifedipin während der Stillzeit zwingend erforderlich, muss abgestillt werden.
In-vitro-Fertilisation
In Einzelfällen von In-vitro-Fertilisation wurden Calciumantagonisten wie Nifedipin mit reversiblen biochemischen Veränderungen in der Kopfregion von Spermatozoen in Verbindung gebracht, die zu einer Beeinträchtigung der Spermienfunktion führen könnten. In Fällen, bei denen wiederholte In-vitro-Fertilisationen erfolglos blieben, ohne dass eine andere Erklärung dafür gefunden werden kann, sollten Calciumantagonisten wie Nifedipin als mögliche Ursache in Betracht gezogen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung mit diesem Arzneimittel bedarf der regelmäßigen ärztlichen Kontrolle. Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen so weit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Die Häufigkeit der unter Nifedipin gemeldeten unerwünschten Arzneimittelwirkungen ist in der nachstehenden Tabelle zusammengefasst. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben. Die Häufigkeit ist dabei folgendermaßen definiert:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklas se (MedDRA) |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
Nicht bekannt |
|
Erkrankungen des Blutes und des Lymphsystems |
Leukopenie, Anämie, Thrombopenie , thrombozyto penische Purpura |
Agranulozytos e |
|
Systemorganklas se (MedDRA) |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
Nicht bekannt |
|
Erkrankungen des Immunsystems |
allergische Reaktionen, allergisches Ödem/Angio-ödem (einschließlich Larynxödem ) , Pruritus, Exanthem |
Urtikaria |
anaphylak- tische/anaphy- laktoide Reaktionen | |||
|
Psychiatrische Erkrankungen |
Angstreaktio nen, Schlafstörun gen | |||||
|
Stoffwechsel- und Ernährungsstöru ngen |
Hyperglykämie |
|
Erkrankungen des Nervensystems |
Kopfschmerze n |
Schwindel Benommenhei t, Schwächege fühl |
Migräne, Tremor, Par- /Dysästhesie Schläfrigkeit/ Müdigkeit, Nervosität |
Hypoästhesie | ||
|
Augenerkrankun gen |
Sehstörungen |
Augenschmer zen | ||||
|
Herzerkrankunge n |
Palpitationen |
Tachykardie, Schmerzen im Brustraum (Angina pectoris2) |
Myokardin farkt2 | |||
|
Gefäßerkrankung en |
periphere Ödeme |
Vasodilatation (z. B. Flush) |
Hypotonie, Synkope | |||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Nasenbluten, verstopfte Nase, Dyspnoe | |||||
|
Erkrankungen des Gastrointestinal trakts |
Obstipation, Nausea |
gastrointes tinale Schmerzen und Bauchschmerzen, Dyspepsie, Flatulenz, Mundtrockenheit |
Gingivahyper plasie, Anorexie, Völlegefühl, Aufstoßen |
Emesis, Ösophagitis, Cardiainsuffizie nz | ||
|
Leber- und Gallenerkrankungen |
vorübergehender Anstieg der Leberenzymwerte |
Ikterus |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Erythromelal-gie, insbesondere zu Beginn der Behandlung, Schwitzen |
Erythem |
allergische Reaktion, Photosensi- tivität, palpable Purpura |
exfoliative Dermatitis |
toxische epidermale Nekrolyse | |
|
Skelett muskulatur-, Bindegewebs- und Knochenerkrank ungen |
Muskelkrämp fe, geschwollene Gelenke, Myalgie |
Arthralgie | ||||
|
Erkrankungen der Nieren und Harnwege |
Polyurie, Dysurie, bei Niereninsuffizienz, vorübergehen de Verschlechterung der Nierenfunktion möglich |
|
Erkrankungen der Geschlechtsorga ne und der Brustdrüse |
erektile Dysfunktion |
Gynäkomastie , die nach Absetzen von Nifedipin reversibel ist | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungso rt |
allgemeines Unwohlsein, Asthenie |
unspezifische Schmerzen Schüttelfrost | ||||
■1
= kann zu lebensbedrohlichem Verlauf führen
2 = Gelegentlich kann es insbesondere zu Beginn der Behandlung zum Auftreten von Angina-pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen.
Vereinzelt ist das Auftreten eines Herzinfarkts beschrieben worden.
Bei Dialysepatienten mit maligner Hypertonie und Hypovolämie kann infolge der Vasodilatation ein deutlicher Blutdruckabfall auftreten.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das aufgeführte nationale Meldesystem anzuzeigen.
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
4.9 Überdosierung Symptome der Intoxikation
Folgende Symptome werden bei einer schweren Vergiftung mit Nifedipin beobachtet: Bewusstseinstrübung bis zum Koma, Blutdruckabfall, tachykarde/bradykarde Herzrhythmusstörungen, Hyperglykämie, metabolische Azidose, Hypoxie, kardiogener Schock mit Lungenödem.
Therapie von Intoxikationen
Therapeutisch stehen die Giftelimination und die Wiederherstellung stabiler Herz-KreislaufVerhältnisse im Vordergrund.
Nach oraler Ingestion ist eine ausgiebige Magenspülung eventuell in Kombination mit einer Dünndarmspülung indiziert.
Insbesondere bei einer Vergiftung mit Retard-Präparaten ist eine möglichst vollständige Elimination, auch aus dem Dünndarm, anzustreben, um die sonst unvermeidliche Nachresorption der Wirksubstanz zu verhindern.
Bei der Gabe von Laxanzien ist allerdings die Hemmung der Darmmuskulatur bis zur Darmatonie unter Calciumantagonisten zu beachten. Eine Hämodialyse ist wegen fehlender Dialysierbarkeit von Nifedipin nicht sinnvoll, eine Plasmapherese (hohe Plasmaeiweißbindung, relativ kleines Verteilungsvolumen) wird jedoch empfohlen.
Bradykarde Herzrhythmusstörungen werden symptomatisch mit Atropin und/oder Beta-Sympathikomimetika behandelt; bei bedrohlichen bradykarden Herzrhythmusstörungen ist eine temporäre Schrittmachertherapie erforderlich.
Die Hypotonie als Folge von kardiogenem Schock und arterieller Vasodilatation wird mit Calcium (1-2 g Calciumgluconat intravenös), Dopamin (bis 25 ^g je kg Körpergewicht je Minute), Dobutamin (bis 15 ^g je kg Körpergewicht je Minute), Epinephrin bzw. Norepinephrin behandelt. Die Dosierung dieser Medikamente orientiert sich allein an der erzielten Wirkung. Der Serumcalciumspiegel sollte hochnormal bis leicht erhöht gehalten werden.
Die zusätzliche Flüssigkeits- oder Volumenzufuhr sollte wegen der drohenden kardialen Überlastung unter hämodynamischer Kontrolle zurückhaltend erfolgen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Calciumantagonist, 1,4-Dihydropyridin-Derivat ATC-Code: C08 CA05
Nifedipin ist ein Calciumantagonist vom 1,4-Dihydropyridintyp. Calciumantagonisten hemmen den Calciumionen-Einstrom durch den langsamen Calciumkanal in der Zelle. Nifedipin wirkt vor allem an den glatten Muskelzellen der Koronararterien und an den peripheren Widerstandsgefäßen. Dieser Effekt hat eine Vasodilatation zur Folge. In therapeutischen Dosen hat Nifedipin praktisch keine direkte Wirkung auf das Myokard.
Am Herzen erweitert Nifedipin vor allem die großen Koronararterien durch Erniedrigung des Muskeltonus, wodurch die Durchblutung verbessert werden kann. Der periphere Widerstand wird gesenkt.
Zu Beginn der Behandlung mit dem Calciumantagonisten kann es reflektorisch zu einer Zunahme der Herzfrequenz und des Herzminutenvolumens kommen. Diese Zunahme ist jedoch nicht ausgeprägt genug, um die Vasodilatation zu kompensieren.
Bei Langzeitbehandlung mit Nifedipin kehrt das anfangs erhöhte Herzminutenvolumen wieder auf den Ausgangswert zurück. Eine besonders deutliche Blutdruckabnahme nach Nifedipin ist beim Hypertoniker zu beobachten.
Kinder und Jugendliche
Es liegen begrenzte Informationen zu Nifedipin in verschiedenen Darreichungsformen und Dosierungen sowohl für akute als auch für chronische Hypertonie im Vergleich zu anderen Antihypertensiva vor. Es wurden antihypertensive Wirkungen von Nifedipin gezeigt, aber Dosierungsempfehlungen, Langzeitdaten zur Unbedenklichkeit und zu Auswirkungen auf das kardiovaskuläre System wurden nicht untersucht. Pädiatrische Darreichungsformen fehlen.
5.2 Pharmakokinetische Eigenschaften
Der Wirkstoff Nifedipin wird nach peroraler Nüchterneinnahme nahezu vollständig resorbiert. Nifedipin unterliegt einem „First-Pass-Effekt" in der Leber, so dass die systemische Verfügbarkeit oral verabreichten schnell freisetzenden Nifedipins bei 50-70 % liegt. Maximale Plasma- bzw. Serumkonzentrationen werden bei Gabe einer Nifedipin-haltigen Lösung nach ca. 15 Minuten, bei Gabe anderer Zubereitungen mit nichtretardierter Freisetzung nach 30-85 Minuten erreicht.
Nifedipin wird zu 95-98 % an Plasmaeiweiß (Albumin) gebunden. Für Nifedipin wurde ein mittleres Verteilungsvolumen Vss von 0,77-1,12 l/kg gefunden.
Nifedipin wird in der Leber nahezu vollständig (hoher „First-Pass-Effekt") vor allem über oxidative Prozesse metabolisiert. Diese Metaboliten zeigen keine pharmakodynamischen Aktivitäten. Weder die unveränderte Substanz noch der Metabolit M-1 werden in nennenswertem Maße renal eliminiert (< 0,1 % der Dosis). Die polaren Metaboliten M-2 und M-3 werden zu etwa 50 % der Dosis im Urin gefunden (zum Teil in konjugierter Form), wobei der überwiegende Teil innerhalb von 24 Stunden ausgeschieden wird. Der Rest wird mit den Fäzes ausgeschieden.
Die Eliminationshalbwertszeit liegt bei 1,7-3,4 Stunden (nichtretardierte Zubereitung).
Eine Kumulation der Substanz bei Dauertherapie nach üblicher Dosierung wurde nicht beschrieben.
Bei eingeschränkter Leberfunktion kommt es zu einer deutlichen Verlängerung der Eliminationshalbwertszeit und zu einer Verminderung der Gesamt-Clearance. Eine Dosisreduzierung kann gegebenenfalls erforderlich sein (siehe Abschnitt 4.4).
Bioverfügbarkeit
NifeHEXAL uno Retardtabletten erlauben eine 1-malige tägliche Gabe. Die Retardtabletten bestehen aus einem Mantel, der den Wirkstoff langsam abgibt, und einem Kern, der den Wirkstoff rasch freisetzt.
In der folgenden Tabelle sind die pharmakokinetischen Parameter (arithmetische Mittelwerte ±
SD) nach Einmalgabe von NifeHEXAL 30 mg uno bzw. NifeHEXAL 60 mg uno zusammengestellt [cmax: maximaler Plasmaspiegel; tmax: Zeit bis zum Erreichen von cmax; AUC (0-24): Fläche unter der Plasmaspiegel-Kurve über 24 Stunden].
|
n |
AUC (0-24) |
cmax |
tmax | |
|
[ng x h/ml] |
[ng/ml] |
[h] | ||
|
NifeHEXAL 30 |
14 |
286,56 |
29,50 |
4,00 |
|
mg uno |
± 101,40 |
± 12,59 |
± 3,43 | |
|
NifeHEXAL 60 |
18 |
647,62 |
66,38 |
3,03 |
|
mg uno |
± 360,61 |
± 41,34 |
± 1,77 |
Abb.: Plasmakonzentrationen von Nifedipin nach Mehrfachgabe von NifeHEXAL 30 mg uno (1-mal täglich), NifeHEXAL 60 mg uno (1-mal täglich), Nifedipin 20 mg Retardtabletten (2-mal täglich) und Nifedipin Kapseln zu 10 mg (3-mal täglich).
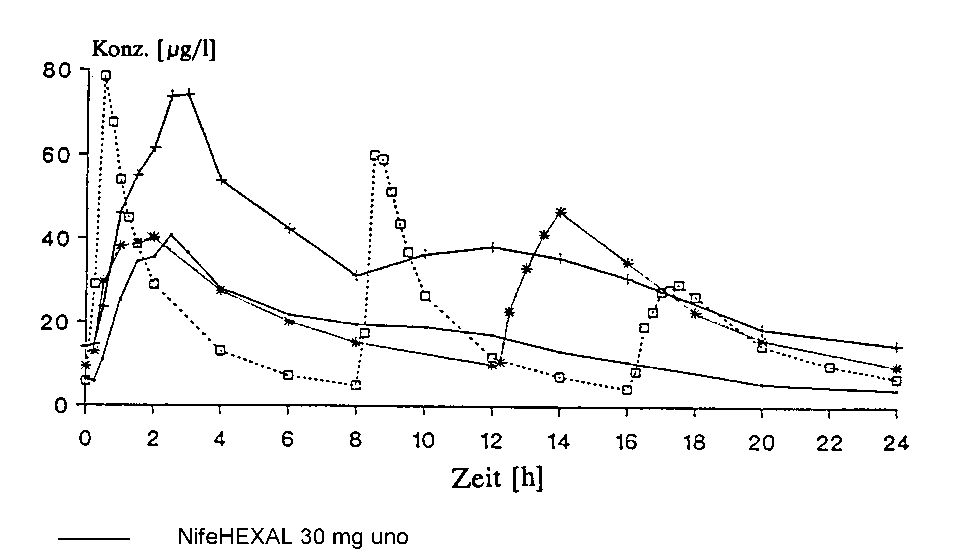
—+— NifeHEXAL 60 mg uno
—¥— Nifedipin 20 mg Retardtabletten —□— Nifedipin 10 mg Kapseln
5.3 Präklinische Daten zur Sicherheit
Die präklinischen Daten, die auf konventionellen Studien zur akuten Toxizität, chronischen Toxizität und zum mutagenen und tumorerzeugenden Potential basieren, lassen keine besondere Gefährdung für den Menschen erkennen.
In-vivo- und In-vitro-Untersuchungen zur Mutagenität verliefen durchweg negativ, so dass eine mutagene Wirkung im Menschen hinreichend ausgeschlossen werden kann. Eine Langzeituntersuchung (2 Jahre) an der Ratte ergab keine Hinweise auf tumorerzeugende Effekte von Nifedipin.
Experimentelle Studien haben bei 3 Tierspezies (Ratte, Kaninchen, Maus) Hinweise auf teratogene Effekte ergeben, einschließlich digitaler Anomalien, Fehlbildungen der Extremitäten, Gaumenspalten, Brustbeinspalten und Fehlbildungen der Rippen. Die digitalen Anomalien und die Fehlbildungen der Extremitäten sind möglicherweise auf die eingeschränkte uterine Durchblutung zurückzuführen; sie traten aber auch bei Tieren auf, die Nifedipin nur nach der Organogenese erhalten hatten.
Infolge der Nifedipin-Gabe traten verschiedene embryotoxische, plazentotoxische und fetotoxische Effekte auf, einschließlich verkrüppelte Feten bei Ratten, Mäusen und Kaninchen, kleine Plazenten und unterentwickelte Chorionzotten bei Affen, Absterben von Embryonen und Feten bei Ratten, Mäusen und Kaninchen sowie verlängerte Trächtigkeiten und verringerte Überlebensraten bei neugeborenen Ratten (andere Tierarten wurden hierauf nicht untersucht). Alle Dosen, die in experimentellen Untersuchungen teratogene, embryotoxische und fetotoxische Effekte zur Folge hatten, wirkten auch toxisch auf die Muttertiere und waren um ein Mehrfaches höher als die empfohlene Höchstdosis für den Menschen (siehe Abschnitt 4.6).
6 PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
mikrokristalline Cellulose Crospovidon
Hyprolose mittel- und niedrigviskos Hypromellose Lactose-Monohydrat Macrogol 4000 Magnesiumstearat (Ph.Eur.)
Maisstärke
hochdisperses Siliciumdioxid
Farbstoffe Titandioxid (E 171), Eisen(III)-oxid (E 172)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Blisterstreifen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
Packungen mit
30, 50 und 100 Retardtabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
7. INHABER DER ZULASSUNGEN
HEXALAG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMERN
NifeHEXAL 30 mg uno 28391.00.00
NifeHEXAL 60 mg uno 28391.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN / VERLÄNGERUNG DER ZULASSUNGEN
02.07.1993 / 12.12.2001
10. STAND DER INFORMATION
Dezember 2014
11.VERKAUFSABGRENZUNG
Verschreibungspflichtig