Nimotop S
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Nimotop® S, 10 mg/50 ml, Infusionslösung Nimotop® S, 30 mg, Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Nimotop S, Infusionslösung
1 Flasche mit Infusionslösung enthält 10 mg Nimodipin in 50 ml alkoholischem Lösungsmittel. Sonstige Bestandteile mit bekannter Wirkung:
Dieses Arzneimittel enthält 23,7 Vol.-% Alkohol und 1 mmol (23 mg) Natrium je 50-ml-Flasche bzw.
5,1 mmol (115 mg) Natrium je 250 ml (siehe Abschnitt 4.4).
Nimotop S, Filmtabletten 1 Filmtablette enthält 30 mg Nimodipin.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Nimotop S, Infusionslösung
Infusionslösung
Klare, leicht gelbliche Lösung
Nimotop S, Filmtabletten Filmtablette
Runde, gelbe, bikonvexe Filmtabletten, die auf einer Seite mit dem "Bayer-Kreuz" und auf der anderen Seite mit "SK" gekennzeichnet sind.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Nimotop S, Infusionslösung
Zur Vorbeugung und Behandlung ischämischer neurologischer Defizite infolge zerebraler Vasospasmen nach aneurysmatisch bedingter Subarachnoidalblutung (aSAH).
Nimotop S, Filmtabletten
Nach vorhergehender Infusion von Nimotop S, Infusionslösung zur Vorbeugung und Behandlung ischämischer neurologischer Defizite infolge zerebraler Vasospasmen nach aneurysmatisch bedingter Subarachnoidalblutung (aSAH).
4.2 Dosierung und Art der Anwendung
Dosierung
Nimotop S, Infusionslösung
Zu Beginn der Behandlung für die Dauer von 2 Stunden 1 mg Nimodipin (= 5 ml Nimotop S, Infusionslösung)/Std. (ca. 15 pg/kg Körpergewicht/Std.). Bei guter Verträglichkeit, insbesondere beim
Fehlen von stärkeren Blutdrucksenkungen, Erhöhung der Dosis nach der 2. Stunde auf 2 mg Nimodipin (= 10 ml Nimotop S, Infusionslösung)/Std. (ca. 30 pg/kg Körpergewicht/Std.). Bei Patienten mit deutlich niedrigerem Körpergewicht als 70 kg oder labilen Blutdruckverhältnissen sollte mit einer Dosierung von 0,5 mg Nimodipin (= 2,5 ml Nimotop S, Infusionslösung)/Std. begonnen werden.
Intrazisternale Instillation
Während eines operativen Eingriffs kann eine frisch zubereitete verdünnte körperwarme Nimotop S-Lösung (1 ml Nimotop S, Infusionslösung und 19 ml Ringer-Lösung) intrazisternal instilliert werden. Diese verdünnte Nimotop S-Lösung soll sofort nach der Zubereitung verwendet werden.
Nimotop S, Filmtabletten
Nach vorausgegangener 5- bis 14tägiger Infusion von Nimotop S, Infusionslösung wird eine Tagesdosis von 6 x 2 Filmtabletten Nimotop S (6 x 60 mg Nimodipin) empfohlen.
Bei Patienten mit unerwünschten Begleiterscheinungen ist die Dosis ggf. zu reduzieren oder die Behandlung abzubrechen.
Bei gleichzeitiger Behandlung mit Arzneimitteln, die das Cytochrom-P450-3A4-System hemmen oder induzieren, kann eine Anpassung der Dosis erforderlich sein (siehe Abschnitt 4.5).
Patienten mit eingeschränkter Leberfunktion
Bei schweren Leberfunktionsstörungen, insbesondere Leberzirrhose, kann aufgrund einer reduzierten First-Pass-Kapazität und einer verringerten metabolischen Clearance die Bioverfügbarkeit von Nimodipin erhöht sein. Die Wirkungen und Nebenwirkungen, z. B. Blutdrucksenkung, können bei diesen Patienten stärker ausgeprägt sein.
In solchen Fällen sollte die Dosis reduziert oder, falls erforderlich, ein Abbruch der Behandlung erwogen werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Nimotop S bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen.
Art der Anwendung
Nimotop S, Infusionslösung
Bei Patienten, bei welchen eine Volumenbelastung unerwünscht bzw. kontraindiziert ist, kann das Präparat ohne zusätzliche Gabe einer Koinfusionslösung zentralvenös über einen Katheter appliziert werden. Nimotop S, Infusionslösung wird als intravenöse Dauerinfusion im Bypass mit einer Infusionspumpe über einen zentralen Katheter verabreicht. Die Leitungen werden über einen Dreiwegehahn miteinander verbunden.
Nimotop S, Infusionslösung darf nicht mit anderen Arzneimitteln gemischt oder Infusionsbeuteln oder -flaschen zugegeben werden.
Geeignete Koinfusionen sind: Glucose 5%, physiologische Kochsalzlösung, Ringer-Laktat, RingerLaktat mit Magnesium, Dextran 40-Lösungen, Poly(O-2-hydroxy-ethyl)stärke 6%, HumanAlbumin 5% oder Blut. Aufgrund experimenteller Ergebnisse kann auch Mannitol über einen Zeitraum bis zu 24 Stunden als Koinfusion verabreicht werden. Das Verhältnis Nimotop S, Infusionslösung zu Koinfusionslösung soll 1:4 betragen.
Es ist zu empfehlen, Nimotop S, Infusionslösung auch während Narkose, Operation und Angiographie weiter zu verabreichen.
Prophylaktische Gabe
Die intravenöse Behandlung sollte nicht später als 4 Tage nach der Blutung beginnen und während der Periode der größten Gefahr der Entwicklung eines Vasospasmus, d. h. bis zum 10. bis 14. Tag nach der Subarachnoidalblutung, fortgesetzt werden.
Wenn während der prophylaktischen Nimotop S-Anwendung die Blutungsquelle chirurgisch versorgt wird, sollte die intravenöse Behandlung mit Nimotop S für mindestens 5 Tage postoperativ fortgesetzt werden.
Nach Abschluss der Infusionsbehandlung wird für etwa 7 weitere Tage die orale Gabe von 6 x täglich 60 mg Nimodipin im Abstand von 4 Std. empfohlen.
Therapeutische Gabe
Bei bereits bestehenden, durch Vasospasmus bedingten ischämischen neurologischen Störungen nach einer Subarachnoidalblutung sollte die Behandlung so früh wie möglich beginnen und für mindestens 5 und maximal 14 Tage fortgesetzt werden.
Anschließend wird für die Dauer von 7 Tagen die orale Gabe von 6 x täglich 60 mg Nimodipin im Abstand von 4 Std. empfohlen.
Wenn während der therapeutischen Nimotop S-Anwendung die Blutungsquelle chirurgisch versorgt wird, sollte die intravenöse Behandlung mit Nimotop S für mindestens 5 Tage postoperativ fortgesetzt werden.
Nimotop S, Filmtabletten
Nach Abschluss der 5-14tägigen Infusionsbehandlung mit Nimotop S, Infusionslösung wird für etwa 7 Tage die Anwendung von Nimotop S, Filmtabletten empfohlen. Im Allgemeinen nimmt man die Filmtabletten unabhängig von den Mahlzeiten unzerkaut mit ausreichend Flüssigkeit (vorzugsweise einem Glas Wasser) ein. Der Abstand zwischen den jeweiligen Einnahmezeitpunkten sollte 4 Stunden betragen und nicht unterschritten werden. Grapefruitsaft muss vermieden werden (siehe Abschnitt 4.5).
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Nimotop S, Filmtabletten
Nimotop S, Filmtabletten dürfen nicht zusammen mit Rifampicin oder den Antiepileptika Phenobarbital, Phenytoin und Carbamazepin angewendet werden, da durch diese Arzneimittel die Wirksamkeit von Nimotop S, Filmtabletten signifikant verringert werden kann (siehe Abschnitt 4.5).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Obwohl die Anwendung von Nimodipin nicht mit einer Zunahme des intrakranialen Druckes verbunden ist, wird in solchen Fällen oder bei erhöhtem Wassergehalt im Hirngewebe (generalisiertes Hirnödem) eine engmaschige Überwachung empfohlen.
Vorsicht ist bei Patienten mit niedrigem Blutdruck (systolischer Blutdruck unter 100 mm Hg) angezeigt.
Bei Patienten mit instabiler Angina pectoris oder innerhalb der ersten vier Wochen nach einem akuten Herzinfarkt sollten Ärzte das potentielle Risiko (z. B. einer reduzierten Durchblutung der Koronararterie und myokardialen Ischämie) gegen den Nutzen (z. B. Verbesserung der Hirndurchblutung) abwägen.
Nimotop S, Infusionslösung
Nimotop S, Infusionslösung soll bei notwendiger Kombination mit Antihypertensiva nur unter besonders sorgfältiger Überwachung angewendet werden (siehe Abschnitt 4.5).
Bei gleichzeitiger Behandlung mit potentiell nephrotoxischen Arzneimitteln (z. B. Aminoglykoside, Cephalosporine, Furosemid) sowie bei Patienten mit eingeschränkter Nierenfunktion kann sich die Nierenfunktion verschlechtern. Eine sorgfältige Überwachung der Nierenfunktion ist in solchen Fällen angezeigt. Bei Verschlechterung der Nierenfunktion sollte ein Abbruch der Behandlung erwogen werden (siehe auch Abschnitt 4.5).
Der Wirkstoff von Nimotop S, Infusionslösung ist in gewissem Grade lichtempfindlich. Deshalb sollte die Anwendung bei direktem Sonnenlicht vermieden werden. Bei Anwendung in diffusem Tageslicht oder Kunstlicht ist Nimotop S jedoch ohne besondere Schutzmaßnahme bis zu 10 Stunden einsetzbar. Sollte eine längere Lichtexposition nicht zu vermeiden sein, sind geeignete Vorkehrungen zu treffen (z. B. Schutz von Infusionspumpe und -leitungen durch lichtundurchlässige Umhüllungen, Verwendung eingefärbter Infusionsleitungen).
Dieses Arzneimittel enthält 23,7 Vol.-% Alkohol. Bei Beachtung der Dosierungsanleitung werden bei der täglichen Dosis(250 ml Infusionslösung) bis zu 50 g Alkohol zugeführt. Vorsicht ist geboten bei Alkoholkranken, beeinträchtigtem Alkoholabbau, während Schwangerschaft und Stillzeit, bei Kindern und Hochrisikogruppen wie Patienten mit Lebererkrankungen oder Epilepsie. Die Wirkung anderer Arzneimittel kann beeinträchtigt oder verstärkt werden (siehe Abschnitt 4.5). Im Straßenverkehr und bei der Bedienung von Maschinen kann das Reaktionsvermögen beeinträchtigt werden.
Dieses Arzneimittel enthält 1 mmol (23 mg) Natrium je 50 ml Flasche bzw. 5,1 mmol (115 mg) Natrium je 250 ml. Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/kochsalzarmer) Diät.
Nimotop S, Filmtabletten
Nimodipin wird über das Cytochrom-P450-3A4-System metabolisiert. Daher können Arzneimittel, von denen bekannt ist, dass sie dieses Enzymsystems entweder inhibieren oder induzieren, den FirstPass-Metabolismus oder die Ausscheidung von Nimodipin verändern (siehe Abschnitte 4.5 und 4.2 „Patienten mit eingeschränkter Leberfunktion“).
Die Plasmaspiegel von Nimodipin können z. B. durch folgende Arzneimittel, die als Inhibitoren des Cytochrom-P450-3A4-Systems bekannt sind, erhöht werden:
- Makrolid-Antibiotika (z. B. Erythromycin)
- HIV-Proteaseinhibitoren (z. B. Ritonavir)
- Antimykotika vom Azol-Typ (z. B. Ketoconazol)
- die Antidepressiva: Nefazodon und Fluoxetin
- Quinupristin/Dalfopristin
- Cimetidin
- Valproinsäure
Wenn Nimotop S, Filmtabletten gleichzeitig mit einem dieser Arzneimittel angewendet wird, sollte der Blutdruck überwacht werden und, falls erforderlich, eine Verringerung der Nimotop S-Dosis in Betracht gezogen werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Nimotop S bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen. Da zur Anwendung bei Kindern und Jugendlichen noch keine ausreichenden Erfahrungen vorliegen, ist diese Altersgruppe bislang nicht für eine Therapie mit Nimodipin vorgesehen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Arzneimittel, die Nimodipin beeinflussen
Fluoxetin
Die gleichzeitige Verabreichung von Nimodipin und dem Antidepressivum Fluoxetin führte im Steady-State zu etwa 50% höheren Plasmakonzentrationen an Nimodipin. Der Fluoxetin-Plasmaspiegel war deutlich erniedrigt, während der aktive Metabolit Norfluoxetin davon nicht betroffen war (siehe Abschnitt 4.4).
Nortriptylin
Die gleichzeitige Verabreichung von Nimodipin und Nortriptylin führt im Steady-State zu einer leichten Abnahme der Nimodipin-Exposition bei unveränderten Nortriptylin-Plasmakonzentrationen.
Nimotop S, Filmtabletten
Nimodipin wird über das Cytochrom-P450-3A4-System, das sowohl in der intestinalen Mukosa als auch in der Leber lokalisiert ist, metabolisiert. Daher kann die gleichzeitige Anwendung von Arzneimitteln, die dieses Enzymsystem induzieren oder hemmen, den First-Pass-Metabolismus oder die Clearance von oral verabreichtem Nimodipin beeinflussen.
Sowohl das Ausmaß als auch die Dauer der Interaktionen sollten in Betracht gezogen werden, wenn Nimotop S Filmtabletten zusammen mit den folgenden Arzneimitteln verabreicht werden sollen.
Rifampicin
Aus den Erfahrungen mit anderen Calciumantagonisten kann man erwarten, dass Rifampicin den metabolischen Abbau von Nimodipin durch Enzyminduktion beschleunigt und damit bei gleichzeitiger Anwendung die Wirksamkeit von Nimodipin signifikant verringern könnte. Deshalb ist die Anwendung von Nimodipin in Kombination mit Rifampicin kontraindiziert (siehe Abschnitt 4.3).
Antiepileptika, die das Cytochrom-P450-3A4- System induzieren wie Phenobarbital, Phenytoin, Carbamazepin
Durch eine vorangegangene Langzeitbehandlung mit den Antiepileptika Phenobarbital, Phenytoin oder Carbamazepin wird die Bioverfügbarkeit von oral verabreichtem Nimodipin deutlich verringert. Die gleichzeitige orale Einnahme von Nimotop zusammen mit diesen Antiepileptika ist daher kontraindiziert (siehe Abschnitt 4.3).
Bei der gleichzeitigen Verabreichung von Nimodipin und den nachfolgend aufgeführten Inhibitoren des Cytochrom-P450-3A4-Systems muss der Blutdruck überwacht und, ggf. die Nimodipin-Dosis angepasst werden (siehe Abschnitt 4.4):
Makrolid-Antibiotika (z. B. Erythromycin)
Studien zu den Wechselwirkungen zwischen Nimodipin und Makrolid-Antibiotika wurden nicht durchgeführt. Es ist bekannt, dass bestimmte Makrolid-Antibiotika das Cytochrom-P450-3A4-System inhibieren. Die Möglichkeit einer Arzneimittelwechselwirkung kann zurzeit nicht ausgeschlossen werden. Daher sollten Makrolid-Antibiotika nicht gleichzeitig mit Nimodipin angewendet werden (siehe Abschnitt 4.4).
Azithromycin hat trotz seiner strukturellen Verwandtschaft mit der Klasse der Makrolid-Antibiotika keine CYP3A4-hemmenden Eigenschaften.
HIV-Proteaseinhibitoren (z. B. Ritonavir)
Formale Studien zu potentiellen Wechselwirkungen zwischen Nimodipin und HIV-Proteaseinhibitoren wurden nicht durchgeführt. Arzneimittel dieser Klasse wurden als potente Inhibitoren des Cytochrom-P450-3A4-Systems beschrieben. Daher kann ein Potential zu einer ausgeprägten und klinisch relevanten Erhöhung der Nimodipin Plasmakonzentrationen bei gleichzeitiger Anwendung mit diesen HIV-Proteaseinhibitoren nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Antimykotika vom Azol-Typ (z. B. Ketoconazol)
Eine formale Studie zu potentiellen Wechselwirkungen zwischen Nimodipine und Ketokonazol wurde nicht durchgeführt. Antimykotika vom Azol-Typ sind dafür bekannt, dass sie das Cytochrom-P450-3A4-System inhibieren. Diverse Wechselwirkungen wurden für andere CalciumAntagonisten vom Dihydropyridin-Typ berichtet. Daher kann bei gleichzeitiger Anwendung von oralem Nimodipin eine signifikante Erhöhung der systemischen Bioverfügbarkeit von Nimodipin, bedingt durch einen erniedrigten First-Pass-Metabolismus, nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Nefazodon
Es wurden keine formalen Studien zur Erfassung einer potentiellen Interaktion zwischen Nimodipin und Nefazodon durchgeführt, jedoch ist bekannt, dass dieses Antidepressivum ein wirksamer Inhibitor des Cytochrom-P450-3A4-Systems ist. Daher kann eine Zunahme der NimodipinPlasmakonzentration bei Komedikation mit Nefazodon nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Quinupristin/Dalfopristin
Basierend auf den Erfahrungen mit dem Calcium-Antagonisten Nifedipin, kann es bei gleichzeitiger Anwendung von Nimodipin und Quinupristin/Dalfopristin zu erhöhten NimodipinPlasmakonzentrationen kommen (siehe Abschnitt 4.4).
Cimetidin
Die gleichzeitige Verabreichung des H2-Antagonisten Cimetidin kann zu einer Erhöhung der Nimodipin-Plasmakonzentration führen (siehe Abschnitt 4.4).
Valproinsäure
Die gleichzeitige Verabreichung des Antikonvulsivums Valproinsäure kann zu einer Erhöhung der Nimodipin-Plasmakonzentration führen (siehe Abschnitt 4.4).
Wirkungen von Nimodipin auf andere Arzneimittel
Blutdrucksenkende Arzneimittel
Durch Nimodipin kann der blutdrucksenkende Effekt von gleichzeitig verabreichten Antihypertensiva verstärkt werden, z. B.:
- Diuretika
- ß-Rezeptorenblockern
- ACE-Inhibitoren
- A1-Rezeptorantagonisten
- anderen Calciumantagonisten
- a-Rezeptorenblockern
- PDE-5-Inhibitoren
- Alpha-Methyldopa
Falls sich jedoch die Kombination mit einem dieser Arzneimittel als unvermeidbar erweisen sollte, ist eine besonders sorgfältige Überwachung des Patienten erforderlich.
Zidovudin
In einer experimentellen Untersuchung an Affen führte die gleichzeitige intravenöse Gabe des HIV -Arzneimittels Zidovudin und Nimodipin als i.v.-Bolus-Gabe zu signifikant erhöhten Zidovudin-Plasmaspiegeln (AUC), wohingegen das Verteilungsvolumen und die Clearance signifikant verringert wurden.
Nimotop S, Infusionslösung
Bei gleichzeitiger intravenöser Gabe von Nimodipin mit einem ß-Rezeptorenblocker besteht die Möglichkeit einer gegenseitigen Verstärkung der negativ inotropen Wirkung bis hin zur dekompensierten Herzinsuffizienz.
Potentiell nephrotoxische Arzneimittel
Bei gleichzeitiger Behandlung mit potentiell nephrotoxischen Arzneimitteln (z. B. Aminoglykoside, Cephalosporine, Furosemid) sowie bei Patienten mit eingeschränkter Nierenfunktion kann sich die Nierenfunktion verschlechtern. Eine sorgfältige Überwachung der Nierenfunktion ist in solchen Fällen angezeigt. Bei Verschlechterung der Nierenfunktion sollte ein Abbruch der Behandlung erwogen werden (siehe auch Abschnitt 4.4).
Alkohol-unverträgliche Arzneimittel
Da Nimotop S Infusionslösung 23,7 Vol.-% Alkohol enthält, sind Wechselwirkungen mit Arzneimitteln zu beachten, die mit Alkohol nicht kompatibel sind (siehe auch Abschnitt 4.4).
Interaktionen mit Nahrungsmitteln und Getränken
Nimotop S, Filmtabletten
Durch Grapefruitsaft wird das Cytochrom-P450-3A4-System gehemmt.
Bei gleichzeitiger Verabreichung eines Calciumantagonisten vom Dihydropyridin-Typ und Grapefruitsaft kommt es daher aufgrund eines verringerten First-Pass-Metabolismus oder einer verlangsamten Ausscheidung zu erhöhten Plasmakonzentrationen und zu einer verlängerten Wirkungsdauer von Nimodipin.
Dadurch kann die blutdrucksenkende Wirkung verstärkt sein. Dieser Effekt kann über mindestens 4 Tage nach der letzten Einnahme von Grapefruitsaft anhalten.
Während der Nimodipin-Behandlung ist deshalb der Genuss von Grapefruit bzw. Grapefruitsaft zu vermeiden (siehe Abschnitt 4.2).
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Erfahrungen aus geeigneten und kontrollierten klinischen Studien mit Schwangeren liegen nicht vor. Wenn Nimotop S während der Schwangerschaft angewendet werden soll, müssen daher Nutzen und mögliche Risiken entsprechend der Schwere des Krankheitsbildes gegeneinander abgewogen werden.
Stillzeit
Nimodipin und seine Metaboliten treten in der Muttermilch in Konzentrationen von vergleichbarer Größenordnung wie im Plasma der Mutter auf. Mütter sollten daher während der Behandlung nicht stillen.
Fertilität
Bei der in-vitro-Fertilisation wurden Calciumantagonisten in einzelnen Fällen mit reversiblen biochemischen Veränderungen der Spermienköpfe in Verbindung gebracht, was zu einer eingeschränkten Funktion der Spermien führen könnte. Es ist nicht bekannt, inwieweit dieser Befund bei einer kurzzeitigen Behandlung von Bedeutung ist.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Prinzipiell kann Nimotop S in Verbindung mit dem möglichen Auftreten von Schwindel die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Bei Anwendung von Nimodipin-Infusionslösung ist diese Wirkung in der Regel nicht von Bedeutung.
4.8 Nebenwirkungen
Im Folgenden sind die in klinischen Studien mit Nimodipin in der Indikation aSAH (placebokontrollierte Studien: Nimodipin N = 703, Placebo N = 692; nicht-kontrollierte Studien: Nimodipin N = 2496; Stand: 31.08.2005) beobachteten Nebenwirkungen gemäß CIMOS III nach Häufigkeitskategorien sortiert. Innerhalb jeder Häufigkeitskategorie werden die Nebenwirkungen nach abnehmendem Schweregrad aufgeführt.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (> 1/10)
Häufig (> 1/100, < 1/10)
Gelegentlich (> 1/1.000, < 1/100)
Selten (> 1/10.000, < 1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Gelegentlich |
Selten | |
|
Erkrankungen des Blutes und des Lymphsystems |
Thrombozytopenie | |
|
Erkrankungen des Immunsystems |
Allergische Reaktion, Hautausschlag | |
|
Erkrankungen des Nervensystems |
Kopfschmerz |
|
Herzerkrankungen |
Tachykardie |
Bradykardie |
|
Gefäßerkrankungen |
Hypotonie, Vasodilatation | |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit |
Ileus |
|
Leber- und Gallenerkrankungen |
Vorübergehender Anstieg der Leberenzymwerte |
Mit Nimotop S, Infusionslösung traten zusätzlich folgende Nebenwirkungen auf:
|
Gelegentlich |
Selten | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Reaktionen an der Injektions- und Infusionsstelle, Thrombophlebitis an der Infusionsstelle |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome der Intoxikation
Als Folge einer akuten Überdosierung muss mit deutlicher Blutdrucksenkung, Tachykardie oder Bradykardie und nach oraler Applikation Magen-Darm-Beschwerden und Übelkeit gerechnet werden.
Therapie von Intoxikationen
Bei akuter Überdosierung muss die Behandlung mit Nimotop S sofort unterbrochen werden. Notfallmaßnahmen sollten sich nach den Symptomen richten. Bei oraler Einnahme ist als sofortige Therapiemaßnahme eine Magenspülung mit Medizinischer Kohle in Betracht zu ziehen. Bei starkem Blutdruckabfall sollte Dopamin oder Noradrenalin intravenös verabreicht werden. Da kein spezifisches Antidot bekannt ist, sollte sich die weitere Behandlung nach den im Vordergrund stehenden Symptomen richten.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Zerebraltherapeutikum, Calciumkanalblocker,
ATC-Code: C08CA06
Wirkmechanismus
Nimodipin ist ein Calciumantagonist aus der 1,4-Dihydropyridingruppe. Die Substanz durchdringt aufgrund ihrer hohen Lipophilie gut die Blut-Hirn-Schranke. Im Tierexperiment bindet Nimodipin mit hoher Affinität und Selektivität an Ca2+-Kanäle vom L-Typ und blockiert hierüber den transmembranösen Ca2+-Einstrom. Es wird angenommen, dass Nimodipin in den pathologischen Zuständen, die mit einer vermehrten Einströmung von Ca2+-Ionen in die Nervenzellen einhergehen, z. B. bei Hirnischämie, die Stabilität und Funktionsfähigkeit verbessert. Die bei einer Subarachnoidalblutung auftretenden ischämischen neurologischen Schäden und die Letalität wurden so durch Nimodipin signifikant vermindert.
Resorption
Die Absorption des oral verabreichten Wirkstoffes Nimodipin erfolgt praktisch vollständig. Bereits 10 - 15 Minuten nach Tablettengabe können der unveränderte Wirkstoff und seine frühen "first-pass"-Stoffwechselprodukte im Plasma nachgewiesen werden. Nach mehrfacher oraler Gabe (3 x 30 mg täglich) werden mittlere maximale Plasmakonzentrationen (Cmax) von 7,3 - 43,2 ng/ml bei älteren Menschen gemessen, die nach 0,6 - 1,6 Stunden (tmax) erreicht werden. Nach einer Einmaldosis von 30 mg bzw. 60 mg werden bei jungen Menschen mittlere maximale Plasmakonzentrationen von 16 ± 8 ng/ml bzw. 31 ± 12 ng/ml gemessen. Die maximale Plasmakonzentration und die Fläche unter der Kurve (AUC) steigen bis zur höchsten geprüften Dosierung von 90 mg dosisproportional an.
Bei Dauerinfusion von 0,03 mg/kg/h werden mittlere steady-state-Plasmakonzentrationen von 17,6 - 26,6 ng/ml erreicht. Nach intravenöser Bolus-Injektion fallen die NimodipinPlasmakonzentrationen biphasisch mit Halbwertszeiten von 5 - 10 Minuten und von etwa 60 Minuten ab. Das Verteilungsvolumen (Vss, nach Zwei-Kompartiment-Modell berechnet) wird bei i.v.-Gabe zu 0,9 - 1,6 l/kg KG berechnet. Die totale (systemische) Clearance beträgt 0,6 - 1,9 l/h/kg.
Proteinbindung und Verteilung
Nimodipin wird zu 97 - 99% an Plasmaproteine gebunden. Nimodipin hat sich im Tierversuch als plazentagängig erwiesen. Obwohl hierüber keine Humandaten vorliegen, ist eine Plazentagängigkeit auch für den Menschen anzunehmen. Bei Versuchen an Ratten wurden in der Milch der Muttertiere wesentlich höhere Konzentrationen von Nimodipin und/oder seinen Metaboliten nachgewiesen als im Plasma. Beim Menschen wird Nimodipin in der Muttermilch in Konzentrationen von vergleichbarer Größenordnung wie im Plasma gemessen.
Nimodipin kann nach oraler und i.v.-Gabe in der Zerebrospinalflüssigkeit in Konzentrationen nachgewiesen werden, die ca. 0,5% der gemessenen Plasmakonzentrationen betragen. Diese entsprechen etwa der freien Konzentration im Plasma.
Biotransformation. Elimination und Exkretion
Nimodipin wird über das Cytochrom-P450-3A4-System metabolisch eliminiert. Dabei stehen die Dehydrogenierung des Dihydropyridin-Ringes und die oxidative Esterspaltung im Vordergrund. Die oxidative Esterspaltung, die Hydroxylierung der 2- und 6-Methylgruppen und die Glukuronidierung als Konjugationsreaktion sind weitere wichtige Metabolisierungsschritte. Die im Plasma auftretenden drei primären Metabolite zeigen keine oder nur therapeutisch unbedeutende Restaktivität.
Eine Beeinflussung der Leberenzyme durch Induktion oder Hemmung ist nicht bekannt. Die Metaboliten werden beim Menschen zu ca. 50% renal und zu ca. 30% biliär ausgeschieden.
Die Eliminationskinetik ist linear. Die Halbwertszeit für Nimodipin beträgt zwischen
1,1 - 1,7 Stunden. Die terminale Halbwertszeit von 5 - 10 Stunden ist für die Festlegung des
Dosisintervalls nicht von Bedeutung.
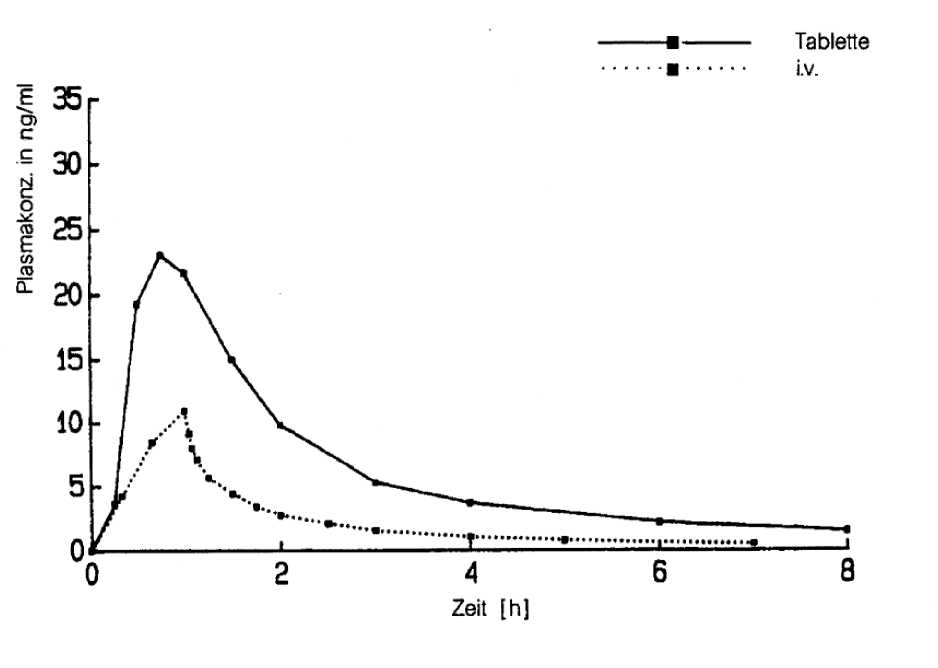
Mittlere Plasmakonzentrationsverläufe von Nimodipin nach oraler Gabe von 30 mg als Tablette und nach intravenöser Infusion von 0,015 mg/kg für eine Stunde (n = 24, ältere Probanden)
Bioverfügbarkeit
Aufgrund der hohen Metabolisierungsrate bei der ersten Leberpassage ("first-pass" ca. 85 - 95%) beträgt die absolute Bioverfügbarkeit 5 - 15%.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Toxizität bei einmaliger und wiederholter Gabe, zur Genotoxizität zum kanzerogenen Potential und zum Einfluss auf die männliche und weibliche Fertilität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Bei trächtigen Ratten führten Dosen von 30 mg/kg/Tag und höher zu verringertem Wachstum und Gewicht der Föten. Bei 100 mg/kg/Tag starben die Embryos ab. Teratogene Wirkungen wurden nicht beobachtet. An Kaninchen traten bei Dosen bis zu 10 mg/kg/Tag keine Embryotoxizität und Teratogenität auf. In einer Studie zur peri-postnatalen Toxizität an Ratten bewirkten Dosen von 10 mg/kg/Tag und mehr eine Zunahme der Sterblichkeit und eine verzögerte körperliche Entwicklung. In weiteren durchgeführten Studien wurden diese Ergebnisse nicht bestätigt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Nimotop S, Infusionslösung
Ethanol 96%, Macrogol 400, Natriumcitrat 2 H2O, wasserfreie Citronensäure, Wasser für Injektionszwecke.
Nimotop S, Filmtabletten
Mikrokristalline Cellulose, Maisstärke, Povidon K25, Crospovidon, Magnesiumstearat, Hypromellose, Macrogol 4000, Titandioxid (E 171), Eisen(III)-hydroxid-oxid (gelb, E 172).
Nimotop S, Infusionslösung
Da der Wirkstoff von Nimotop S, Infusionslösung von Polyvinylchlorid (PVC) absorbiert wird, dürfen nur Infusionspumpen mit Infusionsleitungen aus Polyethylen (PE) verwendet werden.
Nimotop S, Infusionslösung darf nicht mit anderen Arzneimitteln gemischt oder Infusionsbeuteln oder -flaschen zugegeben werden.
6.3 Dauer der Haltbarkeit
Nimotop S, Infusionslösung
4 Jahre
Nimotop S, Infusionslösung ist eine klare, leicht gelbliche Lösung. Flaschen mit getrübtem Inhalt oder Farbänderungen sind von der Verwendung auszuschließen. Nicht verwendete Restmengen sind zu verwerfen.
Nimotop S, Filmtabletten
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nimotop S, Infusionslösung
Die Flaschen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweis zum Lichtschutz unter Anwendungsbedingungen siehe Abschnitt 4.4.
Nimotop S, Filmtabletten
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses Nimotop S, Infusionslösung
Faltschachteln mit 50 ml Braunglasflasche (Glas Typ 2) mit Gummistopfen und farbiger Bördelkappe sowie Infusionsleitung (PE)
Packungen mit 5 Flaschen und 5 Infusionsleitungen
Nimotop S, Filmtabletten
Faltschachteln mit PP/Aluminiumfolie-Blistern
Packungen mit 100 Filmtabletten
Klinikpackung (gebündelt) mit 400 (10 x 40) Filmtabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNGEN
Bayer Vital GmbH
51368 Leverkusen
Tel.: 0214/30-5 13 48
Fax: 0214/30-5 16 03
E-Mail: bayer-vital@bayerhealthcare.com
8. ZULASSUNGSNUMMER(N)
Nimotop S, Infusionslösung
4209.00. 00
Nimotop S, Filmtabletten
4209.00. 02
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNGEN DER ZULASSUNG
Datum der Erteilung der Zulassung: 25. Februar 1985 Datum der letzten Verlängerung der Zulassung: 30. Juni 2005
10. STAND DER INFORMATION
Juni 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
13