Nitroxolin Forte
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels)
Nitroxolin forte Wirkstoff: Nitroxolin
1. BEZEICHNUNG DES ARZNEIMITTELS
Nitroxolin forte 250 mg, Weichkapseln
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Kapsel Nitroxolin forte enthält 250 mg Nitroxolin.
Sonstiger Bestandteil mit bekannter Wirkung: Sojaöl, Ponceau 4R (E124)
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Weichkapsel
4. KLINISCHE ANGABEN 4.1. Anwendungsgebiete
Akute und chronische Infektionen der ableitenden Harnwege (z.B. Cystitis, Urethritis, Ureteritis) mit Nitroxolin-empfindlichen Bakterien und Sprosspilzen. Rezidivprophylaxe.
4.2 Dosierung und Art der Anwendung
Dosierung
Akute Harnwegsinfekte:
Soweit nicht anders verordnet, nehmen Erwachsene 3 x täglich eine Kapsel Nitroxolin forte ein.
Bei chronischen Harnwegsinfekten und zur Rezidivprophylaxe empfiehlt sich die tägliche Einnahme von 1-2 Kapseln Nitroxolin forte.
Art der Anwendung
Nitroxolin forte Kapseln sollten über den Tag verteilt mit einem Glas Wasser möglichst vor den Hauptmahlzeiten eingenommen werden. Bei besonderer Magenempfindlichkeit kann die Einnahme auch 1-2 Stunden nach einer Mahlzeit erfolgen.
Zur Rezidivprophylaxe empfiehlt sich die Einnahme abends vor der Nachtruhe.
4.3 Gegenanzeigen
Nitroxolin forte darf nicht eingenommen werden
- bei Überempfindlichkeit gegenüber Nitroxolin, Sojaöl, Ponceau 4R (E124) oder einem der sonstigen Bestandteile von Nitroxolin forte.
- bei schweren Nieren- und Leberfunktionsstörungen.
Zur Anwendung in Schwangerschaft und Stillzeit, siehe Abschnitt 4.6.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei längerfristiger Anwendung sollten die Leberwerte regelmäßig kontrolliert werden.
Sojaöl und Ponceau 4R (E124) können in seltenen Fällen schwere allergische Reaktionen hervorrufen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Aufgrund theoretischer Überlegungen kann bei gleichzeitiger Einnahme hochdosierter Mineralstoffpräparate mit Nitroxolin forte ein hemmender Einfluss auf die Wirksamkeit von Nitroxolin nicht ausgeschlossen werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine klinischen Daten zu einer Anwendung von Nitroxolin in der Schwangerschaft vor. Tierexperimentelle Studien zur Reproduktionstoxizität von Nitroxolin wurden nicht durchgeführt (siehe 5.3). Aufgrund der vorliegenden Daten zur Toxikologie kann jedoch ein neurotoxisches Risiko für den Fetus/Embryo nicht generell ausgeschlossen werden (siehe 5.3).
Daher darf Nitroxolin forte in der Schwangerschaft nur angewendet werden, wenn aufgrund der individuellen Resistenzsituation (Antibiogramm) eine zwingende Indikation vorliegt.
Stillzeit
Da keine Daten zum Übertritt in die Muttermilch vorliegen, soll Nitroxolin forte während der Stillzeit nicht angewendet werden. Beim gestillten Säugling ist die Möglichkeit einer Beeinflussung der physiologischen Darmflora mit Durchfall oder Sprosspilzbesiedlung zu beachten. An die Möglichkeit einer Sensibilisierung sollte gedacht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nach bisherigen Erfahrungen hat Nitroxolin im Allgemeinen keinen Einfluss auf die Konzentrationsund Reaktionsfähigkeit. Sehr selten können allerdings Nebenwirkungen wie Schwindel und Gangunsicherheit auftreten (siehe 4.8), die zu Risiken bei der Ausübung der genannten Tätigkeiten führen können.
4.8 Nebenwirkungen
Häufig (> 1 % - < 10 %) können gastrointestinale Beschwerden (z. B. Übelkeit, Erbrechen, Diarrhoe) auftreten. Diese Erscheinungen gehen meist während der Behandlung zurück und erfordern im Allgemeinen keinen Therapieabbruch.
Gelegentlich (> 0,1 % - < 1 %) treten allergische Hauterscheinungen (Rötung, Jucken) auf, die entweder passager sind oder sich nach Absetzen des Präparates zurückbilden.
Selten (> 0,01 % - < 0,1 %) wurden unter der Therapie allergische Blutbildveränderungen (Thrombozytopenie) beobachtet.
Sehr selten (< 0,01 %) können neurologische Nebenwirkungen wie Müdigkeit, Kopfschmerz, Schwindel und Gangunsicherheit auftreten.
Hinweis:
Der Wirkstoff Nitroxolin hat eine intensiv gelbe Farbe. Selten (> 0,01 % - < 0,1 %) kann es zu einer geringfügigen Ausscheidung der Wirksubstanz mit dem Schweiß kommen. Dies kann zu einer unbedenklichen und vorübergehenden Gelbfärbung von Haut, Haaren, und Nägeln führen. Sehr selten (< 0,01 %) ist auch eine vorübergehende Gelbfärbung der Skleren möglich.
Sojaöl und Ponceau 4R (E124) können in seltenen Fällen (> 0,1 % - < 1 %) schwere allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Trotz der vielfältigen Anwendung von Nitroxolin ist erst ein Fall einer akuten (in suizidaler Absicht herbeigeführten) Überdosierung mit 5.000 mg Nitroxolin bekannt geworden. Zum Zeitpunkt ihrer stationären Aufnahme war die Patientin müde, jedoch bewusstseinsklar und voll orientiert. Es wurden keine weiteren Intoxikationssymptome festgestellt. Ohne dass weitere Maßnahmen ergriffen wurden, erholte sich die Patientin.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
ATC-Code: J01XX07
Pharmakotherapeutische Gruppe: Harnwegstherapeutikum
Nitroxolin ist ein Antibiotikum mit antibakteriellen und antimykotischen Eigenschaften.
Nitroxolin ist ein Chelatbildner für zweiwertige Kationen. In therapeutisch erreichbaren Konzentrationen wirkt die Substanz vorwiegend bakteriostatisch gegenüber den meisten gramnegativen und grampositiven bakteriellen Erregern von Harnwegsinfektionen. Auf Grund des Wirkmechanismus (Komplexierung von zweiwertigen Kationen) ist Resistenzbildung in Form von Einschrittmutationen unwahrscheinlich.
Das Wirkspektrum umfasst ferner mykotische Erreger, so z.B. humanpathogene Arten der Gattung Candida. Dabei beruht der Wirkmechanismus auf einer selektiven Hemmung bestimmter Enzyme, insbesondere der RNA-Polymerase.
Subinhibitorische Konzentrationen (kleiner MHK/32) inhibieren bereits die bakterielle Adhäsion. Da dies der zentrale und initiierende Schritt einer Harnwegsinfektion ist, eignet sich Nitroxolin zur Infektions- und Rezidivprophylaxe.
Vom Nationalen Antibiotika-Sensitivitätstest-Komitee (NAK) wurden folgende Grenzwerte für Escherichia coli festgelegt:
|
MHK [mg/l] |
Agardiffusion [mm]* | |
|
S < 16 R > 16 |
S > 17 |
R < 171 |
* Die Beschickungsmenge der Testblättchen beträgt 30 |jg.
1 Für Isolate mit Hemmhofdurchmessern 13 - 16 mm muss das Vorliegen von Resistenz mittels MHK-Bestimmung bestätigt werden.
Die Grenzwerte besitzen nur eine Gültigkeit für Isolate von Patienten mit unkomplizierter Zystitis.
In der folgenden Tabelle sind klinisch relevante Erreger auf Grund von in vitro Daten als empfindlich oder resistent eingestuft.
Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation erforderlich.
Die Angaben machen nur eine Aussage über die Wahrscheinlichkeit, ob Mikroorganismen gegenüber Nitroxolin empfindlich sind oder nicht.
I_Üblicherweise empfindliche Spezies:
Staphylococcus aureus_
Staphylococcus epidermidis_
ß-hämolytische Streptokokken_
Citrobacter spp._
Enterobacter spp._
Escherichia coli_
Klebsiella oxytoca_
Morganella morganii_
Proteus mirabilis_
Proteus vulgaris_
Providencia spp._
Mycoplasma hominis_
Ureaplasma urealyticum_
Candida albicans_
Candida (Torulopsis) glabrata_

5.2 Pharmakokinetische Eigenschaften
Oral appliziertes Nitroxolin wird rasch und nahezu vollständig im Darm resorbiert. 15 - 30 Minuten nach einer oralen Gabe von Nitroxolin ist der Wirkstoff im Blut nachweisbar. Maximale Plasmaspiegel werden nach 1 - 1,5 Stunden erreicht.
Wirksame Serum- oder Gewebespiegel werden nicht nachgewiesen, mit Ausnahme der Prostata, in der nach höherer Dosierung therapeutisch wirksame Nitroxolin-Spiegel gefunden wurden. Die Plasmaeiweißbindung beträgt ca. 10 %.
Die Elimination erfolgt größtenteils renal, überwiegend in Form von glucuronierten und sulfatierten Konjugaten. Die mittlere Halbwertszeit im Urin beträgt ca. 2 Stunden. Bei mäßig eingeschränkter Nierenfunktion (Kreatinin im Serum bei 2 mg/100 ml) erfolgt die Ausscheidung zeitlich verzögert, klinisch wirksame Urinspiegel werden jedoch erreicht. Bei stärkerer Niereninsuffizienz (Kreatinin im Serum > 2 mg/100 ml) ist die Elimination von Nitroxolin und damit die klinische Wirksamkeit nicht mehr gewährleistet.
Unter extremen Bedingungen (z.B. Sauna) kann Nitroxolin in geringen Mengen auch über den Schweiß ausgeschieden werden.
Im Urin werden nach 1 - 2 Stunden bakteriologisch aktive Konzentrationen erreicht. Bioverfügbarkeit
Eine im Jahr 1992 durchgeführte Bioverfügbarkeitsuntersuchung erbrachte folgende Ergebnisse: Plasmakonzentrationen im Vergleich zum Referenzpräparat (Pilotuntersuchung an 3 Probanden):
|
Parameter |
Testpräparat Nitroxolin Kapsel 250 mg |
Referenzpräparat Nitroxolin Suspension 250 mg |
|
Cmax [Pg/ml] tmax [h] AUC0- [pgh/ml] |
6,09 - 7,78 1,02 - 1,52 15,11 - 17,68 |
6,17 - 9,56 1,50 - 2,50 14,43 - 20,08 |
Urinspiegelverläufe nach Gabe von 250 mg Nitroxolin (Nitroxolin forte Kapsel bzw. Nitroxolin Suspension) bei 24 Probanden (Konzentrations-Zeit-Diagramm):
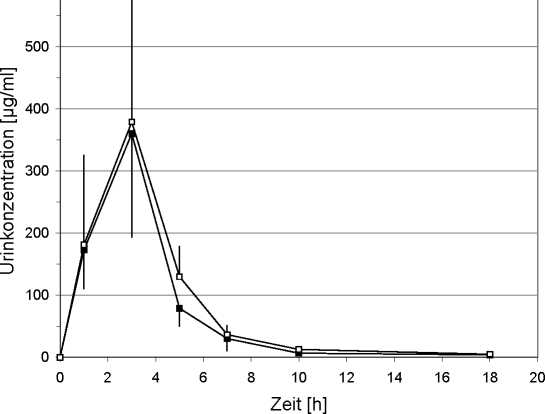
—Nitroxolin Kapsel Nitroxolin Suspension
5.3 Präklinische Daten zur Sicherheit
In den Untersuchungen zur akuten und chronischen oralen Toxizität von Nitroxolin an Maus, Ratte, Katze und Hund wurden dosisabhängige neurotoxische Symptome beschrieben. Hohe Dosen führten bei Nagern zu pathomorphologischen Veränderungen in den motorischen Neuronen des Rückenmarks und im peripheren Nervensystem. Weitere toxische Wirkungen von Nitroxolin bedingten dosisabhängige pathomorphologische Veränderungen in den parenchymatösen Organen. In einer Studie zur Langzeitanwendung hoher Dosierungen wurden bei Ratten Katarakte beobachtet. In anderen Studien und bei anderen Tierspezies wurden solche Effekte jedoch nicht beobachtet.
Bisherige in-vitro- und in-vivo-Tests zur genetischen Toxikologie verliefen negativ. Langzeituntersuchungen zum kanzerogenen Potential liegen nicht vor.
Es wurden keine relevanten tierexperimentellen Studien zur Reproduktionstoxizität von Nitroxolin durchgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Gelbes Wachs, hydriertes Sojaöl (Ph. Eur.), partiell hydriertes Sojaöl (DAB), entölte Phospholipide aus Sojabohnen, mittelkettige Triglyceride, 3-Ethoxy-4-hydroxybenzaldehyd, 1-(4-Methoxyphe-nyl)ethanon, Gelatine, Glycerol, gereinigtes Wasser, Titandioxid (E 171), Ponceau 4R (E 124).
6.2 Inkompatibilitäten
bisher keine bekannt
6.3 Dauer der Haltbarkeit
Nitroxolin forte Kapseln sind 3 Jahre haltbar.
Nach Ablauf des Verfalldatums soll das Arzneimittel nicht mehr angewandt werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
PVC/Aluminium-Blisterpackungen in Faltschachteln
Packungsgrößen:
10 Kapseln 20 Kapseln 50 Kapseln 100 Kapseln
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nitroxolin ist von gelber Farbe. Da der Wirkstoff über den Urin ausgeschieden wird, führt dies zu einer unbedenklichen Gelbfärbung des Harns. Verfärbungen der Unterwäsche werden bei normalem Waschvorgang wieder entfernt. Wäsche aus Synthetikfasern sollte während einer Behandlung mit Nitroxolin forte vorsorglich nicht getragen werden.
7. INHABER DER ZULASSUNG
Chephasaar
Chem.-pharm. Fabrik GmbH Mühlstr. 50 66386 St. Ingbert
Mitvertrieb
Rosen Pharma GmbH Kirkeler Str. 41 66440 Blieskastel Tel.: 0 68 42 / 96 17-0 Fax: 0 68 42 / 96 17-550
Vertrieb
MIP Pharma GmbH Kirkeler Str. 41 66440 Blieskastel
8. ZULASSUNGSNUMMER(N)
6143515.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
31.01.2005
10. STAND DER INFORMATION
Juni 2016
VERKAUFSABGRENZUNG
Verschreibungspflichtig