Otoflamm 250 Mikrogramm/Ml Ohrentropfen, Lösung Im Einzeldosisbehältnis
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS
OtoFlamm
250 Mikrogramm/ml Ohrentropfen, Lösung im Einzeldosisbehältnis
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Lösung enthält 250 pg Fluocinolonacetonid.
Eine Ampulle mit 0,4 ml Lösung enthält 100 pg Fluocinolonacetonid. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Ohrentropfen, Lösung Klare, wässrige Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
OtoFlamm enthält ein niedrig- bis mittelstarkes Kortikosteroid und wird angewendet bei Erwachsenen mit unverletztem Trommelfell zur Behandlung von trockenen Gehörgangsekzemen.
4.2 Dosierung und Art der Anwendung
Zur Anwendung am Ohr Dosierung
Zweimal täglich den Inhalt von 1 Einzeldosisbehältnis in das betroffene Ohr tropfen. Die Behandlungsdauer beträgt 7 Tage.
Kinder und Jugendliche
Die Behandlung des Gehörgangsekzems mit Fluocinolonacetonid wurde bei Kindern und Jugendlichen nicht untersucht. Daher wird die Anwendung dieses Arzneimittels in diesen Altersgruppen nicht empfohlen.
Art der Anwendung
Bei der Instillation der Ohrentropfen sollte der Patient so gelagert werden, dass das betroffene Ohr nach oben zeigt. Nach der Instillation viermal in einer „pumpartigen“ Bewegung den Tragus nach innen drücken, um das Eindringen des Arzneimittels in den Gehörgang zu unterstützen. Anschließend sollte der Patient etwa eine weitere Minute in der gleichen Position liegen bleiben. Falls erforderlich die Anwendung am anderen Ohr wiederholen.
Die Ampulle vor der Instillation in der Hand erwärmen, um keine kalte Lösung in das Ohr zu tropfen.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff Fluocinolonacetonid, andere Kortikosteroide oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
OtoFlamm ist ausschließlich für die Anwendung am Ohr bestimmt. OtoFlamm darf nicht am Auge angewendet und nicht injiziert werden.
Die Behandlung mit OtoFlamm muss bei den ersten Anzeichen eines Hautausschlags oder anderen Zeichen einer lokalen oder systemischen Überempfindlichkeit abgesetzt werden.
Bei gleichzeitig bestehender Ohrinfektion oder bei Auftreten einer Ohrinfektion während der Behandlung mit OtoFlamm ist ein geeignetes antimykotisches oder antibakterielles Arzneimittel anzuwenden. Wenn die Infektion hierauf nicht sofort anspricht, sollte die Behandlung mit OtoFlamm ausgesetzt werden, bis die Infektion unter Kontrolle ist.
Das Arzneimittel ist in der niedrigsten Dosis und nur für die Dauer anzuwenden, die absolut notwendig ist, um die gewünschte therapeutische Wirkung zu erzielen und aufrecht zu erhalten.
Glukokortikosteroide sind nicht für die Behandlung von nicht-trockenen Gehörgangsekzemen geeignet. Allgemeines
Bei einigen Patienten kam es nach Anwendung topischer Kortikosteroide in Gesamtdosen von mehr als 2 g (etwa das 1.000fache der Höchstdosis von OtoFlamm) zu einer reversiblen Suppression der Hypothalamus-Hypophysen-Nebennieren-Achse. Allerdings wurde eine derartige Suppression nach Anwendung von Kortikosteroiden am Ohr nicht beobachtet. Angesichts der niedrigen Gesamtdosis einer Behandlung mit OtoFlamm ist nicht damit zu rechnen, dass die systemische Exposition mit dem Wirkstoff zu messbaren Veränderungen der Kortisol-Spiegel führt.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
In tierexperimentellen Studien waren systemisch verabreichte Kortikosteroide im Allgemeinen bereits in relativ niedrigen Dosen teratogen. Stärker wirksame Kortikosteroide waren in tierexperimentellen Studien auch nach dermaler Applikation teratogen.
Es gibt keine hinreichenden und gut kontrollierten Studien zu den teratogenen Auswirkungen topisch applizierter Kortikosteroide bei Schwangeren. Daher sollten topische Kortikosteroide in der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Feten rechtfertigt. Arzneimittel dieser Klasse sollten in der Schwangerschaft nicht extensiv (in hohen Dosen oder für längere Dauer) angewendet werden.
Stillzeit
Systemisch verabreichte Kortikosteroide werden in die Muttermilch ausgeschieden und könnten beim gestillten Säugling das Wachstum unterdrücken, die endogene Kortikosteroid-Synthese beeinflussen oder andere unerwünschte Wirkungen haben. Es ist nicht bekannt, ob Kortikosteroide nach topischer Verabreichung in ausreichendem Maß systemisch resorbiert werden, um in der Muttermilch nachweisbar zu sein. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist bei Anwendung von OtoFlamm in der Stillzeit Vorsicht geboten.
Fertilität
Es wurden keine tierexperimentellen Studien durchgeführt, in denen die Auswirkungen von topischem Fluocinolonacetonid auf die Fertilität untersucht wurden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
OtoFlamm hat einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Die beschriebenen Nebenwirkungen wurden mit Hilfe der MedDRA-Terminologie klassifiziert:
|
Sehr häufig |
(> |
1/10) |
|
Häufig |
(> |
1/100 bis < 1/10) |
|
Gelegentlich |
(> |
1/1.000 bis < 1/100) |
|
Selten |
(> |
1/10.000 bis < 1/1.000) |
|
Sehr selten |
(< |
1/10.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Brennen, Trockenheit an der Applikationsstelle, Pruritus an der Verabreichungsstelle
Erkrankungen der Haut und des Unterhautzellgewebes Häufig: Pruritus, Hautreizung
Gelegentlich: Follikulitis, Akne, Hautverfärbung, Dermatitis, Kontaktdermatitis
Selten: Hautatrophie, Hautstriae, Hautausschlag
Erkrankungen des Ohrs und des Labyrinths
Häufig: Ohrenbeschwerden, Ohrenerkrankung
Infektionen und parasitäre Erkrankungen Selten: Infektion
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Topisch angewandte Kortikosteroide können in ausreichenden Mengen resorbiert werden, um systemische Wirkungen hervorzurufen (siehe Abschnitt 4.4).
Bei versehentlicher Einnahme sollten so schnell wie möglich Routinemaßnahmen wie eine Magenspülung durchgeführt werden. Es gibt kein spezifisches Antidot gegen eine Überdosierung mit Fluocinolonacetonid. Die Behandlung erfolgt symptomatisch.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Otologika, Corticosteroide ATC-Code: S02BA08
Wirkmechanismus
Fluocinolonacetonid ist ein fluoriertes synthetisches Kortikosteroid mit antiphlogistischen, antipruritischen und vasokonstriktiven Eigenschaften. Zu den frühen antiphlogistischen Wirkungen von topischen Kortikosteroiden gehören die Hemmung der Bewegung und Aktivität von Makrophagen und Leukozyten im entzündeten Bereich durch eine Aufhebung der Gefäßdilatation und -permeabilität. Spätere entzündliche Prozesse wie Kapillarbildung, Kollagenablagerung und Keloid-(Narben-)Bildung werden durch Kortikosteroide ebenfalls gehemmt.
Klinische Studien
Es wurde eine multizentrische, randomisierte, doppelblinde klinische Studie der Phase III mit parallelen Gruppen durchgeführt, an der 135 Männer und Frauen ab 18 Jahren mit der klinischen Diagnose eines Gehörgangsekzems und Eignung für eine topische Therapie teilnahmen.
Die Studie schloss Patienten mit mittelschwerem bis schwerem Juckreiz im Gehörgang (mit oder ohne Beteiligung der Ohrmuschel) und otoskopischem Befund einer Hautschuppung im Gehörgang ein.
Patienten mit klinischem und/oder exploratorischem Befund einer komplizierten ekzematösen Otitis externa oder einer mykotischen oder bakteriellen Otitis media oder Otitis externa waren von der Studie ausgeschlossen.
Die Patienten wurden für die Dauer von 7 Tagen zweimal täglich (alle 12 Stunden) mit Fluocinolonacetonid 250 pg/ml Ohrentropfen oder Placebo behandelt. Die Zuteilung der Patienten auf die beiden Behandlungsgruppen, Verum bzw. Placebo, erfolgte randomisiert. Als Placebo diente die auch im Verum verwendete Vehikellösung ohne Wirkstoff.
Wirksamkeitskriterien
Primärer Endpunkt:
- Die Wirksamkeit wurde anhand der Veränderung des Juckreizes am Behandlungsende beurteilt (mittlerer Juckreiz an den Tagen 4-8 im Vergleich zum Ausgangszustand).
Sekundäre Endpunkte:
- Veränderung des Juckreizes in der Nachbeobachtungsphase (mittlerer Juckreiz an den Tagen 9-15 im Vergleich zum Ausgangszustand).
- Änderung des mittleren Punktwerts für otoskopische Befunde (Erythem, Ödem und Schuppung) am Behandlungsende (Tag 8) im Vergleich zum Ausgangszustand (Tag 1).
- Änderung des mittleren Punktwertes für otoskopische Befunde (Erythem, Ödem und Schuppung) bei der Nachbeobachtung (Tag 15) im Vergleich zum Ausgangszustand (Tag 1).
Wirksamkeitsergebnisse
Die mittleren Ausgangswerte waren in den beiden Behandlungsgruppen nahezu identisch (2,34 in der Placebo-Gruppe und 2,37 in der Fluocinolonacetonid-Gruppe).
Die Wirksamkeit von Fluocinolonacetonid-Ohrentropfen wurde durch die Studie nachgewiesen: Die präspezifizierte primäre Wirksamkeitsanalyse am „Full Analysis Set“ (FAS), die die Änderung des Juckreizes an Tag 8 (Behandlungsende) verglich, zeigte in der Fluocinolonacetonid-Gruppe eine signifikant ausgeprägtere Reduktion als in der Placebo-Gruppe (p = 0,005). Bei Verwendung der Last-Observation-Carried-Forward-(LOCF-)Methode wurde eine mittlere Differenz von -0,36 Punkten zugunsten des experimentellen Behandlungsarms beobachtet. Die folgende Abbildung zeigt den Verlauf des mittleren Punktwertes für Juckreiz über die Zeit (Tage) in den beiden Behandlungsgruppen.
N
E
Ü
r
o
3
c
3
Q_
£
v
2,0
1,5
0,5
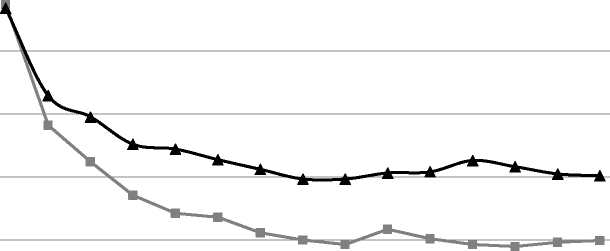
■ Fluociolonacetonid
Placebo
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Tage
Sekundäre Wirksamkeitsanalysen zeigten ebenfalls unter der Fluocinolonacetonid-Therapie signifikant bessere Ergebnisse als unter Placebo: Der Juckreiz hatte sich zum Zeitpunkt der Nachbeobachtung gebessert und auch im Hinblick auf die individuellen und Gesamtpunktwerte für otoskopische Befunde, sowohl am Behandlungsende als auch bei der Nachbeobachtung zeigten sich Vorteile der Fluocinolonacetonid-Gruppe gegenüber der Placebo-Gruppe.
5.2 Pharmakokinetische Eigenschaften
Resorption
Fluocinolonacetonid wird nach topischer Verabreichung allgemein nur wenig resorbiert. Dabei scheint die Resorption je nach Applikationsort zu variieren. Es gibt keine Daten zur Resorption nach topischer Anwendung am Ohr.
Das Ausmaß der perkutanen Resorption von topischen Kortikosteroiden ist von vielen Faktoren abhängig, wie dem Vehikel, der Integrität des Epithels und der Anwendung eines Okklusivverbands.
Topische Kortikosteroide können durch gesunde Haut resorbiert werden. Bei Vorliegen von Entzündungen und/oder anderen Hauterkrankungen ist die perkutane Resorption erhöht.
Nach Resorption durch die Haut entsprechen die pharmakokinetischen Eigenschaften denen von systemisch verabreichten Kortikosteroiden.
Kortikosteroide werden in unterschiedlichem Maß an Plasmaproteine gebunden. Sie werden vorwiegend in der Leber metabolisiert und anschließend über die Nieren ausgeschieden. Einige topische Kortikosteroide und deren Metabolite werden auch über die Galle ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Bezüglich der potenziellen Ototoxizität und lokalen Verträglichkeit von Fluocinolonacetonid zeigten die Ergebnisse präklinischer Studien nach intratympanaler Verabreichung der Kombination aus Fluocinolonacetonid 0,025 % plus Ciprofloxacin 0,3 % ein geringes Potential für Ototoxizität und systemische Toxizität. Die Ergebnisse von tierexperimentellen Studien weisen darauf hin, dass diese Kombination die Haut nicht reizt und nicht sensibilisiert.
Fluocinolonacetonid war in vitro im Ames-Test und Maus-Lymphom-TK-Test und in vivo im MikronukleusTest am Knochenmark von Mäusen nicht genotoxisch.
Es wurden keine tierexperimentellen Langzeitstudien zum kanzerogenen Potential von Fluocinolonacetonid durchgeführt.
Einige Kortikosteroide erwiesen sich in tierexperimentellen Studien nach dermaler Applikation als teratogen, allerdings gibt es keine hinreichenden und gut kontrollierten Studien zur Reproduktions- und Entwicklungstoxizität von Fluocinolonacetonid.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Polysorbat 80 Glycerol Povidon K90F Milchsäure
Natriumhydroxid-Lösung 4 % (m/v) Gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Drei Monate nach Öffnen der Schutzfolie entsorgen.
Die Ampullen nach der Anwendung entsorgen.
6.5 Art und Inhalt des Behältnisses
Die Lösung ist in Kunststoff-Ampullen aus Polyethylen niedriger Dichte (LDPE) abgefüllt. Jedes Einzeldosisbehältnis (Ampulle) enthält 0,4 ml. Die Ampullen sind zum Schutz in einem Folienbeutel aus Aluminium verpackt.
Ein Folienbeutel enthält 15 Ampullen.
Eine Packung enthält 15 oder 30 Ampullen. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen für die Beseitigung.
7. INHABER DER ZULASSUNG
INFECTOPHARM Arzneimittel und Consilium GmbH
Von-Humboldt-Str. 1
64646 Heppenheim
Tel.: 0 62 52/95 70 00
Fax: 0 62 52/95 88 44
E-Mail: kontakt@infectopharm.com
Internet: www.infectopharm.com
8. ZULASSUNGSNUMMER(N)
91816.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
20.04.2015
10. STAND DER INFORMATION
April 2015
11. VERKAUFSABGRENZUNG Verschreibungspflichtig
Dieses Arzneimittel enthält den Wirkstoff Fluocinolonacetonid, dessen Wirkung [bei Erwachsenen mit unverletztem Trommelfell zur Behandlung von trockenen Gehörgangsekzemen] in der medizinischen Wissenschaft noch nicht allgemein bekannt ist.
7