Oxybutynin-Hcl Aristo 5Mg Tabletten
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Oxybutynin-HCL Aristo® 5 mg
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Oxybutynin-HCl Aristo® 5 mg
1 Tablette enthält 5 mg Oxybutyninhydrochlorid entsprechend 4,5 mg Oxybutynin.
Sonstiger Bestandteil mit bekannter Wirkung:
Jede Tablette enthält 101,2 mg Lactose (als Lactose-Monohydrat).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
Die Tablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur symptomatischen Behandlung der Überaktivität des Detrusors (Harnblasenmuskels; idiopathische oder neurogene Detrusorüberaktivität), mit den Symptomen:
- vermehrtem nächtlichen Wasserlassen (Nykturie)
- häufigem Harndrang (Pollakisurie)
- imperativem Harndrang
- unfreiwilligem Harnverlust mit Harndrang (Drang-Inkontinenz)
Kinder und Jugendliche
Oxybutyninhydrochlorid ist angezeigt bei Kindern über 5 Jahre bei:
- Harninkontinenz, imperativem Harndrang und Pollakisurie bei Blaseninstabilität, hervorgerufen durch idiopathische oder neurogene Detrusorüberaktivität.
- Nächtlicher Enuresis bei Detrusorüberaktivität, in Verbindung mit nicht medikamentöser Behandlung, sofern andere Maßnahmen versagt haben.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Dosierung ist individuell vorzunehmen. Soweit nicht anders verordnet gelten folgende Empfehlungen:
Erwachsene:
Erwachsene erhalten als initiale Dosis 1/2 Tablette Oxybutynin-HCl Aristo®5 mg 3 mal täglich (entsprechend 7,5 mg Oxybutyninhydrochlorid täglich). Anschließend ist die Regeldosis 3 mal täglich
1/2 - 1 Tablette Oxybutynin-HCl Aristo®5 mg (entsprechend 7,5 - 15 mg Oxybutynin-hydrochlorid täglich). Danach sollte die niedrigste effektive Erhaltungsdosis gewählt werden.
Bei ungenügendem Therapieerfolg kann die Dosis bis auf maximal 4 mal täglich 1 Tablette Oxybutynin-HCl Aristo®5 mg (entsprechend 20 mg Oxybutyninhydrochlorid) erhöht werden. Oxybutynin-HCl Aristo®5 mg sollte in 2 - 3 (maximal 4) Einzeldosen pro Tag eingenommen werden.
Ältere Menschen:
Ältere Menschen erhalten als initiale Dosis 2 mal täglich 1/2 Tablette Oxybutynin-HCl Aristo®5 mg (entsprechend 5 mg Oxybutyninhydrochlorid täglich). Danach sollte die niedrigste effektive Erhaltungsdosis gewählt werden.
Bei ungenügendem Therapieerfolg kann die Dosis bis auf maximal 4 mal täglich 1 Tablette Oxybutynin-HCl Aristo®5 mg (entsprechend 20 mg Oxybutyninhydrochlorid) erhöht werden.
Die Halbwertszeit ist bei älteren Menschen meist erhöht, deshalb kann eine Dosis von 10 mg pro Tag schon ausreichend sein.
Kinder über 5 Jahren:
Kinder über 5 Jahren erhalten als initiale Dosis 2 mal täglich 14 Tablette Oxybutynin-HCl Aristo®5 mg (entsprechend 5 mg Oxybutynin-hydrochlorid täglich). Danach sollte die niedrigste effektive Erhaltungsdosis gewählt werden.
Je nach Alter und Körpergewicht gelten folgende Dosierungsrichtlinien:
|
Alter |
Körpergewicht |
Dosis pro Tag |
|
5-9 Jahre |
20-30 kg |
7,5 mg aufgeteilt in 3 Einzelgaben |
|
9-12 Jahre |
30-38 kg |
10 mg aufgeteilt in 2 Einzelgaben |
|
12 Jahre u. älter |
>38 kg |
15 mg aufgeteilt in 3 Einzelgaben |
Die maximale tägliche Dosis pro kg Körpergewicht beträgt 0,3-0,4 mg, jedoch darf die Dosis für Kinder 3 Tabletten Oxybutynin-HCl Aristo®5 mg täglich (entsprechend 15 mg Oxybutyninhydrochlorid) nicht überschritten werden.
Eine Anwendung bei Kindern unter 5 Jahren wird nicht empfohlen.
Art der Anwendung
Die Tabletten können vor, während oder nach den Mahlzeiten unzerkaut mit ausreichend Flüssigkeit (ca. 1 Glas Wasser) eingenommen werden.
Die Behandlungsdauer richtet sich nach dem Auftreten der Symptome.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Patienten mit einer Blasenauslassobstruktion, die eine Harnretention auslösen kann (z.B. Prostahyperplasie, Harnröhrenstriktur)
- Obstruktion im Bereich des Magen-Darm-Trakts, intestinale Atonie oder paralytischer Ileus
- Toxisches Megakolon
- Schwere Colitis ulcerosa
- Myasthenia gravis
- Engwinkelglaukom oder flache vordere Augenkammer
4.4 Besondere Warnhinweise und Vorsichtmaßnahmen für die Anwendung
Pollakisurie oder Nykturie infolge Herz- oder Nierenfunktionsstörungen sollten vor der Therapie mit Oxybutynin-HCl Aristo® 5 mg ausgeschlossen werden.
Vorsicht ist auch geboten bei Patienten mit autonomer Neuropathie (wie z. B. ParkinsonKrankheit), schweren gastrointestinalen Motilitätsstörungen, Einschränkung der Leber- oder Nierenfunktion. Zu Patienten mit schwerer Leber- oder Niereninsuffizienz liegen keine Pharmakokinetik-Daten vor; eine Reduzierung der Dosis könnte notwendig werden.
Gastrointestinale Störungen: Anticholinergika können die gastrointestinale Motilität verringern und sollte bei Patienten mit Colitis ulcerosa mit Vorsicht angewendet werden.
Oxybutynin-HCl Aristo® kann eine Tachykardie (sowie Hyperthyreose, Herzinsuffizienz, Herzrhythmusstörungen, koronare Herzkrankheit, Hypertonie), kognitive Störungen und Symptome einer Prostatahyperplasie verstärken.
Über anticholinerge Wirkungen auf das Zentralnervensystem (z. B. Halluzinationen,
Agitiertheit, Verwirrtheit, Somnolenz) wurde berichtet. Daher wird insbesondere während der ersten Monate nach Behandlungsbeginn oder nach Dosiserhöhung eine Überwachung empfohlen. Wenn anticholinerge Wirkungen auf das Zentralnervensystem auftreten, sollte ein Abbruch der Behandlung oder eine Dosisreduktion in Betracht gezogen werden.
Da Oxybutynin-HCl Aristo® das Auftreten eines Engwinkelglaukoms auslösen kann, sollten die Patienten angewiesen werden, unverzüglich einen Arzt aufzusuchen, wenn ein plötzlicher Verlust der Sehschärfe oder Augenschmerzen auftreten. Während der Behandlung sollte gelegentlich die Sehschärfe und der Augeninnendruck kontrolliert werden.
Der langfristige Gebrauch kann die Entwicklung von Karies, Zahnfleischerkrankungen, einer Hefepilzinfektion der Mundhöhle wegen der Einschränkung oder Aufhebung der Speichelsekretion begünstigen.
Bei Patienten, die eine Hiatushernie/gastroösophageale Refluxkrankheit oder Refluxösophagitis oder andere schwere Magen-Darm-Erkrankungen aufweisen und/oder gleichzeitig Arzneimittel (wie z. B. Bisphosphonate) einnehmen, die eine Ösophagitis verursachen oder verschlimmern können, müssen Anticholinergika mit Vorsicht angewendet werden.
Wenn Oxybutynin-HCl Aristo® bei Patienten mit Fieber oder bei hohen Umgebungstemperaturen angewendet wird, können Erschöpfungszustände durch Überhitzung (z. B. Hitzschlag) wegen verminderter Schweißproduktion auftreten.
Bei Patienten mit Parkinson-Krankheit oder bei anderen zentralnervösen Krankheiten, die mit kognitiven Einschränkungen einhergehen, ist ebenfalls Vorsicht geboten, da psychiatrische und zentralnervöse Nebenwirkungen leichter ausgelöst werden. Eine niedrigere Dosierung könnte auch hier notwendig werden.
Wenn während der Therapie eine Infektion des Urogenitalsystems auftritt, muss diese entsprechend behandelt werden.
Kinder und Jugendliche
Da Unbedenklichkeit und Wirksamkeit bei Kindern unter 5 Jahren nicht nachgewiesen sind, wird die Anwendung von Oxybutynin-HCL Aristo® in dieser Altersgruppe nicht empfohlen.
Es gibt nur begrenzte Daten, die die Wirksamkeit von Oxybutynin-HCL Aristo® bei Kindern mit monosymptomatischer Enuresis nocturna, die nicht durch eine Detrusorüberaktivität bedingt ist, bestätigen.
Bei Kindern über 5 Jahren sollte Oxybutynin-HCL Aristo® vorsichtig angewendet werden, weil diese gegenüber den Wirkungen von Oxybutynin-HCL Aristo® empfindlicher reagieren können; dies gilt besonders für die zentralnervösen und psychiatrischen Nebenwirkungen.
Ältere Menschen
Bei älteren Patienten ist Vorsicht geboten, weil diese gegenüber den Wirkungen von Oxybutynin-HCl Aristo® empfindlicher reagieren können. Bei älteren Menschen sind die Plasmaspiegel in der Regel höher. Daher können bei älteren Patienten niedrigere Dosierungen erforderlich sein.
Anticholinergika sollten bei älteren Patienten wegen des Risikos kognitiver Störungen mit Vorsicht angewendet werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Oxybutynin-HCl Aristo® nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Da die anticholinerge Wirkung von Oxybutynin-HCl Aristo® durch die gleichzeitige Behandlung mit anderen Anticholinergika verstärkt wird, ist Vorsicht geboten. Die anticholinerge Aktivität von Oxybutynin-HCL Aristo® wird durch die gleichzeitige Anwendung anderer Anticholinergika oder Arzneimitteln mit anticholinerger Aktivität, wie:
- Amantadin und andere Antiparkinson-mittel (z.B. Biperiden, L-Dopa)
- Antihistaminika
- Neuroleptika (v.a. niederpotente Phenothiazin-Neuroleptika, Clozapin, Olanzapin, Butyrophenone)
- Chinidin, Disopyramid, Digitalis
- Trizyklische Antidepressiva, Atropin und verwandte Verbindungen wie atropine Spasmolytika und Dipyridamol verstärkt.
Durch die Verminderung der Magen-Darm-Motilität kann Oxybutynin die Resorption anderer Arzneimittel beeinflussen.
Oxybutynin wird durch das Cytochrom-P450-Isoenzym CYP3A4 verstoffwechselt. Die gleichzeitige Anwendung mit einem CYP3A4-Inhibitor kann den Metabolismus von Oxybutynin hemmen und die Oxybutynin-Exposition erhöhen.
Dies ist bei einer gleichzeitigen Behandlung mit Azol-Antimykotika (z. B. Ketoconazol) oder Makrolid-Antibiotika (z. B. Erythromycin) zu beachten.
Für Itraconazol wurde eine Hemmung der Verstoffwechselung von Oxybutynin nachgewiesen. Dies führte zu einer Verdoppelung der Oxybutynin-Plasma Konzentrationen, jedoch nur zu einer 10%igen Erhöhung der Plasmaspiegel des aktiven Metaboliten. Da der Metabolit für ca. 90 % der antimuskarinischen Wirkung verantwortlich ist, scheint diese Wechselwirkung von geringfügiger klinischer Relevanz zu sein.
Oxybutynin-HCl Aristo® kann prokinetischen Therapien (z. B. mit Metoclopramid oder Domperidon) entgegenwirken.
Die gleichzeitige Anwendung mit Cholinesterase-Inhibitoren kann zu einer verringerten Wirksamkeit des Cholinesterase-Inhibitors führen.
Die Patienten sollten darüber informiert werden, dass Alkohol die durch Anticholinergika wie Oxybutynin-HCl Aristo® verursachte Benommenheit noch verstärken kann (siehe Abschnitt 4.7).
Aufgrund einer Mundtrockenheit lösen sich sublingual verabreichte Nitrate möglicherweise nicht auf. Patienten, die mit sublingualen Nitraten behandelt werden, sollten daher angewiesen
werden, vor der Anwendung die Mundschleimhaut mit etwas Wasser zu befeuchten.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine klinischen Daten für die Verwendung von Oxybutynin-HC Aristo® bei Schwangeren vor. In tierexperimentellen Studien ruft Oxybutynin-HCl Aristo® Missbildungen hervor (siehe 5.3.). Bezüglich der Wirkungen auf die Schwangerschaft, die embryonale/fötale Entwicklung, die Geburt und die postnatale Entwicklung sind die tierexperimentellen Studien nicht ausreichend. Das potenzielle Risiko für den Menschen ist nicht bekannt. Oxybutynin-HCl Aristo® darf nicht während der Schwangerschaft verwendet werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Bei einer Anwendung von Oxybutynin-HCl Aristo® während der Stillzeit geht eine kleine Menge in die Muttermilch über. Daher wird die Einnahme von Oxybutynin-HCl Aristo® während des Stillens nicht empfohlen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Oxybutynin-HCl Aristo® 5 mg kann Benommenheit und verschwommenes Sehen hervorrufen. Daher sollten die Patienten angewiesen werden, während der Einnahme dieses Arzneimittels bei Tätigkeiten, die Wachsamkeit erfordern, wie das Führen von Fahrzeugen, das Bedienen von Maschinen oder die Durchführung gefährlicher Arbeiten, vorsichtig zu sein. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosierungsänderung, Präparatewechsel und im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: Sehr häufig (> 1/10)
Häufig (> 1/100 bis <1/10)
Gelegentlich (> 1/1000 bis <1/100)
Selten (>1/10.000 bis <1/1000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Die Nebenwirkungen werden am häufigsten durch die anticholinergen Effekte von Oxybutynin-HCl Aristo® verursacht. Folgende Nebenwirkungen können auftreten:
|
Nebenwirkun g im Organsystem |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
Nicht bekannt |
|
Infektionen und parasitäre Erkrankungen |
Harnwegs infektione n | |||||
|
Erkrankungen des Immunsystems |
Überempf indlichkei t | |||||
|
Psychiatrische Erkrankungen |
Verwirrung |
Halluzination en, Orientierung slosigkeit, Erregung, Angstzuständ e, |
Konzentratio nsschwäche, Verhaltensau ffälligkeiten, Verfolgungs wahn |
Alpträume |
Kognitive Störungen bei älteren Patienten |
|
Teilnahmslos igkeit | ||||||
|
Erkrankungen des Nervensystem s |
Schwindel, Kopfschmer zen, Schläfrigkei t |
Benommenh eit |
Müdigkeit, |
Krämpfe | ||
|
Augenerkrank ungen |
Trockene Augen, Pupillenerwe iterung, Verschwom mensehen |
Lichtempfind lichkeit |
Glaukom (Engwinkelgla ukom) |
Erhöhter Augeninn endruck | ||
|
Herzerkrankun gen |
Tachykardie |
Herzklopfen, Arrhythmie | ||||
|
Gefäßerkranku ngen |
Hitzegefühl | |||||
|
Erkrankungen des Gastrointestina ltraktes |
Mundtrocke nheit, Übelkeit, Obstipation, |
Abdominalsc hmerzen, Dyspepsie, Diarrhoe, Erbrechen, |
Anorexie, verminderter Appetit, Dysphagie |
Sodbrennen, Reflux ösophagitis | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Hauttrocken heit |
Hautrötung, Erröten |
Angioödem, allergische Hautreaktione n (Erythem, Urtikaria), Photosensitivit ät |
Hypohidr ose | ||
|
Erkrankungen der Niere und der Harnwege |
Schwierigkei ten beim Wasserlassen Harnverhaltu ng | |||||
|
Erkrankungen der Geschlechtsor gane |
Erektile Dysfunktion | |||||
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikatione n |
Hitzschlag |
Die meisten Nebenwirkungen sind dosisabhängig und können durch eine Dosisreduktion verringert oder beseitigt werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Die Symptome einer Überdosierung von Oxybutynin-HCL Aristo® äußern sich in einer Verstärkung der üblichen Nebenwirkungen auf das Zentralnervensystem (von Ruhelosigkeit und Erregung bis hin zu psychotischen Verhaltensweisen), Änderungen im Kreislaufsystem (Hitzegefühl, Blutdruckabfall, Zirkulationsstörungen), Störungen im Atmungstrakt, Lähmungen bis hin zum Koma.
Außerdem können die Zeichen einer Anticholinergika-Vergiftung auftreten wie z. B. Pupillenerweiterung (Mydriasis), Fieber, rote heiße Haut und trockene Schleimhäute.
Folgende Maßnahmen müssen ergriffen werden:
1) Sofortige Magenspülung und Gabe von Aktivkohle.
2) Physostigmin durch langsame intravenöse Injektion:
Erwachsene
0,5-2 mg Physostigmin i.v., langsame Gabe; falls erforderlich mehrmals bis zu einer Tagesdosis von max. 5 mg.
Kinder
30 gg Physostigmin/kg Körpergewicht i.v., langsame Gabe; falls erforderlich mehrmals bis zu einer Tagesdosis von max. 2 mg.
Fieber sollte symptomatisch behandelt werden.
Bei ausgeprägter Ruhelosigkeit oder Erregung kann Diazepam 10 mg intravenös injiziert werden.
Tachykardien können intravenös mit Propranolol behandelt und Harnverhaltung kann durch Blasenkatheterisierung behoben werden.
Wenn Curare-ähnliche Wirkungen zu einer Lähmung der Atemmuskulatur führen, ist eine künstliche Beatmung erforderlich.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Urologische Spasmolytika ATC-Code: G04B D04
Oxybutynin ist ein synthetisches tertiäres Amin mit direkter anticholinerger und spasmolytischer Wirkung auf die glatte Muskulatur u.a. der Harnblase. Oxybutynin besitzt in tierexperimentellen Untersuchungen auch lokalanästhetische und analgetische Eigenschaften.
Die klinische Wirkung äußert sich in einer Erhöhung der Harnblasenkapazität, in einer Reduzierung der unkontrollierten Kontraktionsfrequenz des instabilen (hyperaktiven) Blasendetrusors und in einem verzögerten Beginn des Miktionsdrangs. Die Inkontinenzprobleme werden dadurch vermindert.
5.2 Pharmakokinetische Eigenschaften
Oxybutynin wird nach oraler Verabreichung rasch resorbiert. Plasmaspitzenkonzentrationen treten nach 60 - 90 Minuten auf. Es tritt eine hohe interindividuelle Variabilität auf. Gleichzeitige Nahrungsaufnahme, vor allem eine Mahlzeit mit hohem Fettgehalt, verzögert die Resorption von Oxybutynin, erhöht jedoch die Bioverfügbarkeit insgesamt. Die Wirkdauer von Oxybutynin beträgt ca. 6 - 10 Stunden.
Biotransformation
Die Bioverfügbarkeit ist aufgrund eines ausgeprägten First-Pass-Metabolismus gering und liegt bei 2 -11%. Oxybutyninhydrochlorid wird unter Beteiligung von Cytochrom P450 (CYP3A4) metabolisiert. Durch die individuelle Disposition kann es zu starken interindividuellen Schwankungen des Oxybutyninmetabolismus kommen.
Hauptmetaboliten sind der inaktive Metabolit 2,2-Phenylcyclohexylglykolsäure und der aktive Metabolit N-Desethyloxybutynin, der eine vergleichbare pharmakologische Aktivität wie das Oxybutynin besitzt, jedoch erheblich höhere Plasmakonzentrationen als die Muttersubstanz erreicht. Die Elimination des Oxybutynins erfolgt biphasisch, die des Metaboliten N-Desethyloxybutynin monophasisch.
Elimination
Die Eliminationshalbwertszeit beträgt sowohl für den Arzneistoff selbst als auch für den aktiven Metaboliten 2-3 Stunden. Eine sehr geringe Menge an Oxybutynin wird unverändert im Urin ausgeschieden. Oxybutynin ist zu 83 - 95% an Plasmaalbumin gebunden.
Bei älteren Patienten kann aufgrund einer höheren Bioverfügbarkeit die Eliminationshalbwertszeit von 2-3 Stunden auf 5 Stunden verlängert sein, ebenso ist die AUC nach mehrfacher Anwendung 2-4mal höher. Unerwünschte Nebenwirkungen können hierdurch verstärkt auftreten und eine Dosisreduktion erfordern.
Bioverfügbarkeit
Eine im Jahr 1993 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab bei einer Dosis von 5 mg Oxybutyninhydrochlorid im Vergleich zum Referenzpräparat:
|
Testprä parat |
Referenz-präparat | |
|
Maximale Plasmakonzentration (Cmax): |
6,16±3,95 ng/ml |
5,4±3,33 ng/ml |
|
Zeitpunkt der max. Plasmakonzentration (Tmax): |
0,74±0,55 h |
0,85±0,28 h |
|
Fläche unter der Konzen-trations-Zeit-Kurve (AUC0-¥): |
10,24±5,5 ng*h/ml |
10,07±6,35 ng*h/ml |
Angabe der Werte als Mittelwert und Standardabweichung
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm:
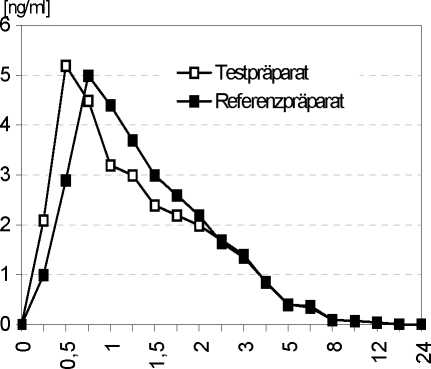
Zeit [h]
5.3 Präklinische Daten zur Sicherheit
Untersuchungen zum mutagenen und kanzerogenen Potential verliefen negativ.
Untersuchungen an trächtigen Ratten haben Hinweise auf ein teratogenes Potential ergeben. Es traten ab einer Dosis von 20 mg/kg/Tag vermehrt Herzfehlbildungen auf. Bei höheren Dosierungen traten außerdem extrathorako-lumbäre Rippen und eine erhöhte neonatale Mortalität auf. Oxybutynin geht bei der Ratte in die Muttermilch über.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose, Cellulosepulver, Magnesiumstearat (Ph.Eur.), Talkum
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Blisterstreifen aus PVC/Al-Folie Originalpackung mit 25 Tabletten (N1)
Originalpackung mit 30 Tabletten (N1)
Originalpackung mit 50 Tabletten (N2)
Originalpackung mit 100 Tabletten (N3)
Unverkäufliches Muster mit 25 Tabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Aristo Pharma GmbH Wallenroder Straße 8-10 13435 Berlin Tel.: +49 30 71094-4200 Fax: + 49 30 71094-4250
8. ZULASSUNGSNUMMER
42240.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER
ZULASSUNG
04.09.1998/ 15.03.2004
10. STAND DER INFORMATION
August 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
10