Pamorelin La 3,75 Mg Pulver Und Lösungsmittel Zur Herstellung Einer Depot-Injektionssuspension
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
Pamorelin® LA 3,75 mg
Pulver und Lösungsmittel zur Herstellung einer Depot-Injektionssuspension
Wirkstoff: Triptorelin
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
• Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Pamorelin LA 3,75 mg und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Pamorelin LA 3,75 mg beachten?
3. Wie ist Pamorelin LA 3,75 mg anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Pamorelin LA 3,75 mg aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. WAS IST PAMORELIN LA 3,75 mg UND WOFÜR WIRD ES ANGEWENDET?
Pamorelin LA 3,75 mg enthält Triptorelin, das dem Gonadotropin-Releasing-Hormon ähnlich ist (GnRH-Analogon). Es handelt sich dabei um eine Formulierung mit Langzeitwirkung, die 3,75 mg Triptorelin über einen Zeitraum von 1 Monat (4 Wochen) langsam freisetzt. Die Wirkung wird erzielt, indem der Spiegel des männlichen Hormons Testosteron im Körper gesenkt wird.
Pamorelin LA 3,75 mg dient der Behandlung des lokal fortgeschrittenen, hormonabhängigen Prostatakarzinoms (Krebserkrankung der Vorsteherdrüse); allein oder während und nach der Strahlentherapie.
Pamorelin LA 3,75 mg wird ebenfalls bei der Behandlung des hormonabhängigen Prostatakarzinoms, das sich auf andere Körperorgane ausgebreitet hat (metastasierendes Karzinom), angewendet.
2. WAS SOLLTEN SIE VOR DER ANWENDUNG VON PAMORELIN LA 3,75 mg BEACHTEN?
Pamorelin LA 3,75 mg darf nicht angewendet werden,
wenn Sie allergisch gegen Triptorelinembonat, Gonadotropin-Releasing-Hormon (GnRH),
anderen GnRH-Analoga oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses
Arzneimittels sind.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, bevor Pamorelin LA 3,75 mg angewendet wird:
• Wenn bei Ihnen depressive Verstimmungen auftreten. Es wurde bei mit Pamorelin LA
3,75 mg behandelten Patienten von Depressionen, die schwerwiegend sein können, berichtet.
• Wenn Sie gleichzeitig Arzneimittel zur Hemmung der Blutgerinnung einnehmen, da an der Einstichstelle Blutergüsse entstehen können.
• Wenn Sie ein starker Trinker oder Raucher sind, Osteoporose (Krankheit, die die Knochen schwächt) haben oder in Ihrer Familie Osteoporose aufgetreten ist, sich ungesund ernähren, krampflösende Arzneimittel (Arzneimittel gegen Epilepsie oder Anfälle) oder Kortikosteroide einnehmen. Wenn Pamorelin LA 3,75 mg über einen längeren Zeitraum angewendet wird, ist das Risiko für die Entwicklung schwacher Knochen erhöht, insbesondere wenn einer der genannten Punkte auf Sie zutrifft.
• Wenn Sie Herz-Kreislauf-Erkrankungen jeder Art, einschließlich Herzrhythmusstörungen (Arrhythmien), haben, oder wenn Sie mit Medikamenten gegen diese Erkrankungen behandelt werden. Das Risiko für Herzrhythmusstörungen kann bei der Anwendung von Pamorelin LA 3,75 mg erhöht sein.
• Wenn Sie Diabetes oder Herz-Kreislauf-Erkrankungen haben.
• Zu Beginn der Behandlung kommt es in Ihrem Körper zu einer vorübergehenden Erhöhung der Testosteronmenge. Dies kann zu einer Verschlechterung der Symptome Ihres Karzinoms führen. Bitte suchen Sie in diesem Fall Ihren Arzt auf. Ihr Arzt wird Ihnen entsprechende Arzneimittel (ein Antiandrogen) geben, um zu verhindern, dass Ihre Symptome sich verschlechtern.
• Sie können (wie auch mit anderen GnRH-Analoga) während der ersten Behandlungswochen Symptome aufgrund einer Rückenmarksquetschung (z. B. Schmerzen, Taubheit oder Schwäche in den Beinen) oder Harnröhrenverengung/-verschluss bekommen. Wenn entsprechende Beschwerden bei Ihnen auftreten, informieren Sie sofort Ihren Arzt, der Sie diesbezüglich eng überwachen und entsprechend behandeln wird.
• Wenn Sie chirurgisch kastriert wurden, kann Triptorelin keine weitere Senkung des Serumtestosteronspiegels bewirken und sollte deshalb nicht angewendet werden.
• Wenn bei Ihnen diagnostische Funktionstests der Hirnanhangdrüse (Hypophyse) oder der Geschlechtsorgane anstehen, können die Ergebnisse irreführend sein, wenn Sie mit Pamorelin LA 3,75 mg behandelt werden, oder die Behandlung erst vor kurzem abgesetzt wurde.
• Wenn Sie eine Ihnen unbekannte Vergrößerung (gutartiger Tumor) der Hirnanhangdrüse (Hypophyse) haben, kann diese während der Behandlung mit Pamorelin LA 3,75 mg entdeckt werden. Anzeichen dafür sind plötzliche Kopfschmerzen, Erbrechen, Sehstörungen und Augenmuskellähmung.
Bitte wenden Sie sich an Ihren Arzt, wenn einer der oben genannten Punkte auf Sie zutrifft.
Die Anwendung des Arzneimittels Pamorelin LA 3,75 mg kann bei Dopingkontrollen zu
positiven Ergebnissen führen.
Kinder und Jugendliche
Pamorelin LA 3,75 mg ist nicht für die Anwendung bei Neugeborenen, Kleinkindern, Kindern und Jugendlichen vorgesehen.
Anwendung von Pamorelin LA 3,75 mg zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen, andere Arzneimittel einzunehmen/anzuwenden.
Pamorelin LA 3,75 mg kann bei gleichzeitiger Anwendung mit einigen Arzneimitteln zur Behandlung von Herzrhythmusstörungen (z. B. Chinidin, Procainamid, Amiodaron und Sotalol) zu Wechselwirkungen führen. Pamorelin LA 3,75 mg kann bei gleichzeitiger Anwendung mit anderen Arzneimitteln (z. B. Methadon (Arzneimittel zur Schmerzlinderung und als Bestandteil der Drogenersatztherapie), Moxifloxacin (ein Antibiotikum), Antipsychotika für schwere psychische Erkrankungen) das Risiko für Herzrhythmusstörungen erhöhen.
Schwangerschaft, Stillzeit und Fortpflanzungsfähigkeit
Pamorelin LA 3,75 mg ist nicht für die Anwendung bei Frauen vorgesehen.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Pamorelin LA 3,75 mg kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass z. B. die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maß im Zusammenwirken mit Alkohol. Sie können sich schwindelig oder müde fühlen oder Probleme mit dem Sehen, wie z. B. Verschwommensehen, haben. Diese Beschwerden können als mögliche Nebenwirkungen der Behandlung oder aufgrund der zugrunde liegenden Erkrankung auftreten. Wenn Sie eine dieser Nebenwirkungen bemerken, sollten Sie kein Fahrzeug lenken und das Bedienen von Maschinen vermeiden.
Pamorelin LA 3,75 mg enthält Natrium.
Dieses Arzneimittel enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Durchstechflasche. Das Arzneimittel ist nahezu „natriumfrei“ und kann während einer kochsalzarmen Diät angewendet werden.
3. WIE IST PAMORELIN LA 3,75 mg ANZUWENDEN?
Pamorelin LA 3,75 mg wird bei Ihnen unter ärztlicher Aufsicht angewendet.
Die Behandlung des Prostatakarzinoms mit Pamorelin LA 3,75 mg erfordert eine Langzeittherapie. Für die Behandlung des lokal fortgeschrittenen, hormonabhängigen Prostatakarzinoms, während und nach der Strahlentherapie, wird eine Therapiedauer von 2-3 Jahren empfohlen.
Die übliche Dosis ist 1 Durchstechflasche Pamorelin LA 3,75 mg, die einmal monatlich (alle 4 Wochen) unter die Haut (subkutan) oder in den Muskel (intramuskulär) injiziert wird.
Ihr Arzt kann Blutabnahmen durchführen, um die Wirksamkeit der Behandlung zu überprüfen.
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie den Eindruck haben, dass die Wirkung von Pamorelin LA 3,75 mg zu stark oder zu schwach ist.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Holen Sie sofort ärztlichen Rat ein, wenn Sie eine der folgenden Symptome bemerken:
Schwierigkeiten beim Schlucken oder Probleme beim Atmen, Schwellung von Lippen, Gesicht, Hals oder Zunge oder Auftreten von Nesselausschlag.
Dies können Anzeichen einer schweren allergischen Reaktion oder eines Angioödems sein, die in seltenen Fällen (kann bis zu 1 von 1.000 Behandelten betreffen) berichtet wurden.
Andere Nebenwirkungen, die auftreten können:
Wie auch bei der Behandlung mit anderen GnRH-Agonisten oder nach chirurgischer Kastration gesehen, waren die Nebenwirkungen, die während der Triptorelin-Behandlung am häufigsten beobachtet wurden, auf die erwarteten pharmakologischen Effekte zurückzuführen. Zu diesen Nebenwirkungen zählten Hitzewallungen und verminderte Libido.
Bei Patienten unter Behandlung mit GnRH-Analoga wurde über eine vermehrte Lymphozytenzahl berichtet.
Mit Ausnahme der allergischen Reaktionen und der Reaktionen an der Injektionsstelle ist von allen Nebenwirkungen bekannt, dass sie im Zusammenhang mit dem veränderten Testosteronspiegel stehen.
Bei anderen Triptorelin-Präparaten wurde nach subkutaner Injektion gelegentlich über druckempfindliche Infiltrate an der Injektionsstelle berichtet.
Sehr häufig: kann mehr als 1 von 10 Behandelten betreffen
• Hitzewallungen
• Kraftlosigkeit
• Übermäßiges Schwitzen
• Rückenschmerzen
• Kribbelgefühl in den Beinen
• Verminderte Libido
• Impotenz
Häufig: kann bis zu 1 von 10 Behandelten betreffen
• Übelkeit, trockener Mund
• Schmerzen, Bluterguss, Rötung und Schwellung an der Injektionsstelle, Muskel- und Knochenschmerzen, Schmerzen in den Armen und Beinen, Ödeme (Flüssigkeitsansammlung im Gewebe), Unterleibsschmerzen, hoher Blutdruck
• Allergische Reaktion
• Gewichtszunahme
• Schwindelanfälle, Kopfschmerzen
• Libidoverlust, Depression, Stimmungsschwankungen
Gelegentlich: kann bis zu 1 von 100 Behandelten betreffen
• Zunahme der Blutplättchen
• Herzklopfen
• Summen im Ohr, Schwindel, Verschwommensehen
• Bauchschmerzen, Verstopfung, Durchfall, Erbrechen
• Benommenheit, Schüttelfrost, Schläfrigkeit, Schmerzen
• Beeinflussung einiger Bluttestwerte (einschließlich erhöhter Lebertestwerte), erhöhter Blutdruck
• Gewichtsabnahme
• Appetitlosigkeit, Appetitzunahme, Gicht (schwere Schmerzen und Schwellungen in den Gelenken, normalerweise im großen Zeh), Diabetes, überhöhte Blutfettwerte
• Gelenkschmerzen, Muskelkrämpfe, Muskelschwäche, Muskelschmerzen, Schwellung und Schmerzempfindlichkeit, Knochenschmerzen
• Kribbel- oder Taubheitsgefühl
• Schlaflosigkeit, Reizbarkeit
• Vergrößerung der männlichen Brustdrüsen, Brustschmerzen, Größenabnahme der Hoden, Schmerzen in den Hoden
• Atemschwierigkeiten
• Akne, Haarausfall, Juckreiz, Hautausschlag, Hautrötung, Nesselausschlag
• Aufstehen für nächtliches Wasserlassen, Probleme beim Wasserlassen
• Nasenbluten
Selten: kann bis zu 1 von 1.000 Behandelten betreffen
• Rote oder violette Verfärbungen der Haut
• Abnormes Empfinden in den Augen, Verschwommensehen oder Sehstörungen
• Völlegefühl im Bauch, Blähungen, Geschmacksveränderungen
• Schmerzen im Brustkorb
• Gleichgewichtsstörungen
• Grippeähnliche Beschwerden, Fieber
• Entzündung von Nase/Rachen
• Erhöhte Körpertemperatur
• Gelenkversteifung, Gelenkschwellung, Versteifung der Skelettmuskulatur, Osteoarthritis
• Gedächtnisverlust
• Verwirrtheit, verminderte Aktivität, Hochgefühl
• Atemnot beim Liegen
• Blasenausschlag
• Niedriger Blutdruck
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
• Veränderungen im EKG (QT-Verlängerung)
• Allgemeines Unwohlsein
• Ängstlichkeit
• Inkontinenz (Blasenschwäche)
Über die zu ergreifenden Gegenmaßnahmen entscheidet Ihr behandelnder Arzt.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das nationale Meldesystem anzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST PAMORELIN LA 3,75 mg AUFZUBEWAHREN?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen Pamorelin LA 3,75 mg nach dem auf dem Umkarton und den Etiketten nach „Verwendbar bis:“ bzw. „Verw. bis:“ angegebenen Verfallsdatum nicht mehr verwenden. Das Verfallsdatum bezieht sich auf den letzten Tag des angegebenen Monats.
Die zubereitete Suspension muss sofort angewendet werden.
Nicht über 25°C lagern.
6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN
Was Pamorelin LA 3,75 mg enthält
Der Wirkstoff ist Triptorelin.
1 Durchstechflasche enthält Triptorelinembonat entsprechend einer Menge von 3,75 mg Triptorelin. Nach dem Auflösen in 2 ml Lösungsmittel enthält 1 ml der zubereiteten Suspension 1,875 mg Triptorelin.
Die sonstigen Bestandteile sind:
Pulver: Poly(glycolsäure-co-milchsäure), Mannitol, Carmellose-Natrium,
Polysorbat 80
Lösungsmittel: Wasser für Injektionszwecke
Wie Pamorelin LA 3,75 mg aussieht und Inhalt der Packung
Bei diesem Arzneimittel handelt es sich um Pulver und Lösungsmittel zur Herstellung einer Depot-Injektionssuspension. Das Pulver ist weiß bis weißlich, und das Lösungsmittel ist eine klare Lösung.
Pamorelin LA 3,75 mg ist erhältlich in Packungen mit
1 Durchstechflasche, 1 Lösungsmittelampulle und 1 Blisterpackung mit 1 Einwegspritze und
2 Injektionsnadeln und in Packungen mit
3 Durchstechflaschen, 3 Lösungsmittelampullen und 3 Blisterpackungen mit je 1 Einwegspritze und je 2 Injektionsnadeln.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer
Ipsen Pharma GmbH 76275 Ettlingen Tel.: 07243 184-80 Fax: 07243 184-39
Hersteller
Ipsen Pharma Biotech SAS
Parc d’Activites du Plateau de Signes
Chemin Departemental 402
83870 Signes
Frankreich
Dieses Arzneimittel ist in den Mitgliedstaaten des Europäischen Wirtschaftsraums (EWR) unter den folgenden Bezeichnungen zugelassen
Österreich und Deutschland: Pamorelin LA 3,75 mg Dänemark, Finnland, Niederlande, Norwegen: Pamorelin 3,75 mg
Diese Gebrauchsinformation wurde zuletzt überarbeitet im März 2016.
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt (siehe auch Abschnitt 3):
1 VORBEREITUNG DES PATTENTEN VOR HERSTELLUNG DER INJEKTIONSSUSPENSION
• Bereiten Sie den Patienten auf die Injektion vor, indem Sie die Injektionsstelle desinfizieren. Dies ist als erstes nötig, da die Injektionssuspension nach Herstellung sofort injiziert werden sollte.
2 VORBEREITUNG DER INJEKTION
In der Faltschachtel werden 2 Nadeln zur Verfügung gestellt:
• Nadel 1: 20 G Nadel (38 mm Länge) ohne Sicherheitssystem zur Rekonstitution
• Nadel 2: 20 G Nadel (38 mm Länge) mit Sicherheitssystem zur Injektion
Nadel 1 - 38 mm Nadel 2 - 38 mm


Blasenbildung an der Oberfläche des Lyophilisats gehört zum normalen Erscheinungsbild des
Produkts.
2a
• Nehmen Sie die Lösungsmittelampulle. Klopfen Sie die eventuell in der Ampullenspitze befindliche Lösung zurück in das Hauptreservoir der Lösungsmittelampulle.
• Drehen Sie Nadel 1 (ohne Sicherheitssystem) auf die Spritze. Den Nadelschutz noch nicht entfernen.
• Brechen Sie die Lösungsmittelampulle mit dem Brechpunkt nach oben auf.
• Entfernen Sie den Nadelschutz von Nadel 1. Führen Sie die Nadel in die Ampulle ein und ziehen Sie das Lösungsmittel vollständig in die Spritze auf. Legen Sie die Spritze mit dem Lösungsmittel beiseite.
Tb
• Nehmen Sie die Durchstechflasche mit Pulver. Klopfen Sie das Pulver, das sich eventuell im oberen Bereich der Durchstechflasche angesammelt hat, zurück auf den Flaschenboden.
• Entfernen Sie die Plastikabdeckung von der Durchstechflasche.
• Nehmen Sie die Spritze mit dem Lösungsmittel und durchstechen Sie den Gummistopfen der Durchstechflasche senkrecht. Spritzen Sie das Lösungsmittel langsam in die Durchstechflasche, nach Möglichkeit so, dass es sich im oberen Teil der Durchstechflasche breitflächig an der
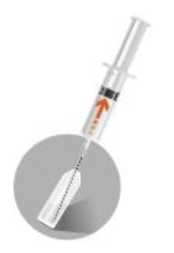
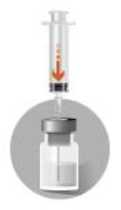
Flaschenwand ergießt. 2c
Ziehen Sie Nadel 1 über den Flüssigkeitsspiegel. Entfernen Sie die Nadel nicht aus der Durchstechflasche. Stellen Sie die Suspension durch leichtes Hin-und-her-Schwenken her. Drehen Sie die Durchstechflasche nicht um.
Stellen Sie sicher, dass ausreichend lang geschwenkt wurde und eine homogene, milchige Suspension entstanden ist.
Wichtig: Vergewissern Sie sich, dass kein nicht suspendiertes Pulver in der Durchstechflasche ist (wenn Pulververklumpungen vorhanden sind, fahren Sie mit dem Schwenken fort, bis diese verschwunden sind).

3
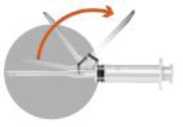
Wenn die Suspension homogen ist, tauchen Sie die Nadel ein und ziehen Sie, ohne die Durchstechflasche umzudrehen, die Injektionssuspension möglichst vollständig in die Spritze auf. Eine kleine Menge wird in der Durchstechflasche verbleiben und muss verworfen werden. Dieser Verlust ist durch Überfüllung abgedeckt. Umfassen Sie die farbige Hülse, die die Nadel mit der Spritze verbindet. Entfernen Sie Nadel 1, die zur Herstellung der Injektionssuspension benutzt wurde. Drehen Sie Nadel 2 auf die Spritze.
Bewegen Sie den Sicherheitsschutz von der Nadel weg in Richtung Spritzenzylinder. Der Sicherheitsschutz verbleibt in der gesetzten Position.
Entfernen Sie den Nadelschutz von der Injektionsnadel.
Entfernen Sie die Luft aus der Spritze und nehmen Sie die Injektion unverzüglich vor.
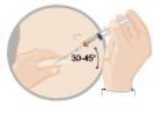
INTRAMUSKULÄRE ODER SUBKUTANE INJEKTION
Um eine Ausfällung (Präzipitat) zu vermeiden, injizieren Sie die Suspension unverzüglich subkutan oder intramuskulär.

intramuskulär
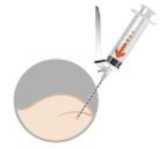
oder subkutan
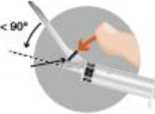
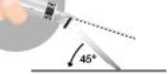
• Aktivierung des Sicherheitssystems mit einer Ein-Hand-Technik.
• Hinweis: Belassen Sie Ihren Finger die ganze Zeit über hinter der Sicherheitsschutzhülle.
Es gibt zwei Möglichkeiten, um das Sicherheitssystem zu aktivieren:
• Methode A: Drücken Sie mit Ihrem Finger die Sicherheitsschutzhülle nach vorne oder
• Methode B: Drücken Sie die Sicherheitsschutzhülle auf eine flache Oberfläche.
• In beiden Fällen drücken Sie mit einer schnellen und festen Bewegung nach unten, bis Sie ein hörbares Klicken vernehmen.
• Überprüfen Sie visuell, dass die Nadel komplett bedeckt bzw. verschlossen ist.
Benutzte Nadeln, jede nicht verwendete Suspension oder andere
Abfallstoffe müssen in Übereinstimmung mit lokalen Anforderungen
verworfen werden.
oder
fest drücken
verschlossen
Seite 10 von 10