Pentox-Ct 600Mg Retardtabletten
F achinformation
(Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DER ARZNEIMITTEL Pentox-CT 600 mg Retardtabletten Wirkstoff: Pentoxifyllin
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Retardtablette enthält 600 mg Pentoxifyllin.
Strukturformel
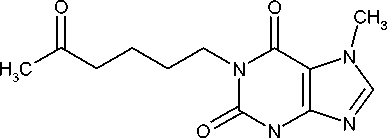
CH.
'3
Chemische Bezeichnung
3,7-Dimethyl-1 -(5 -oxohexyl)-3,7-dihydro-2#-purin-2,6( 1 #)-dion
Summenformel
C13H18N4O3
Molekulargewicht
278,3
Sonstige Bestandteile:
Lactose-Monohydrat.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Retardtablette
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Verlängerung der Gehstrecke bei Patienten mit chronischer peripherer arterieller Verschlusskrankheit im Stadium IIb nach Fontaine (Claudicatio intermittens), wenn andere Therapiemaßnahmen wie z. B. ein Gehtraining, gefäßlumeneröffnende und/oder rekonstruktive Verfahren nicht durchzuführen bzw. nicht angezeigt sind.
4.2 Dosierung, Art und Dauer der Anwendung Dosierung
Soweit nicht anders verordnet, werden 1200 mg Pentoxifyllin/Tag, verteilt auf 2 Einzelgaben, entsprechend 2-mal täglich 1 Retardtablette Pentox-CT 600 mg Retardtabletten, eingenommen.
Besondere Patientengruppen
Patienten mit niedrigen oder schwankenden Blutdruckwerten
Für Patienten mit niedrigen oder schwankenden Blutdruckwerten können besondere
Dosierungsanweisungen erforderlich sein (initial einschleichende Dosierung).
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit eingeschränkter Nierenfunktion (Kreatinin-Clearance unter 30 ml/min) ist eine Dosisanpassung auf 50-70 % der Normdosis in Abhängigkeit von der individuellen Verträglichkeit vorzunehmen.
Patienten mit schweren Leberfunktionsstörungen
Bei Patienten mit schweren Leberfunktionsstörungen ist eine Verringerung der Dosierung erforderlich, die vom Arzt entsprechend dem Schweregrad der Erkrankung und der Verträglichkeit individuell festzulegen ist.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Pentox-CT 600 mg Retardtabletten bei Kindern und Jugendlichen im Alter bis 17 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Die Retardtabletten sind unzerkaut nach dem Essen mit reichlich Flüssigkeit einzunehmen. Hinweis:
Pentox-CT 600 mg Retardtabletten sind Gerüstarzneiformen. Nach Abgabe des Wirkstoffs kann es zu einer weitgehend formstabilen Ausscheidung des Tablettengerüsts kommen. Die Wirkstofffreisetzung wird dadurch nicht beeinträchtigt.
Dauer der Anwendung
Die Dauer der Anwendung ist dem individuellen Krankheitsbild anzupassen und wird vom Arzt festgelegt.
4.3 Gegenanzeigen
Pentox-CT 600 mg Retardtabletten darf nicht angewendet werden bei
- Überempfindlichkeit gegen Pentoxifyllin, andere Methylxanthine oder einen der sonstigen Bestandteile
- akutem Herzinfarkt
- intracerebraler Blutung oder anderen klinisch relevanten Blutungen
- Ulcera im Magen und/oder Darmbereich
- hämorrhagischer Diathese
- Netzhautblutungen
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Treten Netzhautblutungen während der Behandlung mit Pentoxifyllin auf, ist das Präparat sofort abzusetzen.
Bei Patienten mit systemischen Lupus erythematodes (SLE) sowie Mischkollagenosen (mixed connective tissue disease) sollte Pentoxifyllin nur unter strenger Abwägung des Nutzen-RisikoVerhältnisses angewendet werden.
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei Patienten mit Herzrhythmusstörungen, arterieller Hypotension, Koronarsklerose, nach Herzinfarkt oder postoperativ nach chirurgischen Eingriffen.
Bei gleichzeitiger Anwendung von Pentoxifyllin mit oralen Antikoagulantien ist aufgrund des Blutungsrisikos eine sorgfältige Überwachung und eine häufige Kontrolle der Gerinnungswerte (INR) erforderlich.
Wegen der Gefahr des Auftretens aplastischer Anämien während Pentoxifyllin-Behandlung sollten regelmäßige Blutbildkontrollen erfolgen.
Bei eingeschränkter Nierenfunktion (Kreatinin-Clearance unter 30 ml/min) oder bei schweren Leberfunktionsstörungen kann es zur verzögerten Ausscheidung von Pentoxifyllin kommen. In solchen Fällen ist eine Dosisreduktion und eine entsprechende Überwachung erforderlich (siehe auch Abschnitt 4.2.).
Sehr selten ist über sehr schwere, innerhalb von Minuten nach Gabe auftretende Überempfindlichkeitsreaktionen (angioneurotisches Ödem, Verkrampfung der Bronchialmuskulatur, anaphylaktischer Schock) berichtet worden. Bei ersten Anzeichen für eine Überempfindlichkeitsreaktion ist das Arzneimittel sofort abzusetzen, der Arzt zu benachrichtigen, ein venöser Zugang zu schaffen und geeignete Notfallmaßnahmen zu ergreifen.
Patienten mit den seltenen hereditären Krankheiten Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Antihypertonika
Pentoxifyllin kann die Wirkung blutdrucksenkender Arzneimittel verstärken, eine verstärkte Blutdrucksenkung ist möglich.
Antikoagulantien
Pentoxifyllin kann die Wirkung von Antikoagulantien verstärken. Bei Patienten mit erhöhter Blutungsbereitschaft aufgrund von z. B. gleichzeitiger Gabe von gerinnungshemmenden Arzneimitteln ist eine besonders sorgfältige Überwachung (z. B. regelmäßige Kontrolle der INR) erforderlich, da eventuell auftretende Blutungen verstärkt werden können.
Orale Antidiabetika, Insulin
Verstärkte Senkung des Blutzuckers ist möglich, so dass hypoglykämische Reaktionen auftreten können. Die Blutzuckereinstellung sollte in individuell festzulegenden Abständen kontrolliert werden.
Theophyllin
Erhöhte Blutspiegel von Theophyllin sind möglich, so dass bei der Behandlung von Atemwegserkrankungen Nebenwirkungen von Theophyllin verstärkt in Erscheinung treten können.
Cimetidin
Erhöhung der Pentoxifyllin-Plasmaspiegel und Wirkungsverstärkung von Pentoxifyllin ist möglich.
Andere Xanthin-Derivate
Nach zeitgleicher Gabe von Pentoxifyllin und Ciprofloxacin wurde eine erhöhte Serumkonzentration von Pentoxifyllin gemessen.
4.6 Schwangerschaft und Stillzeit
Pentoxifyllin soll während der Schwangerschaft nicht eingenommen werden, da keine ausreichenden Erfahrungen mit schwangeren Frauen vorliegen (siehe auch Abschnitt 5.3). Während der Stillzeit geht Pentoxifyllin in die Muttermilch über, allerdings erhält der Säugling nur äußerst geringe Mengen an Substanz, so dass bei begründeter Anwendung in der Stillzeit Wirkungen beim Säugling nicht zu erwarten sind.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Pentoxifyllin hat keinen oder vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt: Sehr häufig: > 10 %
Häufig: > 1 % - < 10 %
Gelegentlich: > 0,1 % - < 1 %
Selten: > 0,01 % - < 0,1 %
Sehr selten: < 0,01 %
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
Erkrankungen des Blutes und des Lymphsystems
Sehr selten: Thrombozytopenie (Verminderung der Blutplättchenzahl) mit thrombozytopenischer Purpura und u. U. fataler aplastischer Anämie (verminderte oder fehlende Produktion sämtlicher Blutzellen, Panzytopenie). Aus diesem Grund sollten regelmäßige Blutbildkontrollen erfolgen.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen mit Juckreiz, Hautrötung, Urtikaria (Quaddeln mit Juckreiz).
Sehr selten: sehr schwere, innerhalb von Minuten nach Gabe auftretende Überempfindlichkeitsreaktionen (angioneurotisches Ödem, Verkrampfung der Bronchialmuskulatur, anaphylaktischer Schock).
Bei ersten Anzeichen für eine Überempfindlichkeitsreaktion ist das Arzneimittel sofort abzusetzen und der Arzt zu benachrichtigen.
Erkrankungen des Nervensystems Häufig: Schwindel, Tremor, Kopfschmerzen.
Sehr selten: Unruhe, Schlafstörungen, vermehrtes Schwitzen, Konvulsionen, Parästhesien, Symptomatik einer aseptischen Meningitis (prädisponiert scheinen hierfür Patienten mit Autoimmunerkrankungen [SLE, mixed connective tissue disease] zu sein. Nach Absetzen von Pentoxifyllin war die Symptomatik bei allen beobachteten Fällen reversibel.).
Augenerkrankungen
Sehr selten: Sehstörungen, Konjunktivitis, Netzhautblutungen, Netzhautablösungen.
Treten Netzhautblutungen während der Behandlung mit Pentoxifyllin auf, ist das Präparat sofort abzusetzen.
Herzerkrankungen
Selten: Herzrhythmusstörungen (wie z. B. Tachykardien), Angina pectoris, Dyspnoe.
Gefäßerkrankungen
Häufig: Flush (Gesichtsrötung mit Hitzegefühl).
Selten: Blutdrucksenkung.
Sehr selten: Blutdruckerhöhung, Blutungen (z. B. Haut und Schleimhäute, Magen, Darm, Urogenitaltrakt), intrakranielle Blutungen.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Magen-Darm-Beschwerden wie z. B. Übelkeit, Erbrechen, Völlegefühl, Magendruck oder Durchfall.
Leber- und Gallenerkrankungen
Sehr selten: Gallestauung (intrahepatische Cholestase), Anstieg von Leberenzymen (Transaminasen, alkalische Phosphatase).
Erkrankungen der Haut und des Unterhautzellgewebes Sehr selten: epidermale Nekrolyse, Stevens-Johnson-Syndrom.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig: Fieber.
Selten: periphere Ödeme/Angioödeme.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Schwindel, Brechreiz, Blutdruckabfall, Tachykardie, Flush, Bewusstlosigkeit, Fieber, Agitation, Areflexie, tonisch-klonische Krämpfe, kaffeesatzartiges Erbrechen sowie Arrhythmien.
Therapiemaßnahmen bei Überdosierung
Falls die Überdosierung durch eine orale Verabreichung noch nicht lange zurückliegt, kann eine Magenspülung vorgenommen oder die weitere Resorption des Wirkstoffs durch die Anwendung von Aktivkohle verzögert werden.
Ein spezifisches Antidot ist nicht bekannt, so dass die Therapie symptomatisch erfolgt. Zur Vermeidung von Komplikationen kann eine intensivmedizinische Überwachung erforderlich sein.
PHARMAKOLOGISCHE EIGENSCHAFTEN
5.
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Methylxanthin-Derivate mit durchblutungsfördemden Eigenschaften, Hämorheologika
ATC-Code: C04AD03
Pentoxifyllin verbessert die Fließeigenschaften des Blutes durch die Senkung der erhöhten Blutviskosität und hat weitere pharmakologische Eigenschaften, die erklärt werden durch:
- Erhöhung der gestörten Erythrocytenverformbarkeit durch Hemmung der Phosphodiesterase mit konsekutivem Anstieg von intrazellulärem cAMP und ATP sowie Hemmung der Erythrocytenaggregation
- Hemmung der Thrombocytenaggregation
- Senkung des pathologisch erhöhten Plasma-Fibrinogenspiegels
- Hemmung der Leukocytenaktivierung und der Adhäsivität von Leukocyten am Gefäßendothel
Studien zur Untersuchung des Effektes von Pentoxifyllin auf die kardio-/cerebrovaskuläre Morbidität und/oder Mortalität liegen nicht vor.
5.2 Pharmakokinetische Eigenschaften
Nach oraler Applikation wird Pentoxifyllin rasch und nahezu vollständig resorbiert.
Die Substanz unterliegt einem ausgeprägten First-pass-Effekt, so dass die systemische Verfügbarkeit nur bei 20-30 % liegt.
Nach oraler Gabe nicht retardierter Arzneiformen werden maximale Plasmaspiegel nach weniger als 1 Stunde gemessen. Pentoxifyllin wird in der Leber nahezu vollständig metabolisiert. Der aktive Hauptmetabolit 1-(5-Hydroxyhexyl)-3,7-dimethylxanthin ist im Plasma in weit höherer Konzentration (2 : 1) messbar als die Muttersubstanz.
Die Plasmahalbwertszeit von Pentoxifyllin beträgt 0,4-0,8 Stunden, die der Metaboliten I 1,6 Stunden.
Die Ausscheidung erfolgt zum größten Teil renal, nur 4 % werden fäkal eliminiert. Unverändertes Pentoxifyllin wird nur in Spuren ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
In Untersuchungen zur chronischen Toxizität ließen sich nach Verfütterung von Pentoxifyllin über 1 Jahr bei Ratten bis täglich 1000 mg/kg KG und bei Hunden bis täglich 100 mg/kg KG keine substanzbedingten toxischen Organschäden erkennen. Bei Dosierungen über 1 Jahr von täglich 320 mg/kg KG oder darüber wurden an einzelnen Hunden Inkoordination, Kreislaufversagen, Hämorrhagien, Lungenödeme oder Riesenzellen in den Testes festgestellt.
In Mutagenitätsuntersuchungen mit Pentoxifyllin ergaben sich keine relevanten Hinweise auf eine mutagene Wirkung. Langzeituntersuchungen auf ein tumorerzeugendes Potenzial an Mäusen und Ratten verliefen negativ.
Reproduktionstoxikologische Untersuchungen wurden an Ratten, Mäusen, Kaninchen und Hunden durchgeführt. Es ergaben sich keine Anhaltspunkte für teratogene Schäden, Embryotoxizität und Beeinflussung der Fertilität. In sehr hohen Dosen wurde eine erhöhte Resorptionsrate beobachtet.
Pentoxifyllin und seine Metaboliten gehen in die Muttermilch über.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Mikrokristalline Cellulose, Lactose-Monohydrat, Hypromellose, Magnesiumstearat (Ph.Eur.), Hochdisperses Siliciumdioxid, Macrogol, Poly(ethylacrylat-co-methylmethacrylat) (2 : 1), Hypromellosephthalat, Titandioxid.
6.2 Inkompatibilitäten
Bisher keine bekannt.
6.3 Dauer der Haltbarkeit
Haltbarkeit im ungeöffneten Originalbehältnis 5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
Packung mit 30 Retardtabletten Packung mit 50 Retardtabletten Packung mit 100 Retardtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
AbZ-Pharma GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMERN
12300.00.02
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 8. Mai 1992 Datum der Verlängerung der Zulassung: 8. Mai 2002
10. STAND DER INFORMATION
August 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
8