Pertector
ENR: 2180873
FACHINFORMATION

Radioaktives Arzneimittel
1. BEZEICHNUNG DES ARZNEIMITTELS
Pertector 2,3 - 57,1 GBq Radionuklidgenerator
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Natrium[99mTc]pertechnetat-lnjektionslösung wird mittels eines [99Mo/99mTc]- Radionuklidgenerators hergestellt. [99mTc]Technetium zerfällt unter Emission von Gamma-Strahlung mit einer mittleren Energie von 140 keV und einer Halbwertszeit von 6,02 Stunden zu Technetium-99, das aufgrund seiner langen Halbwertszeit von 2,13 x 105 Jahren als quasi-stabil angesehen werden kann.
Der Radionuklidgenerator enthält das Mutternuklid [99Mo]Molybdän, adsorbiert an eine ChromatographieSäule, und liefert sterile Natrium[99mTc]pertechnetat-Injektionslösung.
Das [99Mo]Molybdän auf der Säule befindet sich im Gleichgewicht mit dem gebildeten Tochternuklid [99mTc]Technetium. Die Generatoren werden mit den folgenden [99Mo]Molybdän-Aktivitäten zum Aktivitäts-Referenzzeitpunkt geliefert, woraus sich, unter der Annahme einer 100-%igen Ausbeute und einem Zeitabstand von 24 h zum vorherigen Elutionsvorgang sowie unter Berücksichtigung des Branchfaktors (Korrekturfaktor) von etwa 87% für [99Mo]Molybdän, die folgenden [99mTc]Technetium-Aktivitäten ergeben.
|
99mTc Aktivität (maximal theoretisch eluierbare Aktivität am Kalibriertag 12:00 CET) |
2,00 |
4,00 |
5,00 |
6,00 |
7,50 |
8,00 |
10,00 |
12,00 |
13,00 |
15,00 |
GBq |
|
99Mo Aktivität am Kalibriertag 12:00 CET) |
2,3 |
4,6 |
5,7 |
6,9 |
8,5 |
9,1 |
11,4 |
13,7 |
14,9 |
17,1 |
GBq |
|
99mTc Aktivität (maximal theoretisch eluierbare Aktivität am Kalibriertag 12:00 CET) |
17,00 |
18,50 |
20,00 |
23,00 |
25,00 |
30,00 |
35,00 |
40,00 |
50,00 |
GBq |
|
99Mo Aktivität am Kalibriertag 12:00 CET) |
19,4 |
21,1 |
22,9 |
26,3 |
28,6 |
34,3 |
40,0 |
45,7 |
57,1 |
GBq |
Die verfügbare [99mTc]Technetium-Aktivität einer Elution hängt von der tatsächlichen Elutionsausbeute des Generators ab, die der Hersteller deklariert und von nationalen Behörden genehmigt wird.
Sonstiger Bestandteil mit bekannter Wirkung:
1 ml Natrium[99mTc]pertechnetat-Lösung enthält 3,6 mg Natrium.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Radionuklidgenerator
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Dieses Arzneimittel ist ein Diagnostikum.
Das Eluat (Natrium[99mTc]pertechnetat-Injektionslösung) aus dem Radionuklidgenerator wird angewendet
zur
• Radiomarkierung von Kits für radioaktive Arzneimittel, die speziell für die radioaktive Markierung mit einer derartigen Lösung entwickelt und zugelassen wurden.
• Schilddrüsen-Szintigraphie: Direkte Darstellung und Messung der Schilddrüsenaufnahme, zum Erhalt von Informationen über Größe, Lage, Nodularität und Funktion der Drüse bei Schilddrüsenerkrankungen.
• Speicheldrüsen-Szintigraphie: Diagnostik chronischer Sialadenitiden (z. B. Sjögren Syndrom) sowie Beurteilung der Speicheldrüsenfunktion und der Durchgängigkeit des Speichelganges bei Erkrankungen der Speicheldrüsen und zur Kontrolle des Ansprechens auf therapeutische Eingriffe (insbesondere Radioiodtherapie).
• Lokalisation ektopischer Magenschleimhaut (Meckel-Divertikel).
• Tränenweg-Szintigraphie: zur Beurteilung funktioneller Störungen des Tränenflusses und Erfolgskontrolle nach therapeutischen Maßnahmen.
• Shuntszintigraphie: nach Injektion der sterilen Natrium[99mTc]pertechnetat-Lösung in ein Rickham-Reservoir zur Durchgängigkeitsprüfung von Ventrikelshunts bei Hydrozephalus.
4.2 Dosierung und Art der Anwendung
Dosierung
Wenn Natrium[99mTc]pertechnetat intravenös verabreicht wird, können die (verabreichten) Aktivitäten in Abhängigkeit von der erforderlichen klinischen Information und den verwendeten Geräten breit variieren. Die Injektion von Aktivitäten, die über den lokalen diagnostischen Referenzwerten liegen, ist für die betreffende Indikation zu rechtfertigen. Folgende Aktivitäten werden empfohlen:
Erwachsene (70 kg) und ältere Patienten
• Schilddrüsen-Szintigraphie:
• Speicheldrüsen-Szintigraphie:
• Szintigraphie des Meckel-Divertikels:
• Tränenweg-Szintigraphie:
• Shuntszintigraphie:
20-80 MBq
30-150 MBq für statische Bilder und bis zu 370 MBq für dynamische Bilder 300-400 MBq
2- 4 MBq pro Tropfen pro Auge
3- 4 MBq
Eingeschränkte Nierenfunktion
Bei diesen Patienten ist eine sorgfältige Abwägung der zu verabreichenden Aktivität erforderlich, da bei diesen Patienten ein erhöhtes Strahlenexpositionsrisiko besteht.
Kinder und Jugendliche
Die Anwendung bei Kindern und Jugendlichen sollte unter Berücksichtigung der klinischen Notwendigkeit und Beurteilung des Nutzen-Risiko-Verhältnisses in dieser Patientengruppe sorgfältig abgewogen werden.
Bei Kindern und Jugendlichen muss die zu verabreichende Aktivität angepasst werden und kann gemäß den Empfehlungen der Dosierungskarte für Kinder der Europäischen Gesellschaft für Nuklearmedizin (EANM) berechnet werden. Die bei Kindern und Jugendlichen zu verabreichenden Aktivitäten können durch Multiplikation der Basisaktivitäten (für Kalkulationszwecke) mit dem entsprechenden gewichtsabhängigen Korrekturfaktor errechnet werden (siehe Tabelle 1).
A[MBq]verabreicht= Basisaktivität x Faktor
Schilddrüsen-Szintigraphie: verabreichte Aktivität [MBq] = 5,6 MBq x Korrekturfaktor (Tabelle 1). Eine Mindestaktivität von 10 MBq ist erforderlich, um eine ausreichende Bildqualität zu erzielen.
Nachweis/Lokalisierung ektopischer Magenschleimhaut: Verabreichte Aktivität [MBq] = 10,5 MBq x Korrekturfaktor (Tabelle 1). Eine Mindestaktivität von 20 MBq ist erforderlich um eine ausreichende Bildqualität zu erzielen.
Tabelle 1: Gewichtsabhängige Korrekturfaktoren für die Anwendung bei Kindern (für Schilddrüsen
Szintigraphie und Nachweis/Lokalisierung ektopischer Magenschleimhaut) entsprechend EANM-Richtlinie (Mai 2008)
|
Gewicht [kg] |
Faktor |
Gewicht [kg] |
Faktor |
Gewicht [kg] |
Faktor |
|
3 |
1 |
22 |
5,29 |
42 |
9,14 |
|
4 |
1,14 |
24 |
5,71 |
44 |
9,57 |
|
6 |
1,71 |
26 |
6,14 |
46 |
10,00 |
|
8 |
2,14 |
28 |
6,43 |
48 |
10,29 |
|
10 |
2,71 |
30 |
6,86 |
50 |
10,71 |
|
12 |
3,14 |
32 |
7,29 |
52-54 |
11,29 |
|
14 |
3,57 |
34 |
7,72 |
56-58 |
12,00 |
|
16 |
4,00 |
36 |
8,00 |
60-62 |
12,71 |
|
18 |
4,43 |
38 |
8,43 |
64-66 |
13,43 |
|
20 |
4,86 |
40 |
8,86 |
68 |
14,00 |
Speicheldrüsen-Szintigraphie: Die Arbeitsgruppe Pädiatrie der EANM (1990) empfiehlt, die an ein Kind zu verabreichende Aktivität anhand des Körpergewichts gemäß der nachstehenden Tabelle 2 zu berechnen, mit einer minimalen Dosierung von 10 MBq um Aufnahmen von ausreichender Qualität zu erhalten.
Tabelle 2: Gewichtsabhängige Korrekturfaktoren für die Anwendung bei Kindern (für Speicheldrüsen
Szintigraphie) entsprechend Empfehlungen der EANM 1990
|
Gewicht [kg] |
Faktor |
Gewicht [kg] |
Faktor |
Gewicht [kg] |
Faktor |
|
3 |
0,1 |
22 |
0,50 |
42 |
0,78 |
|
4 |
0,14 |
24 |
0,53 |
44 |
0,80 |
|
6 |
0,19 |
26 |
0,56 |
46 |
0,82 |
|
8 |
0,23 |
28 |
0,58 |
48 |
0,85 |
|
10 |
0,27 |
30 |
0,62 |
50 |
0,88 |
|
12 |
0,32 |
32 |
0,65 |
52-54 |
0,90 |
|
14 |
0,36 |
34 |
0,68 |
56-58 |
0,92 |
|
16 |
0,40 |
36 |
0,71 |
60-62 |
0,96 |
|
18 |
0,44 |
38 |
0,73 |
64-66 |
0,98 |
|
20 |
0,46 |
40 |
0,76 |
68 |
0,99 |
Szintigraphie der Tränenwege und Shuntszintigraphie: Die Dosisempfehlungen gelten sowohl für Erwachsene als auch für Kinder.
Art der Anwendung
Zur Mehrfachdosierung.
Zur intravenösen Anwendung oder zur Anwendung am Auge.
Für Hinweise zur Zubereitung des Arzneimittels vor der Anwendung, siehe Abschnitt 12.
Zur Vorbereitung der Patienten, siehe Abschnitt 4.4.
Bei der Schilddrüsen-Szintigraphie, Speicheldrüsen-Szintigraphie und zum Nachweis ektopischer Magenschleimhaut wird Natrium[99mTc]pertechnetat-Lösung als intravenöse Injektion verabreicht.
Bei der Tränengang-Szintigraphie wird in jedes Auge getropft (Anwendung am Auge).
Bei der Shuntszintigraphie wird die sterile Natrium[99mTc]pertechnetat-Lösung in ein Rickham-Reservoir injiziert.
Bildaufnahme
Schilddrüsen-Szintigraphie: 20 Minuten nach intravenöser Injektion.
Speicheldrüsen-Szintigraphie: unmittelbar nach der intravenösen Injektion und in regelmäßigen Abständen bis zu 15 Minuten.
Nachweis/Lokalisierung ektopischer Magenschleimhaut: unmittelbar nach der intravenösen Injektion und in regelmäßigen Abständen bis zu 30 Minuten.
Tränengang-Szintigraphie: dynamische Aufnahmen innerhalb von 2 Minuten nach dem Eintropfen,, anschließend statische Aufnahmen in regelmäßigen Abständen innerhalb von 20 Minuten.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Informationen über Gegenanzeigen bei der Verwendung zur Markierung von einem Kit für ein radioaktives Arzneimittel sind der Fach- und Gebrauchsinformation des Kits zu entnehmen CSP.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Potenzielle Überem pfindlichkeit oder anaphylaktische Reaktionen
Wenn Überempfindlichkeits- oder anaphylaktische Reaktionen auftreten, ist die Anwendung des Arzneimittels sofort abzubrechen und, falls erforderlich, eine intravenöse Behandlung einzuleiten. Um im Notfall unverzüglich reagieren zu können, sollten entsprechende Arzneimittel und Instrumente, u. a.
Trachealtubus und Beatmungsgerät, griffbereit sein.
Individuelle Nutzen/Risikobewertung
Für jeden Patienten muss die Strahlenbelastung entsprechend dem erwarteten Nutzen vertretbar sein. Die verabreichte Aktivität sollte in jedem Fall so niedrig wie nötig sein, um noch die erforderlichen diagnostischen Informationen zu erhalten
Eingeschränkte Nierenfunktion
Bei diesen Patienten ist eine sorgfältige Abwägung des Nutzen-Risiko-Verhältnisses erforderlich, da ein erhöhtes Strahlenexpositionsrisiko vorliegen kann.
Kinder und Jugendliche
Information zur Anwendung bei Kindern, siehe Abschnitt 4.2 oder 5.1.
Da die effektive Dosis pro MBq höher ist als bei Erwachsenen, ist eine besonders sorgfältige Indikationsstellung erforderlich (siehe Abschnitt 11).
Eine Blockade der Schilddrüse ist bei der Anwendung bei Kindern von besonderer Bedeutung, ausgenommen bei Schilddrüsen-Szintigraphie.
Patientenvorbereitung
Bei bestimmten Indikationen ist unter Umständen eine Vorbehandlung der Patienten mit Schilddrüsenblockern bzw. Thyreostatika erforderlich.
Die Patienten sollten vor der Untersuchung gut hydriert sein und aufgefordert werden, in den ersten Stunden nach der Untersuchung so oft wie möglich die Blase zu entleeren, um die Strahlenexposition zu vermindern.
Zur Vermeidung falsch positiver Ergebnisse oder zur Minimierung der Strahlung durch Verringerung der Anreicherung von [99mTc]pertechnetat in der Schild- oder Speicheldrüse sollte vor einer TränengangSzintigraphie und Szintigraphie des Meckel-Divertikels ein Schilddrüsenblocker verabreicht werden. Umgekehrt darf vor Schilddrüsen-, Nebenschilddrüsen- oder Speicheldrüsen-Szintigraphie keine Schilddrüsenblockade angewendet werden.
Vor Anwendung der Natrium[99mTc]pertechnetat-Lösung zur Szintigraphie eines Meckel-Divertikels sollte der Patient 3 bis 4 Stunden nüchtern bleiben, um die Darmperistaltik gering zu halten.
Nach einer in vivo-Markierung von Erythrozyten mit Zinnionen als Reduktionsmittel wird Natrium[99mTc]pertechnetat primär in Erythrozyten eingebaut. Daher sollte eine Meckel-Szintigraphie vor oder erst einige Tage nach einer in vivo-Markierung von Erythrozyten erfolgen.
Nach vorausgegangenen nuklearmedizinischen Untersuchungen mit einem Zinn(II)-haltigen Kit für ein radioaktives Arzneimittel ist eine Wartezeit von mindestens 8 Tagen angezeigt, da es sonst zu einer unerwünschten Markierung von roten Blutzellen kommen kann.
Nach der Untersuchung
Enger Kontakt mit kleinen Kindern und Schwangeren sollte in den ersten 12 Stunden vermieden werden. Besondere Warnhinweise
Natrium[99mTc]pertechnetat-Lösung enthält 3,6 mg/ml Natrium. Abhängig vom Zeitpunkt der Verabreichung der Injektion kann der dem Patienten verabreichte Natriumgehalt in manchen Fällen größer als 1 mmol (23 mg) sein. Bei Patienten, die eine kochsalzarme Diät einhalten müssen, ist dies zu berücksichtigen.
Bei der Speicheldrüsenszintigraphie muss mit einer geringeren Spezifität der Methode im Vergleich zur MR-Sialographie gerechnet werden.
Bei der Kit-Markierung mit Natrium[99mTc]pertechnetat-Lösung ist der Gesamt-Natriumgehalt der verabreichten Dosis zu beachten und das aus dem Eluat und dem Kit stammende Natrium zu berücksichtigen. Siehe Fachinformation und Packungsbeilage des betreffenden Kits.
Hinweise zur Vermeidung von Gefahren für die Umwelt, siehe Abschnitt 6.6.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Atropin, Isoprenalin und Analgetika können eine Verzögerung der Magenentleerung verursachen und dadurch bei Abdomendarstellungen eine Umverteilung des [99mTc]Pertechnetats bewirken.
Laxanzien sind abzusetzen, da sie zu einer Reizung des Gastrointestinaltrakts führen können. Kontrastmitteluntersuchungen (z. B. mit Barium) und Untersuchungen des oberen Gastrointestinaltrakts sind innerhalb von 48 Stunden vor Verabreichung von [99mTc]Pertechnetat zur Szintigraphie eines MeckelDivertikels zu vermeiden.
Viele pharmakologische Substanzen sind dafür bekannt, die Aufnahme in die Schilddrüse zu beeinflussen:
• Thyreostatika (z. B. Carbimazol oder andere Imidazolderivative wie Propylthiouracil), Salizylate,
Steroide, Natrium-Nitroprussid, Natrium-Sulfobromophthalein, Perchlorat sollten 1 Woche vor der Schilddrüsen-Szintigraphie abgesetzt werden.
• Phenylbutazon und Expektoranzien sollten 2 Wochen zuvor abgesetzt werden.
• Natürliche oder synthetische Schilddrüsenhormone (z. B. Natriumthyroxin, Natriumliothyronin, Schilddrüsenextrakt) sollten 2-3 Wochen zuvor abgesetzt werden.
• Amiodaron, Benzodiazepine, Lithium sollten 4 Wochen zuvor abgesetzt werden.
• Intravenöse Kontrastmittel sollten innerhalb von 1-2 Monaten vor der Untersuchung nicht verabreicht worden sein.
Zinn(II)-Ionen und Sulfonamide können zu erhöhten Natrium[99mTc]pertechnetat-Konzentrationen in den roten Blutzellen führen, d. h. zu verminderter Anreicherung im Plasma und in Hirnläsionen. Entsprechende Medikamente sollten mindestens 8 Tage vor der Behandlung abgesetzt werden.
Bei Patienten mit einer durch Methotrexat induzierten Ventrikulitis kann es bei der cerebralen Shuntszintigraphie zu einer gesteigerten [99mTc]Pertechnetat-Aufnahme in die Wände der Gehirnventrikel kommen.
Inkombatibilitäten: Radioaktive Arzneimittel, die mit Natrium[99mTc]pertechnetat markiert sind, dürfen nicht mit anderen Arzneimitteln gemischt werden. Nach einer vorausgegangenen nuklearmedizinischen Untersuchung mit einem Zinn-Ionen enthaltendem Kit für ein radioaktives Arzneimittel, wird eine Wartezeit von mindestens 8 Tagen vor der Verabreichung von Natrium[99mTc] empfohlen.
Zu Informationen über Wechselwirkungen bei einer Verwendung zur Markierung von einem Kit für ein radioaktives Arzneimittel, wird der Anwender auf die Produktinformationen der Hersteller der jeweiligen Kits verwiesen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Frauen im gebärfähigen Alter
Wenn bei einer Frau im gebärfähigen Alter die Anwendung eines radioaktiven Arzneimittels beabsichtigt ist, ist es wichtig festzustellen, ob sie schwanger ist oder nicht. Jede Frau, deren Periode ausgeblieben ist, muss als schwanger angesehen werden, solange das Gegenteil nicht bewiesen ist. Bei Zweifeln hinsichtlich einer möglichen Schwangerschaft (bei Ausbleiben der Periode, unregelmäßiger Periode etc.) sollten der Patientin (wenn möglich) alternative Techniken, die keine Strahlenbelastung beinhalten, angeboten werden.
Schwangerschaft
Natrium[99mTc]pertechnetat darf bei schwangeren Frauen nur bei medizinischer Notwendigkeit angewendet werden und wenn der zu erwartende individuelle Nutzen das Risiko für Mutter und Kind übersteigt. Alternativ sollten nicht radiologische Verfahren zur Diagnostik in Betracht gezogen werden. Es hat sich gezeigt, dass Natrium[99mTc]pertechnetat plazentagängig ist.
Stillzeit
Vor der Anwendung von Radiopharmaka bei einer stillenden Mutter ist zu prüfen, ob eine Verschiebung der Untersuchung auf einen Zeitpunkt nach Beendigung der Stillperiode klinisch zu verantworten ist und welche Radiopharmaka unter Berücksichtigung der Abgabe von Radioaktivität in die Muttermilch am besten eingesetzt werden. Falls eine Anwendung erforderlich ist, muss das Stillen für mindestens 12 Stunden unterbrochen und die Muttermilch verworfen werden. Enger Kontakt mit Kleinkindern sollte in dieser Zeit vermieden werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zum Einfluss auf die Fahrtüchtigkeit und die Befähigung zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Es liegen Angaben zu unerwünschten Wirkungen aus Spontanmeldungen vor. Bei den berichteten Wirkungen handelte es sich um anaphylaktoide Reaktionen, vegetative Reaktionen sowie verschiedene Arten von Reaktionen am Verabreichungsort der Injektion. Natrium[99mTc]pertechnetat aus dem Pertector-Generator wird zur radioaktiven Markierung verschiedener Substanzen verwendet. Diese Arzneimittel haben im Allgemeinen ein höheres Nebenwirkungspotential als [99mTc]pertechnetat. Daher sind die berichteten Nebenwirkungen eher den markierten Substanzen als [99mTc]pertechnetat zuzuschreiben. Welche Arten von Nebenwirkungen nach intravenöser Verabreichung des [99mTc]pertechnetat -markierten Präparates auftreten können, hängt von der jeweiligen Substanz ab. Die entsprechenden Angaben sind in der Fachinformation des zur Zubereitung des radioaktiven Arzneimittels verwendeten Kits enthalten.
Tabellarische Liste der Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1.000 bis <1/100)
Selten (>1/10.000 bis <1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Immunsystems
Häufigkeit nicht bekannt1: anaphylaktoide Reaktionen (z. B. Dyspnoe, Koma, Urtikaria, Erythem, Hautausschlag, Pruritus, Ödembildung an verschiedenen Stellen, z. B. im Gesicht)
Erkrankungen des Nervensystems
Häufigkeit nicht bekannt1: vasovagale Reaktionen (z. B. Synkope, Tachykardie, Bradykardie,
Schwindelgefühl, Kopfschmerzen, verschwommenes Sehen, Gesichtsrötung/Hitzegefühl (Flushing))
Erkrankungen des Gastrointestinaltrakts
Häufigkeit nicht bekannt1: Erbrechen, Übelkeit, Diarrhoe
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufigkeit nicht bekannt1: Reaktionen am Verabreichungsort der Injektion aufgrund von Paravasation (z. B. Cellulitis, Schmerzen, Erythem, Schwellung)
Ionisierende Strahlen können Krebs und Erbgutveränderungen verursachen. Da die effektive Strahlendosis bei Gabe der maximalen empfohlenen Aktivität von 400 MBq bei 5,2 mSv liegt, sind diese Effekte mit geringer Wahrscheinlichkeit zu erwarten.
Beschreibung ausgewählter Nebenwirkungen
Anaphylaktische Reaktionen (z.B. Dyspnoe, Koma, Urtikaria, Erythem, Hautausschlag, Pruritus, Ödembildung an verschiedenen Stellen [z.B. im Gesicht]),
Anaphylaktoide Reaktionen wurden nach intravenöser Injektion von Natrium[99mTc]perchtechnetat berichtet und beinhalten verschiedene Haut- oder Atemwegsymptome wie Hautreizungen, Ödeme oder Dyspnoe.
Vegetative Reaktionen (Erkrankungen des Nervensystems und des Gastrointestinaltrakts)
Einzelfälle schwerer vegetativer Reaktionen wurden berichtet, jedoch handelte es sich bei den meisten berichteten Nebenwirkungen um gastrointestinale Reaktionen wie Übelkeit oder Erbrechen. Andere Berichte beinhalten vasovagale Reaktionen wie Kopfschmerzen oder Schwindelgefühl. Vegetative Wirkungen werden eher auf die Untersuchungssituation als auf [99mTc]Technetium zurückgeführt, vor allem bei ängstlichen Patienten.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Andere Berichte beschreiben lokale Reaktionen am Verabreichungsort der Injektion. Solche Reaktionen werden durch Extravasation des radioaktiven Materials während der Injektion verursacht. Die beobachten Reaktionen reichen von lokaler Schwellung bis hin zur Cellulitis. Abhängig von der verabreichten Radioaktivität und der markierten Substanz kann eine größere Paravasation eine chirurgische Behandlung erfordern.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: http://www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Im Fall einer Strahlenüberdosis mitNatrium[99mTc]pertechnetat sollte die vom Patienten absorbierte Strahlendosis, wenn möglich durch beschleunigte Ausscheidung des Radionuklids aus dem Körper, durch Defäkation, Förderung der Diurese und möglichst häufiges Entleeren der Blase, verringert werden.
Die Aufnahme in die Schilddrüse, Speicheldrüsen und die Magenschleimhaut kann deutlich vermindert werden, wenn Natriumperchlorat unmittelbar nach einer versehentlichen zu hohen Dosis von Natrium[99mTc]pertechnetat verabreicht wird.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Radiodiagnostika, verschiedene Radiodiagnostika für
die Schilddrüse, ATC-Code: V09FX01
Bei Dosierungen in den für diagnostische Zwecke üblichen Bereichen wurden keine pharmakodynamischen Wirkungen beobachtet.
Anwendung bei Kindern
Die Europäische Arzneimittel-Agentur hat die Verpflichtung zur Vorlage von Studienergebnissen bei Kindern aller Altersgruppen mit dem Natrium[99mTc]pertechnetat Referenzprodukt in den zugelassenen Indikationen aufgehoben (siehe Abschnitt 4.2 für Informationen zur Anwendung bei Kindern).
5.2 Pharmakokinetische Eigenschaften
Verteilung
Das Pertechnetat-Ion hat eine ähnliche biologische Verteilung wie Iodid- und Perchlorat-Ionen und reichert sich vorübergehend in den Speicheldrüsen, im Plexus chorioideus, im Magen (in der Magenschleimhaut) und der Schilddrüse an, aus der es unverändert wieder ausgeschieden wird. Das Pertechnetat-Ion weist auch eine Tendenz zur Anreicherung in Gebieten erhöhter Vaskularisierung oder mit abnormer Gefäßpermeabilität auf, vor allem wenn es durch Vorbehandlung mit Schilddrüsenblockern zur Hemmung der Aufnahme in Drüsenstrukturen kommt. Bei intakter Blut-Hirn-Schranke tritt [99mTc]Pertechnetat nicht in Hirngewebe über.
Organaufnahme
Im Blut liegen 70-80 % des intravenös injizierten Natrium[99mTc]pertechnetats an Proteine, hauptsächlich unspezifisch an Albumin, gebunden vor. Der ungebundene Anteil (20-30 %) reichert sich vorübergehend in Schilddrüse, Speicheldrüsen, Magen- und Nasenschleimhaut sowie Plexus chorioidei an.
Im Gegensatz zu Iod wird Natrium[99mTc]pertechnetat weder in Schilddrüsenhormone eingebaut (Organifizierung) noch im Dünndarm resorbiert. In der Schilddrüse wird die maximale Anreicherung, abhängig von Funktionszustand und Iodsättigung (bei Euthyreose ca. 0,3-3 %, bei Hyperthyreose und Iodmangel bis zu 25 %) etwa 20 min nach Injektion erreicht und nimmt danach rasch wieder ab. Ähnliches gilt für die Belegzellen der Magenschleimhaut und die Azinuszellen der Speicheldrüsen.
Im Gegensatz zur Schilddrüse, die Natrium[99mTc]pertechnetat wieder in die Blutbahn abgibt, erfolgt die Sekretion aus der Speicheldrüse und dem Magen in den Speichel bzw. Magensaft. Die Anreicherung durch die Speicheldrüse liegt in der Größenordnung von 0,5 % der applizierten Aktivität, wobei das Maximum nach etwa 20 Minuten erreicht wird. Eine Stunde nach Injektion liegt die Konzentration im Speichel um das 10-30fache höher als im Plasma. Die Exkretion kann durch Zitronensaft oder Stimulierung des parasympathischen Nervensystems beschleunigt werde, die Aufnahme wird durch Perchlorat vermindert.
Eliminierung
Die Halbwertszeit der Plasmaclearance beträgt ungefähr 3 Stunden. Natrium[99mTc]pertechnetat wird im Organismus nicht metabolisiert. Ein Teil wird sehr schnell renal, der Rest langsamer über Faeces, Speichelund Tränenflüssigkeit eliminiert. Die Ausscheidung erfolgt während der ersten 24 Stunden nach Injektion hauptsächlich über die Nieren (ca. 25 %), und während der folgenden 48 Stunden über die Faeces. Etwa 50 % der verabreichten Aktivität werden innerhalb der ersten 50 Stunden ausgeschieden. Wenn die selektive Natrium[99mTc]pertechnetat-Aufnahme in die Drüsenstrukturen durch Vorbehandlung mit Blockern gehemmt ist, erfolgt die Ausscheidung auf dem gleichen Wege, aber die Nierenclearance ist erhöht.
Die oben genannten Informationen sind nicht gültig, wenn Natrium[99mTc]pertechnetat zur Markierung anderer Radiopharmaka verwendet wird.
5.3 Präklinische Daten zur Sicherheit
Es liegen keine Daten zur akuten, subakuten und chronischen Toxizität nach Einmalverabreichung oder wiederholter Verabreichung vor. Die bei klinischen Diagnoseverfahren verabreichte Menge an Natrium[99mTc]pertechnetat ist sehr klein und abgesehen von allergischen Reaktionen wurden keine anderen unerwünschten Wirkungen beobachtet.
Dieses Arzneimittel ist nicht zur regelmäßigen oder kontinuierlichen Anwendung bestimmt. Mutagenitätsstudien und Langzeit-Karzinogenitätsstudien wurden nicht durchgeführt.
Reproduktionstoxizität
Der Übertritt von [99mTc] aus intravenös verabreichtem Natrium[99mTc]pertechnetat in die Plazenta wurde bei Mäusen untersucht. Ohne vorherige Gabe von Perchlorat wurde bei Mäusen im trächtigen Uterus bis zu 60 % der injizierten [99mTc]-Dosis nachgewiesen. Die Gabe an Mäuse während der Trächtigkeit und/oder Laktation führte bei den Nachkommen zu vermindertem Gewicht, Haarlosigkeit und Sterilität.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Aluminiumoxid
Benzododeciniumbromid
Natriumchlorid
Wasser für Injektionszwecke
Salpetersäure
Natriumhydroxid
6.2 Inkompatibilitäten
Das Arzneimittel darf, außer mit den unter Abschnitt 12 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Generator: 14 Tage ab dem Kalibierzeitpunkt. Kalibrierzeitpunkt und Verfallszeitpunkt sind auf dem Etikett angegeben. Nicht über 30 °C lagern.
Natrium[99mTc]pertechnetat-Eluat: nach der Elution innerhalb von 12 Stunden verwenden. Nicht über 25 °C lagern.
Durchstechflaschen mit 0,9 %ige Natriumchloridlösung sowie evakuierte Durchstechflaschen: 3 Monate.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Generator und Eluat nicht einfrieren.
Eluat: Lagerungsbedingungen nach Elution des Arzneimittels, siehe Abschnitt 6.3.
Die nationalen Bestimmungen für die Lagerung radioaktiven Materials sind zu beachten.
6.5 Art und Inhalt des Behältnisses
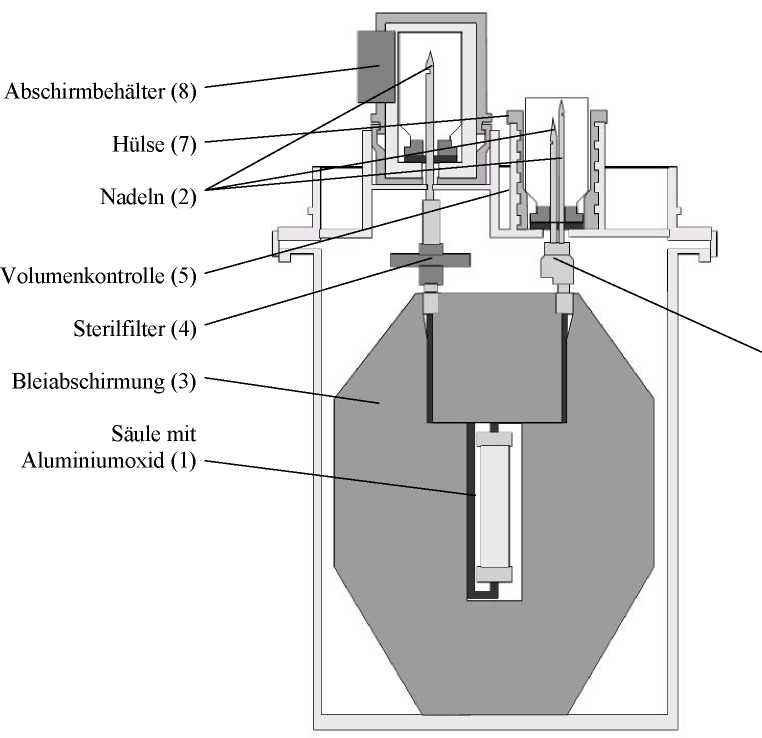
Pertector besteht aus (vgl. Abbildung):
• Sterile Glassäule gefüllt mit Aluminiumoxid (1), an dem das primäre Radionuklid 99Mo adsorbiert ist. Die Säule ist am oberen Ende und am Boden jeweils mit einem durch eine Metallkappe gesicherten Gummistopfen verschlossen.
• Edelstahlnadel-Set (2), das die Verbindung der Generatorsäule mit den Eluent-Durchstechflaschen und den evakuierten Durchstechflaschen ermöglicht. Die Nadeln sind während des Transportes und der Elutionspausen durch zwei Durchstechflaschen mit bakteriostatischer Lösung (0,02 %ige wässrige Benzododeciniumbromid-Lösung) geschützt.
• Bleiabschirmung (3) mit einer Dicke von 50 mm, in der sich die Säule und die Nadeln des Generators befinden.
• Sterilfilter (4 und 9) für das Eluat und die in die Eluat-Durchstechflasche eingesaugte Luft.
• Eluatvolumen-Kontrolle (5), mit der das gewünschte Eluatvolumen (4 bis 8 ± 0,5 ml) und damit die gewünschte radioaktive Konzentration des Eluates einzustellen ist. Die Einstellung erfolgt durch Drehen der oberen Hülse (7) entsprechend der dargestellten Skala.
Zusammen mit dem Generator wird das folgende Material geliefert:
• 16 Durchstechflaschen Elutionslösung (0,9 %ige NaCl Lösung) und 16 evakuierte Durchstechflaschen (zur Aufnahme des Eluates).
• Abschirmbehälter (8) zur Aufnahme der Elutionsdurchstechflasche
Die Durchstechflaschen (Natriumchloridlösung und Vakuum) sind 10-ml-Glasflaschen mit Gummistopfen
und Verschlusskappe.
Elutionslösung (0,9 %ige NaCl Lösung) und evakuierte Durchstechflaschen (Flaschen für das Eluat)
können separat als Zubehör bezogen werden.
Sterilfilter (9)
Hülse (7) Zeiger (6)
Abbildung: Aufbau des Generators
Packungsgrößen:
Radionuklidgenerator mit Aktivitäten von 2,3, 4,6, 5,7, 6,9, 8,5, 9,1, 11,4, 13,7, 14,9, 17,1, 19,4, 21,1, 22,9, 26,3, 28,6, 34,3, 40,0, 45,7 oder 57,1 GBq Molybdän-99 und entsprechenden variablen Technetium-99m-Aktivitäten am Kalibrierzeitpunkt. Die Aktivität des Generators zum Zeitpunkt der Kalibrierung ist auf jeder Packung angegeben.
6.6. Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Allgemeine Warnhimveise
Radioaktive Arzneimittel dürfen nur von dazu berechtigten Personen in speziell dafür bestimmten klinischen Bereichen in Empfang genommen, gehandhabt und verabreicht werden. Entgegennahme, Lagerung, Anwendung, Transport und Entsorgung unterliegen den Anordnungen und/oder entsprechenden Genehmigungen der örtlich zuständigen Aufsichtsbehörden.
Radiopharmaka dürfen vom Anwender nur unter Berücksichtigung der Anforderungen an die radiologische Sicherheit und die pharmazeutische Qualität zubereitet werden. Geeignete aseptische Vorkehrungen sollten getroffen werden.
Anweisungen zur Vorbereitung des Arzneimittels vor Anwendung, siehe Abschnitt 12.
Wenn zu irgendeiner Zeit der Anwendung die Integrität des Generators oder der Durchstechflaschen zweifelhaft ist, sollten sie nicht verwendet werden.
Die Verabreichung ist so durchzuführen, dass das Risiko einer Kontamination des Arzneimittels und einer Strahlenexposition der Anwender so gering wie möglich bleibt. Eine geeignete Abschirmung ist zwingend erforderlich.
Die Anwendung von radioaktiven Arzneimitteln setzt andere Personen einem Risiko durch externe Strahlung oder Kontamination durch Urin, Erbrochenes usw. aus. Daher müssen Strahlenschutzmaßnahmen gemäß nationalen Bestimmungen eingehalten werden.
Vor Entsorgung des Generators muss die Restaktivität abgeschätzt werden.
Sichere Handhabung
Das Gewicht eines Generators beträgt ungefähr 16 kg. Beim Heben und Tragen des Generators ist auf Sicherheit zu achten. Um das Risiko von Verletzungen einzuschränken, sind die jeweils gültigen Vorschriften für eine sichere Handhabung zu beachten.
Entsorgung von Generatoren nach Ablauf der Verwendbarkeitsdauer
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Genaue Anweisungen für die Rückgabe der Generatoren an den Hersteller sind jedem Generator beigepackt. Die Anwender werden darauf hingewiesen, dass Verpackung, Dokumentation und Transportart den internationalen Transportvorschriften und örtlich gültigen Vorschriften oder diesbezüglich zu beachtenden Verhaltenskodizes entsprechen müssen.
7. INHABER DER ZULASSUNG
ROTOP Pharmaka GmbH
Bautzner Landstraße 400
01328 Dresden
Deutschland
Tel: 0 351 -26 310 100
Fax: 0 351 -26 310 303
E-Mail: service@rotop-pharmaka.de
8. ZULASSUNGSNUMMER
80873.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 24.März 2011
10. STAND DER INFORMATION
08/2014
11. DOSIMETRIE
Strahlenexposition
Die Strahlenexposition hängt von einer Vorbehandlung mit blockierenden Substanzen sowie vom Ausmaß körperlicher Aktivität ab.
Die geschätzten absorbierten Strahlendosen einzelner Organe nach direkter Anwendung von Natrium[99mTc]pertechnetat bei gesunden Personen sind in den folgenden Tabellen angegeben. Die Werte beziehen sich auf Anwendungen ohne/mit vorab verabreichten blockierenden Substanzen. Die Daten wurden der Veröffentlichung "Radiation Dose to Patients from Radiopharmaceuticals” ICRP Publication 80 (Addendum 2 to ICRP Publication 53) entnommen.
Tabelle 3: Pertechnetat ohne Vorbehandlung mit einer blockierenden Substanz
|
Organ |
Aufgenommene Dosis je Einheit verabreichter Aktivität (mGy/MBq) | ||||
|
Erwachsener |
15 Jahre |
10 Jahre |
5 Jahre |
1 Jahr | |
|
Nebennieren |
0,0037 |
0,0047 |
0,0072 |
0,011 |
0,019 |
|
Blase |
0,018 |
0,023 |
0,030 |
0,033 |
0,060 |
|
Knochenoberfläche |
0,0054 |
0,0066 |
0,0097 |
0,014 |
0,026 |
|
Gehirn |
0,0020 |
0,0025 |
0,0041 |
0,0066 |
0,012 |
|
Brust |
0,0018 |
0,0023 |
0,0034 |
0,0056 |
0,011 |
|
Gallenblase |
0,0074 |
0,0099 |
0,016 |
0,023 |
0,035 |
|
Magen-Darm-T rakt | |||||
|
Magen |
0,026 |
0,034 |
0,048 |
0,078 |
0,16 |
|
Dünndarm |
0,016 |
0,020 |
0,031 |
0,047 |
0,082 |
|
Dickdarm |
0,042 |
0,054 |
0,088 |
0,14 |
0,27 |
|
Oberer Dickdarm |
0,057 |
0,073 |
0,12 |
0,20 |
0,38 |
|
Unterer Dickdarm |
0,021 |
0,028 |
0,045 |
0,072 |
0,13 |
|
Herz |
0,0031 |
0,0040 |
0,0061 |
0,0092 |
0,017 |
|
Nieren |
0,0050 |
0,0060 |
0,0087 |
0,013 |
0,021 |
|
Leber |
0,0038 |
0,0048 |
0,0081 |
0,013 |
0,022 |
|
Lunge |
0,0026 |
0,0034 |
0,0051 |
0,0079 |
0,014 |
|
Muskeln |
0,0032 |
0,0040 |
0,0060 |
0,0090 |
0,016 |
|
Speiseröhre |
0,0024 |
0,0032 |
0,0047 |
0,0075 |
0,014 |
|
Ovarien |
0,010 |
0,013 |
0,018 |
0,026 |
0,045 |
|
Bauchspeicheldrüse |
0,0056 |
0,0073 |
0,011 |
0,016 |
0,027 |
|
Rotes Knochenmark |
0,0036 |
0,0045 |
0,0066 |
0,0090 |
0,015 |
|
Speicheldrüse |
0,0093 |
0,012 |
0,017 |
0,024 |
0,039 |
|
Haut |
0,0018 |
0,0022 |
0,0035 |
0,0056 |
0,010 |
|
Milz |
0,0043 |
0,0054 |
0,0081 |
0,012 |
0,021 |
|
Testes |
0,0028 |
0,0037 |
0,0058 |
0,0087 |
0,016 |
|
Thymus |
0,0024 |
0,0032 |
0,0047 |
0,0075 |
0,014 |
|
Schilddrüse |
0,022 |
0,036 |
0,055 |
0,12 |
0,22 |
|
Uterus |
0,0081 |
0,010 |
0,015 |
0,022 |
0,037 |
|
Sonstige Gewebe |
0,0035 |
0,0043 |
0,0064 |
0,0096 |
0,017 |
|
Effektive Dosis (mSv/MBq) |
0,013 |
0,017 |
0,026 |
0,042 |
0,079 |
Die effektive Dosis, die sich aus der intravenösen Anwendung intravenöser Verabreichung von 400 MBq Natrium[99mTc]pertechnetat an Erwachsene mit einem Gewicht von 70 kg liegt bei etwa 5,2 mSv.
Tabelle 4: Pertechnetat nach Vorbehandlung mit einer blockierenden Substanz
|
Organ |
Aufgenommene Dosis je Einheit verabreichter Aktivität (mGy/MBq) | ||||
|
Erwachsener |
15 Jahre |
10 Jahre |
5 Jahre |
1 Jahr | |
|
Nebennieren |
0,0029 |
0,0037 |
0,0056 |
0,0086 |
0,016 |
|
Blase |
0,030 |
0,038 |
0,048 |
0,050 |
0,091 |
|
Knochenoberfläche |
0,0044 |
0,0054 |
0,0081 |
0,012 |
0,022 |
|
Gehirn |
0,0020 |
0,0026 |
0,0042 |
0,0071 |
0,012 |
|
Brust |
0,0017 |
0,0022 |
0,0032 |
0,0052 |
0,010 |
|
Gallenblase |
0,0030 |
0,0042 |
0,0070 |
0,010 |
0,013 |
|
Magen-Darm-T rakt | |||||
|
Magen |
0,0027 |
0,0036 |
0,0059 |
0,0086 |
0,015 |
|
Dünndarm |
0,0035 |
0,0044 |
0,0067 |
0,010 |
0,018 |
|
Dickdarm |
0,0036 |
0,0048 |
0,0071 |
0,010 |
0,018 |
|
Oberer Dickdarm |
0,0032 |
0,0043 |
0,0064 |
0,010 |
0,017 |
|
Unterer Dickdarm |
0,0042 |
0,0054 |
0,0081 |
0,011 |
0,019 |
|
Herz |
0,0027 |
0,0034 |
0,0052 |
0,0081 |
0,014 |
|
Nieren |
0,0044 |
0,0054 |
0,0077 |
0,011 |
0,019 |
|
Leber |
0,0026 |
0,0034 |
0,0053 |
0,0082 |
0,015 |
|
Lunge |
0,0023 |
0,0031 |
0,0046 |
0,0074 |
0,013 |
|
Muskeln |
0,0025 |
0,0031 |
0,0047 |
0,0072 |
0,013 |
|
Speiseröhre |
0,0024 |
0,0031 |
0,0046 |
0,0075 |
0,014 |
|
Ovarien |
0,0043 |
0,0054 |
0,0078 |
0,011 |
0,019 |
|
Bauchspeicheldrüse |
0,0030 |
0,0039 |
0,0059 |
0,0093 |
0,016 |
|
Rotes Knochenmark |
0,0025 |
0,0032 |
0,0049 |
0,0072 |
0,013 |
|
Haut |
0,0016 |
0,0020 |
0,0032 |
0,0052 |
0,0097 |
|
Milz |
0,0026 |
0,0034 |
0,0054 |
0,0083 |
0,015 |
|
Testes |
0,0030 |
0,0040 |
0,0060 |
0,0087 |
0,016 |
|
Thymus |
0,0024 |
0,0031 |
0,0046 |
0,0075 |
0,014 |
|
Schilddrüse |
0,0024 |
0,0031 |
0,0050 |
0,0084 |
0,015 |
|
Uterus |
0,0060 |
0,0073 |
0,011 |
0,014 |
0,023 |
|
Sonstige Gewebe |
0,0025 |
0,0031 |
0,0048 |
0,0073 |
0,013 |
|
Effektive Dosis (mSv/MBq) |
0,0042 |
0,0054 |
0,0077 |
0,011 |
0,019 |
Wird dem Patienten vor der Anwendung eine blockierende Substanz verabreicht, beträgt die effektive Dosis nach Anwendung von 800 MBq Natrium[99mTc]pertechnetat 3,36 mSv.
Die Strahlendosis, die nach Anwendung von Natrium[99mTc]pertechnetat zur Szintigraphie des Tränenganges von der Augenlinse aufgenommen wird, beträgt schätzungsweise 0,038 mGy/MBq. Dies entspricht einer effektiven Dosis von weniger als 0,01 mSv bei einer verabreichten Aktivität von 4 MBq.
Die angegebenen Strahlenexpositionen gelten bei normaler Funktion aller Natrium[99mTc]pertechnetat anreichernder Organe. Über- bzw. Unterfunktion (z.B. von Schilddrüse, Magenschleimhaut oder Nieren) sowie Störungen der Blut-Hirn-Schranke oder renale Abflussstörungen können zu veränderten, lokal auch stark erhöhten Strahlenexpositionen führen.
Externe Strahlenexposition
|
Dosisrate 99Mo-99mTc auf der Oberfläche des Generators (^SV/Std./GBq) |
Dosisrate 99Mo-99mTc in 1 m Abstand vom Generator (^SV/Std./GBq) | |
|
50 mm Bleiabschirmung |
31 |
0,3 |
Messungen am Arbeitsplatz und während der Arbeit sind von wesentlicher Bedeutung und sollten zur genaueren und aufschlussreicheren Bestimmung der Dosis der Gesamt-Strahlenbelastung für das Personal durchgeführt werden.
Die Fingerdosisraten auf der Oberfläche der Abschirmung einer Durchstechflasche zum Eluieren, die ein typisches Eluat enthält, betragen:_
|
Messpunkt |
Oberflächendosisrate 99mTc (^SV/Std./GBq) |
|
Bleiabschirmung |
< 0,1 |
|
Bleiglasabschirmung |
< 0,6 |
12. ANWEISUNGEN ZUR ZUBEREITUNG VON RADIOAKTIVEN ARZNEIMITTELN Elutionsanleitung
Die Elution durch den Generator muss in Einrichtungen stattfinden, die hinsichtlich der Sicherheit der Anwendung von radioaktiven Arzneimitteln die nationalen Bestimmungen erfüllen.
Während der Handhabung und der Anwendung des Arzneimittels müssen die Bestimmungen des Strahlenschutzes eingehalten werden. Elutionen dürfen nur in dementsprechenden Räumen durchgeführt werden. Es wird empfohlen, die Elution des Generators und alle weiteren Arbeitsschritte mit der Natrium[99mTc]pertechnetat-Lösung hinter einer zusätzlichen adäquaten Abschirmung (z. B. 50 mm Bleiwand) durchzuführen. Auch die für die Herstellung des Radiopharmakons verwendeten Spritzen sollten mit Bleischutz versehen sein (Code OS-2, OS-5, OS-10 und OS-P-10).
Während der Elution des Generators muss strikt aseptisch gearbeitet werden, damit die Sterilität des Generatoreluats erhalten bleibt. Für eine optimale Leistung und sichere Handhabung des Generators müssen die Arbeitsschritte in der nachstehend beschriebenen Reihenfolge eingehalten werden.
Achtung:
Spülen Sie Nadeln und Flaschenstopfen nicht mit Ethanol, Ethylether oder Detergentien.
Für die Elution des Radionuklidgenerators dürfen ausschließlich die zu diesem Radionuklidgenerator gehörende Elutionslösung (0,9 %ige Natriumchloridlösung) und die mit einem Unterdruck versehenen Durchstechflaschen verwendete werden (nähere Informationen unter „6.5 Art und Inhalt des Behältnisses“).
Vorbereitung
Transportbehälter.
den Eluat-Abschirmbehälter, der sich im oberen Boden des Behälters befindet (bei
den oberen Boden des Behälters.
die Packungen mit den Elutions-Kits.
den Generator und stellen Sie ihn auf den Arbeitsplatz.
- Öffnen Sie den
- Entnehmen Sie Erstlieferung).
- Entnehmen Sie
- Entnehmen Sie
- Entnehmen Sie
Elution
- Drehen Sie den Generatordeckel ab.
- Platzieren Sie den Generator so, dass sich beide Fläschchen mit bakteriostatischem Mittel auf den Generatoranschlüssen in einer parallelen Linie mit dem Anwender befinden und die Einstellung der Eluatvolumenkontrolle gut sichtbar ist.
- Entfernen Sie die Fläschchen mit dem bakteriostatischen Mittel von den Generatornadeln.
- Stellen Sie die Eluatvolumenkontrolle wunschgemäß ein.
Vorsicht: Drehen Sie dabei die Buchse nicht vom Generatorsockel ab!
- Setzen Sie das Fläschchen mit dem Eluenten auf die Nadel im Sockel mit der Volumenkontrolle. Durchstechen Sie es so, dass die Flasche den Boden des Sockels berührt.
- Setzen Sie das Vakuumfläschchen in den Abschirmbehälter. Drücken Sie diesen vorsichtig auf die Nadel im Elutionssockel, bis der Abschirmbehälter den Boden des Elutionssockels berührt.
- Warten Sie, bis die Elution beendet ist. Die Zeit hängt vom Eluatvolumen ab und variiert zwischen 2, 3 und 4 Minuten um 4, 6 bzw. 8 ml Eluatvolumen zu erhalten.
- Entfernen Sie den Abschirmbehälter, entnehmen Sie die Durchstechflasche mit dem Eluat und messen Sie die eluierte Aktivität mit einem geeigneten Gerät.
- Entfernen Sie die Durchstechflasche mit Elutionslösung. Dieses ist leicht zu fassen, wenn Sie die Volumenkontrolle auf „0“ stellen.
Decken Sie die Nadeln des Generators wieder mit den Durchstechflaschen ab, die das Bakteriostatikum enthalten.
- Verschließen Sie den Generator mit dem Deckel.
Berechnung der Generator-Aktivität
Die nominale Aktivität des Generators ist angegeben als Aktivität von Natrium[99mTc]pertechnetat 12:00 MEZ am Kalibriertag (Tag 0, Tabelle 5).
Die zwischen 08:00 und 12:00 Uhr eluierbare Aktivität ist praktisch konstant zwischen einem Wert von 96 bis 100 % der nominalen Aktivität des entsprechenden Tages.
Die höchsten Aktivitäten werden erhalten, wenn die Pause zwischen den Elutionen nicht kürzer als 23 bis 24 Stunden ist.
Tabelle 5: Theoretisch eluierbare Natrium[99mTc]pertechnetat-Aktivität für den entsprechenden Tag
|
99 Mo-Generatoraktivität [GBq] | ||||||||||||||||||||
|
2,3 |
4,6 |
5,7 |
6,9 |
8,5 |
9,1 |
11,4 |
13,7 |
14,9 |
17,1 |
19,4 |
21,1 |
22,9 |
26,3 |
28,6 |
34,3 |
40 |
45,7 |
57,1 | ||
|
99mTc-Generatoraktivität [GBq] | ||||||||||||||||||||
|
Tag | ||||||||||||||||||||
|
Tag vor dem Kalibriertag |
-5 |
7,1 |
14,1 |
17,6 |
21,2 |
26,4 |
28,2 |
35,3 |
42,3 |
45,8 |
52,9 |
59,9 |
65,2 |
70,5 |
81,1 |
88,2 |
105,8 |
123,4 |
141,1 |
176,3 |
|
-4 |
5,5 |
11,0 |
13,7 |
16,4 |
20,6 |
21,9 |
27,4 |
32,9 |
35,6 |
41,1 |
46,6 |
50,7 |
54,8 |
63,0 |
68,5 |
82,2 |
95,9 |
109,6 |
137,0 | |
|
-3 |
4,3 |
8,5 |
10,7 |
12,8 |
16,0 |
17,0 |
21,3 |
25,6 |
27,7 |
32,0 |
36,2 |
39,4 |
42,6 |
49,0 |
53,3 |
63,9 |
74,6 |
85,2 |
106,5 | |
|
-2 |
3,3 |
6,6 |
8,3 |
9,9 |
12,4 |
13,2 |
16,6 |
19,9 |
21,5 |
24,8 |
28,1 |
30,6 |
33,1 |
38,1 |
41,4 |
49,7 |
57,9 |
66,2 |
82,8 | |
|
-1 |
2,6 |
5,1 |
6,4 |
7,7 |
9,6 |
10,3 |
12,9 |
15,4 |
16,7 |
19,3 |
21,9 |
23,8 |
25,7 |
29,6 |
32,2 |
38,6 |
45,0 |
51,5 |
64,3 | |
|
Kalibriertag |
2,00 |
4,00 |
5,00 |
6,00 |
7,50 |
8,00 |
10,00 |
12,00 |
13,00 |
15,00 |
17,00 |
18,50 |
20,00 |
23,00 |
25,00 |
30,00 |
35,00 |
40,00 |
50,00 | |
|
Tag nach dem Kalibriertag |
1 |
1,55 |
3,11 |
3,89 |
4,66 |
5,83 |
6,22 |
7,77 |
9,33 |
10,10 |
11,66 |
13,21 |
14,38 |
15,54 |
17,88 |
19,43 |
23,32 |
27,20 |
31,09 |
38,86 |
|
2 |
1,21 |
2,42 |
3,02 |
3,62 |
4,53 |
4,83 |
6,04 |
7,25 |
7,85 |
9,06 |
10,27 |
11,17 |
12,08 |
13,89 |
15,10 |
18,12 |
21,14 |
24,16 |
30,20 | |
|
3 |
0,94 |
1,88 |
2,35 |
2,82 |
3,52 |
3,76 |
4,69 |
5,63 |
6,10 |
7,04 |
7,98 |
8,69 |
9,39 |
10,80 |
11,74 |
14,08 |
16,43 |
18,78 |
23,47 | |
|
4 |
0,73 |
1,46 |
1,82 |
2,19 |
2,74 |
2,92 |
3,65 |
4,38 |
4,74 |
5,47 |
6,20 |
6,75 |
7,30 |
8,39 |
9,12 |
10,95 |
12,77 |
14,59 |
18,24 | |
|
5 |
0,57 |
1,13 |
1,42 |
1,70 |
2,13 |
2,27 |
2,84 |
3,40 |
3,69 |
4,25 |
4,82 |
5,25 |
5,67 |
6,52 |
7,09 |
8,51 |
9,93 |
11,34 |
14,18 | |
|
6 |
0,44 |
0,88 |
1,10 |
1,32 |
1,65 |
1,76 |
2,20 |
2,64 |
2,87 |
3,31 |
3,75 |
4,08 |
4,41 |
5,07 |
5,51 |
6,61 |
7,71 |
8,82 |
11,02 | |
|
7 |
0,34 |
0,69 |
0,86 |
1,03 |
1,28 |
1,37 |
1,71 |
2,06 |
2,23 |
2,57 |
2,91 |
3,17 |
3,43 |
3,94 |
4,28 |
5,14 |
6,00 |
6,85 |
8,56 | |
|
8 |
0,27 |
0,53 |
0,67 |
0,80 |
1,00 |
1,07 |
1,33 |
1,60 |
1,73 |
2,00 |
2,26 |
2,46 |
2,66 |
3,06 |
3,33 |
3,99 |
4,66 |
5,33 |
6,66 | |
|
9 |
0,21 |
0,41 |
0,52 |
0,62 |
0,78 |
0,83 |
1,03 |
1,24 |
1,35 |
1,55 |
1,76 |
1,91 |
2,07 |
2,38 |
2,59 |
3,10 |
3,62 |
4,14 |
5,17 | |
|
10 |
0,16 |
0,32 |
0,40 |
0,48 |
0,60 |
0,64 |
0,80 |
0,96 |
1,05 |
1,21 |
1,37 |
1,49 |
1,61 |
1,85 |
2,01 |
2,41 |
2,81 |
3,22 |
4,02 | |
|
11 |
0,13 |
0,25 |
0,31 |
0,38 |
0,47 |
0,50 |
0,63 |
0,75 |
0,81 |
0,94 |
1,06 |
1,16 |
1,25 |
1,44 |
1,56 |
1,88 |
2,19 |
2,50 |
3,13 | |
|
12 |
0,10 |
0,19 |
0,24 |
0,29 |
0,36 |
0,39 |
0,49 |
0,58 |
0,63 |
0,73 |
0,83 |
0,90 |
0,97 |
1,12 |
1,21 |
1,46 |
1,70 |
1,94 |
2,43 | |
|
13 |
0,08 |
0,15 |
0,19 |
0,23 |
0,28 |
0,30 |
0,38 |
0,45 |
0,49 |
0,57 |
0,64 |
0,70 |
0,76 |
0,87 |
0,94 |
1,13 |
1,32 |
1,51 |
1,89 | |
|
14 |
0,06 |
0,12 |
0,15 |
0,18 |
0,22 |
0,23 |
0,29 |
0,35 |
0,38 |
0,44 |
0,50 |
0,54 |
0,59 |
0,67 |
0,73 |
0,88 |
1,03 |
1,17 |
1,47 | |
Tabelle 6:
Korrekturfaktoren für die Berechnung der Natrium[99mTc]pertechnetat-Aktivität in Abhängigkeit von den Elutionsintervallen
|
Zeit seit der letzten Elution [Std.] |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
23 |
|
Korrekturfaktor: Zerfall von 99Mo |
1,0 |
0,979 |
0,960 |
0,940 |
0,919 |
0,900 |
0,881 |
0,863 |
0,845 |
0,828 |
0,811 |
0,785 |
|
Korrekturfaktor: Zunahme von 99mTc |
0,0 |
0,21 |
0,39 |
0,51 |
0,62 |
0,71 |
0,79 |
0,85 |
0,89 |
0,93 |
0,96 |
1,0 |
Beispiele für die Berechnung
• Ein Generator mit einer nominalen Aktivität von 15 GBq wird am Tag „+2“ um 08:00 Uhr eluiert und am gleichen Tag um 12:00 Uhr ein weiteres Mal, das ist 4 Stunden nach der vorherigen Elution.
Die Aktivität der ersten Elution ist 9,06 GBq (siehe Tabelle 5).
Die Aktivität der zweiten Elution ist 9,06 * 0,960 * 0,39 = 3,39 GBq (Korrekturfaktoren aus Tabelle 6).
• Ein Generator mit einer nominalen Aktivität von 23 GBq wird am Tag „+4“ um 08:00 Uhr eluiert und am gleichen Tag um 1400 Uhr ein zweites Mal, das ist 6 Stunden nach der vorherigen Elution.
Die Aktivität der ersten Elution ist 8,39 GBq (siehe Tabelle 5).
Die Aktivität der zweiten Elution ist 8,39 * 0,940 * 0,51 = 4,02 GBq (Korrekturfaktoren aus Tabelle 6).
Bei einer Verwendung der Natrium-[99mTc]pertechnetat-Lösungen zur Markierung von einem Kit für ein radioaktives Arzneimittel beachten Sie bitte die Produktinformationen zu dem jeweiligen Kit.
Qualitätskontrolle
Die Klarheit der Lösung, der pH-Wert, die Radioaktivität und der Molybdän-99 Durchbruch müssen vor der Anwendung überprüft werden.
Charakteristika des Eluates aus dem Generator
Die Lösung eluiert als klare und farblose Natrium[99mTc]pertechnetat-Lösung mit den folgenden
Eigenschaften:
Elutionsausbeute 90-110%
Radiochemische Reinheit des Eluates > 98 % Gehalt an 99Mo im Eluat < 0,1 %
Gehalt an Al3+ im Eluat < 5 ^g/ml
pH des Eluates 5,5 - 7,5
Qualitätskontrolle durchgeführt durch den Anwender
Das Eluat erfüllt die Spezifikationen der Europäischen Pharmakopöe für Natrium[99mTc]pertechnetat-Injektionslösungen aus Kernspaltprodukten.
Der Anwender soll das Eluat auf folgende Qualitätsparameter untersuchen:
- Molybdän-99 Durchbruch im ersten Eluat eines jeden Technetium-99m Generators
- Aktivität des Eluates bei jedem Eluat
Beschreibung der Analysenmethoden:
Bestimmung des Molybdän-99 Durchbruchs
Bestimmen Sie die Radioaktivität von Molybdän-99 unter Verwendung eines kalibrierten Messgerätes. Spezifikation: Gehalt von 99Mo im Eluate < 0,1 % (m/m)
Die Prüfung auf Molybdän-99 Durchbruch kann entsprechend Ph. Eur. erfolgen oder nach einer anderen validierten Methode, mit der ein Molybdän (99Mo) Gehalt unter 0,1 Prozent der Gesamtradioaktivität zum Zeitpunkt der Anwendung bestimmt werden kann.
Messung der eluierten Aktivität
Messen Sie die Radioaktivität unter Verwendung eines geeigneten kalibrierten Messgerätes.
Üblicherweise kann das erste Eluat aus dem Generator verwendet werden, sofern nicht anders angegeben. Zur Kitmarkierung kann das Eluat auch 24 Stunden nach der letzten Elution verwendet werden, sofern in der Fachinformation des betreffenden Kits nicht die Verwendung eines frischen Eluats spezifiziert ist.
Sonstige Hinweise
Tabelle 7: Molybdän-99: Zerfallsfaktoren in zeitlichem Abstand zum Kalibrierzeitpunkt (99Mo Halbwertszeit: 66 Stunden)
|
GMT |
Tage vor/nach dem Kalibrierzeitpunkt | ||||||||||||||||||||||||
|
(Std.) |
-10 |
-9 |
-8 |
-7 |
-6 |
-5 |
-4 |
-3 |
-2 |
-1 |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
2,00 |
13,8123 |
10,7349 |
8,3432 |
6,4844 |
5,0397 |
3,9169 |
3,0442 |
2,3660 |
1,8388 |
1,4291 |
1,1107 |
0,8633 |
0,6709 |
0,5215 |
0,4053 |
0,3150 |
0,2448 |
0,1903 |
0,1479 |
0,1149 |
0,0893 |
0,0694 |
0,0540 |
0,0419 |
0,0326 |
|
4,00 |
13,5252 |
10,5118 |
8,1698 |
6,3496 |
4,9349 |
3,8354 |
2,9809 |
2,3168 |
1,8006 |
1,3994 |
1,0876 |
0,8453 |
0,6570 |
0,5106 |
0,3969 |
0,3084 |
0,2397 |
0,1863 |
0,1448 |
0,1125 |
0,0875 |
0,0680 |
0,0528 |
0,0411 |
0,0319 |
|
6,00 |
13,2441 |
10,2933 |
8,0000 |
6,2176 |
4,8324 |
3,7557 |
2,9190 |
2,2686 |
1,7632 |
1,3704 |
1,0650 |
0,8278 |
0,6433 |
0,5000 |
0,3886 |
0,3020 |
0,2347 |
0,1824 |
0,1418 |
0,1102 |
0,0856 |
0,0666 |
0,0517 |
0,0402 |
0,0313 |
|
8,00 |
12,9688 |
10,0794 |
7,8337 |
6,0884 |
4,7319 |
3,6777 |
2,8583 |
2,2215 |
1,7265 |
1,3419 |
1,0429 |
0,8105 |
0,6300 |
0,4896 |
0,3805 |
0,2957 |
0,2299 |
0,1786 |
0,1388 |
0,1079 |
0,0839 |
0,0652 |
0,0507 |
0,0394 |
0,0306 |
|
10,00 |
12,6992 |
9,8699 |
7,6709 |
5,9618 |
4,6336 |
3,6012 |
2,7989 |
2,1753 |
1,6906 |
1,3140 |
1,0212 |
0,7937 |
0,6169 |
0,4794 |
0,3726 |
0,2896 |
0,2251 |
0,1749 |
0,1360 |
0,1057 |
0,0821 |
0,0638 |
0,0496 |
0,0386 |
0,0300 |
|
12,00 |
12,4353 |
9,6647 |
7,5114 |
5,8379 |
4,5373 |
3,5264 |
2,7407 |
2,1301 |
1,6555 |
1,2867 |
1,0000 |
0,7772 |
0,6040 |
0,4695 |
0,3649 |
0,2836 |
0,2204 |
0,1713 |
0,1331 |
0,1035 |
0,0804 |
0,0625 |
0,0486 |
0,0378 |
0,0293 |
|
14,00 |
12,1768 |
9,4638 |
7,3553 |
5,7166 |
4,4429 |
3,4531 |
2,6837 |
2,0858 |
1,6211 |
1,2599 |
0,9792 |
0,7610 |
0,5915 |
0,4597 |
0,3573 |
0,2777 |
0,2158 |
0,1677 |
0,1304 |
0,1013 |
0,0787 |
0,0612 |
0,0476 |
0,0370 |
0,0287 |
|
16,00 |
11,9237 |
9,2671 |
7,2024 |
5,5978 |
4,3506 |
3,3813 |
2,6280 |
2,0425 |
1,5874 |
1,2337 |
0,9589 |
0,7452 |
0,5792 |
0,4502 |
0,3499 |
0,2719 |
0,2113 |
0,1642 |
0,1277 |
0,0992 |
0,0771 |
0,0599 |
0,0466 |
0,0362 |
0,0281 |
|
18,00 |
11,6758 |
9,0745 |
7,0527 |
5,4814 |
4,2602 |
3,3110 |
2,5733 |
2,0000 |
1,5544 |
1,2081 |
0,9389 |
0,7297 |
0,5672 |
0,4408 |
0,3426 |
0,2663 |
0,2069 |
0,1608 |
0,1250 |
0,0972 |
0,0755 |
0,0587 |
0,0456 |
0,0354 |
0,0275 |
|
20,00 |
11,4332 |
8,8859 |
6,9061 |
5,3675 |
4,1716 |
3,2422 |
2,5198 |
1,9584 |
1,5221 |
1,1830 |
0,9194 |
0,7146 |
0,5554 |
0,4316 |
0,3355 |
0,2607 |
0,2026 |
0,1575 |
0,1224 |
0,0951 |
0,0739 |
0,0575 |
0,0447 |
0,0347 |
0,0270 |
|
22,00 |
11,1955 |
8,7012 |
6,7626 |
5,2559 |
4,0849 |
3,1748 |
2,4675 |
1,9177 |
1,4905 |
1,1584 |
0,9003 |
0,6997 |
0,5438 |
0,4227 |
0,3285 |
0,2553 |
0,1984 |
0,1542 |
0,1199 |
0,0932 |
0,0724 |
0,0563 |
0,0437 |
0,0340 |
0,0264 |
|
24,00 |
10,9628 |
8,5203 |
6,6220 |
5,1467 |
4,0000 |
3,1088 |
2,4162 |
1,8779 |
1,4595 |
1,1343 |
0,8816 |
0,6852 |
0,5325 |
0,4139 |
0,3217 |
0,2500 |
0,1943 |
0,1510 |
0,1174 |
0,0912 |
0,0709 |
0,0551 |
0,0428 |
0,0333 |
0,0259 |
Tabelle 8: Faktoren für die Zunahme von Technetium-99m zu verschiedenen Zeitpunkten nach der vorherigen Elution
(99mTc Halbwertszeit: 6,02 Stunden)
|
Stunden |
Faktor |
Stunden |
Faktor |
Stunden |
Faktor |
Stunden |
Faktor |
Stunden |
Faktor |
Stunden |
Faktor |
|
1 |
0,094 |
9 |
0,579 |
17 |
0,788 |
25 |
0,879 |
33 |
0,918 |
41 |
0,935 |
|
2 |
0,179 |
10 |
0,615 |
18 |
0,804 |
26 |
0,884 |
34 |
0,921 |
42 |
0,937 |
|
3 |
0,256 |
11 |
0,648 |
19 |
0,818 |
27 |
0,892 |
35 |
0,924 |
43 |
0,938 |
|
4 |
0,324 |
12 |
0,678 |
20 |
0,831 |
28 |
0,898 |
36 |
0,926 |
44 |
0,940 |
|
5 |
0,386 |
13 |
0,705 |
21 |
0,843 |
29 |
0,903 |
37 |
0,929 |
45 |
0,941 |
|
6 |
0,442 |
14 |
0,729 |
22 |
0,853 |
30 |
0,907 |
38 |
0,930 |
46 |
0,941 |
|
7 |
0,492 |
15 |
0,751 |
23 |
0,863 |
31 |
0,911 |
39 |
0,932 |
47 |
0,941 |
|
8 |
0,538 |
16 |
0,771 |
24 |
0,871 |
32 |
0,915 |
40 |
0,934 |
48 |
0,942 |
13. Verkaufsabgrenzung
V erschreibungspflichtig
spcdeff-pertector-aug-2014 August 2014 Seite 24 von 24
Nebenwirkungen aus Spontanmeldungen