Preflucel
FACHINFORMATION
(Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS PREFLUCEL
Injektionssuspension in einer Fertigspritze
Influenza-Impfstoff (Spaltimpfstoff, inaktiviert, in Zellkulturen hergestellt)
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Influenza-Virus (gespalten, inaktiviert) der folgenden Stämme*:
|
A/California/7/2009 (H1N1) |
15 Mikrogramm HA** |
|
A/Perth/16/2009 (H3N2) entsprechender verwendeter Stamm (A/Victoria/210/2009) |
15 Mikrogramm HA** |
|
B/Brisbane/60/2008 (B) |
15 Mikrogramm HA** |
|
pro 0,5 ml Dosis |
* hergestellt in Vero-Zellen (kontinuierliche Säugetierzelllinie) ** Hämagglutinin
Dieser Impfstoff entspricht den WHO-Empfehlungen (nördliche Hemisphäre) und dem EU-Beschluss für die Saison 2011/2012.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionssuspension in einer Fertigspritze. PREFLUCEL ist eine klare bis opaleszente Suspension.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Prophylaxe der Influenza, bei Erwachsenen und älteren Personen.
Die Anwendung von PREFLUCEL sollte gemäß der offiziellen Impfempfehlung erfolgen.
4.2 Dosierung, Art und Dauer der Anwendung
Erwachsene (ab dem vollendeten 18. Lebensjahr) und ältere Personen (über 60 Jahre): 0,5 ml
Die Immunisierung sollte durch intramuskuläre Injektion (in den Deltamuskel) erfolgen.
Die Unbedenklichkeit und Wirksamkeit wurde bei Personen unter 18 Jahren nicht überprüft (siehe Abschnitt 5.1).
Hinweise zur Handhabung siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile (siehe Abschnitt 6.1) oder Rückstände (z. B. Formaldehyd, Benzonase oder Sucrose).
Bei Patienten mit einer fieberhaften Erkrankung oder einer akuten Infektion soll die Impfung verschoben werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wie bei allen injizierbaren Impfstoffen sollen für den Fall des Auftretens eines anaphylaktischen Ereignisses nach Verabreichung des Impfstoffes sofort geeignete medizinische Behandlungs- und Überwachungsmöglichkeiten verfügbar sein.
PREFLUCEL darf unter keinen Umständen intravaskulär verabreicht werden.
Bei Patienten mit endogener oder iatrogener Immunsuppression kann die Antikörperbildung unzureichend sein.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro 0,5 ml, d. h., es ist praktisch „natriumfrei”.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
PREFLUCEL kann gleichzeitig mit anderen Impfstoffen verabreicht werden. Die Impfung soll an verschiedenen Gliedmaßen erfolgen. Dabei können unerwünschte Reaktionen verstärkt auftreten. Der Impferfolg kann bei gleichzeitiger immunsuppressiver Behandlung beeinträchtigt sein.
Obwohl dies bei PREFLUCEL nicht beobachtet wurde, sind nach Influenzaimpfungen falsch-positive Ergebnisse bei serologischen Tests mit der ELISA-Methode zum Nachweis von Antikörpern gegen HIV-1, Hepatitis C und besonders gegen HTLV-1 beobachtet worden. Die Western Blot-Technik stellt diese falsch positiven ELISA-Ergebnisse richtig. Die vorübergehend falsch positiven Reaktionen können auf die durch die Impfung hervorgerufene IgM-Antwort zurückgeführt werden.
4.6 Schwangerschaft und Stillzeit
Die Unbedenklichkeit von PREFLUCEL während der Schwangerschaft und Stillzeit wurde nicht in klinischen Studien untersucht. Im Allgemeinen lassen die Daten über Influenzaimpfungen bei Schwangeren keine Schädigungen des Fötus oder der Mutter vermuten. Der Einsatz dieses Impfstoffs kann ab dem zweiten Schwangerschaftsdrittel in Betracht gezogen werden. Der Ärztin/dem Arzt wird empfohlen, vor Verschreibung von PREFLUCEL eine sorgfältige Abwägung des möglichen Risikos und des Nutzen der Impfung vorzunehmen. Schwangeren mit Grunderkrankungen, die das Risiko für das Auftreten Influenza-assoziierter-Komplikationen erhöhen, soll die Impfung gemäß den nationalen Impfempfehlungen verabreicht werden.
PREFLUCEL kann während der Stillzeit angewandt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es ist unwahrscheinlich, dass der Impfstoff einen Einfluss auf die Verkehrstüchtigkeit und das Bedienen von Maschinen hat.
4.8 Nebenwirkungen
In klinischen Studien mit PREFLUCEL an über 9.000 Erwachsenen und älteren Personen (7.212 im Alter von 18-59 Jahren; 1.789 Ältere oberhalb von 60 Jahren) traten folgende Nebenwirkungen auf, die gemäß folgenden Häufigkeiten klassifiziert werden:
Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1.000 bis <1/100)
Selten (>1/10.000 bis <1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
System Organ Klasse |
Sehr häufig (>1/10) |
Häufig (>1/100 bis <1/10) |
Gelegentlich (>1/1.000 bis <1/100) |
Selten (>1/10.000 bis <1/1.000) |
|
Erkrankungen des Immunsystems |
Überempfindlichkeit anaphylaktische Reaktionen | |||
|
Erkrankungen des Nervensystems |
Kopfschmerzen * |
Sensorische Abnormalitäten* (Hypästhesie Hyperästhesie) Parästhesie* |
Dysgeusie | |
|
Augenerkrankungen |
Augenrötungen Augenreizungen, |
tränende Augen* | ||
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Husten Schmerzen im Hals-und Rachenraum Rhinorrhoe |
Halsentzündungen Pharynxödeme | ||
|
Erkrankungen des Gastrointestinaltraktes |
Übelkeit* Erbrechen* |
Bauchschmerzen |
Dysphagie* | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Hyperhydrosis |
Pruritus |
Erythem Urtikaria | |
|
Untersuchungen |
Blutdruckanstieg | |||
|
Erkrankungen der Skelettmuskulatur, des Bindegewebes und der Knochen |
Myalgie |
Arthralgie* |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
An der Injektionsstelle: Schmerzen* |
An der Injektionsstelle: Schwellung, Erythem, Induration* |
An der Injektionsstelle: Pruritus, Ecchymosen, |
An der Injektionsstelle: Erwärmung* |
|
Systemische Reaktionen: Müdigkeit, Unwohlsein |
Systemische Reaktionen: Schüttelfrost, Fieber |
Systemische Reaktionen: Brustbeschwerden |
* Diese Reaktionen klingen üblicherweise ohne Behandlung innerhalb von 1-2 Tagen ab.
In einem Fall wurde über Multiple Sklerose bei einem einzelnen, männlichen Patienten berichtet. Die ersten Symptome traten 6 Wochen nach der Impfung auf. Der Kausalzusammenhang mit der Impfung kann nicht ausgeschlossen werden.
Es liegen keine Daten aus der Postmarketing-Überwachung von PREFLUCEL vor.
4.9 Überdosierung
Es ist unwahrscheinlich, dass eine Überdosierung irgendeine ungünstige Wirkung hat.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Influenza-Impfstoff, gereinigtes Antigen; ATC Code: J07BB02 Die Seroprotektion wird im Allgemeinen innerhalb von 2-3 Wochen erreicht. Die Dauer der postvakzinalen Immunität gegenüber homologen Stämmen oder eng verwandten Impfstämmen ist unterschiedlich, beträgt jedoch normalerweise 6 bis 12 Monate.
Klinische Wirksamkeit
Die klinische Wirksamkeit des Impfstoffes gegenüber einer Influenza-Infektion wurde während der Influenza-Saison 2008/2009 in einer pivotalen, randomisierten, plazebo-kontrollierten, doppelblinden Phase-3-Studie untersucht, durchgeführt an gesunden Erwachsenen im Alter von 18-49 Jahren, die entweder PREFLUCEL (N=3626) oder Plazebo (N=3620) erhielten. Die Wirksamkeit von PREFLUCEL wurde definiert als Schutz vor einer in Kultur nachgewiesenen Infektion für passende Stämme und für Driftvarianten.
|
Abschätzung der Wirksamkeit des Impfstoffes während der Influenza-Saison 2008/2009§ | ||
|
Influenza Stämme |
Übereinstimmende Stämme§§ |
Übereinstimmende und veränderte Stämme §§§ zusammen |
|
18-49 Jahre |
18-49 Jahre | |
|
N=3626 |
N=3626 | |
|
A/H1N1 |
79,0 % |
75,2 % |
|
(95 % CI) |
(59,7 bis 89,0) |
(55,4 bis 86,2) |
|
A/H3N2 |
50,0 %1) |
50,0 % |
|
(95 % CI) |
(-173,0 bis 90,8) |
(-173,0 bis 90,8) |
|
A-Stämme zusammen |
77,0 % |
73,5 % |
|
(95 % CI) |
(57,9 bis 87,4) |
(54,0 bis 84,7) |
|
B-Stamm |
100 %2) |
60,1 % |
|
(95 % CI) |
(4,1 bis 100,0) |
(9,5 bis 82,4) |
|
ALLE Stämme |
78,5 % |
71,5 % |
|
(95 % CI) |
(60,8 bis 88,2) |
(54,7 bis 82,1) |
§ Klinische Phase 3-Studie, durchgeführt in der USA während der Influenza-Saison 2008/2009 §§ Wirksamkeit gegen Influenza-Stämme, deren Antigen den Impfstämmen ähnlich war §§§ Wirksamkeit gegen Influenzastämme, unabhängig von der Antigenübereinstimmung ^ 2 dokumentierte Fälle von CCII , in der Impfstoff-Gruppe und 4 dokumentierte Fälle in der Plazebo-Gruppe 2) 4 dokumentierte Fälle von CCII, alle in der Plazebo-Gruppe
Immunogenität
In der pivotalen Phase-3-Studie sind die Immunantworten aufjedes der Antigene in der Tabelle unten aufgeführt.
|
PREFLUCEL | |||
|
Stammspezifische anti-HA-Antikörper |
A/H1N1 |
A/H3N2 |
B |
|
18-49 Jahre |
18-49 Jahre |
18-49 Jahre | |
|
N=3473 |
N=3473 |
N=3473 | |
|
Seroprotektionsrate ** |
88,0 % |
93,3 % |
97,1 % |
|
(95 % CI) |
(86.8 bis 89.0) |
(92.4 bis 94.1) |
(96.5 bis 97.7) |
|
Serokonversionsrate ** |
70,4 % |
79,1 % |
65,7 % |
|
(95 % CI) |
(68,9 bis 71,9) |
(77,7 bis 80,4) |
(64,1 bis 67,3) |
|
Geometrischer Mittelwert der Erhöhung *** (95 % CI) |
11,1 (10.52 bis 11.74) |
13,5 (12.85 bis 14.20) |
7,6 (7.22 bis 7.97) |
In einer früheren randomisierten, plazebo-kontrollierten, doppelblinden, klinischen Phase-3-Studie, durchgeführt an gesunden Erwachsenen im Alter von 18 bis 49 Jahren während der Saison 2007/2008 erhielten 1744 Personen PREFLUCEL. Die Seroprotektionsraten über alle 3 Influenza-Stämme reichten von 75,9 % bis 97,1 %, die Serokonversionsraten von 57, 0 % bis 71,7 % und der geometrische Mittelwert des ursprünglichen HI Titers stieg am Tag 21 auf 6,5 bis 10,8 fach höhere Werte.
In einer randomisierten, doppelblinden, aktiv kontrollierten Phase-3-Studie, durchgeführt während der Saison 2008/2009 an Erwachsenen und Älteren (im Alter von 50 Jahren und älter), wurden Immunogenität und Sicherheit von PREFLUCEL bewertet. Es wurde PREFLUCEL (N=2842) oder ein anderer, trivalenter, aus Eiern gewonnener Influenza-Virus-Vergleichsimpfstoff (N=366) verabreicht. Seroprotektionsrate, Serokonversionsrate und der geometrische Mittelwert der Erhöhung (GMFI) sind in der nachfolgenden Tabelle aufgeführt.
|
PREFLUCEL | ||||||
|
Stammspezifische anti- |
A/H1N1 |
A/H3N2 |
B | |||
|
HA-Antikörper | ||||||
|
50-59 |
60 Jahre + |
50-59 Jahre |
60 Jahre + |
50-59 |
60 Jahre + | |
|
Jahre |
> |
N=1248 |
> |
Jahre |
> | |
|
N=1248 |
N=1548 |
N=1548 |
N=1248 |
N=1548 | ||
|
Seroprotektionsrate * |
76,9 % |
71,1 % |
90,1 % |
90,8 % |
87,5 % |
82,8 % |
|
(95 % CI) |
(74,5 ; 79,2) |
(68,7 ; 73,3) |
(88,3 ; 91,7) |
(89,3 ; 92,2) |
(85,5 ; 89,3) |
(80,8 ; 84,6) |
|
Serokonversionsrate |
50,6 % |
37,2 % |
70,1 % |
59,8 % |
49,1 % |
37,5 % |
|
** |
(47,7 ; 53,4) |
(34,8 ; 39,7) |
(67,5 ; 72,6) |
(57,3 ; 62,3) |
(46,3 ; 51,9) |
(35,0 ; 39,9) |
|
(95 % CI) | ||||||
|
Geometrischer Mittel- |
5,18 |
3,35 |
9,67 |
6,14 |
4,59 |
3,20 |
|
wert der Erhöhung *** |
(4,78 ; 5,63) |
(3,14 ; 3,57) |
(8,86 ; 10,55) |
(5,71 ; 6,59) |
(4,25 ; 4,97) |
(3,00 ; 3,40) |
(95 % CI)
* Seroprotektion = HI Titer >40; CHMP-Kriterium >70 % bei Probanden im Alter von 18-59 Jahren und >60 % bei Probanden im Alter von 60 Jahren und älter
** Serokonversion = negativer prävakzinaler HI Titer und postvakzinaler HI Titer >40: Signifikanter Anstieg = positiver prävakzinaler HI Titer und eine mindestens 4-fache Erhöhung des postvakzinalen HI Titers; CHMP-Kriterium >40 % bei Probanden im Alter von 18-59 Jahren und >30 % bei Probanden im Alter von 60 Jahren und älter
*** Der geometrische Mittelwert der Erhöhung ist die Erhöhung der Antikörperantwort (Hämagglutinations-Inhibitions-Titer) nach der Impfung, verglichen mit der Antikörperantwort vor der Impfung. Die Erhöhung der Antikörperantwort wird als geometrischer Mittelwert der Erhöhung des Antikörperspiegels bei jeder einzelnen Person dargestellt. Dabei wird der Wert 21 Tage nach der Impfung mit dem Wert vor der Impfung verglichen; CHMP-Kriterium >2,5 bei Probanden im Alter von 18-59 Jahren und >2,0 bei Probanden im Alter von 60 Jahren und älter
Der aus Eiern gewonnene, aktive Influenza-Vergleichsimpfstoff erreichte für alle 3 Stämme Seroprotektionsraten zwischen 86,7 % und 95,8 % bei Probanden im Alter von 50-59 Jahren (N=143), beziehungsweise zwischen 79,7 % und 96,2 % bei Probanden im Alter von 60 Jahren und älter (N=212).
Am Tag 21 nach der Impfung lagen die Serokonversionsraten bei Probanden im Alter von 50-59 Jahren zwischen 61,5 % und 87,4 % beziehungsweise zwischen 47,6 % und 72,6 % bei Probanden im Alter von 60 Jahren und älter.
Die Erhöhung des geometrischen Mittelwerts lag 21 Tage nach der Impfung in den beiden Altersklassen zwischen 5,8 und 13,9, beziehungsweise zwischen 4,0 und 10,7.
PREFLUCEL wurde nicht an einer pädiatrischen Population untersucht, daher stehen keine Daten zur Immunantwort bei dieser Altersgruppe zur Verfügung (siehe Abschnitt 4.2).
5.2 Pharmakokinetische Eigenschaften
Nicht zutreffend
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Toxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. PREFLUCEL wurde von Mäusen, Ratten und Meerschweinchen gut vertragen und war bei diesen Tieren immunogen. Eine Studie zur Toxizität bei wiederholter Gabe an Ratten zeigte keine systemische Toxizität und der Impfstoff wurde lokal gut vertagen. Die Genotoxizität und das kanzerogene Potential wurden nicht untersucht, da diese Studien für einen Impfstoff nicht geeignet sind. Eine Entwicklungs- und Reproduktionstoxizitätsstudie bei Ratten zeigte keine schädlichen Auswirkungen, noch wurden weder Störungen der Entwickung noch der Reproduktion oder allgemein toxische Parameter beobachtet.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Trometamol Natriumchlorid Polysorbat 80
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf PREFLUCEL nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
1 Jahr
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (bei 2 °C- 8 °C). Nicht einfrieren.
Im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
0. 5.ml Suspension in einer Fertigspritze (Glas Typ I) mit Nadel, verschlossen mit einem latexfreien Kolbenstopfen (Brombutylgummi).
Packungsgrößen zu 1 und 10 Fertigspritzen jeweils mit Nadel.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Der Impfstoff soll vor der Anwendung Raumtemperatur erreichen.
Vor der Applikation sind die Fertigspritzen gut zu schütteln, um die Impfstoffsuspension sorgfältig zu mischen. Nach dem Aufschütteln ist PREFLUCEL eine klare bis opaleszente Suspension. Vor der Verabreichung sollte der Impfstoff visuell auf sichtbare Partikel und/oder Veränderung des Aussehens überprüft werden. Trifft das eine oder andere zu, ist der Impfstoff zu verwerfen.
Den Nadelschutzschild wie folgt entfernen:
1. Die Fertigspritze an dem unteren Teil des Nadelschutzschildes, der am Glaskörper aufsitzt, festhalten (Abb. 1).
2. Mit der anderen Hand den darüber liegenden Teil des Nadelschutzschildes zwischen Daumen und Zeigefinger nehmen und die beiden Teile gegeneinander verdrehen, um die Versiegelung aufzubrechen (Sicherheitsverschluss) (Abb. 2).
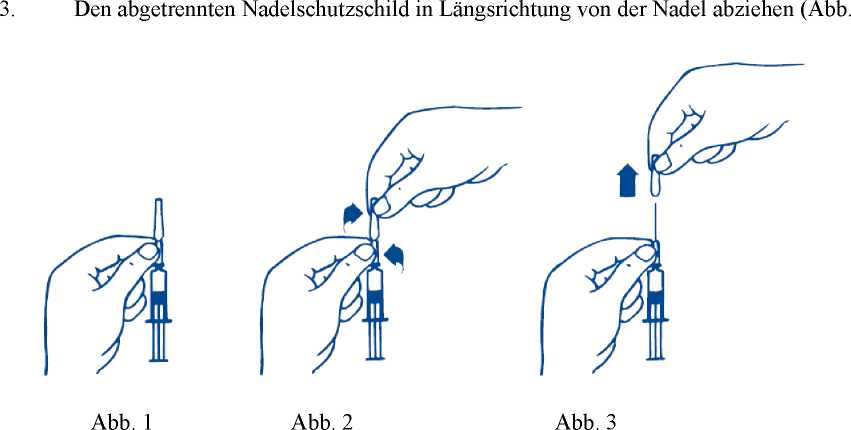
Nach Abnahme des Nadelschutzschildes sollte PREFLUCEL sofort verwendet werden.
Längeres ungeschütztes Liegenlassen der Injektionsspritze kann zu Unsterilitäten und/oder Verstopfung der Nadel führen. Daher soll der Nadelschutzschild der Fertigspritze nur nach dem Aufschütteln und unmittelbar vor Gebrauch abgenommen werden.
Um das Risiko lokaler Nebenwirkungen zu minimieren, muss sorgfältig darauf geachtet werden, dass vor der Impfung kein Tropfen des Impfstoffs auf der externen Oberfläche der Nadel haftet. Wenn Alkohol zur Reinigung der Injektionsstelle verwendet wird, soll dieser vor der Injektion vollständig abtrocknen und nicht mit dem Impfstoff in Kontakt kommen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Baxter Deutschland GmbH, Edisonstraße 4, 85716 Unterschleißheim
8. ZULASSUNGSNUMMER Zul.-Nr.: PEI.H.11496.01.1
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
14. März 2011
10. STAND DER INFORMATION
Juni 2011
VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT
Verschreibungspflichtig
9