Prepidil Gel
PFIZER ((Logo)) FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
PREPIDIL® Gel
Gel mit 0,5 mg Dinoproston
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Dinoproston (Prostaglandin E2)
Eine Fertigspritze Prepidil Gel enthält 0,5 mg Dinoproston.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Gel
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Medizinisch indizierte Geburtseinleitung bei Schwangeren mit unreifer Zervix (Bishop-Score bis zu 5).
Bewertung des Zervixbefundes Bishop Score
|
Punkte |
0 |
1 |
2 |
3 |
|
Befund | ||||
|
Stand der Portio |
sakral |
medio-sakral |
median |
— |
|
Zervixlänge |
>2 cm |
1 bis 2 cm |
0,5 bis 1 cm |
<0,5 cm |
|
Konsistenz |
derb |
mittel |
weich |
— |
|
Muttermunds eröffnung |
0 |
1 bis 2 cm |
3 bis 4 cm |
>4 cm |
|
Höhe des vorangehenden Teils |
-3 |
-2 |
-1 / 0 |
+1 / +2 |
4.2 Dosierung, Art und Dauer der Anwendung
Die Dosierung beträgt 0,5 mg Dinoproston in 2,5 ml Gel (Inhalt einer Fertigspritze Prepidil Gel). Die Anwendung soll unter Sicht (Spiegeleinstellung) erfolgen. Üblicherweise wird mit Hilfe des beigefügten sterilen Katheters der gesamte Inhalt der Fertigspritze in den Zervikalkanal, noch vor den inneren Muttermund, instilliert. Nach der Gelanwendung sollte die Patientin mindestens 30 Minuten liegen bleiben, um ein Auslaufen des Gels zu vermeiden.
Wenn bei wehenlosem Uterus nach einmaliger Anwendung keine Erweichung und Dilatation
der Zervix uteri erreicht wurde, darf eine erneute Anwendung frühestens nach 8 bis 12 Stunden erfolgen, vorausgesetzt, dass bei der maternalen und fetalen Überwachung keine Unregelmäßigkeiten nach der ersten Prepidil-Gel-Gabe auftraten. Die maximale Gesamtdosis innerhalb von 24 Stunden darf 1,5 mg Dinoproston (in 7,5 ml Gel) nicht überschreiten.
Bitte beachten Sie auch die Anleitung zur Anwendung der Fertigspritze auf der folgenden Abbildung.
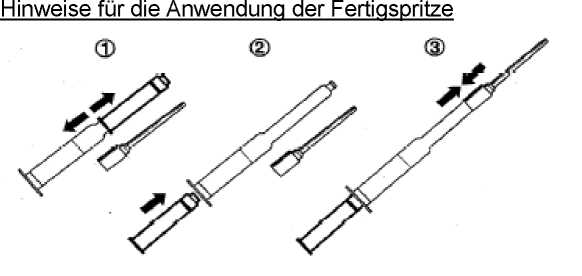
1. Innere Umhüllung aufschneiden und sterile Fertigspritze entnehmen.
Schutzkappe abziehen (dient als Stempel).
2. Schutzkappe in den Spritzenkolben einsetzen.
3. Sterilen Katheter aus der Verpackung entnehmen.
Bei der Befestigung des Katheters auf der Spritzenspitze muss der Katheter vernehmbar einrasten, damit ein sicherer Halt gewährleistet ist.
4. Spritzeninhalt instillieren.
Aus der Spritze sollte das gesamte Gel ausgedrückt werden. Da das Totvolumen des Katheters berücksichtigt wurde, befindet sich ein Überschuss an Gel in der Spritze.
4.3 Gegenanzeigen
Prepidil Gel darf nicht bei Patientinnen eingesetzt werden, die auf Prostaglandine oder einen der sonstigen Bestandteile allergisch sind.
Prepidil Gel ist nicht anzuwenden zur Geburtseinleitung bei vorausgegangenen Uterusoperationen wie Kaiserschnitt oder Hysterotomie, bei Myomennukleation, bei Mehrlingsschwangerschaften, bei Multiparität (6 oder mehr vorausgegangene Geburten), wenn der Kopf des Kindes noch nicht in das Becken eingetreten ist, bei fetopelviner Disproportion, bei fetalen Herzfrequenzmustern, die eine beginnende Gefährdung des Kindes vermuten lassen, bei geburtshilflichen Situationen, bei denen die Nutzen-Risiko-Bewertung für Mutter oder Kind für eine operative Geburtsbeendigung sprechen, bei ungeklärtem vaginalem Ausfluss und / oder anormalen Uterusblutungen während der aktuellen Schwangerschaft, bei vorliegenden Infektionen (Kolpitis, Cervicitis, Amnioninfektionssyndrom), bei regelwidriger Kindeslage oder Poleinstellung, bei Zervixläsion, vorzeitiger Plazentalösung und bei Placenta praevia.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei Patientinnen mit Störungen der Herz-Kreislauf-Funktion, der Leber- oder Nierenfunktion, mit Asthma, einer Asthmavorgeschichte, anamnestisch bekannten und bestehenden Lungenerkrankungen, bestehenden fieberhaften Infektionen, Glaukom oder erhöhtem
Intraokulardruck oder mit einer Ruptur der chorioamniotischen Membran sollte eine Behandlung mit Prepidil Gel mit Vorsicht erfolgen.
Es gibt Hinweise darauf, dass das Risiko für das Auftreten einer postpartalen disseminierten intravasalen Gerinnung (DIG), einer seltenen Komplikation, bei einer pharmakologischen Weheninduktion mit Dinoproston erhöht ist. Dieses erhöhte Risiko ist von größerer Bedeutung für Frauen im Alter von 35 Jahren und älter, für Frauen mit Komplikationen in der Schwangerschaft und für Frauen mit einem Schwangerschaftsalter über 40 Wochen. Bei diesen Frauen sollte die Anwendung von Prepidil Gel mit besonderer Vorsicht erfolgen. Der behandelnde Arzt sollte Anzeichen einer möglichen DIG (z. B. Fibrinolyse) besondere Aufmerksamkeit schenken.
Bei kindlicher Notlage und bei vorausgegangenen Komplikationen bei Geburten sollte Prepidil Gel nicht angewendet werden.
Vor der Anwendung von Prepidil Gel ist eine sorgfältige geburtshilfliche Untersuchung erforderlich. Die kindlichen Herztöne und die Wehentätigkeit sind während der Anwendung von Prepidil Gel durch Kardiotokographie ständig zu registrieren und die Geburt intensiv zu überwachen.
Die fortschreitende Erweiterung des Zervikalkanals ist sorgfältig zu beobachten.
Wie bei allen wehenfördernden Mitteln sollte bei Vorliegen einer übermäßigen Uterusaktivität bzw. uteriner Schmerzzustände oder bei anhaltenden Wehen mit erhöhtem Basaltonus die Gefahr einer Uterusruptur berücksichtigt werden.
Nach Gelapplikation ist eine zweistündige CTG-Kontrolle obligatorisch. Danach ist die Überwachung der geburtshilflichen Situation anzupassen.
Es sollte darauf geachtet werden, dass Prepidil Gel nicht über den inneren Muttermund hinaus extraamnial gegeben wird, um dadurch eine uterusstimulierende Wirkung mit möglicher Uterushypertonie zu vermeiden. Spezielle Vorsicht ist bei einem wehenbereiten Uterus wegen der Möglichkeit der Überstimulation geboten.
Prepidil Gel darf nur von Ärzten in Kliniken angewandt werden, die über intensivmedizinische Überwachungsmöglichkeiten für Mutter und Kind und die Möglichkeit einer operativen Geburtsbeendigung (auch durch Sectio caesarea) verfügen. Patientinnen, bei denen ein erhöhter Muskeltonus oder eine erhöhte Kontraktilität des Uterus auftritt oder bei denen sich ungewöhnliche fetale Herzfrequenzmuster entwickeln, sollten unter Berücksichtigung des Wohlergehens von Mutter und Kind behandelt werden.
Die intrazervikale Platzierung von Dinoproston als Gel (Prepidil Gel) kann zu einer versehentlichen Zerstörung mit anschließender Embolisierung von antigenem Gewebe (Amnion) führen, das in seltenen Fällen zu einer Entstehung des anaphylactoiden Syndroms der Schwangerschaft (Amniotic Fluid Embolism) führen kann.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Aufgrund der additiven Wirkung von Dinoproston mit Oxytocin oder anderen Uterotonika muss dieser Umstand bei gleichzeitiger Behandlung mit diesen Medikamenten kritisch berücksichtigt werden. Um eine unangemessene Wirkungsverstärkung mit anderen Oxytocika auszuschließen, wird empfohlen, dass die Anwendung von z. B. Oxytocin frühestens sechs Stunden nach der letzten Anwendung von intrazervikalem Prepidil Gel erfolgt.
Die intravenöse Infusion von uterusrelaxierenden Substanzen, z. B. Beta-Sympathomimetika, kann die Dinoproston-Wirkung vermindern bzw. aufheben.
Schwangerschaft
Dinoproston wird bei Schwangeren kurz vor oder am Termin angewendet.
In Studien an Ratten und Kaninchen hat Prostaglandin E2 zu Skelettanomalien geführt. Dinoproston erwies sich in Studien an Ratten und Kaninchen embryotoxisch. Jede Dosierung, die über einen längeren Zeitraum einen erhöhten Uterustonus bewirkt, birgt ein Risiko für den Embryo oder Fötus (s. Abschnitt 4.4).
Stillzeit
Dinoproston ist nicht für die Anwendung während der Stillzeit vorgesehen. Grundsätzlich werden Prostaglandine nur in sehr niedriger Konzentration in der Muttermilch ausgeschieden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (>1 / 10)
Häufig (>1 / 100 bis <1 / 10)
Gelegentlich (>1 / 1.000 bis <1 / 100)
Selten (>1 / 10.000 bis <1 / 1.000)
Sehr selten (<1 / 10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Bei der Mutter:
|
Erkrankungen des Blutes und des Lymphsystems | |
|
Selten |
Disseminierte intravasale Gerinnung (DIG) |
|
Erkrankungen des Nervensystems | |
|
Häufig |
Kopfschmerzen |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Häufig |
Übelkeit, Erbrechen, Krämpfe, Diarrhö |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
|
Häufig |
Rückenschmerzen |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
|
Häufig |
Fieber |
|
Schwangerschaft, Wochenbett und perinatale Erkrankungen | |
|
Häufig |
Uterine Überstimulation (erhöhte Frequenz, Intensität oder Dauer der Wehen, Basaltonuserhöhung) |
|
Nicht bekannt |
Uterusruptur |
|
Erkrankungen des Immunsystems |
|
Nicht bekannt |
Überempfindlichkeitsreaktionen, anaphylaktische Reaktion (anaphylaktischer Schock) |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse | |
|
Häufig |
Wärmegefühl in der Vagina |
Bei dem Kind:
|
Untersuchungen | |
|
Sehr häufig |
Alteration der kindlichen Herzfrequenz und deren Oszillationsmuster |
|
Schwangerschaft, Wochenbett und perinatale Erkrankungen | |
|
Sehr selten |
Totgeburt |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Eine Überdosierung von Dinoproston kann sich durch eine erhöhte Kontraktilität oder einen erhöhten Tonus des Uterus manifestieren. Da die Wirkung von Prostaglandin E2 auf die Uterusmuskulatur nur vorübergehend ist, reichten im Falle einer Überstimulation unspezifische, konservative Maßnahmen in der Mehrzahl der Fälle aus: Bei einer uterinen Überstimulation sollte das Medikament aus dem Vaginaltrakt entfernt werden. Die Patientin sollte seitlich gelagert werden und die Zufuhr von Sauerstoff gewährleistet sein. Ferner kann durch die intravenöse Zufuhr von Beta-Sympathomimetika die übermäßige Kontraktion des Myometriums aufgehoben werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Wehenförderndes Mittel, Prostaglandine ATC-Code: G02AD02
Die intrazervikale Gabe von 0,5 mg Dinoproston in Form eines Gels bewirkt eine Erweichung und Dilatation (Priming, Softening) der Cervix uteri in der Vorgeburtsphase bei Schwangeren mit ungünstigem Zervixbefund.
Außerdem konnte gezeigt werden, dass durch eine prophylaktische orale Gabe von ß-Sympathomimetika (Tokolytika) wie Fenoterol der zervixerweichende Effekt von Dinoproston nicht beeinträchtigt wurde.
Der exakte Wirkungsmechanismus, der der Zervixerweichung durch Dinoproston zugrunde liegt, ist bislang noch nicht vollständig aufgeklärt. Dinoproston löst im Myometrium des schwangeren Uterus Kontraktionen aus, die denen bei Geburtswehen ähneln. Ob dies durch eine direkte Wirkung von Dinoproston auf das Myometrium erfolgt, ist noch nicht geklärt. Durch die intravaginale Gabe von Dinoproston werden Uteruskontraktionen ausgelöst, die in den meisten Fällen ausreichen, um die Leibesfrucht auszutreiben.
Ganz allgemein werden die vielfältigen biologischen Aktivitäten des fast ubiquitär im Organismus vorkommenden Dinoprostons auf eine Stimulation der zellulären Adenylatzyklase mit Bildung von cAMP sowie auf die Beeinflussung des Kalzium-Ionen-Transports durch die Zellmembran zurückgeführt.
Im Speziellen konnte gezeigt werden, dass Dinoproston die Durchblutung der Zervix erhöht, vergleichbar der Durchblutungssteigerung zu Beginn einer Spontangeburt. Außerdem bewirkt Dinoproston eine Aufsplittung der Kollagenfasern und Vermehrung der Grundsubstanz der Zervix, was auch bei der spontanen Zervixreifung beobachtet werden kann.
Sowohl im Tierversuch als auch bei der Erprobung am Menschen konnte mit hohen Dosen Dinoproston eine blutdrucksenkende Wirkung, die wahrscheinlich eine Folge des Wirkstoffs auf die glatte Muskulatur des Gefäßsystems ist, gezeigt werden. Außerdem wurden vorübergehende Erhöhungen der Körpertemperatur beobachtet.
Sowohl durch intravenöse, intravaginale als auch intrazervikale Anwendung können rhythmische Uteruskontraktionen hervorgerufen werden. Dinoproston ist gleichzeitig in der Lage, Kontraktionen der glatten Muskulatur des Gastrointestinaltraktes zu induzieren, wodurch die teilweise auftretenden Nebenwirkungen wie Erbrechen und Durchfall erklärt werden können.
Die bei der systemischen Anwendung beschriebenen Nebenwirkungen sind jedoch bei der lokalen Anwendung wesentlich schwächer oder fehlen ganz.
5.2 Pharmakokinetische Eigenschaften
Resorption
Plamaspitzenkonzentrationen werden bei Gabe des Zervikalgels nach 30 bis 45 Minuten erreicht. Dinoproston ist zu 73 % an menschliches Plasmaprotein gebunden.
In einer kontrollierten Studie zur Zervixreifung mit Prepidil Gel bei Schwangeren wurde der Einfluss der intrazervikalen Gelgabe auf den Plasmaspiegel eines stabilen Dinoproston-Metaboliten (Bicyclo-PGEM) untersucht.
Bei den klinisch erfolgreichen Fällen wurden sowohl bei den mit Prepidil Gel behandelten Frauen, als auch bei den nicht behandelten Frauen (Kontrollen) insgesamt höhere Bicyclo-PGEM-Plasmaspiegel gemessen als bei den Therapieversagern. Die Bicyclo-PGEM-AUC-Werte (durchschnittliche Flächen unter den Serumspiegelkurven) waren jedoch bei den erfolgreichen Prepidil-Gel-Fällen um 80 % höher als bei den erfolgreichen Fällen in der Kontrolle (p <0,05). Bei den Versagern waren die AUC-Werte bei der Prepidil-Gel-Anwendung um 18 % höher als bei den Kontrollen.
Verteilung und Metabolisierung
Die Verteilung von Dinoproston in mütterlichen Geweben erfolgt systemisch. Nach i.v.-Gabe erfolgt eine sehr schnelle Verteilung und Metabolisierung. Nach 15 Minuten sind nur noch 3 % des unveränderten Wirkstoffes im Blut vorhanden. Es wurden mindestens 9 Metabolite im Blut und Urin nachgewiesen.
Prostaglandin E2 wird rasch zu 13,14-Dihydro-15-keto-prostaglandin E2 metabolisiert. Dieses wiederum wird abgebaut zu 13,14-Dihydro-15-keto-prostaglandin A2. Dinoproston wird im Menschen vollständig in der Lunge metabolisiert. Die dabei entstehenden Metabolite werden in der Leber und Niere weiter metabolisiert.
Elimination
Die Elimination von Dinoproston und seinen Metaboliten erfolgt überwiegend über die Nieren, zum kleinen Teil über die Fäzes.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die intravenöse LD50 von Dinoproston an der Maus ist bei verschiedenen Mäusestämmen unterschiedlich und schwankt zwischen 47 mg / kg bis 182 mg / kg. Bei der Ratte betrug die LD50 nach intravenöser Applikation 45 mg / kg bzw. 66 mg / kg.
Eine einzelne intravenöse Gabe von 30 mg / kg Dinoproston an trächtige und nicht trächtige Mäuse war nicht toxisch für dieselben, bewirkte jedoch den intrauterinen Tod praktisch aller Feten. Bei der Maus zeigte eine orale Gabe bis zu 500 mg / kg keine letale Wirkung. Die orale LD50 bei der Ratte schwankte zwischen 174 mg / kg und 513 mg / kg.
Chronische Toxizität
Die subakute und chronische Toxizität wurde an Ratten, Kaninchen, Hunden und Affen geprüft. Dabei kam es, unabhängig von der Art der Anwendung, dosisabhängig zu reduzierter Gewichtszunahme, eventuell Anstieg des Hämatokrits als Folge des Wasserverlustes, zu leichtem Temperaturanstieg, Steigerung der Speichelsekretion und des Tränenflusses, außerdem Erbrechen, Diarrhö und Sedation.
Beim Kaninchen wurden nach wiederholter intravaginaler Applikation von Dinoproston Läsionen an der Vagina (fokale Hämorrhagie, fokale ulzerative Vaginitis) erzeugt.
Eine einmalige intramyometriale Injektion von 0,125 mg Dinoproston führte beim Affen (Macaca mulatta) zu einer (geringen) Gewebenekrotisierung; eine Injektion von 1,25 mg Dinoproston bewirkte eine auf das Myometrium übergreifende ausgeprägtere endometriale Granulationsnekrose.
Bei Tierstudien, in denen über mehrere Wochen Prostaglandine der E- und F-Reihe in hohen Dosen verabreicht wurden, konnten Knochenwucherungen beobachtet werden. Ähnliches wurde bei Neugeborenen festgestellt, die über längere Zeit Prostaglandin E1-Infusionen erhielten. Jedoch gibt es keine Hinweise auf ähnliche Knochenveränderungen bei der Kurzzeitanwendung von Dinoproston (Prostaglandin E2).
Mutagenität und Kanzerogenität
Die Mutagenitätstestung (Mikronukleustest oder Ames-Assay) ergab keinen Hinweis auf eine potenzielle Mutagenität bzw. Kanzerogenität. Kanzerogenitätsstudien wurden nicht durchgeführt, da das Arzneimittel nur kurzzeitig angewendet wird.
Teratogene Wirkung
In Studien an Ratten und Kaninchen hat Prostaglandin E2 zu Skelettanomalien geführt. Dinoproston erwies sich in Studien an Ratten und Kaninchen embryotoxisch.
Bei der perinatalen Untersuchung an der Ratte (Applikation von Dinoproston am 20. Schwangerschaftstag und bei neugeborenen Ratten) wurden bei den behandelten Tieren keine pathologischen Veränderungen festgestellt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Siliciumdioxid
Triacetin
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Haltbarkeit des Arzneimittels in der Verkaufspackung 2 Jahre.
Haltbarkeit nach Anbruch Sofort nach Anbruch verwenden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 °C bis 8 °C).
6.5 Art und Inhalt des Behältnisses
Packung mit 1 Fertigspritze mit 3 g (2,5 ml) Gel. Ein steriler Katheter ist beigepackt.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
PHARMACIA GmbH
Linkstr. 10
10785 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-51000
Mitvertreiber
PFIZER PHARMA GmbH
Linkstr. 10
10785 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-51000
8. ZULASSUNGSNUMMER
13120.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Erteilung der Zulassung: 22.03.1990 Verlängerung der Zulassung: 23.03.1995
10. STAND DER INFORMATION
Februar 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig.
spcde-5v15ppg-g-0
spcde-5v15ppg-g-0 9 06.02.2015