Propinorm
1. BEZEICHNUNG DES ARZNEIMITTELS
Propinorm 15 mg überzogene Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede überzogene Tablette enthält 15 mg Propiverinhydrochlorid, entsprechend 13,64 mg Propiverin. Jede überzogene Tablette enthält 63 mg Lactose-Monohydrat, 0,6 mg Glucose-Monohydrat, 49 mg Saccharose und 0.15 mg Cochenillerot A (E 124).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Überzogene Tabletten.
Rosa gefärbte, bikonvexe, runde mit Zucker überzogene Tabletten.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Symptomatische Behandlung von Harninkontinenz und erhöhter Miktionsfrequenz bei Patienten, die entweder eine idiopathische Detrusorhyperaktivität (hyperaktive Blase) oder eine neurogene Detrusorhyperaktivität (Detrusorhyperreflexie) durch Rückenmarkschädigungen, z. B. Querschnittslähmung, haben.
4.2 Dosierung, Art und Dauer der Anwendung
Überzogene Tabletten zur oralen Einnahme.
Empfohlene Tagesdosen:
Erwachsene: Als Standarddosis wird eine überzogene Tablette (= 15 mg Propiverinhydrochlorid) zweimal täglich empfohlen, eine Steigerung auf dreimal täglich ist möglich. Einige Patienten können bereits auf eine Dosis von 15 mg täglich ansprechen.
Bei neurogener Detrusorhyperaktivität wird eine Dosierung von einer überzogenen Tablette dreimal täglich empfohlen. Die maximale empfohlene Tagesdosis beträgt 45 mg.
Ältere: Im Allgemeinen gibt es kein spezielles Dosierungsregime für Ältere (siehe 5.2.)
Anwendung bei Patienten mit eingeschränkter Nierenfunktion:
Bei Patienten mit einer leichten oder mittelschweren Einschränkung der Nierenfunktion muss die Dosierung nicht angepasst werden, diese sollten jedoch mit Vorsicht behandelt werden. Bei Patienten mit starker Einschränkung der Nierenfunktion (Kreatinin-Clearance < 30 ml/min) beträgt die maximale Tagesdosis 30 mg.
Anwendung bei Patienten mit eingeschränkter Leberfunktion:
Bei Patienten mit einer leichten Einschränkung der Leberfunktion besteht keine Notwendigkeit der Dosisanpassung, die Behandlung sollte jedoch mit Vorsicht erfolgen. Studien zur Anwendung von Propiverinhydrochlorid bei Patienten mit mittelschwerer oder schwerer Einschränkung der Leberfunktion wurden nicht durchgeführt.
Fettreiche Mahlzeiten erhöhen die Bioverfügbarkeit von Propiverin. Die Einnahme sollte deshalb vor den Mahlzeiten erfolgen. Dies ist besonders für Patienten mit Einschränkung von Leber- oder Nierenfunktion von Bedeutung (s. 5.2).
Patienten mit gleichzeitiger Behandlung mit potenten Inhibitoren von CYP 3A4 und Methimazol: Patienten, die mit potenten Inhibitoren der flavinhaltigen Monooxygenase (FMO) wie Methimazol und gleichzeitig mit potenten Inhibitoren des Cytochrom-Enzyms CYP 3A4/5 behandelt werden, sollten mit der geringst möglichen Anfangsdosis behandelt werden. Die Dosis kann anschließend vorsichtig auftitriert werden. Jedoch sollten diese Patienten sorgfältig hinsichtlich Nebenwirkungen beobachtet werden. (s. 4.4, 4.5, 5.2)
Dieses Arzneimittel enthält 0,61 mg Glucose. Somit führt eine Tagesdosis von zwei überzogenen Tabletten 1,22 mg Glucose zu.
4.3 Gegenanzeigen
Das Arzneimittel darf nicht bei Patienten mit bekannter Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile und bei Patienten mit einer der folgenden Erkrankungen angewendet werden:
- Darmverschluss
- ausgeprägte Blasenentleerungsstörungen mit vorhersehbarem Harnverhalt
- Myasthenia gravis
- Darmatonie
- schwere Colitis ulcerosa
- toxisches Megacolon
- unbehandeltes Engwinkelglaukom
- moderate oder ausgeprägte Lebererkrankung
- Tachyarrhythmien.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Das Arzneimittel sollte bei Patienten mit folgenden Erkrankungen mit Vorsicht angewendet werden:
- autonome Neuropathie
- Nierenfunktionsstörungen
- Leberfunktionsstörungen.
Die Symptome folgender Erkrankungen können sich nach Verabreichung des Arzneimittels verstärken:
- schwere kongestive Herzinsuffizienz (NYHA IV)
- Prostatahyperplasie
- Hiatushernie mit Refluxösophagitis
- Arrhythmie
- Tachykardie
Wie auch andere Anticholinergika induziert Propiverin eine Mydriasis. Daher kann das Risiko, Glaukomanfälle zu induzieren, bei prädisponierten Personen mit engem Kammerwinkel der vorderen Augenkammer erhöht sein.
Es liegen Berichte vor, dass Wirkstoffe dieser Klasse von Arzneimitteln Glaukomanfälle induzieren oder verstärken können.
Pollakisurie und Nykturie infolge von Nierenerkrankungen oder dekompensierter Herzinsuffizienz sowie organische Blasenerkrankungen (z. B. Harnwegsinfektionen, Malignome) sollten vor der Behandlung ausgeschlossen werden.
Patienten, die gleichzeitig mit potenten Inhibitoren der flavinhaltigen Monooxygenase (FMO) wie Methimazol und mit potenten Inhibitoren des Cytochrom-Enzyms CYP 3A4/5 behandelt werden, sollten mit der gelingst möglichen Anfangsdosis behandelt werden. Die Dosis kann anschließend auftitriert werden. Jedoch sollte umsichtig vorgegangen werden (s. 4.2, 4.5, 5.2).
Dieses Produkt enthält Lactose-Monohydrat, Glucose-Monohydrat und Saccharose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel, Fructose-Intoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel sollten Propinorm nicht einnehmen.
Cochenillerot A (E124, Lackfarbstoff) kann allergische Reaktionen hervorrufen.
Aufgrund fehlender Daten darf Propinorm 15 mg überzogene Tabletten nicht bei Kindern angewendet werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wirkungsverstärkung durch gleichzeitige Verabreichung von tricyclischen Antidepressiva (z. B. Imipramin), Tranquilizern (z. B. Benzodiazepine), Anticholinergika, Amantadin, Neuroleptika (z. B. Phenothiazine) und Beta-Adrenoceptor-Agonisten (ß-Sympathikomimetika).
Wirkungsabschwächung durch gleichzeitige Verabreichung von Cholinergika. Blutdrucksenkung bei Patienten unter Isoniazidbehandlung. Die Wirkung von Prokinetika wie Metoclopramid kann verringert sein.
Pharmakokinetische Wechselwirkungen mit anderen Arzneimitteln, die durch Cytochrom P-450 3A4 (CYP 3A4) verstoffwechselt werden, sind möglich. Ein sehr ausgeprägter Konzentrationsanstieg wird für solche Arzneimittel jedoch nicht erwartet, da die Wirkungen von Propiverin im Vergleich zu klassischen Enzyminhibitoren (z. B. Ketoconazol oder Grapefruit-Saft) gering sind. Propiverin gilt als schwacher Hemmer des Cytochrom P-450 3A4. Pharmakokinetische Untersuchungen bei Patienten, die gleichzeitig starke CYP-3A4-Hemmer wie Azol-Antimykotika (z. B. Ketoconazol, Itraconazol) oder Makrolid-Antibiotika (z. B. Erythromycin, Clarithromycin) erhalten, sind nicht durchgeführt worden.
Patienten, die gleichzeitig mit potenten Inhibitoren der flavinhaltigen Monooxygenase (FMO) wie Methimazol und mit potenten Inhibitoren des Cytochrom-Enzyms CYP 3A4/5 behandelt werden, sollten mit der Anfangsdosis 15mg /Tag behandelt werden. Die Dosis kann anschließend vorsichtig auftitriert werden (s. 4.2, 5.2).
4.6 Fertilität, Schwangerschaft und Stillzeit
In Untersuchungen an Tieren kam es bei hochdosierter oraler Verabreichung an trächtige Weibchen zu einer verzögerten Skelettentwicklung bei den Nachkommen. Das Arzneimittel wurde auch in die Milch säugender Säugetiere abgesondert.
Propiverinhydrochlorid sollte daher nicht an schwangere oder stillenden Frauen verabreicht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Propiverinhydrochlorid kann zu Benommenheit und Verschwommensehen führen. Dadurch kann unter Einnahme dieses Arzneimittels die Fähigkeit des Patienten zum Ausführen von Tätigkeiten, die mentale Aufmerksamkeit erfordern, wie etwa das Führen von Kraftfahrzeugen, das Bedienen von Maschinen oder das Ausführen gefährlicher Arbeiten, eingeschränkt sein.
Beruhigungsmittel können die von Propiverinhydrochlorid verursachte Benommenheit verstärken.
|
Nebenwirkungen |
Systemische Organklasse (Störungen nach MedDRA) |
|
Sehr häufig (>1/10) - Mundtrockenheit |
Gastrointestinale Erkrankungen |
|
Häufig (>1/100, <1/10) - Akkommodation anormal, Akkommodationsstörungen, anormaler Visus |
Augenerkrankungen |
|
- Erschöpfung |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
|
- Kopfschmerz |
Erkrankungen des Nervensystems |
|
- Bauchschmerzen und Dyspepsie |
Gastrointestinale Erkrankungen |
|
- Obstipation |
Gastrointestinale Erkrankungen |
|
Gelegentlich (>1/1000, <1/100) | |
|
- Übelkeit/Erbrechen |
Gastrointestinale Erkrankungen |
|
- Schwindel |
Erkrankungen des Nervensystems |
|
- Tremor |
Erkrankungen des Nervensystems |
|
- Harnverhalt |
Erkrankungen der Nieren und Harnwege |
|
- Hitzewallung |
Gefäßerkrankungen |
|
- Geschmacksstörung |
Erkrankungen des Nervensystems |
|
- Blutdruckabfall mit Benommenheit |
Gefäßerkrankungen |
|
Selten (>1/10.000, <1/1000) | |
|
- Ausschlag bei Idiosynkrasie (Propiverin- hydrochlorid) oder Überempfindlichkeit (sonstige Bestandteile, z. B. Farbstoffe) |
Erkrankungen der Haut und des Unterhautzellgewebes |
|
- Sehr selten (<1/10.000, einschl. Einzelfälle) | |
|
- Palpitationen |
Herzerkrankungen |
|
- Unruhe, Verwirrtheit |
Psychiatrische Erkrankungen |
|
- Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) | |
|
- Halluzinationen |
Psychiatrische Erkrankungen |
Alle Nebenwirkungen sind kurzdauernd und klingen nach einer Dosisreduzierung oder bei Beendigung der Therapie nach maximal 1 - 4 Tagen ab.
Bei einer Langzeittherapie sollten die Leberenzyme kontrolliert werden, da in seltenen Fällen reversible Leberenzymveränderungen auftreten können. Bei Patienten mit der Gefahr einer Glaukomentwicklung wird die Kontrolle des Augeninnendrucks empfohlen.
Bei Harnweginfekten sollte besonders auf die Restharnmenge geachtet werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie
ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
Website: www.bfarm.de
anzuzeigen.
Eine Überdosierung mit dem Muskarinrezeptor-Antagonisten Propiverinhydrochlorid kann potentiell zu zentralnervösen anticholinergen Effekten, wie z. B. Unruhe, Schwindel, Übelkeit,
Sprach- und Sehstörungen und Muskelschwäche, führen. Darüber hinaus können schwere Trockenheit der Schleimhäute, Tachykardie und Harnverhalt auftreten.
Die Behandlung sollte symptomatisch und unterstützend sein. Die Behandlung der Überdosierung kann das Auslösen von Erbrechen oder eine Magenspülung unter Verwendung eines eingeölten Schlauches beinhalten (Vorsicht: trockene Schleimhäute!). Dann symptomatische und unterstützende Behandlung wie bei Atropin-Überdosierung (z. B. Physostigmin) mit einer Dosierung von 1,0 bis 2,0 mg bei Erwachsenen durch langsame intravenöse Injektion (kann bei Bedarf bis zu einer Gesamtmenge von 5 mg wiederholt werden).
Ein 14-jähriges Mädchen, das 450 mg Propiverinhydrochlorid eingenommen hatte, zeigte eine Konfabulation. Die Jugendliche erholte sich vollständig.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe Spasmolytikum, Anticholinergikum
ATC-Code G04B D06
Wirkungsweise
Muskulotrope Spasmolyse durch Hemmung des Calcium-Einstroms und Modulation des intrazellulären Calciums in der glatten Muskulatur der Harnblase.
Hemmung der efferenten Bahnen des Nervus pelvicus durch anticholinerge Wirkung.
Pharmakodynamische Wirkungen
Am Tier bewirkt Propiverinhydrochlorid eine dosisabhängige Abnahme des intravesikalen Drucks und eine Erhöhung der Blasenkapazität.
Der Effekt beruht auf der Summe der pharmakologischen Eigenschaften von Propiverin und drei aktiven Harnmetaboliten, wie an isolierten Detrusorstreifen von Mensch und Tier gezeigt werden konnte.
5.2 Pharmakokinetische Eigenschaften
Allgemeine Eigenschaften der aktiven Substanz
Propiverin wird fast vollständig aus dem Magen-Darm-Trakt resorbiert. Es unterliegt einem extensiven First-Pass-Metabolismus. Wirkungen an den Zellen der glatten Muskulatur der Harnblase sind durch die Stammverbindung sowie drei aktive Metaboliten, die schnell in den Urin ausgeschieden werden, bedingt.
Resorption
Nach oraler Gabe von Propinorm 15 mg überzogene Tabletten wird Propiverin schnell aus dem Gastrointestinaltrakt resorbiert und erreicht maximale Plasmakonzentrationen nach 2,3 Stunden. Die mittlere absolute Bioverfügbarkeit von Propinorm 15 mg überzogene Tabletten beträgt 40,5 % (arithmetischer Mittelwert aus AUC0-OT (p.o.) / AUC0-OT (i.v.)).
Durch Nahrungsaufnahme wird die Bioverfügbarkeit von Propiverin erhöht (mittlerer Anstieg um das 1,3-fache), jedoch ohne signifikanten Einfluss auf die maximale Plasmakonzentration von Propiverin oder seines Hauptmetaboliten Propiverin-N-Oxid. Es ist unwahrscheinlich, dass dieser Unterschied in der Bioverfügbarkeit klinische Bedeutung hat, jedoch kann eine Dosisanpassung bei Patienten mit Nieren- oder Leberfunktionsstörung und der Nahrungsaufnahme erforderlich sein. Die regelmäßige Einnahme wird vor den Mahlzeiten empfohlen.
Verteilung
Nach Gabe von Propinorm 15 mg überzogene Tabletten t. i. d. wird ein Steady State (Fließgleichgewicht) nach vier bis fünf Tagen auf einem höheren Konzentrationsniveau als nach einer Einzelgabe erreicht (CMittelwert = 61 ng/ml).
Das Verteilungsvolumen wurde bei 21 gesunden Probanden nach intravenöser Gabe von Propiverinhydrochlorid bestimmt und lag zwischen 125 und 473 l (Mittelwert 279 l), was darauf hindeutet, dass eine große Menge des verfügbaren Propiverins in periphere Kompartimente verteilt wird. Die Plasmaprotein-Bindung beträgt 90 - 95 % für die Stammverbindung und etwa 60 % für den Hauptmetaboliten.
Plasmakonzentrationen von Propiverin bei 16 gesunden Probanden nach einmaliger und wiederholter Gabe von Propinorm 15 mg überzogene Tabletten (t. i. d. über 6 Tage):
[ng/ml]
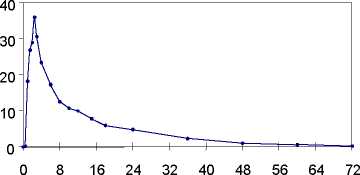
Einmalige Gabe
Zeit [h]
[ng/ml]
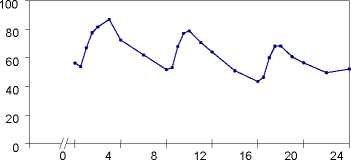
Zeit [h]
Wiederholte Gabe
Steady-State-Eigenschaften von Propiverin nach wiederholter Gabe von Propinorm 15 mg überzogene Tabletten
an 16 gesunde Probanden (t. i. d. über 6 Tage):
|
Dosierungs intervall [h] |
AUC0.x [ng-h/ml] |
CV [%] |
PTF [%] |
CV [%] |
CMittelwert [ng/ml] |
CV [%] |
|
0 - 8 |
515 |
35 |
57 |
16 |
64 |
36 |
|
8 - 16 |
460 |
33 |
70 |
25 |
57 |
33 |
|
16 - 24 |
421 |
36 |
52 |
39 |
52 |
36 |
|
CV: Variationskoeffizient PTF: Maximum-Minimum-Streuung | ||||||
Biotransformation
Propiverin wird extensiv durch intestinale und hepatische Enzyme verstoffwechselt. Der Hauptabbauweg schließt die Oxydation des Piperidyl-N ein und wird durch CYP 3A4 und die Flavin-Monoxygenasen (FMO) 1 und 3 vermittelt und führt zur Bildung des weit weniger aktiven N-Oxids, dessen Plasmakonzentration die der Ausgangssubstanz deutlich übersteigt. Vier Metaboliten wurden im Urin nachgewiesen, zwei davon sind pharmakologisch aktiv und können zur therapeutischen Wirksamkeit von Propinorm 15 mg überzogene Tabletten beitragen.
In vitro ist eine geringfügige Hemmung von CYP 3A4 und CYP 2D6 messbar, die bei Konzentrationen auftritt, die die therapeutischen Plasmakonzentrationen um das 10- bis 100-fache übersteigen (siehe Punkt 4.5.).
Elimination
Nach oraler Gabe von 30 mg 14C-Propiverinhydrochlorid an gesunde Probanden wurden innerhalb von 12 Tagen 60 % der Radioaktivität im Urin und 21 % der Radioaktivität in den Faeces gefunden.
Weniger als 1 % einer oralen Gabe wird unverändert mit dem Urin ausgeschieden. Die mittlere totale Clearance nach einmaliger Gabe von 30 mg beträgt 371 ml/min (191 - 870 ml/min). Im Rahmen von drei Studien, in die insgesamt 37 gesunde Probanden eingeschlossen waren, wurden mittlere Eliminationshalbwertzeiten von 14,1 bzw. 20,1 bzw. 22,1 Stunden ermittelt.
Linearität/Nichtlinearität
Die pharmakokinetischen Parameter von Propiverin und Propiverin-N-Oxid nach oraler Gabe von 10 -30 mg Propiverinhydrochlorid stehen in einem linearen Zusammenhang mit der Dosis. Während des Steady State sind keine Veränderungen in der Pharmakokinetik im Vergleich zur Einzelgabe zu sehen.
Eigenschaften bei Patienten
Nierenfunktionseinschränkung
Aus einer Untersuchung mit einmaliger Gabe an 12 Patienten mit einer Kreatininclearance <30 ml/min wurde geschlussfolgert, dass eine schwere Nierenfunktionseinschränkung die Eliminierung von Propiverin und seinem Hauptmetaboliten Propiverin-N-Oxid nicht wesentlich ändert. Eine Dosisanpasung ist nicht notwendig, wenn die Gesamt-Tagesdosis 30 mg (d. h. Propinorm 15 mg überzogene Tabletten b. i. d.) nicht überschreitet. In dem Fall, dass eine höhere Dosis (d. h. 45 mg) gegeben werden soll, ist eine vorsichtige Titration der Dosis unter Berücksichtigung der anticholinergen Wirkungen als Marker für die Verträglichkeit zu empfehlen.
Leberinsuffizienz:
Verglichen mit 12 gesunden Kontrollpersonen, war die Steady-State-Pharmakokinetik von Propiverin ähnlich der von 12 Patienten mit milder bis moderater Leberfunktionseinschränkung durch eine Fettleber. Für schwere Leberfunktionseinschränkungen liegen keine Daten vor.
Alter:
Der Vergleich von Tal-Plasmakonzentrationen während des Steady State (Propinorm 15 mg überzogene Tabletten t. i. d. über 28 Tage) zeigt keinen Unterschied zwischen älteren Patienten (60 -85 Jahre; Mittelwert 68) und jungen gesunden Probanden. Das Verhältnis der Muttersubstanz zum Metaboliten bleibt bei älteren Patienten unverändert, was darauf hindeutet, dass die metabolische Umsetzung von Propiverin in seinen Hauptmetaboliten Propiverin-N-Oxid nicht altersabhängig oder nicht limitierend bei der Gesamtausscheidung ist.
Glaukom-Patienten:
Propinorm 15 mg überzogene Tabletten t. i. d. erhöht nicht den Augeninnendruck bei Patienten mit Weitwinkelglaukom und bei Patienten mit behandeltem (kontrolliertem) Engwinkelglaukom, wie in zwei Placebo-kontrollierten Studien gezeigt werden konnte.
5.3 Präklinische Daten zur Sicherheit
In Langzeituntersuchungen mit oraler Gabe an zwei Säugetierarten waren die wichtigsten behandlungsbezogenen Effekte Veränderungen in der Leber (einschließlich Erhöhung der Leberenzyme). Diese waren durch Leberhypertrophie und -verfettung gekennzeichnet. Die Verfettung war nach Abbruch der Behandlung reversibel.
In Untersuchungen an Tieren kam es bei hochdosierter oraler Verabreichung an trächtige Weibchen zu einer verzögerten Skelettentwicklung bei den Nachkommen. Bei säugenden Säugetieren wurde Propiverinhydrochlorid in die Milch ausgeschieden.
Es wurde kein Hinweis auf Mutagenität gefunden. Eine Karzinogenitätsstudie an Mäusen zeigte bei hoher Dosierung eine erhöhte Inzidenz an hepatozellulären Adenomen und Karzinomen bei männlichen Tieren. In einer Karzinogenitätsstudie an Ratten traten bei hoher Dosierung bei männlichen Tieren hepatozelluläre Adenome, Nierenadenome und Harnblasenpapillome auf, während bei weiblichen Tieren bei hoher Dosierung Endometriumpolypen auftraten. Alle Tumore wurden jedoch alle als artspezifisch und daher nicht als klinisch relevant eingeschätzt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Tablettenkem:
- Lactose-Monohydrat
- Cellulosepulver
- Magnesiumstearat Tablettenhülle:
- Saccharose
- Talkum
- weißer Ton
- Calciumcarbonat
- T itandioxid (E171)
- Arabisches Gummi
- hochdisperses Siliciumdioxid
- Macrogol 6000
- Glucose-Monohydrat
- Cochenillerot A (E124, Lackfarbstoff)
- Montanglycolwachs
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
PVC/Aluminium-Blister in Packungen mit 14, 20, 28, 30, 50, 56, 60, 84, 100, 112, 168, 252 oder 300 überzogenen Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
APOGEPHA Arzneimittel GmbH Kyffhäuserstr. 27 D-01309 Dresden Deutschland
8. ZULASSUNGSNUMMER
44279.00.00
9. DATUM DER ERTEILUNG/VERLÄNGERUNG DER ZULASSUNG
21.12.1998/31.08.2010
10. STAND DER INFORMATION
Juni 2014
11. VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT
Rp, apothekenpflichtig
9