Prosmin 5 Mg Filmtabletten
|
Bezeichnung |
Prosmin 5 mg Filmtabletten |
v005de |
Seite 1 von 17
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
FACHINFORMATION
Seite 2 von 17
1. BEZEICHNUNG DES ARZNEIMITTELS
Prosmin® 5 mg Filmtabletten
Zur Anwendung bei männlichen Erwachsenen.
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Filmtablette enthält: 5 mg Finasterid.
Sonstiger Bestandteil: 1 Filmtablette enthält 75 mg Lactose-Monohydrat Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtabletten
Weiße, runde, bikonvexe Filmtabletten, 7 mm Durchmesser, mit einseitiger Prägung "F" und "5". Die Filmtabletten haben keine Bruchrille und sollen nicht geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Prosmin® 5 mg ist zur Behandlung und Kontrolle der benignen Prostata-Hyperplasie (BPH) indiziert, um:
- eine Rückbildung der vergrößerten Prostata zu erreichen,
- den Harnfluss und BPH-bedingte Symptome zu verbessern
- das Risiko einer akuten Harnretention und die Notwendigkeit eines chirurgischen Eingriffs einschließlich einer transurethralen Resektion der Prostata (TURP) und einer Prostatektomie zu vermindern.
Prosmin® 5 mg sollte bei Patienten mit einer vergrößerten Prostata (Prostatavolumen über ca. 40 ml) angewendet werden.
4.2 Dosierung, Art und Dauer der Anwendung
Zum Einnehmen.
Dosierung
Die empfohlene Dosierung beträgt einmal täglich eine 1 Filmtablette Prosmin® 5 mg (5 mg Finasterid) .
Kombinationstherapie mit Doxazosin Empfohlen wird eine Dosierung von:
Prosmin® 5 mg: 1 Filmtablette (5 mg Finasterid) täglich Doxazosin:
Woche 1: 1 mg Doxazosin täglich Woche 2: 2 mg Doxazosin täglich
|
Bezeichnung |
Prosmin 5 mg Filmtabletten |
v005de |
Seite 3 von 17
Woche 3: 4 mg Doxazosin täglich
Ab Woche 4: 4 mg oder 8 mg Doxazosin täglich
Eine Dosistitration auf mindestens 4 mg Doxazosin täglich ist erforderlich, um das Risiko einer klinischen Progression der BPH signifikant zu reduzieren (MTOPS-Studie siehe 5.1 Pharmakodynamische Eigenschaften).
Dosierung bei eingeschränkter Leberfunktion
Bisher stehen keine Erkenntnisse über den Einsatz von Finasterid bei Patienten mit Leberinsuffizienz zur Verfügung (siehe Abschnitt 4.4).
Dosierung bei Niereninsuffizienz
Pharmakokinetische Untersuchungen zeigten, dass eine Dosisanpassung bei einer Kreatinin-Clearance von über 9 ml/min/1,73 m2 nicht erforderlich ist. Erkenntnisse über den Einsatz von Finasterid bei dialysepflichtigen Patienten liegen nicht vor.
Dosierung bei älteren Patienten
Die Elimination von Finasterid ist bei Patienten über 70 Jahre geringfügig vermindert. Eine Dosisanpassung ist jedoch nicht erforderlich.
Art der Anwendung
Die Filmtablette kann entweder auf nüchternen Magen oder mit einer Mahlzeit mit ausreichend Flüssigkeit eingenommen werden. Die Filmtablette soll im Ganzen geschluckt und darf nicht geteilt oder zerstoßen werden (siehe Abschnitt 6.6). Obwohl innerhalb kurzer Zeit eine Besserung der Symptome beobachtet wird, kann eine Behandlung über mindestens 6 Monate erforderlich sein, um objektiv entscheiden zu können, ob ein zufrieden stellendes Ansprechen auf die Therapie erreicht wurde. Die Dauer der Anwendung bestimmt der Arzt.
4.3 Gegenanzeigen
Prosmin® 5 mg ist nicht indiziert für die Verwendung bei Frauen und Kindern.
Prosmin® 5 mg ist kontraindiziert bei:
- Überempfindlichkeit gegenüber Finasterid oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- Frauen, die schwanger sind oder sein könnten (siehe Abschnitt 4.6 „Fertilität, Schwangerschaft und Stillzeit,)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Allgemeine Hinweise
Eine Behandlung mit Finasterid sollte in Abstimmung mit einem Arzt für Urologie erfolgen.
Eine Obstruktion aufgrund eines trilobären Wachstumsmusters der Prostata sollte vor Therapiebeginn ausgeschlossen werden.
Um Komplikationen hinsichtlich einer Harnwegsobstruktion zu vermeiden, ist es wichtig, dass Patienten mit einem großen Restharnvolumen und/oder stark vermindertem Harnfluss sorgfältig überwacht werden. Die Möglichkeit chirurgischer Maßnahmen sollte in Erwägung gezogen werden.
Auswirkungen auf das prostataspezifische Antigen (PSA) und Diagnostik eines Prostata-Karzinoms Ein therapeutischer Nutzen von Finasterid 5 mg bei Patienten mit Prostata-Karzinom wurde bislang nicht nachgewiesen.
|
Bezeichnung |
Prosmin 5 mg Filmtabletten |
v005de |
Seite 4 von 17
Patienten mit BPH und erhöhten prostataspezifischen Antigen (PSA)-Spiegeln wurden in klinischen Studien mit regelmäßigen PSA-Spiegel-Kontrollen und Prostatabiopsien überwacht. Diese BPH-Studien waren nicht zur Feststellung eines Unterschiedes in der Rate der Prostatakarzinome ausgelegt. In diesen Studien änderte Finasterid 5 mg die Rate der Entdeckung von Prostatakarzinomen nicht. Die Gesamthäufigkeit der Prostatakarzinome bei den Patienten unter der Behandlung mit Finasterid 5 mg war nicht signifikant unterschiedlich im Vergleich zu der bei Patienten unter Placebo.
Als Kontrolle vor Behandlungsbeginn und in regelmäßigen Abständen während der Behandlung sollten eine digitale rektale Untersuchung durchgeführt und gegebenenfalls das prostataspezifische Antigen (PSA) im Serum bestimmt oder andere Untersuchungen durchgeführt werden, um ein Prostata-Karzinom auszuschließen. Im Allgemeinen erfordert ein PSA-Wert > 10 ng/ml (Hybritech) weitere Maßnahmen, eine Biopsie sollte erwogen werden. Bei PSA-Spiegeln zwischen 4 ng/ml und 10 ng/ml sind weitere Kontrollen zu empfehlen. Die PSA-Spiegel können sich bei Männern mit und ohne Prostata-Karzinom deutlich überlappen. Daher ist bei Männern mit BPH und PSA-Werten im Normbereich ein Prostata-Karzinom, ungeachtet einer Behandlung mit Finasterid 5mg, nicht ausgeschlossen. Auch PSA-Werte < 4 ng/ml schließen ein Prostatakarzinom nicht aus.
Jeder länger anhaltende Anstieg der PSA-Spiegel bei mit Prosmin® 5 mg behandelten Patienten sollte sorgfältig beurteilt werden, auch hinsichtlich der Möglichkeit, dass der Patient die Filmtabletten nicht einnimmt. Der Anteil an freiem PSA ist unter der Therapie mit Prosmin® 5 mg nicht signifikant erniedrigt. Das Verhältnis von freiem PSA zu Gesamt-PSA bleibt auch unter der Wirkung von Prosmin® 5 mg konstant Bei Heranziehung des PSA-Quotienten (= freies PSA/Gesamt-PSA) in der Prostata-Karzinom-Diagnostik ist daher keine rechnerische Korrektur erforderlich.
Wechselwirkungen mit Labortests
Wirkung auf den PSA-Wert
Die PSA-Serumkonzentration korreliert mit dem Alter des Patienten und dem Prostatavolumen, das Prostatavolumen seinerseits korreliert mit dem Alter des Patienten.
Bei der Beurteilung der PSA-Werte sollte berücksichtigt werden, dass PSA unter der Therapie mit Finasterid 5 mg um ca. 50 % absinkt. Durch Finasterid 5 mg kommt es bei Patienten mit BPH auch bei einem bestehenden Prostata-Karzinom zu einer Senkung der Serum-Konzentrationen von PSA. Dieser Abfall der PSA-Werte bei BPH-Patienten, die mit Finasterid 5 mg behandelt werden, sollte bei der Bewertung der PSA-Werte berücksichtigt werden und schließt ein möglicherweise gleichzeitig vorliegendes Prostatakarzinom nicht aus. Bei der Mehrzahl der Patienten fällt der PSA-Spiegel innerhalb der ersten Behandlungsmonate rasch ab, danach stabilisiert sich der PSA-Wert auf einen Ausgangswert, der im Mittel der beobachteten Patienten etwa um die Hälfte niedriger liegt als vor Beginn der Behandlung. Daher sollten die PSA-Werte beim typischen Patienten, der mindestens sechs Monate mit Finasterid 5 mg behandelt wurden im Vergleich zu den normalen Werten bei unbehandelten Männern verdoppelt werden. Dieser Abfall ist über den gesamten Bereich der PSA-Werte vorhersagbar, unterliegt allerdings interindividuell einer Streuung..Eine Analyse von Daten der PSA-Werte von über 3.000 Patienten in einer vierjährigen, doppelblinden, placebo-kontrollierten Wirkungs- und Verträglichkeits-Langzeitstudie mit Finasterid (PLESS) bestätigte, dass bei einem typischen Patienten unter einer mindestens sechsmonatigen Therapie mit Finasterid 5 mg die PSA-Werte im Vergleich zu den Normwerten bei unbehandelten Männern verdoppelt werden sollen. Diese Anpassung erhält die Empfindlichkeit oder Spezifität der PSA-Bestimmung und ihrer Eignung für die Prostata-Karzinom-Aufdeckung.
Brustkrebs bei Männern
In klinischen Studien und nach Markteinführung wurde Brustkrebs bei Männern unter Finasterid 5 mg berichtet. Ärzte sollten ihre Patienten anweisen, unverzüglich jegliche Veränderungen des Brustgewebes wie Knoten, Schmerzen, Gynäkomastie oder Ausfluss aus der Brustwarze zu berichten.
Seite 5 von 17
Leberinsuffizienz
Die Auswirkungen einer Leberinsuffizienz auf die Pharmakokinetik von Finasterid wurden nicht untersucht.
Anwendung bei Kindern
Da Erkenntnisse über den Einsatz von Finasterid bei Kindern nicht zur Verfügung stehen, ist dieser Personenkreis von der Behandlung auszunehmen.
Sonstige Bestandteile
Dieses Arzneimittel enthält Lactose-Monohydrat. Patienten mit einer seltenen erblichen LactoseIntoleranz, Lapp-Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Klinisch bedeutsame Wechselwirkungen sind nicht bekannt. Finasterid wird primär über das Cytochrom P450 3A4 System metabolisiert, führt aber offenbar zu keiner relevanten Beeinflussung. Obwohl das Risiko, dass sich Finasterid auf die Pharmakokinetik von anderen Medikamenten auswirkt, als gering eingeschätzt wird, ist es wahrscheinlich, dass Stoffe, die das Cytochrom P450 3A4 hemmen oder induzieren, die Plasmakonzentration von Finasterid beeinflussen. Wenn man die anerkannten Sicherheitsspannen zugrunde legt, ist es allerdings unwahrscheinlich, dass ein Anstieg, wie er durch die gleichzeitige Gabe solcher Hemmstoffe bedingt sein kann, von klinischer Bedeutung ist. Folgende Arzneimittel wurden beim Menschen überprüft, ohne dass klinisch bedeutsame Wechselwirkungen gefunden wurden: Propranolol, Digoxin, Glibenclamid, Warfarin, Theophyllin und Antipyrin (Phenazon).
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Die Anwendung von Prosmin® 5 mg ist bei Frauen kontraindiziert, wenn sie schwanger sind oder bei denen eine Schwangerschaft nicht auszuschließen ist (siehe Abschnitt 4.3 Gegenanzeigen).
Da 5a-Reduktasehemmer die Umwandlung von Testosteron in Dihydrotestosteron hemmen, können diese Arzneimittel, inklusive Prosmin® 5 mg, Anomalien der äußeren Geschlechtsorgane männlicher Feten hervorrufen (siehe Abschnitt 4.4 und 5.3), wenn Prosmin® 5 mg von einer schwangeren Frau eingenommen wird.
Finasterid-Exposition - Risiko für männliche Feten
Zerstoßene oder zerbrochene Prosmin® 5 mg Filmtabletten sollten von Frauen, speziell des medizinischen Assistenzpersonals, die einem Gefährdungsrisiko unterliegen, wenn sie schwanger oder möglicherweise schwanger sind, nicht berührt werden, da eine Resorption von Finasterid und damit ein potenzielles Risiko für den männlichen Feten nicht ausgeschlossen werden kann (siehe Abschnitt 4.6 Fertilität, Schwangerschaft und Stillzeit).
Prosmin® 5 mg Filmtabletten haben einen Filmüberzug, der bei normaler Handhabung den Kontakt mit dem aktiven Wirkstoff verhindert, vorausgesetzt, dass die Tabletten nicht zerbrochen oder zerstoßen wurden.
Fertilität
Geringe Mengen von Finasterid wurden auch im Sperma von Männern, die 5 mg Finasterid/Tag erhielten, wiedergefunden. Es ist nicht bekannt, ob ein männlicher Fetus, dessen Mutter mit dem Samen eines mit Finasterid behandelten Patienten in Kontakt kommt, geschädigt wird. Wenn die
|
Bezeichnung |
Prosmin 5 mg Filmtabletten |
v005de |
Seite 6 von 17
Sexualpartnerin schwanger ist oder schwanger werden könnte, wird dem Patienten empfohlen, die Sperma-Exposition seiner Partnerin zu minimieren.
Stillzeit
Prosmin® 5 mg ist nicht für die Anwendung bei Frauen bestimmt. Es ist nicht bekannt, ob Finasterid in die Muttermilch übergeht.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es gibt keine Daten, die vermuten lassen, dass Prosmin® 5 mg die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen beeinträchtigt.
4.8 Nebenwirkungen
Die häufigsten Nebenwirkungen sind Impotenz und verminderte Libido. Diese Wirkungen treten in der Regel zu Behandlungsbeginn auf und sind bei fortgesetzter Behandlung bei den meisten Patienten von vorübergehender Natur.
Die Nebenwirkungen, die während klinischer Studien und/oder nach Markteinführung berichtet wurden, werden in der untenstehenden Tabelle gezeigt.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Da die Nebenwirkungen, die nach Markteinführung für Prosmin® 5 mg und/oder Finasterid in niedrigen Dosierungen aus Spontanberichten aus einer Population unbestimmter Größe stammen, ist es nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen bzw. einen Kausalzusammenhang mit der Anwendung des Arzneimittels nachzuweisen.
|
Systemorgan-Klasse |
Nebenwirkungen mit Häufigkeitsangabe |
|
Erkrankungen des Immunsystems |
Nicht bekannt: Überempfindlichkeitsreaktionen wie Angioödeme (einschließlich Schwellung der Lippen, der Zunge, des Halses und des Gesichts) |
|
Psychiatrische Erkrankungen |
Häufig: verminderte Libido Nicht bekannt: Depression, verminderte Libido, die auch nach dem Absetzen der Behandlung andauerte |
|
Herzerkrankungen |
Nicht bekannt: Palpitationen |
|
Leber- und Gallenerkrankungen |
Nicht bekannt: erhöhte Leberwerte |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Gelegentlich: Hautausschlag Nicht bekannt: Pruritus, Urtikaria |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Häufig: Impotenz Gelegentlich: Ej akulationsstörungen, Spannungsgefühl in der Brust und Berührungsempfindlichkeit der Brust, |
Seite 7 von 17
|
Vergrößerung der Brust Sehr selten: Sekretion aus der Brustdrüse, Knoten in der Brust, die bei einzelnen Patienten operativ entfernt wurden Nicht bekannt: Hodenschmerzen, sexuelle Funktionsstörungen (erektile Dysfunktion und Ejakulationsstörungen), die auch nach dem Absetzen der Behandlung andauerten; Infertilität bei Männern und/oder schlechte Spermienqualität. Eine Normalisierung oder Verbesserung der Spermienqualität wurde nach dem Absetzen von Finasterid berichtet. | |
|
Untersuchungen |
Häufig: vermindertes Ejakulatvolumen |
Zusätzlich wurde in klinischen Studien nach Markteinführung Folgendes berichtet: Brustkrebs beim Mann (siehe auch Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Laborparameter
Bei der Bestimmung des PSA-Wertes sollte berücksichtigt werden, dass die PSA-Spiegel im Allgemeinen bei mit Finasterid behandelten Patienten um 50 % erniedrigt sind (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Kombinationstherapie mit Doxazosin
Die folgenden Nebenwirkungen wurden häufiger berichtet, wenn Finasterid 5 mg zusammen mit dem alpha-Rezeptorenblocker Doxazosin angewendet wurde:
Asthenie 16,8 % (Plazebo 7,1 %), posturale Hypotonie 17,8 % (Plazebo 8,0 %), Schwindel 23,2 % (Plazebo 8,1 %) und Ejakulationsstörungen 14,1 % (Plazebo 2,3 %).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
anzuzeigen.
4.9 Überdosierung
Einzeldosen bis zu 400 mg Finasterid sowie Mehrfachdosen bis zu 80 mg/Tag über drei Monate blieben beim Menschen ohne Nebenwirkungen. Eine Empfehlung zur spezifischen Behandlung einer Überdosierung von Prosmin® 5 mg kann nicht gegeben werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
Seite 8 von 17
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: 4-Azasteroid, 5a-Reduktasehemmer Arzneimittel zur Behandlung der benignen Prostatahyperplasie ATC-Code: G04C B01
Die benigne Prostatahyperplasie (BPH) tritt bei der Mehrzahl der Männer über 50 Jahre auf, und ihre Prävalenz steigt mit höherem Lebensalter. Epidemiologische Untersuchungen lassen vermuten, dass eine Vergrößerung der Prostata mit einem dreifach höheren Risiko für einen Harnverhalt und urologische Operationen assoziiert ist. Bei Männern mit einer vergrößerten Prostata ist die Wahrscheinlichkeit für das Auftreten von mäßigen bis schweren urologischen Symptomen oder einer Verringerung des Uroflows ebenfalls dreifach höher als bei Männern mit kleinerer Prostata.
Das normale Wachstum der Prostata und ihre Vergrößerung sowie die Entwicklung einer BPH sind abhängig von Dihydrotestosteron (DHT), einem potenten Androgen. Testosteron, das von Hoden und Nebennieren sezerniert wird, wird hauptsächlich in der Prostata, Leber und Haut durch die Typ II 5a-Reduktase rasch zu DHT verstoffwechselt. In diesen Geweben erfolgt anschließend eine Bindung im Zellkern und dadurch die Auslösung der Wirkungen des DHT.
Finasterid, der Wirkstoff von Prosmin® 5 mg ist kompetitiver Hemmer der humanen Typ-II-5a-Reduktase, mit der dieser langsam einen stabilen Enzymkomplex bildet. Der Abbau dieses Komplexes erfolgt sehr langsam (tJ/2 ca. 30 Tage). Finasterid erwies sich in vitro und in vivo als ein spezifischer Typ II 5a-Reduktase-Hemmer ohne Affinität zum Androgenrezepor.
Eine Einzeldosis von 5 mg Finasterid führte zu einem raschen Abfall der DHT-Konzentration im Plasma mit einem Maximum des Abfalls nach acht Stunden. Während die Plasmaspiegel von Finasterid schwanken, bleibt der DHT-Plasmaspiegel über 24 Stunden konstant. Dies zeigt, dass die Plasmakonzentrationen von Finasterid und DHT nicht direkt miteinander korrelieren.
Patienten mit BPH erhielten 5 mg Finasterid täglich über vier Jahre. Die DHT-Konzentration wurde dabei um ca. 70 % gesenkt, verbunden mit einer mittleren Reduktion des Prostatavolumens um ca. 20 % (Medianwert), das mittels transrektaler Sonographie gemessen wurde. Zusätzlich wurde auch das prostataspezifische Antigen (PSA) um ca. 50 % seines Ausgangswertes gesenkt. Dies lässt auf einen Rückgang des epithelialen Zellwachstums in der Prostata schließen. Die Reduktion der DHT-Spiegel und die Verkleinerung der hyperplastischen Prostata zusammen mit verminderten PSA-Spiegeln blieben in klinischen Studien von bis zu vier Jahren Therapiedauer erhalten.
Die Testosteronspiegel stiegen dabei um etwa 10 - 20 % an und blieben damit innerhalb des physiologischen Bereichs.
Bei Patienten, die Finasterid 7 - 10 Tage vor Prostatektomie erhielten, führte Finasterid zu einer Senkung des DHT im Prostatagewebe um ca. 80 %. Die Testosteronkonzentration im Prostatagewebe stieg bis um das 10-fache über den Ausgangswert an.
Bei Probanden erreichten die DHT-Spiegel nach Beendigung einer 14-tägigen Einnahme von Finasterid innerhalb von etwa zwei Wochen wieder die Ausgangswerte. Bei Patienten, die drei Monate behandelt wurden, stieg das Prostatavolumen, welches um ca. 20 % verringert war, ca. drei Monate nach Ende der Behandlung wieder annähernd auf den Ausgangswert an.
Finasterid hatte in Plazebo-kontrollierten Studien keinen Einfluss auf die Spiegel von Hydrocortison, Östradiol, Prolaktin, thyreostimulierendem Hormon (TSH) und Thyroxin. Kein klinisch bedeutsamer Effekt wurde auf das Plasma-Lipidprofil (wie Gesamt-, LDL-,HDL-Cholesterin und Triglyzeride) oder auf die mineralische Knochendichte beobachtet.
Seite 9 von 17
Bei Patienten, die 12 Monate behandelt wurden, stieg das luteinisierende Hormon (LH) bzw. das follikelstimulierende Hormon (FSH) um etwa 15 % bzw. 9 % an. Diese Werte blieben innerhalb des physiologischen Bereichs. Die durch das Gonadotropin-Releasing-Hormon (GnRH) stimulierten Spiegel von LH und FSH waren nicht verändert; dies bedeutet, dass die hypophysäre Kontrolle der Gonaden nicht beeinträchtigt wird.
Zur Beurteilung von Sperma-Parametern wurde Finasterid 5mg über 24 Wochen gesunden Probanden verabreicht. Die Konzentration der Spermien, die Mobilität und die Morphologie der Spermien oder der pH-Wert wurden nicht klinisch relevant beeinflusst. Das Ejakulatvolumen nahm im Median um 0,6ml ab bei einer gleichzeitigen Reduktion der Gesamtzahl der Spermien pro Ejakulat. Diese Parameter blieben innerhalb des normalen Bereichs und erreichten nach Beendigung der Therapie wieder die Ausgangswerte.
Finasterid hemmt offensichtlich die Metabolisierung der C19- und C21-Steroide und scheint einen Hemmeffekt auf die Aktivität der hepatischen und peripheren Typ II 5a-Reduktase zu haben. Die Metaboliten von DHT im Serum, Androstendiolglucuronid und Androsteronglucuronid,waren ebenfalls signifikant vermindert. Dieses Metabolitenmuster ähnelt dem bei Personen mit hereditärem Typ II 5a-Reduktase-Mangel. Die Betroffenen weisen deutlich erniedrigte DHT-Spiegel und eine kleine Prostata auf. Sie entwickeln keine BPH. Bei ihnen zeigen sich Veränderungen im Urogenitalbereich bei der Geburt und Abweichungen bei biochemischen Parametern. Ansonsten bleibt der Typ II 5a-Reduktase-Mangel ohne klinisch bedeutsame Folgen.
Die Ergebnisse der nachstehend beschriebenen Studien, die ein vermindertes Risiko für einen akuten Harnverhalt und für die Notwendigkeit chirurgischer Interventionen, Linderung der BPH-bedingten Symptome, verstärkten maximalen Harnfluss und ein vermindertes Prostatavolumen zeigten, lassen darauf schließen, dass Finasterid bei Männern mit vergrößerter Prostata ein Aufhalten der BPH-Progression bewirkt.
Eine erste klinische Prüfung von Finasterid (5 mg/Tag) bei Patienten mit BPH-Symptomen und durch digitale rektale Untersuchung festgestellter Prostatavergrößerung erfolgte in zwei einjährigen Plazebo-kontrollierten, randomisierten Doppelblindstudien der Phase III und in deren fünfjährigen offenen Anschlussstudien. Die zusätzlichen fünf Behandlungsjahre schlossen 234 der 536 Patienten ab, die in den Doppelblindstudien randomisiert der Behandlung mit Finasterid (5 mg/Tag) zugeordnet worden waren; die Auswertung erfolgte anhand der Daten dieser 234 Patienten. Die Zielkriterien der Wirksamkeit waren der Symptomenscore, die maximale Harnflussrate und das Prostatavolumen.
Des Weiteren wurde Finasterid 5mg in einer Long-Term Efficacy and Safety Study (PLESS), einer vierjährigen, doppelblinden, randomisierten, Plazebo-kontrollierten Multizenterstudie, geprüft. In dieser Studie wurde untersucht, welche Auswirkungen die Therapie mit Finasterid (5 mg/Tag) auf die Symptome der BPH und die BPH-bezogenen urologischen Ereignisse hat (chirurgische Intervention [z. B. transurethrale Resektion der Prostata, TURP, oder Prostatektomie] oder akuter Harnverhalt, der eine Katheterisierung erfordert). Insgesamt 3.040 Patienten (Alter 45 - 78 Jahre) mit mäßiggradigen bis schweren BPH-Symptomen und einer durch digitale rektale Untersuchung festgestellten Prostatavergrößerung wurden randomisiert der Behandlung mit Finasterid (n = 1.524) bzw. Plazebo (n =1.516) zugeführt; 3.016 Patienten waren auswertbar. Insgesamt 1.883 Patienten schlossen die vierjährige Studie ab (1.000 in der Finasterid- und 883 in der Plazebogruppe). Geprüft wurden auch die Wirkungen auf die maximale Harnflussrate und das Prostatavolumen.
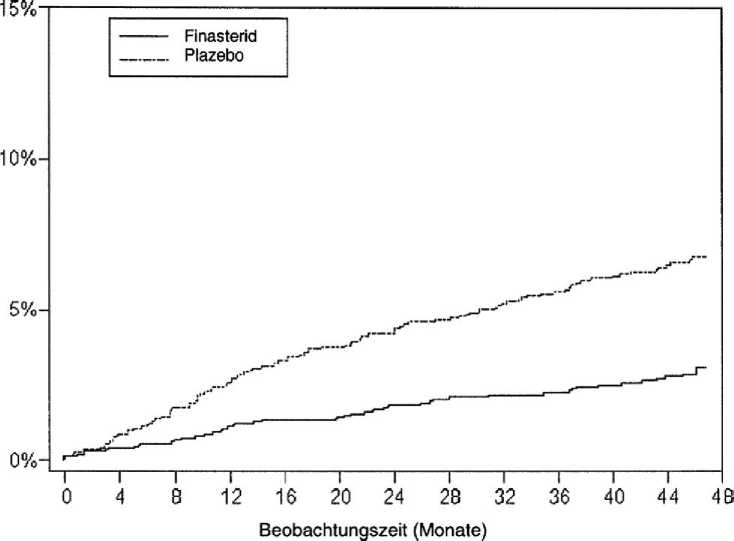
Wirkung auf akute Harnretention und die Notwendigkeit chirurgischer Interventionen In der vierjährigen PLESS-Studie wurde bei 13,2 % der Patienten unter Plazebo im Vergleich zu 6,6 % der Patienten unter Finasterid ein chirurgischer Eingriff oder eine Katheterisierung wegen eines akuten Harnverhalts erforderlich, wodurch gezeigt wurde, dass im Zeitraum von vier Jahren durch die Gabe von Finasterid 5 mg das Risiko für eine chirurgische Intervention oder akute Harnretention um insgesamt 51 % verringert wurde. Das Risiko für eine chirurgische Intervention sank unter Finasterid 5 mg um 55 % (10,1 % unter Plazebo vs. 4,6 % unter Finasterid), das Risiko für eine akute
Seite 10 von 17
Hamretention wurde um 5 7% vermindert (6,6 % unter Plazebo vs. 2,8 % unter Finasterid 5 mg). Diese Risikoverringerung war schon bei der ersten Nachuntersuchung nach vier Monaten evident und blieb während der gesamten vierjährigen Studiendauer aufrechterhalten (siehe Abb. 1 und 2). In Tabelle 1 sind die Häufigkeiten und die Risikoverringerung urologischer Ereignisse während der Studie
zusammengestellt.
Abbildung 1: Prozentsatz Patienten, bei denen ein chirurgischer Eingriff wegen BPH (einschließlich TURP) erfolgte
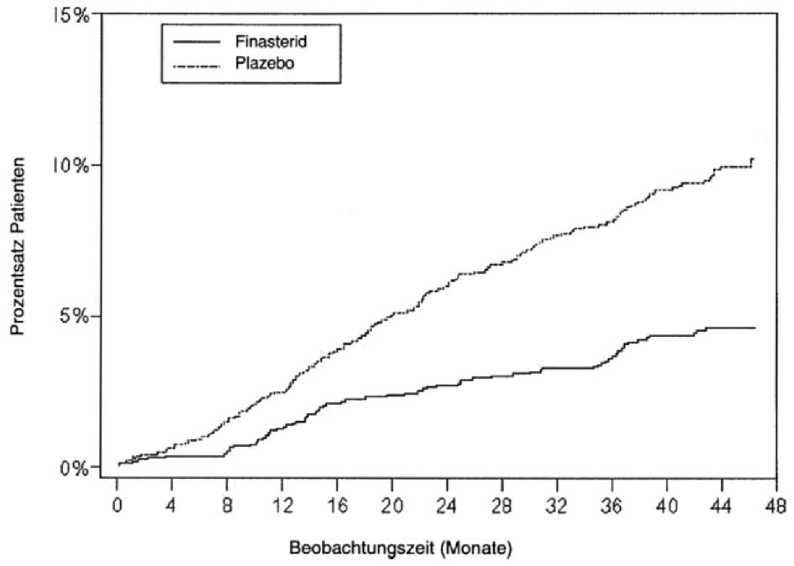
Abbildung 2: Prozentsatz Patienten, bei denen ein akuter Harnverhalt (spontan und von anderen Faktoren ausgelöst) auftrat
|
Bezeichnung |
Prosmin 5 mg Filmtabletten |
v005de |
Seite 11 von 17
Prozentsatz Patienten
Seite 12 von 17
|
Tabelle 1 Häufigkeit urologischer Ereignisse und Risikominderung durch Finasterid 5 mg im Zeitraum von vier Jahren | |||
|
Uroiogische Ereignisse |
Prozentsatz Patienten |
Risikoreduktion | |
|
Plazebo (n = 1.503) |
Fmastend 5 mg (n = 1.513) | ||
|
Chirurgische Intervention oder akute Hamretention |
13,2% |
6,6 % |
51 %* |
|
Chirurgische |
10,1 % |
4.6% |
55 %* |
|
Intervention' TURP |
8.3% |
4,2% |
49 %* |
|
Akute Hamretention |
6,6 % |
2.8% |
57 %* |
' Eingriff in Zusammenhang mit der BPH
* p < 0 , 0 0 1
Wirkung auf den Symptomenscore
In den beiden einjährigen Phase-III-Studien fand sich schon in der zweiten Woche eine Verringerung des durchschnittlichen Symptomenscores im Vergleich zum Ausgangswert. Nach sieben und nach zehn Monaten wurde in diesen Studien eine signifikante Besserung der Beschwerden im Vergleich zum Befund unter Plazebo festgestellt. In einigen Fällen kam es schon sehr früh zu einer Besserung der urologischen Symptome, in der Regel war jedoch ein Behandlungszeitraum von sechs Monaten erforderlich, um günstige Wirkungen im Sinne einer symptomatischen Besserung festzustellen. Die Besserung der BPH-Symptome blieb während des ersten Studienjahres und während der fünfjährigen Verlängerungsstudie aufrechterhalten. In der vierjährigen PLESS-Studie litten die Patienten zu Beginn unter mäßiggradigen bis schweren Symptomen (im Durchschnitt ca. 15 Punkte auf einer Skala mit 0 - 34 Punkten). Bei den Patienten, bei denen die Therapie während der gesamten Dauer der vierjährigen Studie fortgeführt wurde, besserte sich unter Finasterid 5 mg der Symptomenscore um 3,3 Punkte im Vergleich mit 1,3 Punkten (p < 0,001) unter Plazebo. Eine Besserung des Symptomenscores war bei den Patienten unter Behandlung mit Finasterid 5 mg schon im ersten Jahr festzustellen und diese Besserung setzte sich bis zum vierten Jahr fort. Bei den Patienten unter Plazebo kam es in einigen Fällen zwar zu einer Besserung des Symptomenscores während des ersten Jahres, danach jedoch erfolgte eine Verschlechterung. Die stärkste Besserung des Symptomenscores fand sich meist bei Patienten, bei denen zu Studienbeginn mäßiggradige bis schwere Symptome vorgelegen hatten.
Wirkung auf die maximale Harnflussrate
In den beiden einjährigen Phase-III-Studien fand sich schon in der zweiten Woche ein signifikanter Anstieg der maximalen Harnflussrate im Vergleich zum Ausgangswert. Im vierten und im siebten Monat dieser Studien wurde ein signifikanter Anstieg der maximalen Harnflussrate im Vergleich zum Befund unter Plazebo festgestellt. Diese Wirkung blieb während des ersten Studienjahres und während der fünfjährigen Verlängerungsstudie aufrechterhalten. In der vierjährigen PLESS-Studie fand sich ab dem vierten Monat ein deutlicher Unterschied zwischen den Behandlungsgruppen zugunsten von Finasterid im Hinblick auf die maximale Harnflussrate. Dieser Unterschied blieb während der gesamten Studie aufrechterhalten. Bei Studienbeginn betrug die durchschnittliche maximale Harnflussrate in beiden Behandlungsgruppen ca. 11 ml/sek. Bei den Patienten, bei denen die Therapie über die gesamte Studiendauer fortgeführt wurde und bei denen auswertbare Harnflussdaten vorlagen, nahm die maximale Harnflussrate unter Finasterid 5 mg um durchschnittlich
1,9 ml/sek im Vergleich zu 0,2 ml/sek unter Plazebo zu.
Wirkung auf das Prostatavolumen
In den beiden einjährigen Phase-III-Studien betrug das Prostatavolumen bei Studienbeginn im Durchschnitt 40 - 50 cm3. In beiden Studien fand sich schon bei der ersten Nachuntersuchung nach drei Monaten eine signifikante Verringerung des Prostatavolumens, sowohl im Vergleich zum Ausgangswert als auch imVergleich zu Plazebo. Diese Wirkung blieb während des ersten Studienjahres und während der fünfjährigen Verlängerungsstudie aufrechterhalten. In der vierjährigen
|
Bezeichnung |
Prosmin 5 mg Filmtabletten |
v005de |
Seite 13 von 17
PLESS-Studie wurde in einer Untergruppe von Patienten (n = 284) das Prostatavolumen in jährlichen Abständen kernspintomographisch untersucht. Bei den Patienten unter Behandlung mit Finasterid 5 mg fand sich eine Verringerung des Prostatavolumens, sowohl im Vergleich zum Ausgangswert als auch im Vergleich zu Plazebo während des gesamten vierjährigen Studienverlaufs. Bei den Patienten dieser Untergruppe, bei denen die Therapie während der gesamten Studiendauer fortgeführt wurde, senkte Finasterid das Prostatavolumen um 17,9% (von 55,9 cm3 zu Beginn auf 45,8 cm3 nach vier Jahren), während es in der Plazebogruppe zu einer Zunahme des Prostatavolumens um 14,1% kam (von 51,3 cm3 auf 58,5 cm3) (p <0,001).
Das Prostatavolumen als Prädiktor für den Therapieerfolg
Eine Metaanalyse aus sieben doppelblinden, Plazebo-kontrollierten Einjahres-Studien mit ähnlichem Studiendesign mit insgesamt 4.491 Patienten mit symptomatischer BPH zeigte, dass bei den mit Finasterid 5 mg behandelten Patienten das Ausmaß der Symptomverbesserung und der Erhöhung der maximalen Harnflussrate bei Patientenmit einer vergrößerten Prostata (ab ca. 40 cm3) größer waren.
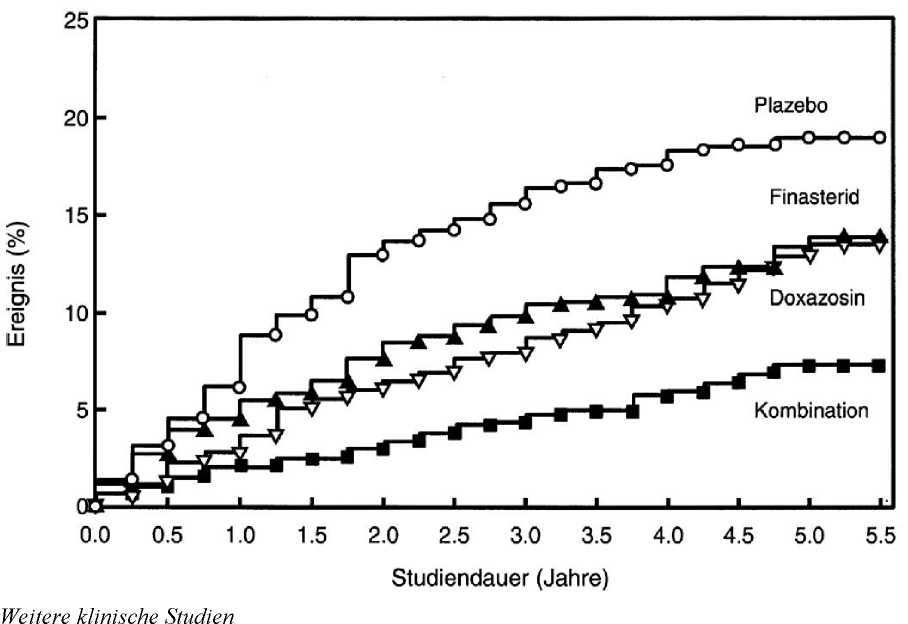
Wirkung auf die klinische Progression der BPH (Kombination mit Doxazosin)
Die Medical Therapy of Prostatic Symptoms (MTOPS) Studie war eine doppelblinde, randomisierte, Plazebo-kontrollierte Multizenterstudie über im Mittel fünf Jahre mit 3.047 Männern mit symptomatischer BPH, die randomisiert entweder Finasterid 5 mg/Tag (n= 768), Doxazosin 4 oder 8 mg/Tag (n= 756), die Kombination von Finasterid 5mg/Tag mit Doxazosin 4 oder 8 mg/Tag (n= 786), oder Plazebo (n= 737) erhielten. Die Doxazosindosis wurde wöchentlich erhöht, beginnend von 1 mg, über 2 mg, dann 4 mg bis hin zu 8 mg. Nur die Patienten, die eine Dosierung von 4 mg oder 8 mg vertrugen, verblieben in der Studie. Der primäre Endpunkt war die Zeitdauer von Randomisierung bis zur klinischen Progression der BPH, die definiert wurde als erstmaliges Auftreten von einem der folgenden Ereignisse: ein um > 4 Punkte gesicherter Anstieg im Symptomenscore, akute Harnretention, BPH-abhängige Niereninsuffizienz (Kreatininanstieg), wiederholte Infektionen der Harnwege oder Urosepsis, oder Inkontinenz. Im Vergleich zu Plazebo verringerte die Behandlung mit Finasterid, Doxazosin oder der Kombinationstherapie signifikant das Risiko einer klinischen Progression der BPH. Die Kombinationstherapie reduzierte das Risiko einer klinischen Progression der BPH in signifikant größerem Ausmaß als Finasterid oder Doxazosin allein. Letztere unterschieden sich nicht signifikant (siehe Abb. 3).
Seite 14 von 17
Abbildung 3: Kumulative Inzidenz der klinischen Progression einer BPH bei den Behandlungsgruppen
Aus einer 7-jährigen Placebo-kontrollierten Studie an 18.882 gesunden Männern (> 55 Jahre) mit normalem rektalen Tastbefund und einem PSA < 3,0 ng/ml lagen für 9.060 Männer die Daten einer Nadelbiopsie der Prostata zur Analyse vor. Dabei wurden Prostatakarzinome bei 803 Männern (18,4 %) unter Finasterid und bei 1.147 Männern (24,4 %) unter Plazebo festgestellt. In der Gruppe unter Finasterid 5 mg wurden durch die Nadelbiopsie bei 280 Männern (6,4 %) Prostatakarzinome mit einem Gleason-Score zwischen 7 - 10 entdeckt, in der Plazebo-Gruppe dagegen bei 237 Männern (5,1 %). Zusätzliche Analysen legen nahe, dass die erhöhte Prävalenz von Prostatakarzinomen mit einem schlechteren Differenzierungsgrad in der Gruppe unter Finasterid durch eine systematische Erfassungsabweichung auf Grund der Wirkung von Finasterid auf das Prostatavolumen erklärt werden kann. Ca. 98 % aller in dieser Studie diagnostizierten Fälle von Prostatakarzinomen wurden bei Diagnosestellung als intrakapsulär klassifiziert (klinisches Stadium T1 oder T2). Die klinische Bedeutung dieser Ergebnisse (Gleason 7 - 10 Daten) ist unklar. Diese Informationen könnten für Männer, die derzeit auf Grund einer BPH mit Finasterid therapiert werden, von Bedeutung sein. Finasterid 5 mg ist nicht zur Verminderung des Risikos der Entwicklung von Prostatakarzinomen indiziert.
5.2 Pharmakokinetische Eigenschaften
Nach oraler Gabe von 14C-Finasterid wurden beim Menschen von der verabreichten Dosis 39 % in Form von Metaboliten im Harn und 57 % mit den Faeces ausgeschieden. Praktisch erscheint kein unverändertes Finasterid im Harn. Es wurden bei dieser Untersuchung zwei Metaboliten identifiziert, die nur einen Bruchteil der 5a-Reduktase-Hemmaktivität von Finasterid aufweisen. Plasmaspitzenspiegel werden etwa zwei Stunden nach Einnahme erreicht. Die Resorptionsdauer beträgt 6 - 8 Stunden. Die mittlere Eliminationshalbwertszeit beträgt ca. 6 Stunden. Die PlasmaProteinbindung liegt bei etwa 93 %. Die Plasma-Clearance beträgt ca. 165 ml/min, das scheinbare Verteilungsvolumen ca. 76 Liter. In einer Studie mit wiederholten Gaben zeigte sich eine langsame
Seite 15 von 17
Kumulation geringer Mengen von Finasterid, der Talspiegel liegt bei einer täglichen Gabe von 5mg im Steady State kontinuierlich bei 8 - 10 ng/ml.
Die Elimination von Finasterid ist geringfügig erniedrigt bei älteren Patienten. Die Eliminationshalbwertszeit verlängert sich mit steigendem Alter von etwa 6 Stunden bei Männern von 18 - 60 Jahren auf ca. 8 Stunden bei Männern über 70. Da dieser Befund ohne klinische Relevanz ist, wird eine Dosisreduktion nicht erforderlich. Bei Patienten mit chronischer Niereninsuffizienz (Kreatinin-Clearance von 9 bis 55 ml/min/1,73 m2) unterschied sich die charakteristische Kinetik nach einer Einmalgabe von 14C-Finasterid nicht von derjenigen bei Probanden. Auch bei der Proteinbindung gab es keine Unterschiede.
Ein Teil der Metaboliten, der sonst über die Nieren ausgeschieden wird, erschien hier in den Faeces. Die vermehrte Ausscheidung über die Faeces kompensiert offenbar die verminderte Ausscheidung der Metaboliten über die Nieren. Eine Dosisanpassung ist bei nicht dialysepflichtigen Patienten mit einer Niereninsuffizienz nicht erforderlich. Erkenntnisse mit Finasterid bei dialysepflichtigen Patienten liegen nicht vor.
Finasterid wurde im Liquor (CSF) von Patienten nach einer 7 - 10-tägigen Behandlung nachgewiesen; es scheint sich jedoch nicht bevorzugt im Liquor anzureichern. Finasterid wurde auch in der Samenflüssigkeit von Männern nachgewiesen, die eine Dosis von 5 mg/Tag erhielten. Die Menge entsprach höchstens 1/50 bis 1/100 der Mindestdosis (5 pg), die erforderlich ist, um beim Mann den zirkulierenden DHT-Spiegel zu senken.
Bezogen auf eine intravenöse Referenzdosis beträgt die Bioverfügbarkeit etwa 80 %. Diese wird durch Nahrungsaufnahme nicht beeinträchtigt.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Toxizität nach wiederholter Gabe von Finasterid, zur Genotoxizität und Kanzerogenität ließen die präklinischen Daten keine speziellen Risiken für den Menschen erkennen.
In Reproduktionstoxizitätsstudien an männlichen Ratten kam es zu einer Gewichtsreduktion der Prostata und der Samenbläschen, einer verminderten Sekretion der akzessorischen Geschlechtsdrüsen und einem geringeren Fertilitätsindex (aufgrund der primären pharmakologischen Wirkung von Finasterid). Die klinische Bedeutung dieser Beobachtungen ist noch unklar. Wie bei anderen 5a-Reduktase-Hemmern zeigte sich nach Finasteridgabe in der Gravidität eine Feminisierung männlicher Feten bei Ratten. Eine intravenöse Gabe von Finasterid bei trächtigen Rhesusaffen in Dosen bis zu 800 ng/Tag während der gesamten embryonalen und fetalen Entwicklungsphase führte nicht zu Anomalien der männlichen Feten. Diese Dosis liegt ca. 60 - 120-mal höher als die geschätzte Menge im Samen eines Mannes, der 5 mg Finasterid eingenommen hat, und der eine Frau durch den Samen ausgesetzt sein könnte.
Die Relevanz des Modells der Rhesusaffen für die Entwicklung eines menschlichen Feten wurde dadurch bestätigt, dass 2 mg/kg/Tag Finasterid oral bei trächtigen Affen zu Anomalien bei den männlichen Feten führten (die systemische Exposition [AUC] bei Affen war etwas höher [3*] als die bei Männern unter 5 mg Finasterid oder das 1- 2-Millionenfache der geschätzten Menge Finasterid im Samen).
Unter allen Dosierungen wurden keine anderen Anomalien bei männlichen Feten und keine mit Finasterid assoziierten Anomalien bei weiblichen Feten beobachtet.
6. PHARMAZEUTISCHE ANGABEN
Seite 16 von 17
6.1 Liste der sonstigen Bestandteile
Tablettenkern Lactose-Monohydrat Mikrokristalline Cellulose vorverkleisterte Stärke (aus Mais)
Poly(O-carboxymethyl)stärke, Natriumsalz Magnesiumstearat (Ph.Eur.)
Natriumdodecylsulfat
Filmüberzug Hypromellose Mikrokristalline Cellulose Macrogolstearat (Ph.Eur.) Typ I, x=8
6.2 Inkompatibilitäten
Inkompatibilitäten sind bisher nicht bekannt.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Blisterpackungen (PVC/PVDC/Aluminium) in Faltschachteln mit: 30, 50, oder 100 Filmtabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Zerstoßene oder zerbrochene Finasterid Tabletten sollten von Frauen, die schwanger sind oder möglicherweise schwanger werden könnten, wegen der Möglichkeit einer Resorption von Finasterid und dem resultierenden potenziellen Risiko für den männlichen Fetus nicht berührt werden (siehe Abschnitt 4.6).
7. INHABER DER ZULASSUNG
APOGEPHA Arzneimittel GmbH
Kyffhäuserstraße 27
01309 Dresden
Tel.: 0351 3363-3
Fax: 0351 3363-440
8. ZULASSUNGSNUMMER 66271.00.00
|
Bezeichnung |
Prosmin 5 mg Filmtabletten |
v005de |
Seite 17 von 17
9. DATUM DER ERTEILUNG DER ZULASSUNG
16. Juli 2007
10. STAND DER INFORMATION
Januar 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig