Prothromplex Nf 600
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Prothromplex NF 600
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Prothromplex NF 600 enthält die Faktoren II, VII, IX und X des Prothrombin-Komplexes vom Menschen und ist ein Pulver zur Herstellung einer Lösung zur intravenösen Anwendung. Jede Durchstechflasche enthält nominal:
|
Gerinnungsfaktoren vom |
Pro Durchstechflasche |
Nach der Rekonstitution mit 20 ml Wasser für |
|
Menschen |
(IE.) |
Injektionszwecke (I.E./ml) |
|
Gerinnungsfaktor II |
480 - 900 |
24 - 45 |
|
Gerinnungsfaktor VII |
500 |
25 |
|
Gerinnungsfaktor IX |
600 |
30 |
|
Gerinnungsfaktor X |
600 |
30 |
Jede Durchstechflasche enthält mindestens 400 I.E. Protein C.
Darüber hinaus sind Heparin (maximal 0,5 I.E./I.E. Faktor IX) und Antithrombin III (0,25 - 1,5 I.E./ml) enthalten.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Die Gesamtmenge pro Durchstechflasche beträgt 300 - 750 mg. Die spezifische Aktivität des Produktes liegt bei mindestens 0,6 I.E./mg, bezogen auf die Faktor IX-Aktivität.
Die Faktor IX-Aktivität (I.E.) wird, wie in der Europäischen Pharmakopoe beschrieben, mittels Einstufen-Test bestimmt und gegen den Internationalen Standard für Faktor IX-Konzentrate der Welt-GesundheitsOrganisation (WHO) gemessen.
Die Aktivitäten (I.E.) des Faktor II, des Faktor VII und des Faktor X werden, wie in der Europäischen Pharmakopoe beschrieben, mittels chromogenem Substrat bestimmt und gegen den Internationalen Standard für Faktor II-, Faktor VII- und Faktor X-Konzentrate der Welt-Gesundheits-Organisation (WHO) gemessen.
Die Protein C-Aktivität wird mittels chromogenem Substrat bestimmt und gegen den Internationalen Standard der WHO für Protein C-Konzentrate gemessen.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
Weißes oder leicht gefärbtes Pulver oder Pellet. Nach der Rekonstitution weist die Lösung einen pH zwischen
6,5 und 7,5 und eine Osmolalität von mindestens 240 mosm/kg auf.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- Behandlung von Blutungen und perioperative Blutungsprophylaxe bei erworbenem Mangel der Gerinnungsfaktoren des Prothrombinkomplexes, wenn eine schnelle Korrektur des Mangels erforderlich ist, wie z. B. bei einem durch die Behandlung mit Vitamin K-Antagonisten verursachten Mangelzustand oder bei einer Überdosierung mit Vitamin K-Antagonisten.
- Behandlung von Blutungen und perioperative Blutungsprophylaxe bei angeborenem Mangel eines der Vitamin K-abhängigen Gerinnungsfaktoren, wenn hochgereinigte, spezifische Einzelfaktorenkonzentrate nicht zur Verfügung stehen.
4.2 Dosierung und Art der Anwendung Dosierung
Nachstehend werden nur allgemeine Dosierungsrichtlinien gegeben. Die Behandlung sollte unter der Überwachung eines Arztes erfolgen, der in der Behandlung von Gerinnungsstörungen erfahren ist. Dosierung und Dauer der Substitutionsbehandlung hängen von der Schwere der Störung, der Art und dem Ausmaß der Blutung und vom klinischen Zustand des Patienten ab.
Häufigkeit und Menge der Verabreichung sollten individuell für jeden Patienten berechnet werden. Die Dosierungsintervalle müssen den unterschiedlichen Halbwertszeiten der verschiedenen Gerinnungsfaktoren des Prothrombinkomplexes angepasst werden (siehe Abschnitt 5.2).
Die individuellen Dosierungsanforderungen können nur auf der Basis von regelmäßigen Bestimmungen der individuellen Plasmaspiegel der relevanten Gerinnungsfaktoren oder auf der Basis von Globaltests des Prothrombinkomplexes (z. B. Quick-Wert, INR-Thrombinzeit) festgelegt werden. Weiterhin hängt die individuelle Dosierung von der kontinuierlichen Überwachung des klinischen Zustandes des Patienten ab.
Im Falle eines größeren, chirurgischen Eingriffs ist eine genaue Überwachung der Substitutionstherapie durch Gerinnungsanalysen (Tests auf spezifische Gerinnungsfaktoren und/oder Globaltests der Prothrombinkomplex-Spiegel) erforderlich.
Blutung und perioperative Blutungsprophylaxe während einer Behandlung mit Vitamin KAntagonisten:
Bei einer schweren Blutung oder vor Operationen mit hohem Blutungsrisiko sollten normale Werte (QuickWert = 100 %, INR = 1,0) angestrebt werden.
Es gilt die folgende Grundregel: 1 I.E./kg Körpergewicht erhöht den Quick-Wert um 1 %.
Die durch das Prothrombinkomplex-Konzentrat innerhalb kurzer Zeit erreichte Umkehr der durch den Vitamin-K-Antagonisten hervorgerufenen Verminderung der Blutgerinnung hält 6 - 8 Stunden an. Die gleichzeitige Verabreichung von Vitamin K mit dem Prothrombinkomplex-Konzentrat (siehe Abschnitt 6.2 Inkompatibilitäten) sollte immer in Erwägung gezogen werden, da durch Vitamin K die Normalisierung der Synthese der Vitamin K-abhängigen Gerinnungsfaktoren nach 4 - 6 h erreicht wird. Bei gleichzeitiger Gabe von Vitamin K ist eine wiederholte Behandlung mit Prothrombinkomplex-Konzentrat normalerweise nicht erforderlich.
Da diese Empfehlungen auf empirischen Daten beruhen und Wiederfindungsrate (Recovery) und Wirkungsdauer variieren können, ist eine kontinuierliche Überwachung des INR bzw. des Quick-Wertes erforderlich.
Blutung und perioperative Blutungsprophylaxe bei angeborenem Mangel an Vitamin K-abhängigen Gerinnungsfaktoren, wenn keine spezifischen Gerinnungsfaktoren-Konzentrate verfügbar sind:
Die für die Behandlung erforderliche Dosierungsberechnung basiert auf der klinischen Erfahrung, dass 1 I.E. an Faktor VII oder Faktor IX pro kg Körpergewicht die Aktivität des Faktor VII bzw. IX im Plasma um
ungefähr 0,019 I.E./ml bzw. um ungefähr 0,09 I.E./ml erhöhen. Eine I.E. an Faktor II bzw. Faktor X pro kg Körpergewicht erhöhen die Aktivität des Faktor II bzw. Faktor X im Plasma um 0,02 I.E./ml bzw. um 0,017 I.E./ml.
Die Dosis an spezifisch verabreichtem Faktor wird in Internationalen Einheiten (I.E.) angegeben, was sich auf den jüngsten WHO-Standard für jeden Faktor bezieht. Die Plasma-Aktivität eines spezifischen Gerinnungsfaktors wird entweder in Prozent (bezogen auf Normalplasma) oder in Internationalen Einheiten (bezogen auf den Internationalen Standard für diesen spezifischen Faktor) angegeben.
Eine Internationale Einheit (I.E.) einer Gerinnungsfaktor-Aktivität entspricht der Menge in 1 ml normalem, menschlichem Plasma.
Beispielsweise basiert die Berechnung der erforderlichen Faktor X-Dosis auf der klinischen Erfahrung, dass eine Internationale Einheit (I.E.) an Faktor X pro kg Körpergewicht den Plasmaspiegel um 0,017 I.E./ml erhöht. Die entsprechende Dosierung wird mittels folgender Formel errechnet:
Erforderliche Einheiten = Körpergewicht (kg) x erwünschter Faktorenanstieg (I.E./ml) x 60
wobei 60 (ml/kg) der reziproke Wert der geschätzten Recovery ist.
Wenn eine individuelle Recovery bekannt ist, sollte dieser Wert für die Berechnung herangezogen werden. Kinder und Jugendliche
Es liegen keine Studien zur Unbedenklichkeit und Wirksamkeit von Prothromplex NF 600 bei Kindern im Alter von bis zu 12 Jahren vor. Eine Dosierungsempfehlung für Kinder kann daher nicht gegeben werden.
Art der Anwendung
Das Produkt ist für die intravenöse Anwendung bestimmt. Die empfohlene Infusionsgeschwindigkeit sollte 2 ml pro Minute (60 I.E./Min.) nicht übersteigen.
Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Bekannte Allergie gegen Heparin oder eine aus der Vorgeschichte bekannte heparin-induzierte Thrombozytopenie (Typ II).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Es sollte ein Spezialist mit Erfahrung in der Behandlung von Gerinnungsstörungen zu Rate gezogen werden.
Wenn der Patient einen erworbenen Mangel an Gerinnungsfaktoren des Prothrombinkomplexes aufweist (z. B. durch eine Behandlung mit Vitamin K-Antagonisten) sollte Prothromplex NF 600 nur dann eingesetzt werden, wenn eine rasche Korrektur des Prothrombinkomplex-Spiegels erforderlich ist, wie z. B. bei starken Blutungen oder Notoperationen. In anderen Fällen ist normalerweise die Reduktion des Vitamin K-Antagonisten und/oder die Verabreichung von Vitamin K ausreichend.
Patienten, die Vitamin K-Antagonisten erhalten, haben möglicherweise vor der Behandlung einen Zustand der Hyperkoagulabilität aufgewiesen, und die Infusion von humanem Prothrombinkomplex könnte diesen Zustand wieder hervorrufen.
Sofern verfügbar, sollten bei einem Mangel der einzelnen Vitamin K-abhängigen Gerinnungsfaktoren spezifische Gerinnungsfaktoren verabreicht werden.
Wenn allergische oder anaphylaktische Reaktionen auftreten, muss die Injektion sofort abgebrochen werden. Bei einem Schock müssen die medizinischen Standardmaßnahmen für eine Schockbehandlung durchgeführt werden.
Standardmaßnahmen zur Vorbeugung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut oder Blutplasma hergestellt sind, schließen die Auswahl der Spender und das Screening der einzelnen Blutspenden und Plasmapools auf spezifische Infektionsmarker, sowie effektive Schritte zur Inaktivierung/Eliminierung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene.
Die getroffenen Maßnahmen werden als wirksam erachtet für umhüllte Viren wie das Immunschwächevirus (HIV), das Hepatitis B-Virus (HBV) und Hepatitis C-Virus (HCV), und für das nicht-umhüllte Hepatitis A-Virus (HAV). Für nicht-umhüllte Viren wie Parvovirus B19 können diese Maßnahmen möglicherweise nur begrenzt wirksam sein. Parvovirus B19-Infektionen können schwerwiegende Folgen für Schwangere (Infektion des Fötus) und für Menschen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z. B. hämolytische Anämie) haben.
Für Patienten, die regelmäßig/wiederholt aus Blutplasma hergestellte Produkte erhalten, sollte ein geeigneter Impfschutz (Hepatitis A und B) in Betracht gezogen werden.
Es wird dringend empfohlen, bei jeder Verabreichung von Prothromplex NF 600 den Namen sowie die Chargenbezeichnung des Produkts mit Hilfe des beigefügten selbstklebenden Etiketts zu dokumentieren, damit eine Verbindung zwischen dem Patienten und der angewendeten Charge hergestellt werden kann.
Bei der Behandlung von Patienten mit angeborenen oder erworbenen Gerinnungsstörungen besteht, besonders im Wiederholungsfall, das Risiko einer Thrombose und einer Verbrauchskoagulopathie (DIC), wenn sie mit Prothrombinkomplex-Konzentraten, wie Prothromplex NF 600, behandelt werden.
Das Risiko kann bei der Behandlung eines isolierten Faktor VII-Mangels weiter erhöht sein, da dabei die anderen Vitamin K-abhängigen Gerinnungsfaktoren mit längeren Halbwertszeiten akkumulieren können, was zu beträchtlich erhöhten Normalwerten führen kann.
Patienten, die mit Prothrombinkomplex-Konzentraten vom Menschen behandelt werden, sollten engmaschig auf Anzeichen und Symptome einer intravasalen Gerinnung oder Thrombose überwacht werden. Wegen des Risikos von thrombotischen Komplikationen sollten während der Behandlung mit ProthrombinkomplexKonzentraten vom Menschen besonders
• Patienten mit einer Vorgeschichte einer koronaren Herzerkrankung
• Patienten mit Lebererkrankungen
• prä- oder postoperative Patienten
• Neugeborene
• Patienten mit Thromboserisiken oder mit Verbrauchskoagulopathie
sorgfältig überwacht werden. Bei jeder der genannten Situationen sollte der Nutzen der Behandlung gegen das Komplikationsrisiko abgewogen werden.
Es liegen keine Daten zum Gebrauch von Prothromplex NF 600 im Fall perinataler Blutungen aufgrund eines Vitamin K-Mangels bei Neugeborenen vor.
Prothromplex NF 600 enthält ca. 80 mg Natrium (kalkuliert) pro Durchstechflasche. Dies sollte bei Patienten, die auf eine natriumarme Ernährung achten müssen, berücksichtigt werden.
Nach der Anwendung hoher Dosen von humanem Prothrombinkomplex ist bei der Durchführung
heparinempfindlicher Gerinnungsanalysen das mit dem Präparat zugeführte Heparin zu berücksichtigen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Produkte mit Prothrombinkomplex vom Menschen reduzieren die Wirkung von Vitamin K-Antagonisten, jedoch wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Die Auswirkungen von Prothromplex NF 600 auf die Fertilität wurden nicht in kontrollierten, klinischen Studien untersucht.
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Prothromplex NF 600 bei schwangeren und stillenden Frauen vor. Der Arzt sollte vor Anwendung von Prothromplex NF 600 eine sorgfältige Abwägung des möglichen Risikos und des Nutzens für jede einzelne Patientin vornehmen.
Tierversuche sind nicht aussagekräftig hinsichtlich der Sicherheit in der Schwangerschaft, der embryonalen/fötalen Entwicklung, der Geburt oder der postnatalen Entwicklung. Daher sollten Prothrombinkomplex-Konzentrate vom Menschen während der Schwangerschaft und Stillzeit nur bei strenger Indikation verabreicht werden.
Zum Risiko einer Infektion mit Parvovirus B19 während der Schwangerschaft siehe Abschnitt 4.4.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es liegen keine Informationen über die Auswirkungen von Prothromplex NF 600 über die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen vor.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die im Folgenden aufgelisteten Nebenwirkungen basieren auf der Erfahrung in der Anwendung dieses Produkttyps: Angioödem, Reaktionen an der Injektionsstelle, Lethargie, Parästhesie, Unruhe.
Wie bei allen Plasmaderivaten können Überempfindlichkeitsreaktionen (wie Fieber, Nesselsucht, Übelkeit, Erbrechen, Atemnot, Blutdruckabfall und möglicherweise anaphylaktischer Schock) auftreten.
Eine Substitutionstherapie mit Prothrombinkomplex-Konzentraten kann zur Bildung von zirkulierenden Antikörpern gegen einen oder mehrere der Gerinnungsfaktoren führen. Das Auftreten solcher Inhibitoren zeigt sich als unzureichende klinische Wirksamkeit von Prothrombinkomplex-Konzentraten.
Es besteht das Risiko von thromboembolischen Ereignissen nach der Verabreichung von humanen Prothrombinkomplex-Konzentraten (siehe Abschnitt 4.4).
Zur Sicherheit vor übertragbaren Erregern siehe Abschnitt 4.4.
Tabellarische Übersicht über die Nebenwirkungen
Die in der Tabelle aufgeführten Nebenwirkungen beruhen auf Berichten aus einer klinischen Studie, in der Prothromplex NF 600 bei Patienten (n = 61) mit erworbenem Mangel an Gerinnungsfaktoren des Prothrombinkomplexes (Faktor II, VII, IX, X) zur Aufhebung der Wirkung von oralen Antikoagulanzien angewendet wurde, sowie auf den Erfahrungen aus der Pharmakovigilanz nach Markteinführung des
Arzneimittels. Sie sind nach MedDRA-Systemorganklassen (SOC), bevorzugtem Terminus und, soweit möglich, nach Schweregrad sortiert.
Die Häufigkeiten werden gemäß MedDRA folgendermaßen definiert:
Sehr häufig (>1/10), Häufig (>1/100, <1/10), Gelegentlich (>1/1.000, <1/100), Selten (>1/10.000, <1/1.000), Sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Systemorganklassen gemäß MedDRA-Datenbank |
Nebenwirkung |
Häufigkeit |
|
Erkrankungen des Blutes und des Lymphsystems |
Disseminierte intravasale Gerinnung Inhibitoren gegen einen oder mehreren Faktoren des Prothrombinkomplexes (Faktor II, VII, IX, X)* |
Häufig |
|
Erkrankungen des Immunsystems |
Anaphylaktischer Schock Anaphylaktische Reaktion Überempfindlichkeit |
Häufig |
|
Erkrankungen des Nervensystems |
Hirnschlag Kopfschmerzen |
Häufig |
|
Herzerkrankungen |
Herzversagen Akuter Myokardinfarkt Tachykardie |
Nicht bekannt Häufig Häufig |
|
Gefäßerkrankungen |
Arterielle Thrombose Venöse Thrombose Hypotonie Flush Thrombophlebitis |
Häufig Häufig Häufig Häufig Nicht bekannt |
|
Erkrankungen der Atemwege, des Brustraumes und Mediastinums |
Lungenembolie Atemnot Keuchen |
Häufig |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit Erbrechen |
Häufig |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Nesselsucht Erythematöser Hautausschlag Juckreiz |
Häufig |
|
Erkrankungen der Nieren und Harnwege |
Nephrotisches Syndrom |
Nicht bekannt |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Fieber |
Häufig |
* Bei Patienten mit angeborenem Mangel an Gerinnungsfaktoren
4.9 Überdosierung
Der Einsatz von Produkten mit Prothrombinkomplex vom Menschen kann manchmal mit Herzinfarkt, disseminierter intravasaler Gerinnung, venösen Thrombosen und Lungenembolie verbunden sein. Daher besteht bei Überdosierung ein gesteigertes Risiko für die Entwicklung von thromboembolischen Komplikationen oder für eine Verbrauchskoagulopathie.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihämorrhagika, Kombination der Gerinnungsfaktoren II, VII, IX und X, ATC-Code: B02BD01.
Die Gerinnungsfaktoren II, VII, IX und X werden in der Leber synthetisiert und benötigen Vitamin K. Sie sind als Prothrombinkomplex bekannt.
Faktor VII ist das Zymogen der aktiven Serinprotease Faktor VIIa, durch die der intrinsische Gerinnungsweg gestartet wird. Der Gewebefaktor VIIa-Komplex aktiviert die Gerinnungsfaktoren X und IX, wodurch die Faktoren Xa und IXa entstehen. Durch weitere Aktivierung der Gerinnungskaskade wird Prothrombin (Gerinnungsfaktor II) aktiviert und in Thrombin umgewandelt. Durch Thrombin wird Fibrinogen in Fibrin umgewandelt, wodurch die Gerinnselbildung stattfindet. Die Bildung von Thrombin ist als Teil der primären Hämostase ebenso zur normalen Plättchenfunktion erforderlich.
Isolierter, schwerer Faktor VII-Mangel führt zur reduzierten Thrombinbildung und zur Blutungsneigung durch eine verschlechterte Fibrinbildung und eine geringere, primäre Hämostase. Isolierter Faktor IX-Mangel ist eine der klassischen Hämophilien (Hämophilie B). Isolierter Mangel an Faktor II oder Faktor X tritt sehr selten auf, kann aber in schweren Fällen eine Blutungsneigung zeigen, die der klassischen Hämophilie ähnelt.
Ein erworbener Mangel der Vitamin K-abhängigen Gerinnungsfaktoren des Prothrombinkomplexes tritt während der Behandlung mit Vitamin K-Antagonisten auf und zeigt sich im Falle von schweren Blutungsneigungen eher als charakteristische, retroperitoneale oder zerebrale Blutungen als Muskel- oder Gelenkblutungen. Eine schwere, hepatische Insuffizienz zeigt sich ebenfalls als deutliche Reduktion der Prothrombinkomplex-Spiegel und klinisch als Blutungsneigung. Diese ist jedoch häufig komplex wegen der gleichzeitig fortschreitenden, niedrig-gradigen, intravasalen Gerinnung, der niedrigen Plättchenzahl, wegen dem Mangel an Gerinnungsinhibitoren und wegen der gestörten Fibrinolyse.
Die Verabreichung von humanen Prothrombinkomplex-Konzentraten verursacht einen Anstieg der Plasmaspiegel der Vitamin K-abhängigen Gerinnungsfaktoren und kann zeitweilig eine Gerinnungsstörung des Patienten aufgrund des Mangels an verschiedenen dieser Faktoren ausgleichen.
5.2 Pharmakokinetische Eigenschaften
Halbwertszeit 40 - 60 Stunden 3 - 5 Stunden 16 - 30 Stunden 30 - 60 Stunden
Gerinnungsfaktoren Faktor II Faktor VII Faktor IX Faktor X
5.3 Präklinische Daten zur Sicherheit
Die Faktoren des Prothrombinkomplexes vom Menschen (in einem Konzentrat) sind normale Bestandteile des menschlichen Plasmas und wirken in derselben Weise wie endogene Gerinnungsfaktoren.
In höheren Dosen führen sie zur Volumenüberlastung. Die Verabreichung einer einzelnen Gabe im Tiermodell ergab keine Hinweise auf ein bedenkliches toxikologisches Potential für die Anwendung am Menschen.
Wiederholte Verabreichungen von humanen Proteinen sind in Tierversuchen nicht sinnvoll durchführbar, da sich Antikörper gegen heterologe Proteine entwickeln können. Deshalb sind keine Studien zur Mutagenität, Reproduktionstoxizität oder Kanzerogenität durchgeführt worden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Pulver:
Natriumchlorid Natriumzitrat Heparin-Natrium Antithrombin III
Lösungsmittel:
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Prothromplex NF 600 darf nicht mit anderen Arzneimitteln oder Lösungen gemischt werden, außer mit dem beigepackten Wasser für Injektionszwecke.
Nur das beigepackte Injektions-/Infusionsset verwenden.
6.3 Dauer der Haltbarkeit
3 Jahre
Die chemische und physikalische Stabilität der rekonstituierten Lösung ist bei +20 °C bis +25 °C über 3 Stunden belegt.
Aus mikrobiologischer Sicht sollte Prothromplex NF 600 jedoch unmittelbar nach der Rekonstitution verwendet werden, es sei denn, die Rekonstitution erfolgt unter validierten aseptischen Bedingungen und eine mikrobiologische Kontamination ist damit ausgeschlossen. Wird die rekonstituierte Lösung nicht sofort verwendet, ist der Anwender für die Lagerungsbedingungen und die Lagerungszeit verantwortlich. Die rekonstituierte Lösung darf nicht wieder in den Kühlschrank gestellt werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank bei 2 °C - 8 °C aufbewahren.
In der Originalpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Innerhalb der angegebenen Laufzeit darf das Produkt einmal bis zu maximal 6 Monaten bei Raumtemperatur (nicht über 25 °C) aufbewahrt werden. Der Beginn der Raumtemperaturlagerung sollte auf dem Umkarton vermerkt werden. Nach der Lagerung bei Raumtemperatur muss Prothromplex NF 600 sofort verbraucht oder verworfen werden. Es darf nicht wieder in den Kühlschrank verbracht werden.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt 6.3.
6.5 Art und Inhalt der Behältnisse
Das Pulver ist in Durchstechflaschen aus Glas Typ II mit Gummistopfen abgefüllt. Das Lösungsmittel befindet sich in Durchstechflaschen aus Glas Typ I mit Gummistopfen.
1 Durchstechflasche mit Prothromplex NF 600-Pulver zur Herstellung einer Injektionslösung 1 Durchstechflasche mit 20 ml Wasser für Injektionszwecke 1 Transfernadel
1 Filtemadel 1 Einmalnadel 1 Belüftungsnadel 1 Infusionsset
Packungsgröße 1 x 600 I.E.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Zur Rekonstitution nur das beigepackte Verabreichungsset benutzen.
Prothromplex NF 600 erst unmittelbar vor der Verabreichung rekonstituieren.
Die Zubereitung enthält keine Konservierungsstoffe, ist farblos oder leicht gelblich und klar oder leicht
opaleszent und praktisch frei von sichtbaren Partikeln.
Die gebrauchsfertige Lösung vor der Verabreichung visuell auf Partikel und Trübungen überprüfen. Lösungen,
die trüb sind oder Niederschläge aufweisen, nicht verwenden.
Rekonstitution des Pulvers zur Herstellung einer Injektionslösung
1. Das Lösungsmittel (Wasser für Injektionszwecke) in der ungeöffneten Durchstechflasche auf Raumtemperatur erwärmen (auf höchstens 37 °C).
2. Schutzkappen von den Durchstechflaschen mit Konzentrat und Lösungsmittel entfernen (Abb. A) und die Gummistopfen beider Flaschen desinfizieren.
3. Den Schutz der beigepackten Transfernadel durch Drehen abziehen und die freigelegte Nadel senkrecht in die Mitte des Gummistopfens der Lösungsmittelflasche einstechen (Abb. B und C).
4. Kunststoffkappe vom anderen Ende der Transfernadel abziehen. Freies Nadelende nicht berühren!
5. Die Lösungsmittelflasche kopfüber über die Konzentratflasche halten und das Ende der Transfernadel durch den Gummistopfen der Pulverflasche stechen (Abb. D). Durch das entstehende Vakuum wird das Lösungsmittel angesaugt.
6. Lösungsmittelflasche samt Nadel von der Konzentratflasche abziehen (Abb. E). Lösungsvorgang durch Schwenken der Pulverflasche beschleunigen.
7. Ist das Pulver aufgelöst, die mitgelieferte Belüftungsnadel (Abb. F) einführen, so dass eventuell vorhandener Schaum zusammenfallt. Anschließend die Belüftungsnadel wieder entfernen.
Injektion/Infusion
Aseptische Technik anwenden!
1. Die Schutzkappe der beiliegenden Filtemadel durch Drehen und Ziehen entfernen und die Nadel auf eine Einmalspritze setzen. Die Lösung in die Spritze aufziehen (Abb. G).
2. Die Filtemadel von der Spritze trennen und die Lösung mit Hilfe des mitgelieferten Infusionssets langsam intravenös applizieren.
Wenn Prothromplex NF 600 als Infusion verabreicht wird, nur das beigepackte Infusionsset verwenden.
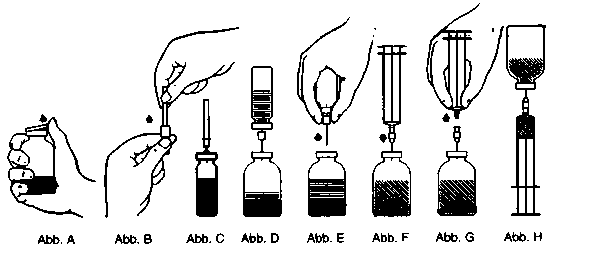
Nach der Verabreichung alle unversiegelten Nadeln zusammen mit den Spritzen und/oder dem Infusionsset in der Produktschachtel entsorgen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Baxter Deutschland GmbH
Edisonstraße 4
85716 Unterschleißheim
Telefon: 089/31701-0
Fax:089/31701-177
E-Mail: info_de@baxter.com
8. ZULASSUNGSNUMMER
10584a/95
9. DATUM DER ERTEILUNG DER ZULASSUNG/ VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 20. Juni 1995 Datum der Verlängerung der Zulassung: 2. Juni 2005
10. STAND DER INFORMATION
April 2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
12. HERKUNFTSLAND DES PLASMAS
Deutschland, Finnland, Norwegen, Österreich, Schweden, Schweiz, Tschechien und Vereinigte Staaten von Amerika.
13. SONSTIGE HINWEISE
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Seite 10/10