Resochin Junior Tabletten 81 Mg
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Resochin Tabletten 250 mg Resochin junior Tabletten 81 mg
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Chloroquinphosphat Resochin Tabletten
1 Filmtablette enthält 250 mg Chloroquinphosphat (entsprechend 155 mg Chloroquin).
Resochin junior Tabletten
1 Filmtablette enthält 81 mg Chloroquinphosphat (entsprechend 50 mg Chloroquin).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Resochin Tabletten
Weiße, runde, konvexe Filmtablette, mit Kreuzbruchrille auf der einen Seite und Bayer Kreuz auf der anderen Seite
Resochin junior Tabletten Weiße, runde Filmtablette
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Resochin Tabletten:
- Therapie und Prophylaxe der Malaria.
Resochin wirkt bei allen vier menschenpathogenen Malariaerregern mit Ausnahme
Chloroquin-resistenter Stämme. Es ist auf die geographisch unterschiedliche
Resistenzhäufigkeit zu achten.
- Chronische Polyarthritis (rheumatoide Arthritis) einschließlich juveniler chronischer Arthritis.
- Systemischer Lupus erythematodes.
Resochin junior Tabletten:
- Therapie und Prophylaxe der Malaria.
Malariaerregern mit Ausnahme geographisch unterschiedliche
Resochin wirkt bei allen vier menschenpathogenen
Chloroquin-resistenter Stämme. Es ist auf die
Resistenzhäufigkeit zu achten.
- Chronische Polyarthritis (rheumatoide Arthritis) einschließlich juveniler chronischer Arthritis.
4.2 Dosierung, Art und Dauer der Anwendung
Malaria-Prophylaxe:
|
Dosierung |
Dauer der Anwendung | |
|
Erwachsene |
Kinder | |
|
500 mg Chloroquinphosphat (310 mg Chloroquin) oral, einmal wöchentlich. |
8,1 mg pro kg Körpergewicht Chloroquinphosphat (5 mg/kg Chloroquin) oral, einmal wöchentlich, die Maximaldosis ist 500 mg Chloroquinphosphat (310 mg Chloroquin). |
Beginn der Einnahme 1 bis 2 Wochen vor der Reise in Malariagebiete. Einnahme wöchentlich jeweils am selben Tag der Woche während des Aufenthalts in Malariagebieten und für 4 Wochen nach Verlassen dieser Gebiete. |
Erwachsene:
Gemäß den WHO Richtlinien können kumulative Gesamtdosierungen von 1 g Chloroquin pro Kilogramm Körpergewicht oder 50-100 g Gesamtdosis zu einer Schädigung der Retina führen. Deshalb sollte eine kumulative Gesamtdosis von 50 g Chloroquin nicht überschritten werden.
Dosierungstabelle für Kinder (Malariaprophylaxe):
|
Resochin junior Tabletten | |
|
Körpergewicht (kg) |
wöchentliche Dosis (Anzahl Filmtabletten) |
|
3-5 |
/ |
|
>5-10 |
1 |
|
>10-15 |
1/ |
|
>15-20 |
2 |
|
>20-25 |
2/ |
|
>25-30 |
3 |
|
>30-35 |
3/ |
|
>35-50 |
5 |
In bestimmten Malariagebieten ist für Kurzaufenthalte die doppelte wöchentliche Gesamtdosis zu empfehlen. Die Einnahme der Tabletten sollte dabei gleichmäßig über die Woche verteilt werden.
Malaria-Therapie:
Kinder und Erwachsene erhalten pro Kilogramm Körpergewicht 16 mg Chloroquinphosphat (10 mg Chloroquin) und nach 6 Stunden weitere 8 mg Chloroquinphosphat (5 mg Chloroquin). Danach werden täglich 8 mg Chloroquinphosphat (5 mg Chloroquin) für die nächsten 2 bis 3 Tage gegeben.
Die Gesamtdosis beträgt 40 bis 50 mg Chloroquinphosphat (25 bis 30 mg Chloroquin) pro Kilogramm Körpergewicht.
Dosierungstabellen (Malariatherapie):
|
Resochin Tabletten | |||
|
Körpergewicht (kg) |
1. Tag 1. Dosis (Anzahl Filmtabletten) |
1. Tag 2. Dosis [6 h später] (Anzahl Filmtabletten) |
Taeesdosis für weitere 2 bis 3 Tage (Anzahl Filmtabletten) |
|
16 |
1 |
/ |
/ |
|
31 |
2 |
1 |
1 |
|
47 |
3 |
1/ |
1/ |
|
63 |
4 |
2 |
2 |
|
78 |
5 |
2/ |
2/ |
|
94 |
6 |
3 |
3 |
|
Resochin junior Tabletten | |||
|
Körpergewicht (kg) |
1. Tag 1. Dosis (Anzahl Filmtabletten) |
1. Tag 2. Dosis [6 h später] (Anzahl Filmtabletten) |
Taeesdosis für weitere 2 bis 3 Tage (Anzahl Filmtabletten) |
|
4-5 |
1 |
/ |
/ |
|
>5-7 |
1/ |
1 |
1 |
|
>7-10 |
2 |
1 |
1 |
|
>10-12 |
2/ |
1/ |
1/ |
|
>12-15 |
3 |
1/ |
1/ |
|
>15-20 |
4 |
2 |
2 |
|
>20-25 |
5 |
2/ |
2/ |
|
>25-30 |
6 |
3 |
3 |
|
>30-35 |
7 |
3/ |
3/ |
|
>35-40 |
8 |
4 |
4 |
|
>40-45 |
9 |
4/ |
4/ |
Therapie von chronischer Polyarthritis (rheumatoide Arthritis) und systemischem Lupus erythematodes:
Die Dosierung wird individuell festgelegt und ggf. nach Verträglichkeit und Wirkung im Laufe der Therapie angepasst. Eine typische Einstiegsdosis beim Erwachsenen ist 250 mg Chloroquinphosphat (entsprechend 155 mg Chloroquin) einmal täglich.
Wegen der Gefahr einer Retinopathie bei Dauertherapie sollte bei Erwachsenen und Kindern täglich nicht mehr als 4 mg Chloroquinphosphat (entsprechend 2,5 mg Chloroquin) pro Kilogramm Körpergewicht gegeben werden.
Der Erfolg der Behandlung kann frühestens nach 4 bis 12 Wochen beurteilt werden. Die Behandlung ist abzubrechen, wenn nach 6 Monaten keine Besserung eingetreten ist.
Erwachsene:
Gemäß den WHO Richtlinien können kumulative Gesamtdosierungen von 1 g Chloroquin pro Kilogramm Körpergewicht oder 50-100 g Gesamtdosis zu einer Schädigung der Retina führen. Deshalb sollte eine kumulative Gesamtdosis 50 g Chloroquin nicht überschritten werden.
Unter Berücksichtigung dieser kumulativen Gesamtdosis kann die Gesamtdauer der Anwendung entsprechend des Körpergewichts des Patienten und der individuellen Dosis variieren. Es wird empfohlen, bei der Erstverschreibung die Gesamtdauer der Anwendung für den Patienten zu berechnen, und sicherzustellen, dass die Anwendungsdauer bei jeder Änderung der Verschreibungsparameter neu berechnet und dem Patienten mitgeteilt wird. Es ist darauf zu achten, dass die Gesamtdauer der Anwendung nicht überschritten wird.
Hinweis:
Patienten mit eingeschränkter Nieren- oder Leberfunktion bedürfen ggf. einer Dosisanpassung (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Die Filmtabletten sind unzerkaut mit ausreichend Flüssigkeit einzunehmen.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen Chloroquinphosphat, einen der sonstigen Bestandteile oder 4-Aminochinoline,
- Retinopathie und Gesichtsfeldeinschränkungen,
- Erkrankungen des blutbildenden Systems,
- Glukose-6-Phosphat-Dehydrogenase-Mangel (hämolytische Anämie, Favismus),
- Myasthenia gravis, sowie
- Schwangerschaft und Stillzeit (siehe Abschnitt 4.6 Schwangerschaft und Stillzeit).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Retinopathie
Vor Beginn einer längerfristigen oralen Therapie muss eine augenärztliche Untersuchung durchgeführt werden, die in 3-Monats-Abständen zu wiederholen ist, solange die Therapie fortgeführt wird. Bei den ersten Anzeichen einer Retinopathie (Ausfall des Rotsehens) ist die Behandlung abzubrechen.
Irreversible Sehstörungen bedingt durch eine Resochin induzierte Retinopathie sind bei Dauertherapie mit hohen Dosierungen gut dokumentiert. Für Patienten, die eine Langzeittherapie mit Resochin erhalten, werden Netzhautuntersuchungen empfohlen. Kumulierte Gesamtdosen von 1 g pro kg Körpergewicht Chloroquin oder von 50 bis 100 g Gesamtdosis sind mit dem Vorkommen von Netzhautschäden assoziiert. Eine Retinopathie wurde, wenn überhaupt, selten von Dosierungen hervorgerufen, die zur Malariaprophylaxe empfohlen werden. Im Rahmen der Prophylaxe ist die Retinopathie somit nur bei einer Langzeitanwendung (> 5 Jahre) mit Resochin von Bedeutung.
Eingeschränkte Leberfunktion
Da es bekannt ist, dass sich Resochin in der Leber anreichert, muss die Dosis für Patienten mit eingeschränkter Leberfunktion ggf. angepasst werden.
Eingeschränkte Nierenfunktion
Resochin wird teilweise über die Nieren ausgeschieden. Deshalb muss die Dosis für Patienten mit schwerer Nierenfunktionsstörung ggf. angepasst werden.
Nierenversagen
Aufgrund fehlender Daten ist die Gabe von Resochin bei Patienten mit Nierenversagen (Kreatinin-Clearance < 10 ml/min) nicht zu empfehlen.
Nervensystem
Patienten, die an Epilepsie leiden, sollten eine regelmäßige ärztliche Betreuung erhalten.
Blutbild
Vor Beginn einer Langzeitbehandlung muss eine Blutbildkontrolle durchgeführt und in Abständen von zwei Monaten wiederholt werden.
Metabolische Störungen
Resochin sollte bei Patienten mit Psoriasis oder Porphyrie nicht angewendet werden.
QT Verlängerung
Resochin kann zu einer Verlängerung des QT Intervalls führen (siehe Abschnitt 4.9 Überdosierung).
Hypoglykämie
Es wurde gezeigt, dass Chloroquin schwere Hypoglykämien verursacht, einschließlich Bewusstseinsverlust, unabhängig davon, ob die Patienten mit Antidiabetika behandelt werden oder nicht. Dies kann lebensbedrohlich sein. Patienten, die mit Chloroquin behandelt werden, sollten vor dem Risiko einer Hypoglykämie und den damit verbundenen klinischen Anzeichen und Symptomen gewarnt werden. Patienten, die während der Behandlung mit Chloroquin klinische Symptome einer Hypoglykämie aufweisen, sollten ihren Blutzuckerspiegel kontrollieren lassen und die Notwendigkeit einer Therapieanpassung prüfen lassen.
Langzeitanwendung bei Frauen im gebärfähigen Alter
Patientinnen, die Resochin Tabletten zur Langzeitanwendung einnehmen, sollten einen sicheren Konzeptionsschutz während der Behandlung und für 3 Monate danach durchführen (siehe Abschnitt 4.6 Schwangerschaft und Stillzeit).
Langzeitprophylaxe bei Kindern
Resochin sollte mangels ausreichender Erfahrung nicht zur Langzeitprophylaxe bei Kindern angewendet werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wirkung von anderen Substanzen auf Resochin:
- Antazida und Kaolin können die Resorption von Chloroquin verringern, deshalb sollten zwischen der Verabreichung von Antazida bzw. Kaolin und der Gabe von Chloroquin mindestens 4 Stunden verstreichen,
- Phenylbutazon erhöht das Risiko einer exfoliativen Dermatitis,
- Probenecid erhöht die Wahrscheinlichkeit einer Sensibilisierung,
- Kortikosteroid-Derivate können Myopathien und Kardiomyopathien verstärken,
- Resochin darf nicht gleichzeitig mit anderen Medikamenten mit hepatotoxischem Potential (z. B. Isoniazid, Amiodaron, Carbamazepin, Phenytoin, Phenothiazine und Ketoconazol) und MAO-Hemmstoffen (z. B. Tranylcypromin und Selegilin) verabreicht werden,
- Cimetidin kann die Ausscheidung von Chloroquin vermindern,
- Mefloquin und Bupropion können das Risiko von Krampfanfällen erhöhen,
- nach Metronidazol wurde eine akute dystonische Reaktion beobachtet,
- Penicillamin erhöht das Risiko schwerer hämatologischer, renaler oder kutaner Nebenwirkungen,
- Pyrimethamin und Sulfadoxin erhöhen deutlich das Risiko von Hautreaktionen.
Wirkung von Resochin auf andere Substanzen:
- Verminderung der Antikörperbildung bei der Tollwutimpfung mit HDC-Impfstoff; ist eine gleichzeitige Tollwutimpfung unumgänglich, sollte diese Impfung intramuskulär erfolgen. Ein negativer Einfluss auf Routineimpfungen (Tetanus, Diphtherie, Masern, Poliomyelitis, Typhus und Tuberkulose) wurde nicht beobachtet,
- Erhöhung der Digoxin-Plasmakonzentration mit Glykosidintoxikation bei langfristiger Komedikation,
- Verstärkung der Wirkung von Folsäureantagonisten (Methotrexat),
- Verminderung der Wirkung von Neostigmin und Pyridostigminbromid,
- Erhöhung der Plasmakonzentration von Ciclosporin,
- Verminderung der Resorption von Ampicillin (die Gabe von Ampicillin sollte mindestens 2 Stunden nach der Verabreichung von Chloroquin erfolgen),
- Verringerung der Praziquantel-Konzentration im Blut.
4.6 Schwangerschaft und Stillzeit
Anwendung bei chronischer Polyarthritis und systemischem Lupus erythematodes:
Resochin darf in der Schwangerschaft nicht angewendet werden, weil es die Plazentaschranke passiert und beim Feten Organschäden verursachen kann. Vor Behandlung ist eine Schwangerschaft auszuschließen. Während der Behandlung und für drei Monate danach ist ein wirksamer Konzeptionsschutz einzuhalten.
Resochin darf in der Stillzeit nicht angewendet werden, weil ca. 2 bis 4 % des Wirkstoffs in die Muttermilch übergehen und aufgrund der langen Halbwertszeit von Resochin mit einer Akkumulation beim Säugling gerechnet werden muss. Bisher sind keine Schädigungen des Säuglings bekannt geworden, dennoch darf aufgrund der unzureichenden Erfahrungen nicht gestillt werden.
Anwendung zur Malariatherapie und -prophylaxe:
Während der Schwangerschaft fällt bei Aufenthalt in einem Endemiegebiet eine Nutzen-RisikoAbwägung in der Regel für die Anwendung von Resochin aus, da die Malariainfektion selbst den Feten schädigt. Vor Beginn einer Malariatherapie und -prophylaxe ist festzustellen, ob eine Schwangerschaft vorliegt. Bei deren Ausschluss ist während der Behandlung sowie für drei Monate danach ein wirksamer Konzeptionsschutz einzuhalten.
Es darf nicht gestillt werden (s. oben).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Diese Arzneimittel können aufgrund von zentralnervösen Nebenwirkungen (Kopfschmerzen, Schwindel, Schläfrigkeit, Verwirrtheitszuständen, Akkomodationsstörungen, Flimmerskotomen) auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße bei Therapiebeginn und im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Die meisten beobachteten Nebenwirkungen sind dosisabhängig. Sie treten vor allem bei Chloroquin-Plasmakonzentrationen über 250 qg/l auf.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten: (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorgan klasse |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
Nicht bekannt |
|
Erkrankungen des Blutes und des Lymphsystems |
Agranulozytose, Panzytopenie, Thrombozytopenie |
Eosinophilie Methämoglobin ämie | |||
|
Erkrankungen des Immunsystems |
Medikamenten- induziertes Hypersensitivitäts- syndrom berichtet mit Symptomen wie z. B. Fieber, bullöses Exanthem, Bauchschmerzen, Diarrhoe, Husten und Eosinophilie, Pulmonale Eosinophilie |
Allergische und anaphylaktische Reaktionen einschließlich Urtikaria und Angioödem | |||
|
Stoffwechsel-und Ernährungsstörungen |
Appetitlosigkeit |
Verschlimmerung einer Porphyrie, Porphyrinurie |
Erworbene Lipidose (Phospholipidose) |
Hypoglykämie (siehe Abschnitt 4.4) | |
|
Psychiatrische Erkrankungen |
Angstreaktionen |
Psychotische Reaktionen | |||
|
Erkrankungen des Nervensystems |
Verwirrtheitszu stände, Schwindel, Kopfschmerzen, Tonuserniedri gung, Schlafstörungen, Par- und Dysästhesien, Benommenheit, Schläfrigkeit |
Krampfanfall, Periphere Neuropathie und Polyneuropathie | |||
|
Augener krankungen |
Hornhauttrübungen, Sehstörungen, Beeinträchtigun g des Farbensehens (reversibel) |
passagere Akkomodations störungen |
Retinopathie (irreversibel), Gesichtsfeldaus fälle, Flimmerskotome | ||
|
Erkrankungen des Ohrs und des Labyrinths |
Hörverlust, Tinnitus | ||||
|
Herzer krankungen |
Blutdruckabfall, Depression der T-Welle im EKG |
Kardiomyo pathien, EKG- Veränderungen | |||
|
Erkrankungen des Gastrointestinaltraktes |
Gastrointestinal e und abdominale Schmerzen, Diarrhöen, Übelkeit, |
|
Systemorgan klasse |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
Nicht bekannt |
|
Erbrechen | |||||
|
Leber-und Gallener krankungen |
Einschränkung der Leberfunktion, Anstieg der Transaminasen | ||||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Haarausfall, Verschlimmerung einer Psoriasis, Pigmentstörungen an den Haaren (Ausbleichen oder Ergrauen der Haare), Photosensitivitäts- reaktionen, Juckreiz, Pigmentstörungen an der Haut (dunkle Verfärbung der dem Licht ausgesetzten Haut), Verfärbung der Mundschleimhaut, Hautausschlag |
Stevens-Johnson Syndrom, toxisch-epidermale Nekrolyse | |||
|
Skelettmusku latur-, Bindegewebs-und Knochenerkrankungen |
myasthenisches Syndrom, Myopathien | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Gewichtsverlust | ||||
|
Untersuchungen |
Veränderte Laborwerte |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Akute Überdosierung:
Die akute Vergiftung mit 3 bis 8 g Chloroquinphosphat (entsprechend 2 bis 5 g Chloroquin) kann infolge der lähmenden Wirkung auf das Herz, den Kreislauf und die Atmung in 1 bis 3 Stunden zum Tode führen. Symptome des Prodromalstadiums einer Chloroquinintoxikation sind Kopfschmerzen, Sehstörungen und Herzrhythmusstörungen. Nach einem Blutdruckabfall entwickelt sich ein Schockzustand mit Bewusstlosigkeit und Krämpfen, wenig später kommt es zu Atem- und Herzstillstand.
Akute Überdosierung mit Resochin kann dabei QT Verlängerung, ventrikuläre Arrhythmien und Torsade de Pointes Tachykardien verursachen.
Chronische Überdosierung:
Eine chronische Überdosierung kann zu einer fatalen Kardiomyopathie führen. Wenn Anzeichen einer Kardiomyopathie auftreten, sollte die Behandlung mit Chloroquin sofort abgebrochen werden. Eine toxische Chloroquin bedingte Kardiomyopathie kann reversibel verlaufen, wenn sie frühzeitig erkannt wird. Die chronische Überdosierung kann darüber hinaus zu einem vollständigen AV-Block führen.
Therapiemaßnahmen bei Überdosierung:
Ein Antidot ist nicht bekannt. Zuerst sollte man wenn zeitnah möglich, die sofortige Entfernung des Giftes durch Magenspülung versuchen. Danach muss frühzeitig eine Atem- und Kreislaufhilfe (Epinephrin) eingeleitet werden. Die Krämpfe sind durch Benzodiazepine (Diazepam), Phenobarbital, notfalls durch periphere Muskelrelaxanzien bei künstlicher Beatmung zu unterdrücken. Die Hämodialyse ist zur Behandlung nicht geeignet. Eventuell muss eine ausgeprägte Hypokaliämie ausgeglichen werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Malariamittel, ATC-Code: P01BA01
Chloroquin gehört zur Gruppe der 4-Aminochinoline, die zur Malariabehandlung und Malariaprophylaxe geeignet sind. Die Antimalariawirkung des Chloroquins wird u. a. über die Bindung von Chloroquin an Porphyrine erklärt, die zur Zerstörung bzw. Hemmung von asexuellen Formen nichtresistenter Plasmodien in den Erythrozyten führt sowie die Entwicklung von Geschlechtsformen (Gametozyten) bei P. ovale, P. vivax, P. malariae und unreifer Formen von P. falciparum stört. Chloroquin ist außerdem in Kombination mit Emetin-Derivaten gegen extraintestinale Amoebiasis wirksam.
Chloroquin ist ein Wirkstoff, der bei Langzeitbehandlung den Krankheitsverlauf der rheumatoiden Arthritis positiv beeinflussen und eine Remission induzieren kann. Chloroquin zeigt in den meisten tierexperimentellen Entzündungsmodellen keine Wirkung. Die antirheumatische Wirkung dieses Stoffes könnte über eine immunsuppressive Wirkung zustande kommen. Außerdem ist die Wirksamkeit bei systemischem Lupus erythematodes belegt.
5.2 Pharmakokinetische Eigenschaften
Pharmakokinetik:
Nach oraler Gabe wird Chloroquin rasch und nahezu vollständig resorbiert. Es verteilt sich in unterschiedlicher Konzentration in den Geweben. Die maximalen Blutspiegel werden nach 3 h erreicht. Das Verteilungsvolumen ist groß. Im Vollblut ist der größere Teil des Chloroquins an zelluläre Elemente gebunden. Der im Plasma gefundene Anteil ist zu 50 bis 60 % an Plasmaproteine gebunden. Im Verlaufe einer Behandlung reichert sich das Chloroquin in den Organen an. In Herz, Lunge, Nieren und Leber wird mehr als das 10 fache, in parenchymatösen Zellen das 100- bis 500 fache und in pigmentierten Zellen bis zum 1000 fachen der Plasmakonzentration gefunden. Die Ausscheidung aus den tiefen Kompartimenten erfolgt nur langsam. Die Halbwertszeit, berechnet aus einem Multikompartimentsystem, wird mit 30 bis 60 Tagen angegeben.
Für die Malariaprophylaxe sind Plasmaspiegel oberhalb von 9,6 pg/l (> 30 nmol/l), d. h. etwa 12,8 bis 32 pg/l erforderlich. Für die Malariatherapie werden Plasmaspiegel von 96 bis 192 pg/l benötigt.
Chloroquin wird zu 40 bis 70 % unverändert über die Nieren eliminiert. Die Metabolisierung erfolgt in der Leber. Hauptmetabolit ist das Monodesethyl-chloroquin, das auch noch eine Antimalariawirkung zeigt. Es wird über die Galle und die Nieren ausgeschieden.
Bioverfügbarkeit:
|
155 mg Resochin Tabletten |
3 x 50 mg Resochin junior Tabletten |
Infusion 155 mg/l h Resochin Injektion | |
|
maximale Plasmakonzentration (cmax) |
28,45 ± 8,44 gg/l |
29,56 ± 11,36 gg/l |
232,3 ± 82,9 gg/l |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) |
5 h |
2 h |
1 h |
|
Fläche unter der KonzentrationsZeit-Kurve (AUC) |
3045 ± 494 gg x h/l |
2995 ± 287,6 gg x h/l |
3453 ± 682,3 gg x h/l |
Angaben der Werte als arithmetischer Mittelwert und Streubreite, ausgewertet n = 15
Mittlere Plasmaspiegelverläufe von Resochin i.v./oral in einem Konzentrations-Zeit-Diagramm:
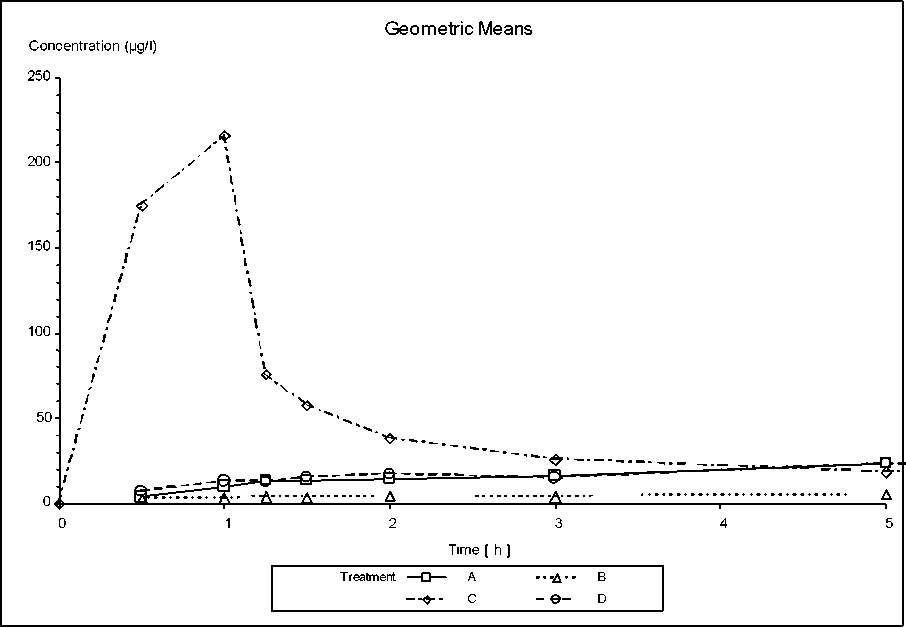
A - Resochin Tabl. 250 mg B - Resochin junior Tabl. 81 mg C - Resochin Injektion 50 mg/ml i. v. D - 3x Resochin junior Tabl. 81 mg
Arithmetische Mittelwerte (lineare Skalen),
Pharmakokinetisch gewertete Probanden, n = 15 Pharmakokinetik des Chloroquins (gg/l)
5.3 Präklinische Daten zur Sicherheit
Es sind keine regulär durchgeführten Studien zur systemischen Toxizität, Genotoxizität, Kanzerogenität und Embryotoxizität verfügbar. Chloroquin ist bei der Ratte teratogen (verschiedene Missbildungen). In einer weiteren Studie induziert Chloroquin Augendefekte bei 47 % der pränatal exponierten Ratten.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Tablettenkern:
Maisstärke
Talkum
Magnesiumstearat (Ph. Eur.)
Filmüberzug:
Hypromellose Macrogol 4000 Titandioxid (E 171)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Faltschachteln mit Blistern aus PP/Aluminium
Resochin Tabletten
Packung mit 20, 50, 100 Filmtabletten
Resochin junior Tabletten Packung mit 30 Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Bayer Vital GmbH D-51368 Leverkusen Telefon: (0214) 30-5 13 48 Telefax: (0214) 30-5 16 03
E-Mail-Adresse: bayer-vital@bayerhealthcare.com
ZULASSUNGSNUMMERN
8.
Resochin Tabletten Zul.-Nr.: 6070271.01.00
Resochin junior Tabletten Zul.-Nr.: 6070271.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLANGERUNG DER ZULASSUNG
Datum der Zulassung:
Resochin Tabletten: 07/04/1999
Resochin junior Tabletten: 19/04/1999
Verlängerung der Zulassung:
Resochin Tabletten: 07/04/2004
Resochin junior Tabletten: 07/04/2004
10. STAND DER INFORMATION
11/2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
13