Somnosan 7,5Mg
Fachinformation
1. Bezeichnung des Arzneimittels
Somnosan® 7,5 mg
2. Qualitative und quantitative Zusammensetzung
1 Filmtablette Somnosan® 7,5 mg enthält 7,5 mg Zopiclon Sonstiger Bestandteil: Lactose-Monohydrat
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Filmtablette
Somnosan® 7,5 mg sind weiße, runde Filmtabletten mit einer einseitigen Bruchrille.
Die Filmtablette kann in gleiche Hälften geteilt werden.
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Kurzzeitbehandlung von Schlafstörungen.
Benzodiazepine und Benzodiazepin-ähnliche Arzneistoffe sollten nur bei Schlafstörungen von klinisch bedeutsamem Schweregrad angewendet werden.
4.2 Dosierung, Art und Dauer der Anwendung
Die empfohlene Tagesdosis für Erwachsene beträgt 7,5 mg Zopiclon. Diese Dosis sollte nicht überschritten werden.
Bei älteren oder geschwächten Patienten, Patienten mit beeinträchtigter Leberfunktion oder chronischer Ateminsuffizienz sollte die Behandlung mit einer % Filmtablette Somnosan® 7,5 mg (entsprechend 3,75 mg Zopiclon) als Tagesdosis begonnen werden.
Obwohl bei Nierenkranken bisher keine Anreicherung des Wirkstoffs beobachtet wurde, wird auch hier empfohlen, die Behandlung mit einer % Filmtablette (entsprechend 3,75 mg Zopiclon) als Tagesdosis zu beginnen.
Kinder und Jugendliche unter 18 Jahren sollten nicht mit Zopiclon behandelt werden.
Art und Dauer der Anwendung
Die Filmtabletten werden abends direkt vor dem Schlafengehen unzerkaut mit etwas Flüssigkeit (Wasser) eingenommen.
Die Dauer der Behandlung sollte so kurz wie möglich sein. Sie sollte im Allgemeinen wenige Tage bis zu 2 Wochen betragen, und einschließlich der schrittweisen Absetzphase, 4 Wochen nicht übersteigen.
Im Einzelfall kann eine über diesen Zeitraum hinausgehende Behandlung erforderlich sein. Sie sollte jedoch nicht ohne erneute Beurteilung des Zustandsbildes des Patienten erfolgen.
4.3 Gegenanzeigen
- Überempfindlichkeit gegenüber Zopiclon bzw. einem der anderen Bestandteile des Arzneimittels
- Myasthenia gravis
- schwere Ateminsuffizienz
- Schlafapnoe-Syndrom
- schwere Leberinsuffizienz
- Kinder und Jugendliche unter 18 Jahre
- Stillzeit.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vor Beginn einer Behandlung mit Zopiclon sollten gegebenenfalls spezifisch zu behandelnde Ursachen der Schlaflosigkeit abgeklärt werden.
Toleranzentwicklung
Nach wiederholter Einnahme von Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen über wenige Wochen kann es zu einem Verlust an Wirksamkeit (Toleranz) kommen. Während einer Behandlung mit Zopiclon von bis zu 4 Wochen ist jedoch bisher keine ausgeprägte Toleranz aufgetreten.
Abhängigkeit
Die Anwendung von Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen kann zur Entwicklung von psychischer und physischer Abhängigkeit führen. Das Risiko einer Abhängigkeit steigt mit der Dosis und der Dauer der Behandlung und ist bei Patienten mit Alkohol- oder Drogenabhängigkeit in der Anamnese zusätzlich erhöht.
Wenn sich eine körperliche Abhängigkeit entwickelt hat, wird ein plötzlicher Abbruch der Behandlung von Entzugssymptomen begleitet. Diese können sich in Kopfschmerzen, Muskelschmerzen, außergewöhnlicher Angst, Spannungszuständen, innerer Unruhe, Verwirrtheit und Reizbarkeit äußern.
In schweren Fällen können außerdem folgende Symptome auftreten: Realitätsverlust, Persönlichkeitsstörungen, Überempfindlichkeit gegenüber Licht, Geräuschen und körperlichem Kontakt, Taubheit und Parästhesien in den Extremitäten, Halluzinationen oder epileptische Anfälle.
Rebound-Schlaflosigkeit
Auch beim Beenden einer kürzeren Behandlung kann es vorübergehend zu Absetzerscheinungen (Rebound-Phänomen) kommen, wobei die Symptome, die zu einer Behandlung mit Somnosan® 7,5 mg führten, in verstärkter Form wieder auftreten können. Als Begleitreaktionen sind Stimmungswechsel, Angstzustände und Unruhe möglich.
Da das Risiko von Entzugs- bzw. Absetz-Phänomenen nach plötzlichem Beenden der Therapie höher ist, wird empfohlen, die Behandlung durch schrittweise Verringerung der Dosis zu beenden.
Dauer der Behandlung
Die Dauer der Behandlung sollte so kurz wie möglich sein. Sie sollte, einschließlich der schrittweisen Absetzphase, 4 Wochen nicht übersteigen. Eine Verlängerung der Behandlung über diesen Zeitraum hinaus sollte nicht ohne erneute Beurteilung des Zustandsbildes erfolgen (s. 4.2. Dosierung, Art und Dauer der Anwendung).
Es ist angebracht, den Patienten zu Beginn der Therapie über die begrenzte Dauer der Behandlung zu informieren und ihm ausführlich die allmähliche Verringerung der Dosis genau zu erklären. Darüber hinaus ist es wichtig, dass dem Patienten die Möglichkeit von Rebound-Phänomenen bewusst ist, wodurch die Angst vor solchen Symptomen - falls sie beim Absetzen das Medikaments auftreten sollten - verringert werden kann.
Es gibt Hinweise dafür, dass es bei kurzzeitig wirksamen Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen auch innerhalb des Dosisintervalls zu Entzugserscheinungen kommen kann, insbesondere bei hoher Dosierung.
Amnesie
Benzodiazepine und Benzodiazepin-ähnliche Stoffe können anterograde Amnesien (Gedächtnislücken über einen bestimmten Zeitraum) verursachen, insbesondere während der ersten Stunden nach der Einnahme.
Dieses Risiko kann durch eine ausreichend lange, ununterbrochene Schlafdauer (7-8 Stunden) verringert werden (s. 4.8 Nebenwirkungen).
Psychiatrische und "paradoxe” Reaktionen
Bei der Anwendung von Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen kann es, meist bei älteren Patienten oder Kindern, zu psychiatrischen sowie sogenannten "paradoxen Reaktionen”, wie Unruhe, Reizbarkeit, Aggressivität, Wut, Alpträumen, Halluzinationen, Psychosen, unangemessenem Verhalten und anderen Verhaltensstörungen kommen. In solchen Fällen sollte die Behandlung mit diesem Präparat beendet werden.
Spezifische Patientengruppen
Ältere Patienten: s. 4.2 Dosierung, Art und Dauer der Anwendung.
Für Patienten mit chronischer Ateminsuffizienz wird auf Grund des Risikos einer Atemdepression eine niedrigere Dosis empfohlen.
Patienten mit schweren Leberfunktionsstörungen sollten nicht mit Benzodiazepinen oder Benzodiazepin-ähnlichen Stoffen behandelt werden, da bei ihnen die Gefahr einer Enzephalopathie besteht.
Zopiclon wird zur primären Behandlung von Psychosen nicht empfohlen.
Benzodiazepine und Benzodiazepin-ähnliche Stoffe sollten nicht zur alleinigen Behandlung von Depressionen oder Angstzuständen, die von Depressionen begleitet sind, angewandt werden (bei Patienten kann hierdurch die Suizidgefahr erhöht werden).
Zopiclon sollte bei Patienten mit Alkohol- und Drogenmissbrauch in der Anamnese nur mit äußerster Vorsicht angewendet werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Somnosan® 7,5 mg nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Während der Behandlung mit Somnosan® 7,5 mg sollte kein Alkohol getrunken werden, da hierdurch die Wirkung von Zopiclon in nicht vorhersehbarer Weise verändert und verstärkt wird. Auch die Fahrtüchtigkeit und die Fähigkeit, Maschinen zu bedienen, wird durch diese Kombination zusätzlich beeinträchtigt.
Die Kombination mit anderen zentral dämpfenden Arzneimitteln (Neuroleptika, Antidepressiva, Hypnotika, Anxiolytika/Sedativa, Narkoanalgetika, Antiepileptika, Narkotika, sedative Antihistaminika), kann zu einer gegenseitigen Verstärkung der zentraldämpfenden Wirkung führen und sollte daher kritisch erwogen werden.
Die Kombination mit Narkoanalgetika kann zu einer Verstärkung der euphorisierenden Wirkung und damit zu beschleunigter Abhängigkeitsentwicklung führen.
Bei gleichzeitiger Gabe von Muskelrelaxantien kann die relaxierende Wirkung verstärkt werden.
Substanzen, die bestimmte Leberenzyme (insbesondere Cytochrom P450) hemmen, können die Wirkung von Benzodiazepinen und Benzodiazepin-ähnlichen Wirkstoffen verstärken (Cimetidin z. B.).
4.6 Schwangerschaft und Stillzeit
Zur Einschätzung der Sicherheit von Zopiclon während der Schwangerschaft und Stillzeit liegen unzureichende Daten vor. Deshalb sollte Zopiclon während der Schwangerschaft nur in Ausnahmefällen, nach strenger Nutzen-Risiko-Abwägung verordnet werden. Frauen, die während der Therapie mit Zopiclon schwanger werden möchten oder vermuten, schwanger zu sein, sollten aufgefordert werden, ihren Arzt davon in Kenntnis zu setzen, damit er über Weiterführung bzw. Umstellung der Behandlung entscheiden kann.
Bei längerer Einnahme von Zopiclon durch Schwangere können beim Neugeborenen postnatal Entzugserscheinungen auftreten. Eine Anwendung gegen Ende der Schwangerschaft, vor oder während der Geburt kann beim Neugeborenen zu erniedrigter Körpertemperatur, Blutdruckabfall, Atemdepression, herabgesetzter Muskelspannung und Trinkschwäche (sog. “floppy-infant-syndrome") führen.
Da Zopiclon in die Muttermilch übertritt, darf Somnosan® 7,5 mg in der Stillzeit nicht angewendet werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Sedierung, Amnesie, verminderte Konzentrationsfähigkeit und beeinträchtigte Muskelfunktion können sich nachteilig auf die Fahrtüchtigkeit oder die Fähigkeit zum Arbeiten mit Maschinen auswirken. Dies gilt in besonderem Maße nach unzureichender Schlafdauer bzw. im Zusammenwirken mit Alkohol (s. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen).
4.8 Nebenwirkungen
Folgende Nebenwirkungen können - vorwiegend bei Therapiebeginn - auftreten:
- Müdigkeit, Benommenheit am folgenden Tage
- emotionale Dämpfung
- vermindertes Reaktionsvermögen
- Verwirrtheit, Schwindelgefühl
- Kopfschmerzen
- Muskelschwäche, Ataxie, Bewegungsunsicherheit
- Sehstörungen (Doppeltsehen).
In der Regel verringern sich diese Symptome im Laufe der Behandlung.
Die häufigste Nebenwirkung sind bittere Geschmacksempfindungen.
Über Störungen des Magen-Darm-Traktes, Änderungen der Libido und Hautreaktionen wurde selten berichtet.
Amnesie
Benzodiazepine und Benzodiazepin-ähnliche Stoffe können bereits in therapeutischer Dosierung anterograde Amnesien verursachen wobei das Risiko mit der Dosierung zunimmt. Amnesien können mit unangemessenem Verhalten einhergehen. (s. 4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Depressionen
Eine bereits vorhandene Depression kann während der Anwendung von Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen demaskiert werden (s. 4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung / Spezifische Patientengruppen).
Psychiatrische und "paradoxe" Reaktionen
Bei der Anwendung von Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen kann es, insbesondere bei älteren Patienten oder Kindern, zu psychiatrischen sowie sogenannten "paradoxen Reaktionen", wie Unruhe, Reizbarkeit, Aggressivität, Wut, Alpträumen, Halluzinationen, Psychosen, unangemessenem Verhalten und anderen Verhaltensstörungen kommen. In solchen Fällen sollte die Behandlung mit diesem Präparat beendet werden.
Abhängigkeit
Die Anwendung von Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen (auch in therapeutischen Dosen) kann zur Entwicklung einer physischen und psychischen Abhängigkeit führen; bei Beenden der Therapie können Entzugs- und ReboundPhänomene auftreten. Über Missbrauch ist berichtet worden (s. 4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
4.9 Überdosierung
Wie auch bei anderen Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen ist eine Überdosierung mit Zopiclon im Allgemeinen nicht lebensbedrohlich (Cave: Kombination mit anderen zentral dämpfenden Arzneimitteln oder Alkohol!).
Intoxikationen mit Benzodiazepinen und Benzodiazepin-ähnlichen Stoffen sind gewöhnlich -in Abhängigkeit von der aufgenommenen Dosis - durch verschiedene Stadien der zentralen Dämpfung gekennzeichnet, die von Somnolenz, geistiger Verwirrung, Lethargie, Sehstörungen und Dystonie bis hin zu Ataxie, Bewusstlosigkeit, zentraler Atem- und Kreislaufdepression und Koma reichen können. Außerdem sind im Rahmen der Bewusstseinsstörungen "paradoxe" Reaktionen (Unruhezustände, Halluzinationen) möglich.
Bei der Therapie stehen symptomatische Maßnahmen im Vordergrund:
Patienten mit leichteren Vergiftungserscheinungen sollten unter Atem- und Kreislaufkontrolle ausschlafen. In schwereren Fällen können weitere Maßnahmen (Magenspülung, Kreislaufstabilisierung, Intensivüberwachung) erforderlich werden.
Erforderlichenfalls kann als Antidot der spezifische Benzodiazepin-Antagonist Flumazenil verwendet werden.
Auf Grund des großen Verteilungsvolumens dürften forcierte Diurese oder Hämodialyse bei reinen Zopiclon-Vergiftungen nur von geringem Nutzen sein.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
ATC-Code: N05C F01
Zopiclon ist ein Benzodiazepin-ähnliches Hypnotikum aus der Gruppe der Cyclopyrrolone mit sedierenden, hypnotischen und anxiolytischen Eigenschaften. Darüber hinaus wirkt Zopiclon muskelrelaxierend und antikonvulsiv. Als spezifischer GABA-Agonist entfaltet es seine Wirkung über den GABA- Q-(BZ1 und BZ2)-Rezeptor-Komplex und Modulation des Chlorid-lonen-Kanals.
5.2 Pharmakokinetische Eigenschaften
Absorption
Nach oraler Gabe wird Zopiclon schnell resorbiert, maximale Plasmaspiegel werden nach 1,5-2 Stunden erreicht. Sie betragen in Abhängigkeit von der Dosis (3,75/7,5 mg) 30 bzw. 60 ng/ml. Die Resorption ist geschlechtsunspezifisch und wird nicht durch Einnahmezeit oder Einnahmehäufigkeit beeinflusst.
Verteilung
Aus dem zentralen Kompartiment wird Zopiclon rasch im Organismus verteilt. Die Plasmaeiweißbindung ist relativ niedrig (sie beträgt ca. 45 %) und nicht sättigbar. Das Risiko medikamentöser Interaktionen aufgrund der Plasmaeiweißbindung dürfte deshalb sehr gering sein.
Die Eliminationshalbwertszeit beträgt ca. 5 Stunden. Die Abnahme des Plasmaspiegels ist dabei im Bereich der therapeutischen Dosierung dosisunabhängig.
Nach wiederholter Einnahme erfolgt keine Kumulation, und die interindividuelle Variationsbreite scheint gering zu sein.
Während der Laktation gleichen sich die pharmakokinetischen Profile in Blutplasma und Muttermilch, d. h. der Säugling erhielte ca. 1 % der mütterlichen Tagesdosis.
Metabolismus
Bei der Metabolisierung von Zopiclon entstehen im Wesentlichen zwei Metaboliten: Das im Tiermodell pharmakologisch aktive Zopiclon-N-oxid (Plasma-HWZ: 4,5 Stunden) und das nicht aktive N-Desmethyl-Zopiclon (Plasma-HWZ: 1,5 Stunden). Eine Kumulation der Metabolite wurde auch bei wiederholten Dosen (15 mg über 14 Tage) nicht beobachtet. Auch bei hoher Dosierung trat im Tiermodell keine Enzyminduktion auf.
Elimination
Eine niedrige renale Clearance von unverändertem Zopiclon (durchschnittlich 8,4 ml/min) und eine Plasma-Clearance von 232 ml/min zeigen, dass Zopiclon hauptsächlich in metabolisierter Form eliminiert wird.
Die Ausscheidung der Substanz und der Metabolite erfolgt zu ca. 80 % über die Nieren und zu ca. 16 % mit den Faeces.
Pathophysiologische Variationen
In zahlreichen Studien konnte bei älteren Patienten trotz leicht verzögerter hepatischer Metabolisierung und verlängerter Eliminations-HWZ von Zopiclon (ca. 7 Stunden) auch bei wiederholter Gabe keine Kumulation beobachtet werden.
Auch bei Niereninsuffizienz wurde selbst nach Gabe über einen längeren Zeitraum keine Kumulation des Wirkstoffes oder seiner Metaboliten festgestellt. Zopiclon ist dialysabel.
Bei eingeschränkter Leberfunktion ist durch eine Verlangsamung der Demethylierung die Plasma-Clearance von Zopiclon deutlich verringert. Deshalb sollte bei diesen Patienten die Dosierung reduziert werden.
Bioverfügbarkeit
Nachfolgend wird eine vergleichende Bioverfügbarkeitsstudie mit Somnosan® 7,5 mg aus dem Jahre 1996 dokumentiert.
Ergebnisse
Pharmakokinetische Parameter von Zopiclon nach Einmalgabe von 1 Filmtablette Somnosan® 7,5 mg bzw. Referenzpräparat:
|
Somnosan® 7,5 mg |
Referenzpräparat | |||
|
(MW ± SD) |
(MW ± |
SD) | ||
|
Cmax |
[ng/ml] |
69,14 ± 22,75 |
62,30 ± |
18,42 |
|
tmax |
[h] |
1,08 ± 0,70 |
1,18 ± |
0,68 |
|
AUC0-<x> |
[h x ng/ml] |
386,50 ± 93,25 |
363,59 ± |
85,32 |
Cmax maximale Plasmakonzentration
tmax Zeitpunkt der maximalen Plasmakonzentration
AUC Fläche unter der Konzentrations-Zeit-Kurve MW Mittelwert
SD Standardabweichung
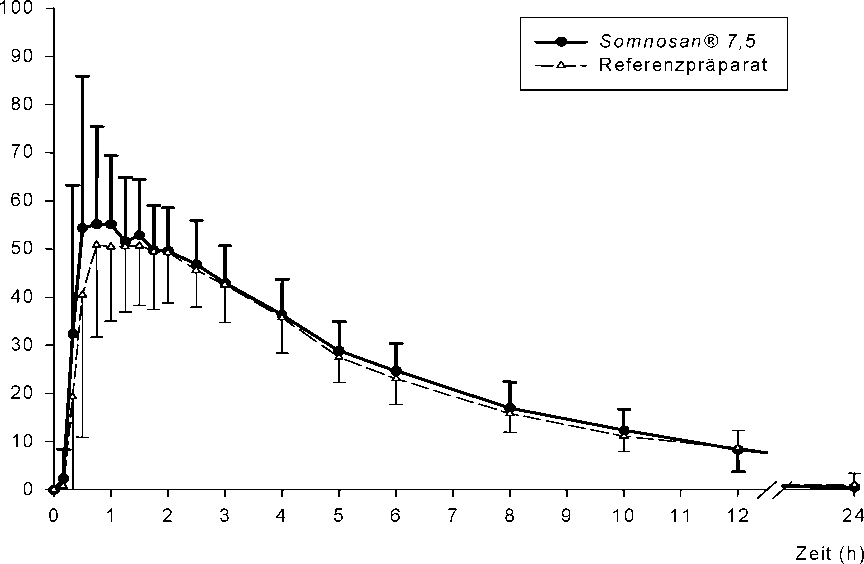
Abb.: Mittelwerte und Standardabweichungen der Plasmakonzentration von Zopiclon nach Einmalgabe von 1 Filmtablette Somnosan® 7,5 mg bzw. Referenzpräparat.
5.3 Präklinische Daten zur Sicherheit
In chronischen Toxizitätsstudien wurden bei Ratten und Hunden hepatotoxische Effekte beobachtet. In einigen Studien trat bei Hunden eine Anämie auf.
Zopiclon war in in-vitro und in-vivo Tests nicht mutagen.
Die bei weiblichen Ratten erhöhte Inzidenz an Mammatumoren lässt sich auf eine Erhöhung der 17-Beta-Estradiol Serumspiegel zurückführen. Dabei wurde die erhöhte Karzinomrate bei Blutspiegeln von Zopiclon beobachtet, die weit über den beim Menschen nach maximaler therapeutischer Dosis auftretenden lagen. Bei Ratten führte Zopiclon zu follikulären Karzinomen der Schilddrüse, die von einem erhöhten TSH-Spiegel begleitet waren. Beim Menschen wurden keine Veränderungen der Schilddrüsenhormone gemessen.
Untersuchungen an Mäusen, Ratten und Kaninchen ergaben keine Hinweise auf teratogene Effekte. Die Fertilität wurde bei Kaninchen nicht, bei Ratten in 2 Studien beeinträchtigt.
In mehreren Studien wurde bei männlichen Tieren Infertilität beobachtet. In einer doppelblinden Langzeitstudie an gesunden männlichen Probanden wurden bei Dosierungen von 7,5 mg Zopiclon über einen Zeitraum von 84 Tagen in Spermatogrammen keine negativen Veränderungen beim Spermienvolumen, der Spermienkonzentration, der Motilität der Spermien und der Zellmorphologie festgestellt.
PHARMAZEUTISCHE ANGABEN
6.
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat, Calciumhydrogenphosphat, Maisstärke, Croscarmellose-Natrium, Magnesiumstearat (Ph.Eur.), Hypromellose, Titandioxid.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Umkarton und nicht oberhalb 25°C aufbewahren.
6.5 Art und Inhalt des Behältnisses
10er-Blisterstreifen, bestehend aus einer 20 pm Aluminiumfolie und einer 250 pm PVC-Folie, in einem Umkarton aus bedrucktem Pappkarton.
Originalpackungen mit 10 Filmtabletten Originalpackungen mit 20 Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Hormosan Pharma GmbH Wilhelmshöher Straße 106 60389 Frankfurt/M Telefon: (069) 47 87 3-0 Telefax: (069) 47 87 3-16 www.hormosan.de info@hormosan.de
8. Zulassungsnummer
41136.00.00
Datum der Erteilung der Zulassung / Verlängerung der Zulassung
9.
• 15.03.1999 / 09.06.2005
10. Stand der Information
November 2008
11. Verkaufsabgrenzung
Verschreibungspflichtig
Seite: 11 von 11