Trospi 30 Mg
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Trospi 30 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette enthält 30 mg Trospiumchlorid.
Sonstiger Bestandteil mit bekannter Wirkung: 1 Tablette enthält 100 mg Lactose-Monohydrat. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tabletten
Runde, beidseitig gewölbte Tablette mit einseitiger Bruchkerbe. Die Tablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung der Detrusor-Instabilität oder der Detrusor-Hyperreflexie mit den Symptomen Pollakisurie, imperativem Harndrang und Dranginkontinenz.
4.2 Dosierung und Art der Anwendung
Dosierung
Es wird 3-mal täglich 1/2 Tablette oder morgens 1 und abends 1/2 Tablette eingenommen.
Bei stark eingeschränkter Nierenfunktion (Kreatininclearance zwischen 10 und 30 ml/min/1,73 m2) sollte eine Tagesdosis von 20 mg nicht überschritten werden. Die empfohlene Dosis beträgt 20 mg/Tag bis 20 mg alle 2 Tage.
Art der Anwendung
Die Tabletten werden unzerkaut vor einer Mahlzeit auf leeren Magen mit ausreichend Flüssigkeit eingenommen.
Die Notwendigkeit der Weiterbehandlung sollte in regelmäßigen Abständen von 3 - 6 Monaten überprüft werden.
Gegenanzeigen
4.3
• Überempfmdlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Harnverhaltung
• Engwinkelglaukom
• T achyarrhythmie
• Myasthenia gravis
• schwere chronisch entzündliche Darmerkrankung
• toxisches Megakolon
• dialysepflichtige Niereninsuffizienz (Kreatininclearance < 10 ml/min/1,73 m2)
Kinder unter 12 Jahren dürfen Trospi nicht einnehmen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Trospiumchlorid sollte bei Patienten
• mit obstruktiven Zuständen des Gastrointestinaltraktes (z. B. Pylorusstenose),
• mit Behinderung des Harnabflusses mit dem Risiko der Restharnbildung,
• mit autonomer Neuropathie,
• mit einer Hiatushernie mit Refluxösophagitis,
• bei denen eine schnelle Herzschlagfolge nicht erwünscht ist, z. B. jenen mit Hyperthyreose, koronarer Herzkrankheit und Herzinsuffizienz,
nur mit Vorsicht angewendet werden.
Da es keine Daten zur Verwendung von Trospiumchlorid bei eingeschränkter Leberfunktion gibt, wird die Anwendung bei diesen Patienten nicht empfohlen.
Trospiumchlorid wird hauptsächlich über die Nieren ausgeschieden. Bei Patienten mit starker Einschränkung der Nierenfunktion wurden beträchtliche Erhöhungen der Plasmaspiegel beobachtet. Deshalb sollte in dieser Patientengruppe, aber auch bei leichter bis mäßiger Einschränkung der Nierenfunktion, mit Vorsicht behandelt werden.
Vor Beginn einer Therapie sollten organische Ursachen für Pollakisurie, Drangsymptomatik und Dranginkontinenz, wie Herz- oder Nierenkrankheiten, Polydipsie, sowie Infektionen und Tumoren der Harnorgane ausgeschlossen werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Trospi nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Mögliche Wechselwirkungen sind
• Verstärkung der anticholinergen Wirkung von Amantadin, trizyklischen Antidepressiva, Chinidin, Antihistaminika und Disopyramid.
• Verstärkung der tachykarden Wirkung von Beta-Sympathomimetika.
• Abschwächung der Wirkung von Prokinetika (z. B. Metoclopramid).
Da Trospiumchlorid die gastrointestinale Motilität und Sekretion beeinflussen kann, kann die Möglichkeit nicht ausgeschlossen werden, dass die Resorption anderer, gleichzeitig eingenommener Medikamente verändert wird.
Bei gleichzeitiger Einnahme von Medikamenten, die Stoffe wie Guar, Cholestyramin und Cholestipol enthalten, kann nicht ausgeschlossen werden, dass die Resorption von Trospiumchlorid verringert wird. Deshalb wird die gleichzeitige Anwendung von Medikamenten, die diese Stoffe enthalten, nicht empfohlen.
Stoffwechselbedingte Wechselwirkungen mit Trospiumchlorid wurden in vitro mit Cytochrom-P-450-Enzymen, die am Medikamentenstoffwechsel beteiligt sind, durchgeführt (P450 1A2, 2A6, 2C9, 2C19, 2D6, 2E1, 3A4). Dabei wurde kein Einfluss von Trospiumchlorid auf deren metabolische Aktivität festgestellt. Da Trospiumchlorid nur zu einem geringen Teil verstoffwechselt wird und eine Esterhydrolyse den einzigen relevanten Stoffwechselweg darstellt, werden keine stoffwechselbedingten Wechselwirkungen erwartet.
Zudem ergaben sich weder aus klinischen Studien noch aus der Arzneimittelüberwachung Erkenntnisse, welche auf klinisch relevante Wechselwirkungen schließen lassen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Tierexperimentelle Studien ergaben keine Hinweise darauf, dass Trospiumchlorid schädliche Effekte auf die Schwangerschaft, die embryonale und fötale Entwicklung, die Geburt oder die nachgeburtliche Entwicklung ausüben könnte.
Dennoch sollte Trospi 30 mg Tabletten in der Schwangerschaft und Stillzeit nur unter strenger Indikationsstellung angewandt werden, da keine Erfahrungen über die Anwendung beim Menschen während der Schwangerschaft und Stillzeit vorliegen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch Störungen der Akkomodation kann es zu einer Beeinträchtigung der Fähigkeit zur aktiven Teilnahme am Straßenverkehr und zur Bedienung von Maschinen kommen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100, < 1/10)
Gelegentlich (> 1/1.000, < 1/100)
Selten (> 1/10.000, < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Bei der Behandlung mit Trospi 30 mg Tabletten kann es zu anticholinergen Nebenwirkungen wie Mundtrockenheit, Dyspepsie und Verstopfung kommen.
|
Organklasse |
Häufigkeit |
|
Erkrankungen des Immunsystems |
Nicht bekannt: Überempfindlichkeitsreaktionen gegenüber Trospiumchlorid (u.a. Hautausschlag, Juckreiz, Urtikaria, Angioödeme) einschließlich Anaphylaxie |
|
Erkrankungen des Nervensystems |
Nicht bekannt: Schwindel |
|
Augenerkrankungen |
Gelegentlich: Störungen der Akkomodation (besonders bei Patienten die hyperop und nicht ausreichend korrigiert sind) |
|
Herzerkrankungen |
Gelegentlich: Tachykardie Selten: T achyarrhythmie |
|
Gefäßerkrankungen |
Nicht bekannt: Bluthochdruck |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Gelegentlich: Dyspnoe |
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig: Mundtrockenheit Häufig: Dyspepsie, Verstopfung, Bauchschmerzen, Übelkeit Gelegentlich: Diarrhoe, Flatulenz |
|
Leber- und Gallenerkrankungen |
Selten: Milder bis mäßiger Anstieg der Transaminasen |
|
Erkankungen der Haut und des Unterhautzellgew ebes |
Nicht bekannt: Stevens-Johnson Syndrom, toxische-epidermale Nekrolyse |
|
Erkrankungen der Nieren und Harnwege |
Gelegentlich: Störungen der Harnentleerung (z. B. Restharnbildung) Selten: Harnverhalt |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Gelegentlich: Schwäche, Brustschmerzen |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit.
Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Als höchste Einzeldosis wurden gesunden Probanden 360 mg Trospiumchlorid oral verabreicht. Hierbei traten Mundtrockenheit, Tachykardie und Miktionsbeschwerden verstärkt als
Nebenwirkungen auf. Fälle schwerwiegender Überdosierung oder Vergiftung mit Trospiumchlorid sind bisher nicht bekannt geworden.
Als Zeichen einer Überdosierung sind verstärkte anticholinerge Symptome wie Sehstörungen, Tachykardie, Mundtrockenheit und Hautrötung zu erwarten.
Bei Vorliegen einer Vergiftung sollten folgende Maßnahmen ergriffen werden:
• Magenspülung und Verminderung der Resorption (z. B. Aktivkohle)
• lokale Gabe von Pilocarpin bei Glaukomkranken
• Katheterisierung bei Harnverhalt
• Gabe eines Parasympathomimetikums bei schweren Symptomen (z. B. Neostigmin)
• Gabe von Betablockern bei ungenügendem Ansprechen, ausgeprägter Tachykardie und/oder Kreislaufinstabilität (z. B. initial 1 mg Propranolol i.v. unter EKG und Blutdruckkontrolle).
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Urologika, ATC-Code: G 04 BD 09
Trospiumchlorid ist ein quartäres Derivat des Nortropans und gehört zur Stoffgruppe der Parasympatholytika oder Anticholinergika. Der Wirkstoff konkurriert konzentrationsabhängig und kompetitiv mit der körpereigenen Überträgersubstanz Acetylcholin um postsynaptische Bindungsstellen. Trospiumchlorid besitzt eine hohe Affinität zu den M1- und den M3-Rezeptoren und eine vergleichsweise etwas geringere Affinität zu den M2-Rezeptoren und bindet vernachlässigbar gering an nicotinischen Rezeptoren.
Für die anticholinerge Wirkung von Trospiumchlorid ist vor allem der über die MuskarinRezeptoren vermittelte relaxierende Effekt an glattmuskulären Geweben und Organen wesentlich.
Trospiumchlorid vermindert den Tonus der glatten Muskeln im Bereich des Magen-Darm- und des Urogenitaltraktes. Es hemmt die Bronchial-, Speichel- und Schweißsekretion und lähmt die Akkomodation. Zentrale Effekte wurden bislang nicht beobachtet.
5.2 Pharmakokinetische Eigenschaften
Pharmakokinetik
Nach oraler Applikation von Trospiumchlorid werden nach 4 - 6 Stunden maximale Blutspiegelwerte erreicht. Die Eliminationshalbwertszeit ist sehr variabel und beträgt bei oraler Verabreichung im Mittel 6 - 18 Stunden. Es tritt keine Akkumulation auf. Die Plasmaproteinbindung beträgt 50 - 80 %. Im Dosisbereich von 20 bis 60 mg als Einzeldosis sind die Plasmaspiegel proportional zur verabreichten Dosis. Die überwiegende Menge des systemisch verfügbaren Trospiumchlorids wird unverändert, ein geringerer Teil (ca. 10 %) als Spiroalkohol, dem durch Hydrolyse entstehenden Metaboliten, renal ausgeschieden.
Pharmakokinetische Daten ergaben keine wesentlichen Unterschiede bei älteren Patienten, sowie keine Geschlechtsunterschiede.
In einer Studie bei Patienten mit schwerer Einschränkung der Nierenfunktion (Kreatininclearance 8 - 32 ml/min) war die durchschnittliche AUC 4-fach und die 2-fach erhöht. Die
Halbwertszeit war gegenüber gesunden Personen 2-fach verlängert. Es sind keine Studien bei Patienten mit geringerem Grad der Einschränkung der Nierenfunktion bekannt.
Zu Patienten mit eingeschränkter Leberfunktion gibt es keine Daten.
Bioverfügbarkeit
Eine im Jahr 2002 durchgeführte Bioverfügbarkeitsuntersuchung an 18 Probanden ergab im Vergleich zum Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
Maximale Plasmakonzentration (Cmax): |
4,39 ± 3,07 ng/ml |
4,08 ± 2,88 ng/ml |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax): |
5,2 ± 1,1 h |
5,3 ± 1,2 h |
|
Fläche unter der Konzentrations -Zeit-Kurve (AUC 0 - *>): |
52,873 ± 34,978 h x ng/ml |
49,103 ± 30,857 h x ng/ml |
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm:
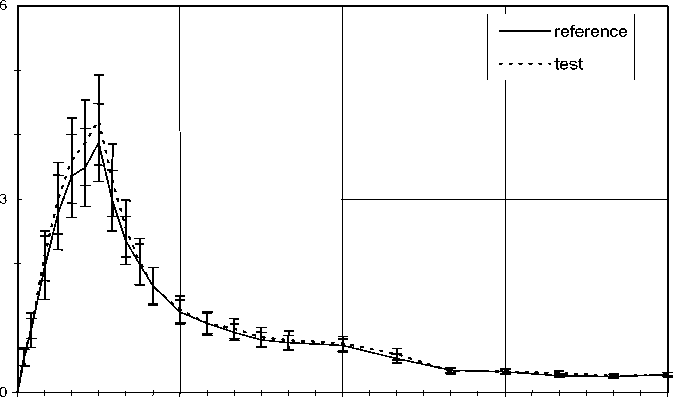
0
12
24
36
48
time [h]
Die Bioverfügbarkeit von Trospiumchlorid ist vom Füllungszustand des Magens bzw. gleichzeitiger Nahrungsaufnahme abhängig. Gleichzeitige Nahrungsaufnahme schränkt die Resorption von Trospiumchlorid ein. Nach einer Mahlzeit mit hohem Fettanteil betragen die Cmax und die AUC nur noch 15 - 20 % des Ausgangswertes unter Nüchternbedingungen.
5.3 Präklinische Daten zur Sicherheit
T oxikologis che Eigens chaften
a. Mutagenes und tumorerzeugendes Potential
Trospiumchlorid zeigte in vitro und in vivo keine mutagenen Wirkungen. Langzeitkanzerogenitätsstudien an Ratten und Mäusen ergaben keine Hinweise auf ein tumorerzeugendes Potential.
b. Reproduktionsstoxizität
Embryotoxizitätsstudien an Ratten und Kaninchen haben keine Hinweise auf embryotoxische Wirkungen ergeben. Entwicklung der Feten, Geburtsvorgang, postnatale Entwicklung der Nachkommen sowie Fertilität bei Ratten wurden nicht beeinträchtigt. Trospiumchlorid passiert bei der Ratte die Plazenta und geht in die Muttermilch über. Erfahrungen über die Anwendung beim Menschen während der Schwangerschaft und Stillzeit liegen nicht vor.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose, mikrokristalline Cellulose, Maisstärke, Carboxymethylstärke-Natrium, Stearinsäure, hochdisperses Siliciumdioxid, Polyvidon (K25)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses PVC/Aluminium-Blisterpackung mit 30, 50 und 100 Tabletten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG medac
Gesellschaft für klinische Spezialpräparate mbH Theaterstr. 6 22880 Wedel
Telefon: +49 (0)4103 8006-0 Telefax: +49 (0)4103 8006-100
8. ZULASSUNGSNUMMER(N)
3000624.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 20.11.2002
10. STAND DER INFORMATION
Juni 2014
11. VERKAUFSABGRENZUNG
Verschreibungs pflichtig
spc (DE) Trospi 30 mg tablets
National version: 06/2014