Vanco-Saar 500Mg
Vanco-saar® 500 mg / 1 g
Vancomycinhydrochlorid
Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen
Fachinformation
Vanco-saar® 500 mg / 1 g
Vancomycinhydrochlorid
Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen
Fachinformation
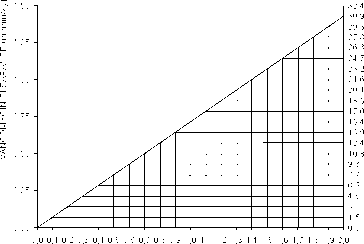
VANCOMYCIN DOSIS (mg/kg/24h)
CREATININ CLEARANCE (ml/min/kg)
1. Bezeichnung des Arzneimittels
Vanco-saar® 500 mg Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen.
Vanco-saar® 1 g
Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen. Vancomycinhydrochlorid
2. Qualitative und quantitative Zusammensetzung
1 Durchstechflasche Vanco-saar® 500 mg enthält 510 mg Vancomy-cinhydrochlorid (entspr. 500 mg Vancomycin).
1 Durchstechflasche Vanco-saar® 1 g enthält 1020 mg Vancomycin-hydrochlorid (entspr. 1000 mg Vancomycin).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen.
Feines, weißes Pulver mit wenig rosafarbenem bis braunem Schimmer.
4. Klinische Angaben
4.1 Anwendungsgebiete
Bei oraler Anwendung: Vancomycin-Pulver kann nach Auflösen eingenommen werden zur Behandlung bestimmter Darmentzündungen:
- antibiotikabedingter pseudomembranöser Enterokolitis (z. B. durch Clostridium difficile)
- Staphylokokken-Enterokolitis. Parenteral angewandt ist Vanco-mycin bei diesen Erkrankungen nicht wirksam.
Bei intravenöser Infusion:
Die parenterale Gabe ist auf schwere Infektionen, die durch gegen andere Antibiotika resistente Erreger verursacht sind, oder bei Patienten mit einer Allergie gegen Betalactam-Antibiotika zu begrenzen. Hier kann Vancomycin eingesetzt werden bei:
- Endokarditis
- Infektionen der Knochen (Osteitis, Osteomyelitis) und Gelenke
- Pneumonie
- Septikämie, Sepsis
- Weichteilinfektionen.
Zur perioperativen Prophylaxe bei erhöhter Gefährdung des Patienten durch Infektionen mit grampositiven Erregern in der Herz- und Gefäßchirurgie sowie bei Knochen- und Gelenkoperationen.
Antibakterielles Spektrum und Resistenzen siehe Abschnitt 5.1.
4.2 Dosierung und Art der Anwendung
Soweit nicht anders verordnet, gelten die folgenden Dosierungsrichtlinien:
Intravenöse Infusion
Patienten mit normaler Nierenfunktion
- Kinder ab 12 Jahre und Erwachsene:
Die übliche intravenöse Dosis beträgt 500 mg alle 6 Stunden oder 1 g alle 12 Stunden.
- Ältere Patienten:
Die natürliche Abnahme der glo-merulären Filtrationsrate mit zunehmendem Lebensalter kann zu erhöhten Vancomycinserumkon-zentrationen führen, wenn die Dosis nicht angepasst wird (s. Nomogramm bei eingeschränkter Nierenfunktion).
- Kinder (unter 12 Jahre):
Die übliche intravenöse Tagesdosis beträgt 40 mg/kg Körpergewicht meistens verteilt auf 4 Einzelgaben, d. h. 10 mg/kg Körpergewicht alle 6 Stunden.
- Säuglinge und Neugeborene:
Für junge Säuglinge und Neugeborene kann die Dosis geringer sein. Empfohlen wird eine Anfangsdosis von 15 mg/kg und Erhaltungsdosen von 10 mg/kg alle 12 Stunden in der ersten Lebenswoche und alle 8 Stunden bis zu einem Alter von einem Monat. Eine Überwachung der Serumkonzentrationen kann nötig sein.
Perioperative Prophylaxe Dosierungsvorschlag: Erwachsene erhalten 1 g Vancomycin i.v. vor der Operation (bei Einleitung der Narkose) und je nach Länge und Art der Operation eine oder mehrere Gaben von 1 g Vancomycin i.v. postoperativ.
Kinder erhalten 20 mg Vancomy-cin/kg Körpergewicht i.v. zu den gleichen Zeitpunkten.
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit eingeschränkter Nierenfunktion muss die Dosis der Ausscheidungsleistung angepasst werden. Dies ist - besonders bei schwerkranken Patienten mit wechselnder Nierenleistung - sinnvoll. Die Serumspiegel müssen regelmäßig bestimmt werden. Dabei gelten die folgenden Vorgaben:
Cmax: 30 - 40 mg/ml; Cmin: 5 -
10 mg/ml; Css (mittlerer Blutspiegel im steady-state): 15 mg/ml.
Für viele Patienten mit Nierenfunktionsstörung kann das folgende Nomogramm benutzt werden. Die Kreatinin-Clearance kann bestimmt bzw. näherungsweise ermittelt werden. Die Vancomycin-Gesamt-tagesdosis (in mg) beträgt ca. 15 Mal die glomeruläre Filtrationsrate (in ml/min).
Die Initialdosis sollte immer mindestens 15 mg/kg betragen. Nomogramm für Erwachsene mit eingeschränkter Nierenfunktion (nach Moellering et al., Ann. Intern. Med. (1981); 94:343)
Das Nomogramm ist nicht anwendbar auf Patienten mit Anurie (mit praktisch nicht vorhandener Nierenfunktion). Diesen Patienten sollte eine Dosis von 15 mg/kg zum Erreichen therapeutischer Serumkonzentrationen gegeben werden. Die Erhaltungsdosen betragen 1,9 mg/kg/24 Std.
Dosierung bei Hämodialyse Bei Patienten ohne Nierenfunktion, auch mit regelmäßiger Hämodialyse, ist auch folgende Dosierung möglich:
Sättigungsdosis 1000 mg, Erhaltungsdosis 1000 mg alle 7 - 10 Tage.
Werden bei der Hämodialyse Poly-sulfonmembranen verwendet ("high flux dialysis"), verkürzt sich die
Halbwertszeit von Vancomycin. Bei Patienten, die regelmäßig hämodia-lysiert werden, kann eine zusätzliche Erhaltungsdosis erforderlich sein.
Wenn nur der Serumkreatininwert bekannt ist, lässt sich anhand der folgenden Formeln der Wert für die Kreatinin-Clearance annähernd errechnen:
ClCr (Cockroft und Gault) _
[(140 - Alter) x Gewicht (kg)] : [A x Kreatinin im Serum (mg/dl)]
A: für Männer 72 A: für Frauen 85
Der Serumkreatininwert muss einem stabilen Zustand der Nierenfunktion entsprechen. Bei folgenden Patientengruppen liegt der annäherungsweise errechnete Wert meist über der tatsächlichen Kreatinin-Clearance:
Bei Patienten mit abnehmender Nierenleistung (z. B. bei Schock, schwerem Herzversagen oder Oligurie), fettleibigen Patienten oder Patienten mit Lebererkrankungen, Ödem oder Aszites; geschwächte, mangelernährte oder inaktivierte Patienten. Wann immer möglich, sollte die Kreatinin-Clearance direkt bestimmt werden.
Nur bei oraler Gabe
Erwachsene mit Enterokolitis nehmen üblicherweise 500 mg bis 2 g Vancomycin täglich in 3 oder 4 Teilgaben ein. Kinder erhalten 40 mg/kg Körpergewicht pro Tag in 3 oder 4 Teilgaben. Eine Tagesdosis von 2 g Vancomycin sollte nicht überschritten werden.
Art der Anwendung
Bei oraler Gabe:
Der Inhalt einer Durchstechflasche Vanco-saar® 500 mg wird in 10 ml Wasser, der Inhalt einer Durchstechflasche Vanco-saar® 1 g in 20 ml Wasser aufgelöst. Teilmengen (z.B. 2,5 ml = 125 mg Vancomycin) können entnommen und dem Patienten etwas verdünnt zu trinken gegeben oder über eine Magensonde zugeführt werden. Dieser Zubereitung kann man ein Geschmackskorrigens hinzufügen.
Bei intravenöser Infusion:
Parenteral darf Vancomycin nur als langsame i.v. Infusion (nicht mehr als 10 mg/min, Einzeldosen auch von weniger als 600 mg über mindestens 60 min) und in ausreichen-
der Verdünnung (100 ml pro 500 mg bzw. mindestens 200 ml pro 1 g) gegeben werden.
Patienten, bei denen die Flüssigkeitsaufnahme eingeschränkt werden muss, kann auch eine Lösung von 500 mg/50 ml bzw. von 1 g/100 ml gegeben werden. Bei dieser höheren Konzentration kann das Risiko infusionsbedingter Erscheinungen erhöht sein.
Zubereitung der Lösung:
Vor dem Gebrauch das Pulver in Wasser für Injektionszwecke auflösen. Weiteres Verdünnen entsprechend den nachfolgenden Anweisungen ist erforderlich. Die rekonstituierte Lösung muss mit kompatiblen Infusionslösungen weiter verdünnt werden. Die Van-comycin-Konzentration soll 2,5 -5 mg/ml Infusionslösung nicht übersteigen.
Der Inhalt einer Durchstechflasche Vanco-saar® 500 mg wird in 10 ml Wasser für Injektionszwecke gelöst und mit anderen Infusionslösungen weiter auf 100-200 ml verdünnt.
Der Inhalt einer Durchstechflasche Vanco-saar® 1 g wird in 20 ml Wasser für Injektionszwecke gelöst und mit anderen Infusionslösungen auf 200-400 ml verdünnt.
Kompatibilität mit intravenösen Flüssigkeiten
Zur Herstellung der Infusionslösung sind geeignet:
- Wasser für Injektionszwecke
- 5%ige Glucoselösung
- physiol. Kochsalzlösung
Vancomycin-Lösung ist, sofern nicht die chemisch-physikalische Verträglichkeit mit anderen Infusionslösungen erwiesen ist, grundsätzlich getrennt von diesen zu verabreichen (siehe hierzu auch Abschnitt 6.2).
Kombinationstherapie Im Falle einer Kombinationstherapie von Vancomycin mit anderen Anti-biotika/Chemotherapeutika sollen die Präparate getrennt gegeben werden.
Dauer der Anwendung
Die Behandlungsdauer richtet sich nach der Schwere der Infektion sowie nach dem klinischen und bakteriologischen Verlauf.
Bei Enterokolitis sollte Vancomycin oral 7 - 10 Tage lang eingenommen werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff Vancomycin.
Bei akuter Anurie sowie bei Vorschädigung des Cochlearapparates darf Vancomycin nur bei vitaler Indikation infundiert werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei Patienten mit eingeschränkter Nierenfunktion sollte die Therapie sorgfältig überwacht werden.
Bei Patienten mit eingeschränkter Hörfunktion, bei zusätzlicher Gabe ototoxischer Medikamente sowie bei Nierenfunktionsstörungen sind regelmäßige Kontrollen der Hörfunktion erforderlich.
Wird Vancomycin über längere Zeit oder zusammen mit Medikamenten angewandt, die zu einer Neutrope-nie führen können, ist das Blutbild regelmäßig zu kontrollieren.
Therapeutische Blutspiegel sollten eine Stunde nach Ende der Infusion zwischen 30 und 40 mg/l liegen, die Talspiegel (unmittelbar vor der nächsten Gabe) zwischen 5 und 10 mg/l. Eine regelmäßige Kontrolle der Serum-Konzentrationen ist angezeigt bei längerer Anwendungsdauer, insbesondere bei Patienten mit Nierenfunktionsstörungen oder Beeinträchtigung des Hörvermögens sowie bei gleichzeitiger Gabe ototoxischer bzw. nephrotoxischer Substanzen.
Bei schweren und anhaltenden Durchfällen ist an eine pseudomembranöse Kolitis zu denken, die lebensbedrohlich sein kann. Deshalb ist in diesen Fällen eine Beendigung der Therapie mit Vanco-saar® 500 mg/1 g in Abhängigkeit von der Indikation zu erwägen und ggf. sofort eine angemessene Behandlung einzuleiten (z. B. Einnahme von speziellen Antibio-tika/Chemotherapeutika, deren Wirksamkeit klinisch erwiesen ist). Arzneimittel, die die Peristaltik hemmen, dürfen nicht eingenommen werden.
Schwere akute Überempfindlichkeitsreaktionen (z. B. Anaphylaxis): Hier muss die Behandlung mit Vanco-saar® 500 mg/1 g sofort abgebrochen werden und die üblichen entsprechenden Notfallmaßnahmen
(z. B. Antihistaminika, Kortikosteroide, Sympathomimetika und ggf. Beatmung) eingeleitet werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Achtung:
Bei Patienten mit einer entzündlichen Darminfektion können auch nach oraler Anwendung von Van-comycin klinisch bedeutsame Serumkonzentrationen auftreten, vor allem, wenn gleichzeitig eine Nierenfunktionseinschränkung besteht. Dann sind Wechselwirkungen wie nach intravenöser Infusion möglich.
Vancomycin / andere potentiell nieren- bzw. gehörschädigende Medikamente
Eine gleichzeitige oder aufeinanderfolgende Gabe von Vancomycin und anderen potentiell oto- oder nephrotoxischen Medikamenten kann die Oto- und/oder Nephrotoxi-zität verstärken. Besonders bei gleichzeitiger Gabe von Aminoglykosiden ist eine sorgfältige Überwachung notwendig. In diesen Fällen ist die Maximaldosis von Vancomycin auf 500 mg alle 8 Stunden zu begrenzen.
Vancomycin / Narkosemittel Es gibt Berichte, dass die Häufigkeit der im zeitlichen Zusammenhang mit der intravenösen Vancomycin-Infusion möglichen Nebenwirkungen [(wie z. B. Hypotonie, Hautrötung, Erythem, Nesselsucht und Juckreiz) siehe auch Abschnitt Nebenwirkungen] bei gleichzeitiger Gabe von Vancomycin und Narkosemitteln zunimmt.
Vancomycin / Muskelrelaxantien Wird Vancomycin unter oder unmittelbar nach Operationen verabreicht, kann bei gleichzeitiger Anwendung von Muskelrelaxantien (wie z. B. Succinylcholin) deren Wirkung (neuromuskuläre Blok-kade) verstärkt und verlängert sein.
4.6 Schwangerschaft und Stillzeit
Zu einer Anwendung von Vancomy-cin in der Schwangerschaft und Stillzeit beim Menschen liegen keine ausreichenden Erfahrungen vor, daher sollte Vanco-saar® 500 mg/1 g Schwangeren nur nach einer eingehenden Nutzen-Risiko-Abwägung gegeben werden.
Tierversuche haben keine Hinweise auf Missbildungen ergeben.
Vancomycin geht in die Muttermilch über und sollte daher in der Stillzeit nur bei Versagen anderer Antibiotika angewendet werden. Beim Säugling kann es zu Störungen der Darmflora mit Durchfällen, Sprosspilzbesiedlung und möglicherweise auch zu einer Sensibilisierung kommen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Vancomycin hat keinen oder vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Achtung:
Bei Patienten mit einer entzündlichen Darminfektion können auch nach oraler Anwendung von Van-comycin klinisch bedeutsame Serumkonzentrationen auftreten, vor allem, wenn gleichzeitig eine Einschränkung der Nierenfunktion besteht. Dann sind Nebenwirkungen wie nach intravenöser Infusion möglich.
Im Zusammenhang mit bei der intravenösen Infusion auftretenden Reaktionen (siehe auch Überempfindlichkeitsreaktionen)
Während oder kurz nach rascher Infusion von Vancomycin können anaphylaktoide Reaktionen einschließlich Blutdruckabfall, Atemnot, Nesselfieber oder Juckreiz auftreten. Es kann auch zu Hautrötung am Oberkörper ("red neck" bzw. "red man"), zu Schmerzen und Krämpfen der Brust- oder Rückenmuskulatur kommen. Die Reaktionen klingen nach Absetzen der Infusion im allgemeinen innerhalb von 20 Minuten bis zu einigen Stunden ab. Da diese Erscheinungen bei langsamer Infusion selten auftreten, muss unbedingt darauf geachtet werden, Vancomycin genügend zu verdünnen und über einen ausreichend langen Zeitraum zu infundieren (siehe Abschnitt 4.2).
Wird Vancomycin schnell, z. B. innerhalb einiger Minuten injiziert, kann es zu starkem Blutdruckabfall einschließlich Schock und gelegentlich (> 0,1% - < 1%) zu Herzstillstand kommen.
Wirkungen auf die Niere Eine Nierenschädigung, hauptsächlich erkennbar an erhöhten Serumkreatinin- oder Serumharnstoff-
konzentrationen, wurde häufig (> 1% - < 10%) beobachtet, und zwar meist bei Patienten, die hohe Vancomycin-Dosen erhielten oder bei gleichzeitiger Gabe von Amino-glykosiden oder bereits bestehender Nierenfunktionseinschränkung. Sehr selten (< 0,01%) wurde über Entzündungen der Nieren (interstitielle Nephritis) und/oder akutes Nierenversagen berichtet. Nach Absetzen von Vancomycin normalisierten sich die Befunde meist. Insbesondere bei Patienten mit bereits eingeschränkter Nierenfunktion oder bei gleichzeitiger Gabe von Aminogly-kosiden sollte jedoch die Nierenfunktion regelmäßig überwacht und die Dosierung der Nierenfunktionseinschränkung angepasst werden. Eine therapiebegleitende Kontrolle der Serumkonzentrationen von Vancomycin ist in diesen Fällen angezeigt.
Wirkungen auf Sinnesorgane Gelegentlich (> 0,1% - < 1%) wurde über eine vorübergehende oder bleibende Verschlechterung des Hörvermögens berichtet. Die davon betroffenen Patienten hatten sehr hohe Dosen von Vancomycin oder zusätzlich andere ototoxische Medikamente erhalten oder bei ihnen lag eine Nierenfunktionseinschränkung oder ein bereits beeinträchtigtes Hörvermögen vor. Bei diesen Patienten sind regelmäßige Kontrollen der Hörfunktion angebracht.
Schwindel und Ohrenklingen wurden gelegentlich (> 0,1% - < 1%) beobachtet.
Wirkungen auf Blut und Blutkörperchen
Eine vorübergehende Neutropenie kommt gelegentlich (> 0,1% -
< 1%) vor. Sie tritt gewöhnlich eine Woche nach Therapiebeginn oder später auf bzw. nach Infusion einer Gesamtdosis von über 25 g. Nach Absetzen von Vancomycin normalisiert sich das Blutbild meistens schnell. Sehr selten (< 0,01%) wurde über reversible Agranulozytose berichtet. Ein ursächlicher Zusammenhang mit der Vancomycin-Behandlung wurde jedoch nicht belegt. Bei Patienten, die Vanco-mycin über längere Zeit oder gleichzeitig andere Medikamente erhalten, die eine Neutropenie oder Agranulozytose verursachen können, sollte die Leukozytenzahl regelmäßig überwacht werden.
Gelegentlich (> 0,1% - < 1%) wurde auch eine Thrombozytopenie sowie Eosinophilie beobachtet.
Überempfindlichkeitsreaktionen (siehe auch im Zusammenhang mit bei der intravenösen Infusion auftretenden Reaktionen)
Häufig (> 1% - < 10%) können Exantheme und Schleimhautentzündungen mit und ohne Juckreiz auftreten.
Sehr selten (< 0,01%) wurde im zeitlichen Zusammenhang mit einer Vancomycin-Infusion über einen starken und bis zu 10 Stunden anhaltenden Tränenfluss berichtet.
Gelegentlich (> 0,1% - < 1%) werden schwerwiegendere Überempfindlichkeitsreaktionen mit Symptomen wie z. B. Arzneimittelfieber, Eosinophilie, Schüttelfrost und Vaskulitis beobachtet.
Überempfindlichkeitsreaktionen aller Schweregrade - bis zum Schock - sind möglich.
Schwere anaphylaktoide Reaktionen erfordern unter Umständen entsprechende Notfallmaßnahmen.
Selten (> 0,01% - < 0,1%) ist im zeitlichen Zusammenhang mit einer Vancomycin-Therapie über schwere Hauterscheinungen mit lebensbedrohlichen Allgemeinreaktionen (wie z. B. exfoliative Dermatitis, StevensJohnson-Syndrom, Lyell-Syndrom) berichtet worden.
Wirkungen auf den Magen-DarmTrakt
Häufig (> 1% - < 10%) kann Übelkeit auftreten.
Sehr selten (< 0,01%) wurde über eine pseudomembranöse Entero-kolitis bei Patienten berichtet, denen Vancomycin intravenös gegeben wurde.
Bei Auftreten von schweren, anhaltenden Durchfällen während oder nach der intravenösen Therapie ist an eine pseudomembranöse Ente-rokolitis zu denken, die sofort behandelt werden muss (siehe Abschnitt 4.4).
Lokale Reaktionen: Venenentzündungen können auftreten. Durch langsame Infusion verdünnter Lösungen (250 -500 mg/100 ml) und Wechsel der
Infusionsstelle kann man sie vermindern. Versehentliche paravenöse oder intramuskuläre Injektionen führen zu Schmerzen, Gewebs-reizungen und Nekrosen.
Die Einnahme von Vancomycin kann zur Überwucherung mit nicht empfindlichen Bakterien oder Pilzen führen.
Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Intoxikationen im strengen Sinne sind unbekannt. Bei bestimmten Risikokonstellationen (z. B. bei stark eingeschränkter Nierenfunktion) kann es zu hohen Serumkonzentrationen und zu ototoxischen und nephrotoxischen Effekten kommen. Maßnahmen bei Überdosierung:
• Ein spezifisches Antidot ist nicht bekannt.
• Hohe Serumkonzentrationen können durch Hämodialyse unter Verwendung von Polysul-fonmembranen wirksam reduziert werden, ebenso mit dem Verfahren der Hämofiltration oder Hämoperfusion mit Polysul-fon-Harzen.
• Im Übrigen ist bei Überdosierung eine symptomatische Behandlung unter Aufrechterhaltung der Nierenfunktion erforderlich.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe Vancomycin ist ein Antibiotikum aus der Gruppe der Glykopeptide.
ATC-Code J01XA01, A07AA09
Wirkungsweise
Der Wirkungsmechanismus von Vancomycin beruht auf der Hemmung der Transglykosylierungsreaktion, so dass die für die Quervernetzung des Mureins benötigten Vorstufen (N-Acetylglucosamin, N-Acetylmuraminsäure) nicht mehr in die wachsende Zellwand eingebaut werden. Hieraus resultiert eine bakterizide Wirkung.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik Die Wirksamkeit hängt im Wesentlichen von der Zeitdauer ab, während der der Wirkstoffspiegel oberhalb der minimalen Hemmkonzentration (MHK) des Erregers liegt.
Resistenzmechanismen Eine Resistenz gegenüber Vancomycin kann auf folgenden Mechanismen beruhen:
- Veränderung der Zielstruktur: Diese Form der Resistenz ist in den letzten Jahren insbesondere bei der Spezies Enterococcus faecium aufgetreten. Die Veränderung beruht auf dem Austausch der endständigen D-Alanin-D-Ala-nin-Funktion der Aminosäureseitenkette einer Mureinvorstufe durch D-Ala-D-Lactat, so dass die Affinität zum Vancomycin stark vermindert ist. Die hierfür verantwortlichen Enzyme sind eine neu gebildete D-Lactat-Dehydrogenase bzw. Ligase.
- Die verminderte Empfindlichkeit oder Resistenz bei Staphylokokken gegenüber Vancomycin beruht auf der Überproduktion von Vorstufen des Mureins, an die Vancomycin gebunden wird.
Eine partielle Kreuzresistenz von Vancomycin besteht mit dem Glyko-peptid-Antibiotikum Teicoplanin.
Grenzwerte
Die Testung von Vancomycin erfolgt unter Benutzung der üblichen Verdünnungsreihe. Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt:
EUCAST (European Committee on Antimicrobial Susceptibility Testing) Grenzwerte
|
Erreger |
Sensibel |
Resistent |
|
Staphylococcus spp. |
< 4 mg/l |
> 8 mg/l |
|
Enterococcus spp. |
< 4 mg/l |
> 8 mg/l |
|
Streptococcus spp.tGruppen A, B, C, G) |
< 4 mg/l |
> 4 mg/l |
|
Streptococcus pneumoniae |
< 4 mg/l |
> 4 mg/l |
|
Nicht speziesspezifische Grenzwerte* |
< 4 mg/l |
> 8 mg/l |
* Basieren hauptsächlich auf der Serumpharmakokinetik
Prävalenz der erworbenen Resistenz in Deutschland Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation wünschenswert. Sollte auf Grund der lokalen Prävalenz der Resistenz die Anwendung von Van-comycin zumindest bei einigen Infektionen bedenklich erscheinen, sollte eine Beratung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Vanco-mycin anzustreben.
Prävalenz der erworbenen Resistenz in Deutschland auf der Basis von Daten der letzen 5 Jahre aus nationalen Resistenzüberwa
chungsprojekten und -studien (Stand: 19.12.2006):
Üblicherweise empfindliche Spezies_
Aerobe Gram-positive Mikroorganismen
Corynebacterium jeikeium° Enterococcus faecalis
Staphylococcus aureus (inkl. Methicillin-resistenter Stämme) Staphylococcus epidermidis Staphylococcus haemolyticus Staphylococcus hominis Streptococcus agalactiae Streptococcus dysgalactiae subsp. equisimilis° (Streptokokken der Gruppen C & G)
Streptococcus pneumoniae Streptococcus pyogenes Streptokokken der „Viridans“-Gruppe°A
Anaerobe Mikroorganismen
Clostridium difficile°
Peptococcus spp.° Peptostreptococcus spp.°_
Spezies, bei denen erworbene Resistenzen ein Problem bei der Anwendung darstellen können
Aerobe Gram-positive Mikroorganismen
Enterococcus faecium_
Von Natur aus resistente Spezies
Alle Gram-negativen Bakterien Andere Mikroorganismen
Chlamydia spp.
Chlamydophila spp.
Legionella pneumophila Mycoplasma spp._
° Bei Veröffentlichung der Tabellen lagen keine aktuellen Daten vor. In der Primärliteratur, Standardwerken und Therapieempfehlungen wird von einer Empfindlichkeit ausgegangen.
A Sammelbezeichnung für eine heterogene Gruppe von Streptokokken-Spe-zies. Resistenzrate kann in Abhängigkeit von der vorliegenden StreptokokkenSpezies variieren.
5.2 Pharmakokinetische Eigenschaften
Vancomycin verteilt sich nach i.v. Gabe in fast allen Geweben. In Pleura-, Perikard-, Aszites- und Synovialflüssigkeit sowie im Herzmuskel und in den Herzklappen werden ähnlich hohe Konzentrationen wie im Blutplasma erreicht. Die Angaben über die Vancomycin-Konzentratio-nen im Knochen (Spongiosa, Com-pacta) variieren stark. Das scheinbare Verteilungsvolumen im "steady state" wird mit 0,43 (bis zu 0,9) l/kg angegeben. Bei nicht entzündeten Meningen passiert Vancomycin die Blut-Hirn-Schranke nur in geringem Umfang.
Vancomycin wird zu 55% an Plasmaproteine gebunden. Es wird nur zu einem geringen Teil metaboli-siert. Nach parenteraler Gabe wird es fast vollständig als mikrobiologisch aktive Substanz (ca. 75 - 90% innerhalb von 24 h) durch glomeru-läre Filtration über die Nieren ausgeschieden. Die biliäre Ausscheidung ist unbedeutend (weniger als 5% einer Dosis).
Bei Patienten mit normaler Nierenfunktion beträgt die Halbwertzeit im Serum ca. 4 - 6 (5 - 11) h, bei Kindern 2,2 bis 3 Stunden. Bei eingeschränkter Nierenfunktion kann die Halbwertzeit von Vancomycin erheblich verlängert sein (bis auf 7,5 Tage); wegen der Ototoxizität des Vancomycins ist in solchen Fällen eine therapiebegleitende Überwachung der Plasmakonzentrationen angezeigt.
Die durchschnittlichen Plasmakonzentrationen nach der i.v. Infusion von 1 g Vancomycin über 60 Min. betrugen am Ende der Infusion etwa 63 mg/l, nach 2 Std. etwa 23 mg/l und nach 11 Std. etwa 8 mg/l.
In einer Untersuchung von Boeckh, Lode et al. (Antimicrob. Agents Chemother. 32 (1988): 92 - 95) betrugen die durchschnittlichen Plasmakonzentrationen nach der i.v. Infusion von 500 mg Vancomycin über 60 Minuten etwa 32 mg/l am Ende der Infusion, nach 1 Stunde etwa 13 mg/l und nach 4 Stunden etwa 5,7 mg/l.
Die Clearance von Vancomycin aus dem Plasma korreliert annähernd mit der glomerulären Filtrationsrate.
Die gesamte systemische und renale Clearance von Vancomycin kann bei älteren Patienten vermindert sein.
Wie Untersuchungen an anephri-schen Patienten gezeigt haben, scheint die metabolische Clearance sehr gering zu sein. Beim Menschen wurden bisher keine Vanco-mycin-Metabolite identifiziert.
Wird Vancomycin während einer Peritonealdialyse intraperitoneal gegeben, so gelangen während 6 Stunden ca. 60% in den systemischen Kreislauf. Nach i.p. Gabe von 30 mg/kg werden Serumspiegel von ca. 10 mg/l erreicht.
Bei oraler Gabe wird das hochpolare Vancomycin praktisch nicht resorbiert. Es erscheint nach oraler Zufuhr in aktiver Form im Stuhl und stellt deshalb für die pseudomembranöse Colitis und Staphylo-kokkencolitis ein geeignetes Chemotherapeutikum dar.
Nach wiederholter oraler Gabe von Vancomycin können bei Patienten mit aktiver pseudomembranöser Enterokolitis gelegentlich messbare Serumspiegel auftreten.
Vancomycin passiert die Plazenta und tritt in die Muttermilch über.
Zwei Stunden nach intravenöser Verabreichung von 50 mg/kg an trächtige Kaninchen am 13. Tag der Gestation betrugen die Konzentrationen im mütterlichen Plasma 20,0, im fetalen Plasma 3,7 und im Fruchtwasser 12,5 Einheiten/ml.
In der Milch laktierender Katzen lagen die Konzentrationen nach i.m. Verabreichung von Vancomycin zwischen einem Drittel und zwei Drittel der mütterlichen Serumkonzentration.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die LD 50 betrug (in mg/kg KG):
|
i.v |
Lp. |
oral | |
|
Maus |
489 |
>5000 | |
|
Ratte |
319 |
2218 | |
|
Hund |
292 | ||
|
Meer schweinchen |
737 |
Ratten und Mäuse starben nach letalen Dosen unmittelbar nach Behandlung aufgrund toxischer Erscheinungen des Zentralnervensystems, Hunde mehrere Tage später an Nierenversagen.
Chronische Toxizität Bei Ratten, die 35 Tage lang tägliche orale Dosen zwischen 375 und 3000 mg/kg KG erhielten, wurden ab 1500 mg/kg eine Retikulozytose und Lymphozytopenie, ab 750 mg/kg KG im Vergleich zur Kontrollgruppe verminderte Gewichte von Milz und Thymus beobachtet. In allen Dosisgruppen trat eine Reduktion von Gesamteiweiß, Glucose und Cholesterin im Serum und eine histologisch feststellbare Störung des Coecum-Mukosaepithels auf.
Intravenöse Dosen von 25 mg/kg bei Hunden und 50 mg/kg bei Affen, sowie i.m. Verabreichung von 50 mg/kg an Katzen führten lediglich zu lokalen Reaktionen an der Injektionsstelle.
Höhere Dosen ab 50 mg/kg i.v. beim Hund und 350 mg/kg i.p. bei der Ratte erwiesen sich als nephrotoxisch.
Mutagenes und tumorerzeugendes Potential
Vancomycin wurde nur eingeschränkt bezüglich mutagener Wirkungen geprüft. Bisherige Tests zeigten negative Ergebnisse. Langzeituntersuchungen am Tier auf ein tumorerzeugendes Potential liegen nicht vor.
Reproduktionstoxizität In Teratogenitätsstudien wurden Ratten Dosierungen bis zu 200 mg/kg KG gegeben und Kaninchen bis zu 120 mg/kg KG. Dabei wurden keine teratogenen Effekte beobachtet.
Tierstudien zur Anwendung in der Peri-/Postnatalperiode und zu Auswirkungen auf die Fertilität liegen nicht vor.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Keine.
6.2 Inkompatibilitäten
Vancomycin-Lösungen haben einen niedrigen pH-Wert. Dies kann zu chemischer oder physikalischer Instabilität führen, wenn sie mit anderen Substanzen gemischt werden.
Jede parenterale Lösung sollte daher vor der Anwendung auf Ausfällungen und Verfärbungen visuell überprüft werden. Trübungen traten auf, wenn Vancomycin-Lösungen mit Lösungen folgender Substanzen gemischt wurden: Aminophyllin; Barbiturate; Benzylpenicilline; Chlor-amphenicolhydrogensuccinat; Chlo-rothiazid-Natrium; Dexamethason-21-dihydrogenphosphat-Dinatrium; Heparin-Natrium; Hydrocortison-21-hydrogensuccinat; Methicillin-Na-trium; Natriumhydrogencarbonat; Nitrofurantoin-Natrium; Novobiocin-Natrium; Phenytoin-Natrium; Sulfadiazin-Natrium; Sulfafurazoldietha-nolamin.
6.3 Dauer der Haltbarkeit
2 Jahre.
Haltbarkeit der rekonstituierten Lösung:
Die chemische und physikalische Stabilität der in Wasser für Injektionszwecke rekonstituierten Lösung wurde bei einer Temperatur von < 25°C für eine Lagerdauer von 96 Stunden nachgewiesen.
Für die parenterale Anwendung sollte die frisch zubereitete Lösung wegen des Risikos einer mikrobiellen Kontamination bei der Auflösung alsbald gebraucht werden. Für die orale Anwendung kann die zubereitete Lösung 96 Stunden im Kühlschrank aufbewahrt werden.
Haltbarkeit der zubereiteten Infusionslösung:
Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung wurde für 96 Stunden bei 2 - 8°C nachgewiesen. Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden.
Wenn die gebrauchsfertige Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich.
Sofern die Herstellung der gebrauchsfertigen Zubereitung nicht unter kontrollierten und validierten aseptischen Bedingungen erfolgt, ist diese nicht länger als 24 Stunden bei 2°C bis 8°C aufzubewahren.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern. Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Vanco-saar® 500 mg:
1 Durchstechflasche
5 Durchstechflaschen
6 Durchstechflaschen 10 Durchstechflaschen
Vanco-saar® 1 g:
1 Durchstechflasche
5 Durchstechflaschen
6 Durchstechflaschen 10 Durchstechflaschen
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
MIP Pharma GmbH Kirkeler Straße 41 66440 Blieskastel Tel.: 06842 / 9609-0 Fax: 06842 / 9609-355
8. Zulassungsnummern
Vanco-saar® 500 mg: 39981.00.00 Vanco-saar® 1 g: 49101.01.00
9. Datum der Erteilung / Verlängerung der Zulassung
Vanco-saar® 500 mg: 02.04.1998 / 23.05.2003
Vanco-saar® 1 g: 07.09.2000 / 11.06.2008
10. Stand der Information
Mai 2015
Verkaufsabgrenzung
Verschreibungspflichtig