Venomenhal Wespe (Fortsetzungsbehandlung)
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS VENOMENHAL® Biene VENOMENHAL® Wespe
100 pg/ml. Pulver und Lösungsmittel zur Herstellung einer Lösung zur Hauttestung und zur subkutanen Injektion.
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
2.1 VENOMENHAL Biene
VENOMENHAL Biene enthält 6 Durchstechflaschen mit je 120 pg reinem, gefriergetrockneten Insektengift von Honigbienen (Apis mellifera).
2.2 VENOMENHAL Wespe
VENOMENHAL Wespe enthält 6 Durchstechflaschen mit je 120 pg reinem, gefriergetrockneten Insektengift von Wespen (Vespula germanica, Vespula vulgaris).
Für eine vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Lösung zur Hauttestung und zur subkutanen Injektion.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
VENOMENHAL Biene oder VENOMENHAL Wespe ist angezeigt zur Hauttestung (Prick-, Intrakutantestung) und kausalen Behandlung (spezifische Immuntherapie, Hyposensibilisierung) von Patienten mit einer IgE-vermittelten Insektengiftallergie, bei denen systemische Reaktionen nach Bienen- oder Wespenstich aufgetreten sind.
4.2 Dosierung, Art und Dauer der Anwendung
4.2.1 Dosierung
Hauttestung
Testort ist die Innenseite des Unterarmes. Die Hauttestung beginnt immer mit einem Pricktest, um zusätzliche Anhaltspunkte für den Sensibilisierungsgrad des Patienten zu erhalten. Bei Patienten mit schweren Stichreaktionen oder anderen Risikofaktoren sollten die Hauttests stationär mit Überwachung bis zum nächsten Tag erfolgen. Die Hautestungen sollten in jedem Fall sowohl mit Bienengift als auch mit Wespengift durchgeführt werden.
■ Beim Pricktest wird ein Tropfen des aufgelösten und verdünnten Insektengiftes auf die Haut aufgebracht. Durch den Tropfen hindurch wird mit einer Pricklanzette o.ä. die Haut oberflächlich senkrecht durchstochen bzw. beim modifizierten Pricktest im spitzen Winkel durchstoßen und leicht angehoben. Es sollen keine Blutungen entstehen.
■ Die Intrakutantestung erfolgt durch langsame Injektion von 0,02-0,05 ml des aufgelösten und verdünnten Insektengiftes mit einer Tuberkulinspritze in die obere Hautschicht am Unterarm des Patienten.
■ Die Hautreaktion wird bei beiden Tests nach 15 - 20 Minuten beurteilt. Während dieser Zeit sollte der Patient am Testort nicht reiben oder sich kratzen. Zur Erfassung von verzögerten oder späten Reaktionen ist eine weitere Ablesung am Folgetag angezeigt.
■ Pricktest und Intrakutantest machen für jeden Patienten die Verwendung neuer Lanzetten bzw. Spritzen mit Kanülen erforderlich.
■ Die Hauttests sollten möglichst bald, aber frühestens 2 Wochen nach dem letzten Stichereignis vorgenommen werden. Möglicherweise könnte eine zweimalige Hautestung unmittelbar nach dem Stich und nach 4 - 6 Wochen zuverlässiger sein. Neben einer Refraktärperiode durch die anaphylaktische Reaktion (die Empfindlichkeit des Patienten nach einem Stich ist häufig für eine gewisse Zeit herabgesetzt) ist auch die möglicherweise notfallmäßig verabreichte Medikation bei der Testung zu berücksichtigen.
■ Bei beiden Testmethoden ist immer eine Negativ-Kontrolle mit dem HSA-haltigen Verdünnungsmittel durchzuführen. Eine Positiv-Kontrolle mit einer Histaminlösung (1%ig im Falle des Pricktests bzw. 0,01%ig im Falle des Intrakutantests) sollte ebenfalls bei beiden Testmethoden immer vorgenommen werden, damit eine herabgesetzte Empfindlichkeit des Patienten durch Einnahme von Antihistaminika, Kortikoiden oder ähnlichen Medikamenten ausgeschlossen werden kann. Bei einigen Patienten können sich leichte Reaktionen auf die Negativkontrolle zeigen. Dies ist bei der Auswertung der Hautreaktionen zu berücksichtigen.
■ Diagnostisch verwertbar sind die Hauttestergebnisse nur, wenn auf die Negativkontrolle keine (maximaler Quaddeldurchmesser < 2 mm), auf die Histaminkontrolle eine eindeutige Reaktion (Quaddeldurchmesser beim Pricktest mindestens 3 mm, beim Intrakutantest mindestens 5 mm Durchmesser) auftritt. Wenn die Negativkontrolle eine Quaddel verursacht, ist dieses bei der Beurteilung in Betracht zu ziehen und der Test gegebenenfalls zu einem späteren Zeitpunkt zu wiederholen. Wenn der Quaddeldurchmesser der Negativkontrolle mehr als 2 mm beträgt, ist der Hauttest nicht auswertbar.
■ Die Hautteste werden im Allgemeinen schrittweise mit ansteigender Konzentration der aufgelösten und verdünnten Insektengifte zur Erfassung der Reaktionsschwelle durchgeführt (Endpunkttitration).
■ Schwellenkonzentration ist diejenige Giftkonzentration, auf die eine eindeutige Soforttypreaktion auftritt. Bis zum Auftreten einer mindestens einfach positiven Reaktion (Quaddeldurchmesser im Pricktest > 3 mm, im Intrakutantest > 5 mm) wird die Giftkonzentration je nach Testart wie folgt gesteigert:
Im Pricktest übliche Konzentrationsstufen sind 0,1 pg, 1,0 pg, 10 pg und 100 pg Insektengift/ml. Tritt im Pricktest keine Reaktion auf, so wird ein Intrakutantest mit 0,1 pg/ml und 1,0 pg/ml durchgeführt.
■ Kommt es bereits bei der niedrigsten dieser Testkonzentrationen zu einer Reaktion, so werden zur Feststellung der Hauttestschwelle weitere Verdünnungsstufen hergestellt und zusätzlich getestet. Die niedrigste Konzentration im Pricktest, die eine Quaddel von ca. 3 mm Durchmesser erzeugt, ist dann der Endpunkt der Titration.
■ Der Intrakutantest ist um das 100- bis 1000fache sensitiver als der Pricktest. Er wird als Endpunkttitration zur Ermittlung der individuellen Anfangskonzentration für die spezifische Immuntherapie durchgeführt. Die Ausgangskonzentration der Testreihe liegt üblicherweise bei 0,0001 pg Insektengift/ml. Wird bereits bei dieser Konzentration eine deutliche Reaktion beobachtet, so muss der Endpunkt mit noch niedrigeren Konzentrationen bestimmt werden. Ist bei 0,0001 pg/ml keine Reaktion aufgetreten, wird die Testung mit steigenden Konzentrationen (0,001, 0,01 pg/ml usw.) in Abständen von 20 Minuten fortgesetzt. Höhere Konzentrationen als 1,0 pg/ml werden nicht getestet, da sie unspezifische Reaktionen auslösen können. Die niedrigste Konzentration, die eine Quaddel von annähernd 5 mm Durchmesser zeigt, ist der Titrationsendpunkt.
Immuntherapie
Für die Injektionen des aufgelösten und verdünnten Insektengiftes werden entsprechend graduierte
Einmalspritzen verwendet. Die Injektion ist streng subkutan an der Außenseite des Oberarmes ca.
handbreit oberhalb des Ellenbogens zu verabreichen.
Im Allgemeinen wird die Einleitungsbehandlung bis zum Erreichen der Erhaltungsdosis von 1 ml der
Konzentrationsstufe 100 pg Insektengift/ml stationär mit mehreren Injektionen steigender Dosis pro
Tag als Schnellhyposensibilisierung durchgeführt. Ist die Aufnahme in eine Klinik unmöglich oder
unerwünscht, kann die Einleitungsbehandlung auch ambulant mit einer Injektion pro Woche durchgeführt werden.
Die nachfolgend für beide Behandlungsarten angegebenen Dosierungshinweise können höchstens Empfehlungen, keinesfalls jedoch generelle Richtlinien sein. Die Dosierung ist immer der individuellen Verträglichkeit des Patienten anzupassen. Bei Therapieunterbrechungen muss ggf. die Dosierung angepasst werden.
Die Erhaltungsdosis von 1 ml der Konzentrationsstufe 100 pg Insektengift/ml sollte angestrebt und möglichst erreicht werden, auch bei hoch sensibilisierten Patienten und Kindern. In Ausnahmefällen kann die Toleranzschwelle anfänglich bei einer geringeren Dosis erreicht sein (z.B. 0,7 ml der Konzentrationsstufe 100 pg Insektengift/ml). Zu beachten ist dabei, dass die Erhaltungsdosis die minimal effektive Dosis von 50 pg nicht unterschreitet. Diese Dosis ist dann als Erhaltungsdosis zu betrachten, mit der die Fortsetzungsbehandlung begonnen wird.
Werden bei einem Patienten nach Erreichen der empfohlen Erhaltungsdosis von 100 pg Insektengift pro Injektion allergische Reaktionen auf einen Insektenstich beobachtet, kann es nötig sein, die Erhaltungsdosis vorsichtig und schrittweise auf z.B. 150 oder 200 pg alle 4 Wochen zu erhöhen.
Gleichzeitige Behandlung einer Bienen- und einer Wespengiftallergie: VENOMENHAL Biene darf dabei nicht mit VENOMENHAL Wespe gemischt werden! Die Behandlung sollte bei Patienten die auf beide Insektengifte allergisch reagieren, zuerst nur mit einem Gift begonnen werden. Nach Erreichen der Erhaltungsdosis kann dann die Einleitungsbehandlung mit dem anderen Insektengift erfolgen. In der Fortsetzungsbehandlung ist es empfehlenswert, einen Abstand von mindestens 2 - 3 Tagen zwischen den verschiedenen Insektengiftinjektionen einzuhalten.
Dosierung bei Einleitungsbehandlung als stationäre Schnellhyposensibilisierung:
Die Behandlung beginnt mit einer Dosis von 0,1 ml der Konzentrationsstufe 0,0001 pg Insektengift/ml. Vom ersten bis zum fünften Tag erhält der Patient täglich - jeweils im Abstand von zwei Stunden - 4 Injektionen in steigenden Konzentrationen. Die Erhaltungsdosis von 1 ml der Konzentration 100 pg Insektengift/ml wird am fünften Tag erreicht (siehe Dosierungsschema: Einleitungsbehandlung als Schnellhyposensibilisierung).
Die Therapie wird als Fortsetzungsbehandlung mit dieser Erhaltungsdosis ambulant weitergeführt, wobei das Injektionsintervall stufenweise von 7 über 14 und 21 auf 28 Tage ausgedehnt wird (siehe Dosierungsschema: Fortsetzungsbehandlung mit der individuell vertragenen Erhaltungsdosis). Zur Sicherstellung der kontinuierlichen Behandlung muss rechtzeitig vor Anbruch der letzten Flasche eine neue Packung mit 6 Flaschen gefriergetrocknetem Insektengift und 6 Durchstechflaschen mit Lösungsmittel bestellt werden.
Dosierung bei Einleitungsbehandlung mit wöchentlichen Injektionen:
Kommt eine stationäre Behandlung nicht in Betracht, kann die Immuntherapie auch ambulant erfolgen, das heißt, mit je einer subkutanen Injektion alle 7 Tage in langsam steigenden Dosen und Konzentrationen.
Die Wahl der Anfangsdosis orientiert sich immer am Sensibilisierungsgrad des Patienten, ist also abhängig von der Anamnese und vom Ergebnis der Endpunkttitration.
Anfangsdosis bei Bestimmung des Endpunktes durch Pricktestung:
Die Anfangsdosis beträgt 0,1 ml einer 1:1000 Verdünnung der im Pricktest ermittelten EndpunktKonzentration.
Anfangsdosis bei Bestimmung des Endpunktes durch Intrakutantestung:
Die Anfangsdosis beträgt 0,1 ml einer 1:10 Verdünnung der im Intrakutantest ermittelten EndpunktKonzentration.
Bei hoch empfindlichen Patienten wird die Immuntherapie mit einer Dosis von 0,1 ml der Konzentration 0,0001 pg Insektengift/ml (oder eventuell noch geringer) eingeleitet. In Abständen von jeweils 7 Tagen werden daraufhin jeweils 0,1 ml der nächst höheren Konzentrationen injiziert, bis die Konzentration 1 pg Insektengift/ml erreicht ist.
Aus der Flasche mit der Konzentration 1 gg Insektengift/ml werden in wöchentlichen Abständen Injektionen in steigenden Dosen von 0,05 ml, 0,1 ml, 0,2 ml und 0,4 ml verabreicht. In gleicher Weise verfährt man, bis der Übergang auf die Stammlösung (Konzentration 100 gg Insektengift/ml) erfolgt. Wiederum wird in wöchentlichen Intervallen gesteigert, bis die Dosis von 1,0 ml erreicht ist (siehe Dosierungsschema: Einleitungsbehandlung mit wöchentlichen Dosissteigerungen). Mit dieser Erhaltungsdosis (oder einer niedrigeren individuellen Erhaltungsdosis) wird die Therapie als Fortsetzungsbehandlung fortgesetzt. Dabei wird das Injektionsintervall stufenweise von 7 über 14 und 21 auf 28 Tage ausgedehnt (siehe Dosierungsschema: Fortsetzungsbehandlung mit der individuell vertragenen Erhaltungsdosis). Rechtzeitig vor Anbruch der letzten Flasche muss eine neue Packung mit 6 Flaschen gefriergetrocknetem Insektengift und 6 Durchstechflaschen mit Lösungsmittel bestellt werden, damit die Therapie ohne Unterbrechung fortgesetzt werden kann.
Kinder und Jugendliche
Bei Kindern unter 5 Jahren sollte eine besonders sorgfältige Nutzen- / Risikoabwägung vor der Behandlung mit VENOMENHAL Biene oder VENOMENHAL Wespe erfolgen. Bei Kindern ab 5 Jahren liegen nur wenige klinische Daten über die Effektivität vor, Sicherheitsdaten deuten jedoch auf kein erhöhtes Risiko im Vergleich zu Erwachsenen hin.
Zur Dosisanpassung bei Kindern nach gesteigerter Reaktion siehe die folgende Tabelle.
Dosisanpassung bei gesteigerter Reaktion:
Unvorhergesehene Überdosierungen können gesteigerte Reaktionen zur Folge haben (siehe auch Punkt 4.8 „Nebenwirkungen"). Das Auftreten lokaler oder systemischer Reaktionen im Zusammenhang mit der Injektion von VENOMENHAL Biene oder VENOMENHAL Wespe erfordert eine unverzügliche Behandlung (siehe Tabelle „Behandlung von Nebenwirkungen") und macht ggf. eine Anpassung der Dosierung erforderlich.
|
Maximaler Durchmesser der Schwellung | ||
|
Kinder |
Erwachsene |
Empfohlene Dosisreduktion |
|
< 5 cm |
< 8 cm |
Dosis weiter gemäß Dosierungsschema steigern |
|
5-7 cm |
8-12 cm |
Dosis der letzten Injektion wiederholen, nicht steigern |
|
7-12 cm |
12-20 cm |
Eine Dosisstufe im Schema zurückgehen |
|
12-17 cm |
> 20 cm |
Zwei Dosisstufen zurückgehen |
|
> 17 cm |
Drei Dosisstufen zurückgehen | |
|
Milde Allgemeinreaktion |
Dosisreduktion auf 1/2 der letzten Dosis, die Therapie ggf. mit Zwischenschritten fortsetzen | |
|
Gesteigerte Allgemeinreaktion |
Dosisreduktion auf 1/10 der letzten Dosis, die Therapie ggf. mit Zwischenschritten fortsetzen | |
Schwere Allgemeinreaktionen oder anaphylaktischer Schock erfordern eine Überprüfung der Therapieindikation. Sicherheitshalber sollte die Therapie im Falle der Weiterbehandlung neu eingeleitet werden.
Dosisreduktion bei Intervallüberschreitung:
War die Einhaltung der empfohlenen Intervalle im Rahmen der konventionellen Immuntherapie nicht möglich (z.B. wegen einer akuten Erkrankung oder einer Schutzimpfung), kann ebenfalls eine Änderung der Dosierung notwendig werden.
Intervallüberschreitung in der Einleitungsbehandlung mit wöchentlichen Injektionen:
Wird in Ausnahmefällen ein Intervall von 1 Woche überschritten, so kann die Dosis nicht weiter gesteigert, sondern nur wie folgt angepasst werden:
|
Intervallüberschreitung von bis zu 1 Woche (max. 2 Wochen seit der letzten Injektion) |
Dosis nicht steigern. Wiederholung der letzten Dosis |
|
Intervallüberschreitung von bis zu 2 Wochen (2 bis 3 Wochen seit der letzten Injektion) |
Reduktion auf 1/2 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von bis zu 3 Wochen (3 bis 4 Wochen seit der letzten Injektion) |
Reduktion auf 1/10 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von mehr als 3 Wochen (mehr als 4 Wochen seit der letzten Injektion) |
Neubeginn der Therapie (mit individueller Anfangsdosis) |
Intervallüberschreitung in der Fortsetzungsbehandlung:
Wird in Ausnahmefällen das Intervall von 4 Wochen überschritten, so muss die Dosis wie folgt reduziert werden:
|
Intervallüberschreitung von bis zu 2 Wochen (4 bis 6 Wochen seit der letzten Injektion) |
Reduktion auf 3/4 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von 2 bis 4 Wochen (6 bis 8 Wochen seit der letzten Injektion) |
Reduktion auf 1/2 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von 4 bis 6 Wochen (8 bis 10 Wochen seit der letzten Injektion) |
Reduktion auf 1/4 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung mehr als 6 Wochen (mehr als 10 Wochen seit der letzten Injektion) |
Neubeginn der Therapie (mit individueller Anfangsdosis) |
Nach einer Dosisreduktion wird wiederum bis zur individuellen Erhaltungsdosis gesteigert. Die Steigerung erfolgt mit Injektionsintervallen von (3 bis) 7 Tagen und entspricht dem Dosierungsschema für die Einleitungsbehandlung mit wöchentlichen Injektionen.
4.2.2 Art der Anwendung
Herstellung der gebrauchsfertigen Lösungen zur Hauttestung und Einleitungsbehandlung (ambulant oder als stationäre Schnellhyposensibilisierung)
Auflösung des gefriergetrockneten Insektengiftes:
Die Insektengifte der Präparate VENOMENHAL Biene und VENOMENHAL Wespe sind gefriergetrocknet und vakuumverschlossen abgefüllt. Vor Gebrauch erfolgt die Auflösung des gefriergetrockneten Insektengiftes.
Dazu werden mittels steriler Spritze und Kanüle aus einer Flasche mit Lösungsmittel 1,2 ml entnommen und in eine der Flaschen mit dem gefriergetrockneten Insektengift (120 gg) gegeben. Gleichmäßig einfließen lassen! Anschließend sollte die Flasche mit dem Insektengift leicht hin und her bewegt werden, bis eine vollständige Auflösung des Insektengiftes erreicht ist. Nicht schütteln! Auf vollständige, rückstandslose Auflösung achten! Nach erfolgter Auflösung enthält diese Flasche eine Lösung mit der Konzentration 100 gg Insektengift/ml. Das Etikett der Flasche mit dem Insektengift enthält:
■ Die Chargenbezeichnung (Ch.-B.),
■ das Verfallsdatum des gefriergetrockneten Insektengiftes.
Bitte notieren Sie auch
■ das Datum der Auflösung des Insektengiftes,
■ das Verfallsdatum des gelösten Insektengiftes.
Die für die Leerspalten vorgesehenen Daten trägt der behandelnde Arzt selbst ein.
Herstellung der Verdünnungsstufen für die Hauttestung und Einleitungsbehandlung:
Aus dem gelösten Insektengift wird eine Verdünnungsreihe hergestellt. Für diesen Zweck ist für VENOMENHAL Biene bzw. VENOMENHAL Wespe eine Packung Verdünnungsmittel mit 10 Flaschen zu je 4,5 ml einer Verdünnungslösung separat erhältlich. Jede Packung enthält zusätzlich Leeretiketten, die der behandelnde Arzt zur Kennzeichnung der einzelnen Flaschen verwendet. In die vorgedruckten Spalten erfolgt die Eintragung von:
■ Insektenart (Biene oder Wespe)
■ Konzentration (in gg/ml)
■ Datum der Herstellung der Verdünnung
■ Verfallsdatum der Verdünnung.
Um Verwechslungen zu vermeiden, sollten die Flaschen bereits vor der Verdünnung mit den beschrifteten Haftetiketten versehen werden. Das Verfallsdatum der Verdünnungen darf die Haltbarkeitsdauer des gelösten Insektengiftes und des gefriergetrockneten Insektengiftes nicht überschreiten.
Eine Verdünnungsreihe wird auf die folgende Weise hergestellt:
1. Aus der Flasche mit dem gelösten Insektengift (Stammlösung mit 100 gg Insektengift/ml) unter Verwendung einer sterilen und entsprechend graduierten Spritze mit Kanüle 0,5 ml entnehmen und in eine Flasche mit 4,5 ml Verdünnungsmittel geben ■=> Konzentration: 10 gg Insektengift/ml.
2. Aus dieser Flasche wie beschrieben 0,5 ml entnehmen und in eine weitere Flasche mit 4,5 ml Verdünnungsmittel geben; ^Konzentration: 1 gg Insektengift/ml.
3. Aus dieser Flasche wiederum 0,5 ml entnehmen und in eine weitere Flasche mit 4,5 ml Verdünnungsmittel geben; ^Konzentration: 0,1 gg Insektengift/ml.
4. So wird weiter verfahren, bis eine Konzentration von 0,0001 gg Insektengift/ml oder eine noch geringere Konzentration erreicht ist (vgl. Schema Nr. 1).
Die Verdünnungsstufen jeweils vor dem nächsten Verdünnungsschritt durch vorsichtiges Schwenken gut mischen. Nicht schütteln!
Schema Nr. 1 zur Herstellung der gebrauchsfertigen Lösungen:
Auflösung des gefriergetrockneten Insektengiftes und Herstellung der Verdünnungsreihe zur Hauttestung, stationären Schnellhyposensibilisierung oder ambulanten Einleitungsbehandlung.
L
1,2 ml Stammlosung
Lösungs- mit 100 gg/ml mittel Insektengift
Konz.: 10 g,g/ml
Konz.: 1 g.g/ml
Konz.: Konz.: Konz.: Konz.:
0,1 ^g/ml 0,01 g.g/ml 0,001 g.g/ml 0,0001 g.g/ml
Auflösung
J
Verdünnung _
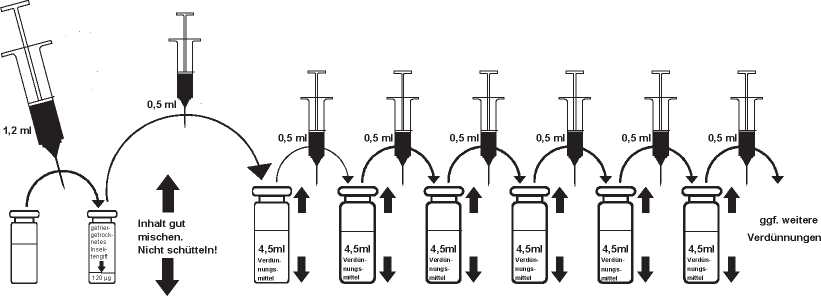
Herstellung der gebrauchsfertigen Lösung zur Fortsetzungsbehandlung Auflösung des gefriergetrockneten Insektengiftes:
Die beigefügten Durchstechflaschen enthalten Lösungsmittel zu je 1,2 ml. Zur Auflösung des Insektengiftes wird mittels steriler Spritze der Inhalt einer Durchstechflasche vollständig in eine Durchstechflasche mit 120 gg gefriergetrocknetem Insektengift überführt. Gleichmäßig einfließen lassen! Anschließend sollte die Flasche mit dem Insektengift leicht hin und her bewegt werden, bis eine vollständige Auflösung des Insektengiftes erreicht ist.
Nicht schütteln! Auf vollständige, rückstandslose Auflösung achten!
Die entstandene Behandlungslösung von 1,2 ml enthält 100 gg Insektengift/ml (vgl. Schema Nr. 2). Es wird empfohlen, die Herstellung der gebrauchsfertigen Lösung unmittelbar vor der Behandlung vorzunehmen. Das Etikett der Flasche mit dem Insektengift enthält:
■ Die Chargenbezeichnung (Ch.-B.),
■ das Verfallsdatum des gefriergetrockneten Insektengiftes.
Bitte notieren Sie auch
■ das Datum der Auflösung des Insektengiftes,
■ das Verfallsdatum des gelösten Insektengiftes.
Schema Nr. 2 zur Herstellung der gebrauchsfertigen Lösung:
Auflösung des gefriergetrockneten Insektengiftes zur Herstellung der Behandlungslösung für die Fortsetzungsbehandlung
< > C
Insektengift
auflösen
gefrierge
trocknetes
Insekten
gift
120 ug

Behandlungslösung mit 100 ug/ml Insektengift
1,2 ml Durchstechflasche
Lösungs- mit Insektengift
mittel
Nicht
schütteln!
4.2.3 Dauer der Anwendung
Die Immuntherapie mit VENOMENHAL Biene oder VENOMENHAL Wespe sollte 3-5 Jahre lang ohne Unterbrechung durchgeführt werden. Dies gilt in besonderem Maße für Patienten, bei denen nach einem Insektenstich lebensbedrohliche systemische Reaktionen aufgetreten sind. Bei besonderen Risikofaktoren ist oft eine Therapie über mehr als 5 Jahre angezeigt, vor allem Patienten mit Mastozytose oder erhöhtem basalen Serum-Tryptasespiegel sind nach heutigem Kenntnisstand lebenslang zu hyposensibilisieren.
4.3 Gegenanzeigen
4.3.1 Hauttest (Pricktest und Intrakutantest)
Absolute:
■ Sekundärinfektionen der Haut (Keimverschleppung).
■ Akute und chronische Ekzeme, z.B. atopische Dermatitis im Testbereich, sekundär entzündliche oder sekundär degenerative Hautveränderungen (z.B. Ichthyosis, Sklerodermie). Generalisierte Urtikaria und Urtikaria factitia können die Reagibilität der Haut verändern und die Aussagekraft von Hauttestungen stark beeinflussen.
■ Instabiles oder therapeutisch nicht adäquat eingestelltes Asthma bronchiale.
■ Deutlich beeinträchtigter Allgemeinzustand.
■ Überempfindlichkeit gegen einen der sonstigen Bestandteile des Arzneimittels.
Relative:
■ Akute schwere allergische Symptomatik.
■ Behandlung mit ß-Blockern.
■ Schwangerschaft.
■ Herz- und Kreislauferkrankungen mit erhöhtem Risiko bei der Anwendung von Adrenalin.
4.3.2 Therapie
■ Akute Entzündungsprozesse/fieberhafte Infektionskrankheiten am Reaktionsorgan.
■ Sekundärveränderungen am Reaktionsorgan (z. B. Emphysem, Bronchiektasen).
■ Autoimmunerkrankungen (z. B. der Niere, des Nervensystems, der Schilddrüse und rheumatische Erkrankungen).
■ Aktive Tuberkulose.
■ Immundefekte (auch durch Immunsuppressiva induziert).
■ Instabiles oder therapeutisch nicht adäquat eingestelltes Asthma bronchiale, insbesondere bei einem persistierenden FEV1 unter 70% des Sollwertes.
■ Herz- und Kreislauferkrankungen mit erhöhtem Risiko bei der Anwendung von Adrenalin.
■ Behandlung mit ß-Blockern (auch ß-Blocker enthaltenden Augentropfen) und mit ACE-Hemmern.
■ Maligne Tumorerkrankungen mit aktuellem Krankheitswert.
■ Überempfindlichkeit gegenüber einem der sonstigen Bestandteile des Arzneimittels.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine Immuntherapie mit Insektengiften sollte bei Patienten mit den vorstehend aufgeführten Erkrankungen möglichst nicht durchgeführt werden. Eine individuelle Nutzen-Risiko-Abwägung sollte erfolgen. Wiederholte lebensbedrohliche Stichreaktionen können beispielsweise ungeachtet bestehender Begleiterkrankungen oder bei einer Begleiterkrankung ohne weiteres wesentliches Progressionsrisiko für eine Hyposensibilisierung sprechen.
Hyposensibilisierungsimpfstoffe zur Injektion dürfen nur durch allergologisch weitergebildete bzw. allergologisch erfahrene Ärzte verschrieben und angewendet werden.
4.4.1 Allgemeine Hinweise
Die Therapie mit VENOMENHAL Biene oder VENOMENHAL Wespe wird mit selbst hergestellten Verdünnungen aus dem zuvor aufgelösten Insektengift durchgeführt. Eine sorgfältige und umgehende Beschriftung der Verdünnungsstufen ist unbedingt zu beachten. Vor jeder Anwendung sollte immer geprüft werden, ob die richtige Konzentration ausgewählt wurde, ob das angegebene Haltbarkeitsdatum der Konzentrationsstufe ggf. abgelaufen ist und welches Volumen injiziert werden soll (siehe Punkt 6.3 „Dauer der Haltbarkeit").
Da schon geringfügige Überdosierungen zu lokalen und systemischen Begleitreaktionen führen können, muss eine Notfallapotheke mit allen erforderlichen Medikamenten und Geräten zum sofortigen Einsatz bereit stehen.
Der Patient ist prinzipiell darauf hinzuweisen, dass er sich vor und nach jeder Injektion keiner schweren körperlichen Belastung (z.B. Sport, schwere körperliche Arbeit, auch Sauna oder heißes Duschen) unterziehen sollte.
4.4.2 Besondere Maßnahmen vor der Injektion
■ Befragen des Patienten nach Reaktionen auf die vorausgegangene Injektion, Ausschluss akuter Erkrankungen.
■ Befragen des Patienten nach Änderung der Einnahme von Medikamenten.
■ Dosis überprüfen, ggf. Dosisanpassung vornehmen.
■ Ängstlichen oder vegetativ labilen Patienten wird die Injektion zweckmäßigerweise im Liegen verabreicht.
■ Eine intravasale Injektion ist durch Aspirationskontrolle unbedingt auszuschließen!
4.4.3 Besondere Maßnahmen nach der Injektion
■ Der Patient ist darüber zu informieren, dass er sich bei später auftretenden Anzeichen einer Nebenreaktion sofort mit dem behandelnden Arzt oder dessen Vertretung in Verbindung setzt.
■ Nach der Injektion muss der Patient mindestens 30 Minuten unter ärztlicher Aufsicht bleiben.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
■ Eine Immuntherapie sollte nicht parallel zu einer Behandlung mit Immunsuppressiva, ß-Blockern (inklusive ß-Blocker enthaltenden Augentropfen) oder ACE-Hemmern durchgeführt werden. Grundsätzlich dürfen Patienten mit systemischen anaphylaktischen Reaktionen nicht mit ß-Blockern oder ACE-Hemmern behandelt werden. Kann nach sorgfältiger Prüfung der Indikationen auf solche Wirkstoffe aus vitalen Gründen nicht längerfristig verzichtet werden, so sollte während der Steigerungsphase der Hyposensibilisierung kurzfristig auf andere Antihypertonika umgestellt werden. Nach Erreichen einer gut verträglichen Erhaltungstherapie kann dann die ß-Blocker- bzw. ACE-Hemmer-Behandlung wieder aufgenommen werden.
■ Schutzimpfungen sollten frühestens 1 Woche nach der letzten Injektion durchgeführt werden (Ausnahme: vitale Indikation!). Die nächste Injektion sollte erst nach vollständigem Abklingen der Impfreaktion, frühestens jedoch 2 Wochen nach der Impfung erfolgen. Die Immuntherapie ist dann - je nach Dauer der Unterbrechung - mit reduzierter Dosis fortzusetzen oder von vorn zu beginnen (siehe unter Punkt 4.2.2 „Dosisreduktion bei Intervallüberschreitung“).
■ Bei einer begleitenden Therapie mit symptomatischen Antiallergika (z.B. Antihistaminika, Corticosteroiden) ist mit einer Beeinflussung der Reagibilität der Haut zu rechnen, so dass Hauttestergebnisse verfälscht werden können.
Eine Dosisreduktion oder das Absetzen symptomatischer Antiallergika kann die Toleranzgrenze des Patienten beeinflussen, so dass die bis dahin erreichte Dosis bei der Immuntherapie gegebenenfalls verringert werden muss, um allergische Nebenwirkungen zu vermeiden.
■ Die Durchführung einer weiteren Hyposensibilisierungsbehandlung kann die Toleranzgrenze verändern.
■ VENOMENHAL Biene darf niemals mit VENOMENHAL Wespe gemischt werden!
4.6 Fertilität, Schwangerschaft und Stillzeit
Es liegen keine ausreichenden Daten über den Einfluss von VENOMENHAL Biene oder VENOMENHAL Wespe auf die Fertilität vor.
Während der Schwangerschaft ist von der Einleitung einer Behandlung mit VENOMENHAL Biene oder VENOMENHAL Wespe abzusehen. Über eine bereits begonnene Behandlung ist nach Rücksprache mit dem behandelnden Arzt zu entscheiden. Sie kann im Einzelfall bei guter Verträglichkeit fortgeführt werden. Während der Schwangerschaft sind systemische Stichreaktionen der Mutter auch für das ungeborene Kind mit einem erheblichen Risiko verbunden. Daher sollte bei Frauen im gebärfähigen Alter eine Hyposensibilisierung möglichst vor Eintritt einer Schwangerschaft begonnen werden.
Stillzeit: Während der Stillzeit ist die Behandlung mit VENOMENHAL Biene oder VENOMENHAL Wespe möglich. Eine Risiko/Nutzen-Bewertung sollte zuvor erfolgen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
In seltenen Fällen kann nach der Injektion von VENOMENHAL Biene bzw. Wespe leichte Müdigkeit auftreten, was beim Führen von Kraftfahrzeugen und beim Bedienen von Maschinen zu berücksichtigen ist.
4.8 Nebenwirkungen
Auch bei korrekter Anwendung sind Nebenwirkungen nicht völlig auszuschließen. Neben Lokalreaktionen können bei Testung und Therapie systemische Reaktionen unterschiedlicher Schweregrade auftreten.
Insbesondere bei hochgradig sensibilisierten Patienten kann es zu folgenden verstärkten allergischen Reaktionen kommen, die in der Regel innerhalb von 30 Minuten nach der Injektion auftreten:
■ Gesteigerte Lokalreaktion im Bereich der Injektionsstelle.
■ Wiederauftreten der patientenspezifischen allergischen Symptomatik als milde Allgemeinreaktion (Nesselsucht [Urtikaria], Juckreiz, Hautrötung, Übelkeit).
■ Gesteigerte Allgemeinreaktion: Atemnot, generalisierte Nesselsucht (Urtikaria),
Gesichtsschwellung (Quincke-Ödem), Kreislaufdysregulation (Blutdruck-, Pulsveränderungen).
■ Im Extremfall ist auch ein anaphylaktischer Schock möglich. Typische Alarmsymptome sind Brennen, Jucken und Hitzegefühl auf und unter der Zunge, im Rachen und an den Handinnenflächen und Fußsohlen (siehe auch Tabelle „Behandlung von Nebenwirkungen“).
Gelegentlich treten auch Reaktionen vom verzögerten Typ (Typ III nach Coombs und Gell) auf. Dabei können Krankheitsmerkmale wie Fieber, Schmerzen, Neuritis (selten), Unwohlsein, Gelenkschwellungen sowie Urtikaria und andere Anzeichen einer vaskulären Schädigung auftreten, wie sie für eine Serumkrankheit typisch sind. Diese Symptome werden erst mehrere Stunden nach der Injektion beobachtet. In solchen Fällen ist die Therapie abzubrechen.
Schockreaktionen treten bei Einhaltung aller Vorsichtsmaßnahmen, bei richtiger Dosierung und lege artis durchgeführter Injektion nur selten auf. Trotzdem muss eine entsprechend ausgestattete Schockapotheke griffbereit sein.
Beim Auftreten von Nebenwirkungen, die nicht in dieser Packungsbeilage aufgeführt sind, soll der Patient diese umgehend dem Arzt oder Apotheker mitteilen.
4.9 Überdosierung
Eine Überdosierung kann zu allergischen Reaktionen bis hin zum anaphylaktischen Schock führen. Zur Behandlung von Nebenreaktionen siehe Tabelle „Behandlung von Nebenwirkungen
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Allergen-Extrakte.
ATC-Code: V01AA07 (Insekten).
Hauttest:
Die in der Testlösung enthaltenen Allergene reagieren bei entsprechender Sensibilisierung des Patienten mit allergenspezifischem Immunglobulin E, das sich auf den Mastzellen der Haut befindet. Diese Antigen-Antikörper-Reaktion führt zur Freisetzung von verschiedenen Mediatorsubstanzen (u.a. Histamin) aus den Mastzellen. Dadurch bildet sich an der Haut eine umschriebene Quaddel und Hautrötung (Erythem).
Therapie:
Die spezifische Immuntherapie mit VENOMENHAL Biene bzw. VENOMENHAL Wespe erhöht die Toleranzschwelle des allergischen Patienten gegenüber Insektengiften von Bienen oder Wespen. Die durch einen Stich ausgelösten systemischen Reaktionen oder eine anaphylaktische Reaktion treten nach der spezifischen Immuntherapie üblicherweise nicht mehr auf. Auf Basis von immunologischen Befunden werden folgende Wirkmechanismen der spezifischen Immuntherapie diskutiert:
■ Langfristiger Abfall des IgE-Spiegels
■ Anstieg von Insektengift-spezifischem IgG
■ Toleranzinduktion
■ Abnahme der Reaktionsbereitschaft Mediator-sezernierender Zellen
■ Umorientierung der T-Zell-Antwort
5.2 Pharmakokinetische Eigenschaften
Keine Angaben.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Das Lyophilisat enthält humanes Serum Albumin (HSA), Mannitol.
Das Lösungsmittel und das Verdünnungsmittel enthalten: Natriumchlorid, Phenol, humanes Serum Albumin (HSA) und Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. Sonstige Wechselwirkungen siehe Punkt 4.5 „Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen“.
6.3 Dauer der Haltbarkeit
(Aufbewahrung im Kühlschrank bei +2°C bis +8°C vorausgesetzt):
gefriergetrocknete Insektengifte: Lösungsmittel:
gelöste Insektengifte:
|
36 Monate | ||
|
36 Monate | ||
|
gg/ml |
max. |
6 Monate ab Auflösung |
|
gg/ml |
max. |
6 Monate ab Auflösung |
|
gg/ml |
max. |
6 Monate ab Auflösung |
|
gg/ml |
max. |
6 Monate ab Auflösung |
|
gg/ml |
max. |
1 Tag ab Verdünnung |
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Gefriergetrocknete Insektengifte, gelöste Insektengifte, Lösungs- und Verdünnungsmittel sind im Kühlschrank bei +2°C bis +8°C aufzubewahren. Nicht einfrieren! Lösungen, die einmal eingefroren waren, dürfen nicht mehr verwendet werden.
6.5 Art und Inhalt des Behältnisses
Eine Packung VENOMENHAL Biene bzw. VENOMENHAL Wespe zur Hauttestung und subkutanen spezifischen Immuntherapie enthält lyophilisiertes Insektengift und Lösungsmittel zur Herstellung einer Zubereitung zur subkutanen Injektion:
■ 6 Typ-I-Klarglasflaschen mit jeweils 120 gg gefriergetrocknetem Insektengift, verschlossen mit einem Brombutylstopfen und einer Flip-off-Bördelkappe aus Aluminium.
■ 6 Typ-I-Klarglasflaschen mit jeweils 1,2 ml Lösungsmittel zum Auflösen des gefriergetrockneten Insektengiftes, verschlossen mit einem Brombutylstopfen und einer Flip-off-Bördelkappe aus Aluminium.
Eine Packung VERDÜNNUNGSMITTEL (separat erhältlich) zur Verdünnung der gelösten Insektengifte enthält:
10 Typ-I-Klarglasflaschen mit jeweils 4,5 ml Verdünnungsmittel, verschlossen mit einem durchstechbaren Brombutylstopfen und einer Flip-off-Bördelkappe aus Aluminium.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Verpackungen, äußere Umhüllungen und Arzneimittelreste sind über die dem VfW-Remedica-Verwertungssystem angeschlossenen Apotheken zu entsorgen.
7. INHABER DER ZULASSUNG
HAL Allergie GmbH Poststraße 5-6 40213 Düsseldorf Postfach 13 04 50 40554 Düsseldorf Telefon: (02 11) 9 77 65-0 Telefax: (02 11) 9 77 65-49 E-Mail: info@hal-allergie.de
8./9. ZULASSUNGSNUMMER(N) UND DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
|
Zul.-Nr. |
Zulassung |
Verlängerung | |
|
VENOMENHAL Biene |
191a/96 b |
29.10.1997 |
05.03.2008 |
|
VENOMENHAL Wespe |
192a/96 b |
29.10.1997 |
05.03.2008 |
10. STAND DER INFORMATION
September 2011
11. VERKAUFSABGRENZUNG
Die Präparate VENOMENHAL Biene und VENOMENHAL Wespe sind verschreibungs- und apothekenpflichtig.
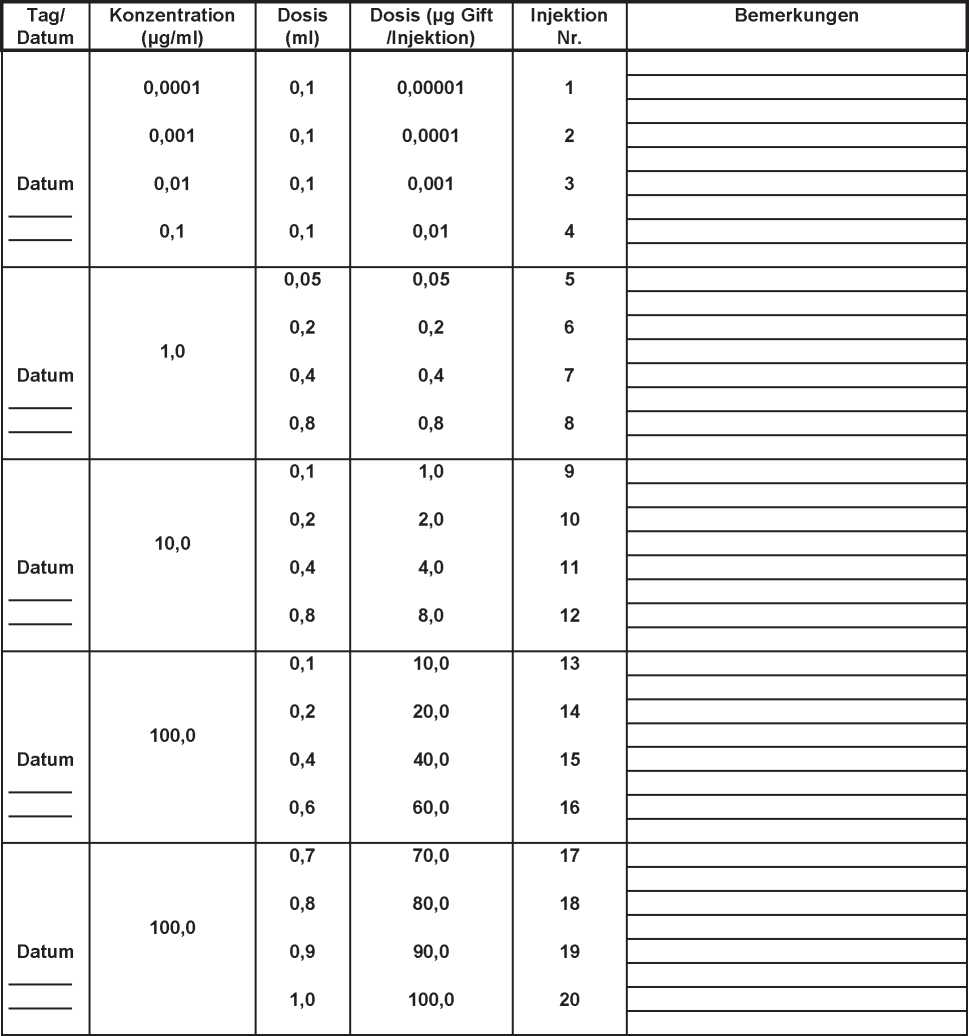
Die Fortsetzung der Therapie folgt den Dosierungsempfehlungen für die Fortsetzungsbehandlung mit der Konzentration von 100 pg Insektengift/ml (siehe Dosierungsschema).
bzw. VENOMENHAL®Wespe
- Einleitungsbehandlung mit wöchentlichen Dosissteigerungen -
|
Konzentration (pg/ml) |
Dosis (ml) |
Dosis (pg Gift /Injektion) |
Injektion Nr. |
Datum |
Bemerkungen |
|
0,0001 0,001 0,01 0,1 |
0,1 0,1 0,1 0,1 |
0,00001 0,0001 0,001 0,01 |
1 2 3 4 | ||
|
1,0 |
0,05 0,1 0,2 0,4 |
0,05 0,1 0,2 0,4 |
5 6 7 8 | ||
|
10,0 |
0,05 0,1 0,2 0,4 |
0,5 1,0 2,0 4,0 |
9 10 11 12 | ||
|
100,0 |
0,05 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 1,0 |
5.0 10.0 20,0 30.0 40.0 50.0 60.0 70.0 80.0 100,0 |
13 14 15 16 17 18 19 20 21 22 | ||
Begonnen wird mit 0,1 ml einer Konzentration, die 1000-fach (Prick) bis 10-fach (Intrakutan) niedriger ist als diejenige, die im Hauttest ein positives Ergebnis auslöste (siehe Text). Vorsicht bei der Dosissteigerung! Die individuelle Verträglichkeit ist immer zu beachten!
Dosierungsschema zur Immuntherapie mit VENOMENHAL®Biene bzw. VENOMENHAL®Wespe
- Fortsetzungsbehandlung mit der individuell vertragenen Erhaltungsdosis -Die Erhaltungsdosis sollte möglichst 100 ^g Insektengift/ml betragen (Erreichte Erhaltungsdosis:_ml der Konzentration_^g/ml)
|
Injektionsintervalle |
Dosis (ml) |
Dosis (pg Gift /Injektion) |
Injektion Nr. |
Datum |
Bemerkungen |
|
1 Woche nach Ende der Einleitungsbehandlung / Schnellhyposensibilisierung |
1,01 |
100,01 | |||
|
2 Wochen nach vorausgegangener Injektion |
1,01 |
100,01 | |||
|
3 Wochen nach vorausgegangener Injektion |
1,01 |
100,01 | |||
|
4 Wochen nach vorausgegangener Injektion |
1,01 |
100,01 | |||
|
weiter alle 4 Wochen |
1,01 |
100,01 | |||
|
1,01 |
100,01 | ||||
|
1,01 |
100,01 | ||||
|
1,01 |
100,01 | ||||
|
1,01 |
100,01 | ||||
|
1,01 |
100,01 |
Behandlung von Nebenwirkungen Symptome und Notfallmaßnahmen
|
Symptome |
Behandlung | |
|
Grad 0 (Lokalreaktion) |
Übermäßige Schwellung/Rötung der Injektionsstelle |
Allergenzufuhr beenden, Staubinde oberhalb der Injektionsstelle. Je nach Schweregrad zusätzlich kühlen und Antihistaminikagabe (evtl. oral); ggf. subkutane Um- und Unterspritzung der Injektionsstelle mit 0,1 - 0,2 mg Adrenalin (1:10.000 (0,1 mg/ml) in einem ausreichenden Volumen 0,9% NaCl) |
|
Grad I (leichte Allgemein reaktion) |
Haut und Schleimhäute: Juckreiz, Erythem (Flush), Urtikaria, Angio-(Quincke) Ödem |
Basismaßnahmen: Lagerung, i.v. Zugang, Volumen (Kristalloid) ■ Antihistaminika H1 i.v. ■ Glukokortikoid i.v. Nachbeobachtung. Blutdruck und Puls kontrollieren. |
|
Grad II (ausgeprägte Allgemein reaktion) |
Haut- und Schleimhautbeschwerden wie bei Grad I (nicht obligat) Gastrointestinal: Nausea, Krämpfe Respirationstrakt: Rhinorrhö, Heiserkeit, Dyspnoe Herz-Kreislauf: Tachykardie, Hypotonie |
Basismaßnahmen: Lagerung, i.v. Zugang, Volumen (Kristalloid) Vorwiegend kardiovaskulär: ■ Adrenalin i.m. ■ Volumen ■ Glukokortikoid i.v. ■ Sauerstoff ■ Antihistaminikum H1 + H2 i.v. Vorwiegend Atemwege: ■ Adrenalin inhalativ, evtl. i.m. ■ ß2-Agonisten inhalativ ■ Antihistaminikum H1 i.v. ■ Glukokortikoid i.v. ■ evtl. ß2-Agonisten i.v. ■ Sauerstoff Stationäre Überwachung. |
|
Grad III (starke Allgemein reaktion) |
Haut- und Schleimhautbeschwerden wie bei Grad I (nicht obligat) Gastrointestinal: Erbrechen, Defäkation Respirationstrakt: Larynxödem, Bronchospasmus, Zyanose Herz-Kreislauf: Schock |
Basismaßnahmen: Lagerung, i.v. Zugang, Volumen (Kristalloid) ■ Adrenalin i.m. ■ Kolloid ■ evtl. Adrenalin i.v. (1 mg Adrenalin in 10 ml NaCl 0,9% verdünnen, das heißt 1:10.000). Langsam milliliterweise injizieren! Minütliche Kreislauf- und Pulskontrolle. ■ Glukokortikoid i.v. ■ Sauerstoff ■ Antihistaminikum H1 + H2 i.v. Stationäre Überwachung. |
|
Grad IV (vitales Organversagen) |
Haut- und Schleimhautbeschwerden wie bei Grad I (nicht obligat) Gastrointestinal: Erbrechen, Defäkation Respirationstrakt: Atemstillstand Herz-Kreislauf: Kreislaufstillstand |
Reanimation ■ Adrenalin i.m. ■ i.v. Zugang ■ Adrenalin i.v. Verlegung auf Intensivstation. |
Gelingt es nicht, einen venösen Zugang zu legen, ist ab Schweregrad II mit zunehmender kardiovaskulärer Symptomatik die sofortige intramuskuläre Applikation von 0,3 - 0,5 mg Adrenalin (bei Kindern 0,1 mg/10 kg Körpergewicht) in die Außenseite des Oberschenkels die medikamentöse Therapie der ersten Wahl, die bei Bedarf in Abhängigkeit von Wirkung und Nebenwirkung alle 10 - 15 Minuten wiederholt werden kann.
Dieses Schema kann als Richtlinie dienen. Je nach Einzelfall kann ein abweichendes ärztliches Handeln erforderlich werden. Die Dosisangaben sind bei Kindern grundsätzlich dem Lebensalter bzw. Körpergewicht entsprechend zu reduzieren.
Die individuelle Erhaltungsdosis kann niedriger als 1,0 ml der Stammlösung (100 gg Insektengift/ml) sein.