Venomenhal Wespe (Fortsetzungsbehandlung)
Fachinformation
1 BEZEICHNUNG DES ARZNEIMITTELS
VENOMENHAL Biene 100 Mikrogramm/ml, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung und Hauttestlösung
VENOMENHAL Wespe 100 Mikrogramm/ml, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung und Hauttestlösung
2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG VENOMENHAL Biene
Jede Durchstechflasche VENOMENHAL Biene enthält 120 Mikrogramm reines gefriergetrocknetes Insektengift von Honigbienen (Apis mellifera). Nach der Rekonstitution beträgt die Konzentration 100 Mikrogramm/ml.
VENOMENHAL Wespe
Jede Durchstechflasche VENOMENHAL Wespe enthält 120 Mikrogramm reines gefriergetrocknetes Insektengift von Wespen (Vespula germanica, Vespula vulgaris). Nach der Rekonstitution beträgt die Konzentration 100 Mikrogramm/ml.
Natriumchlorid
Die rekonstituierte Lösung von 100 Mikrogramm/ml enthält 4 mg/ml Natriumchlorid.
Das Lösungsmittel von VENOMENHAL Biene und VENOMENHAL Wespe enthält 4 mg/ml Natriumchlorid.
Das Verdünnungsmittel von VENOMENHAL Biene und VENOMENHAL Wespe enthält 7,6 mg/ml Natriumchlorid.
Die vollständige Auflistung der sonstigen Bestandteile entnehmen Sie Abschnitt 6.1.
3 DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung und Hauttestlösung.
VENOMENHAL Biene und VENOMENHAL Wespe enthalten gefriergetrocknetes Insektengift als weißes Pulver. Das Lösungsmittel ist eine klare Lösung.
4 KLINISCHE ANGABEN
4.1 Anwendungsgebiete
VENOMENHAL Biene oder VENOMENHAL Wespe ist angezeigt zur Hauttestung (Prick-, Intrakutantestung) und kausalen Behandlung (spezifische Immuntherapie) von Patienten mit einer IgE-vermittelten Insektengiftallergie, bei denen systemische Reaktionen nach Bienen- oder Wespenstich aufgetreten sind.
Die Diagnosestellung muss auf der Grundlage einer sorgfältigen Anamnese und der Allergenexposition des Patienten erfolgen.
4.2 Dosierung und Art der Anwendung Dosierung bei Hauttestung
Zur Ermittlung der individuellen Ausgangskonzentration bei der jeweiligen Immuntherapie werden titrierte Hauttests durchgeführt.
■ Im Pricktest übliche Konzentrationsstufen sind 1 Mikrogramm, 10 Mikrogramm und 100 Mikrogramm Insektengift/ml. Tritt im Pricktest keine Reaktion auf, so wird ein Intrakutantest mit 0,1 Mikrogramm/ml und 1 Mikrogramm/ml durchgeführt.
■ Kommt es bereits bei der niedrigsten dieser Testkonzentrationen zu einer Reaktion, so werden weitere Verdünnungsstufen hergestellt und zusätzlich getestet. Die niedrigste Konzentration im Pricktest, die eine Quaddel von > 3 mm Durchmesser erzeugt, ist dann der Endpunkt der Titration.
Doc name: Based on date chars pages
■ Anstelle von Pricktests können auch ausschließlich Intrakutantests durchgeführt werden. Der Intrakutantest ist etwa 100 - 1000 Mal sensitiver als der Pricktest. Die Ausgangskonzentration für die Testreihe beträgt normalerweise 0,001 Mikrogramm Insektengift/ml.
■ Wird bereits bei dieser Konzentration eine deutliche Reaktion beobachtet, so muss der Endpunkt mit noch niedrigeren Konzentrationen bestimmt werden. Ist bei 0,001 Mikrogramm/ml keine Reaktion aufgetreten, wird die Testung mit steigenden Konzentrationen (0,01, 0,1 Mikrogramm/ml und 1 Mikrogramm/ml) in Abständen von 20 Minuten fortgesetzt. Höhere Konzentrationen als 1 Mikrogramm/ml werden nicht getestet, da sie unspezifische Reaktionen auslösen können. Die niedrigste Konzentration, die eine Quaddel von > 5 mm Durchmesser zeigt, ist der Titrationsendpunkt.
Dosierung bei Immuntherapie
Die Immuntherapie besteht aus einer Einleitungsbehandlung mit einer stufenweisen Steigerung der Dosis bis zur Erhaltungsdosis und der anschließenden Fortsetzungsbehandlung mit wiederholter Verabreichung der Erhaltungsdosis. Die Erhaltungsdosis beträgt in der Regel 100 Mikrogramm Insektengift pro Injektion. Bei der Fortsetzungsbehandlung werden die Injektionsintervalle allmählich von anfangs 1 Woche bis auf 4 Wochen ausgedehnt. Nach dem ersten Behandlungsjahr können die Intervalle auf 4 bis 6 Wochen ausgedehnt werden.
Die nachfolgend für beide Behandlungsarten angegebenen Dosierungshinweise können höchstens Empfehlungen, keinesfalls jedoch generelle Richtlinien sein. Die Dosierung ist immer der individuellen Verträglichkeit des Patienten anzupassen. Gleiches gilt für eine Überschreitung des Injektionsintervalls.
Einleitungsbehandlung
In der Regel wird die Einleitungsbehandlung bis zum Erreichen der Erhaltungsdosis von 1 ml der Konzentrationsstufe 100 Mikrogramm Insektengift/ml stationär mit mehreren Injektionen steigender Dosis pro Tag als Schnellhyposensibilisierung durchgeführt. Ist die Aufnahme in eine Klinik unmöglich oder unerwünscht, kann die Einleitungsbehandlung auch ambulant mit einer Injektion pro Woche durchgeführt werden.
Dosierung bei stationärer Einleitungsbehandlung als Schnellhyposensibilisierung
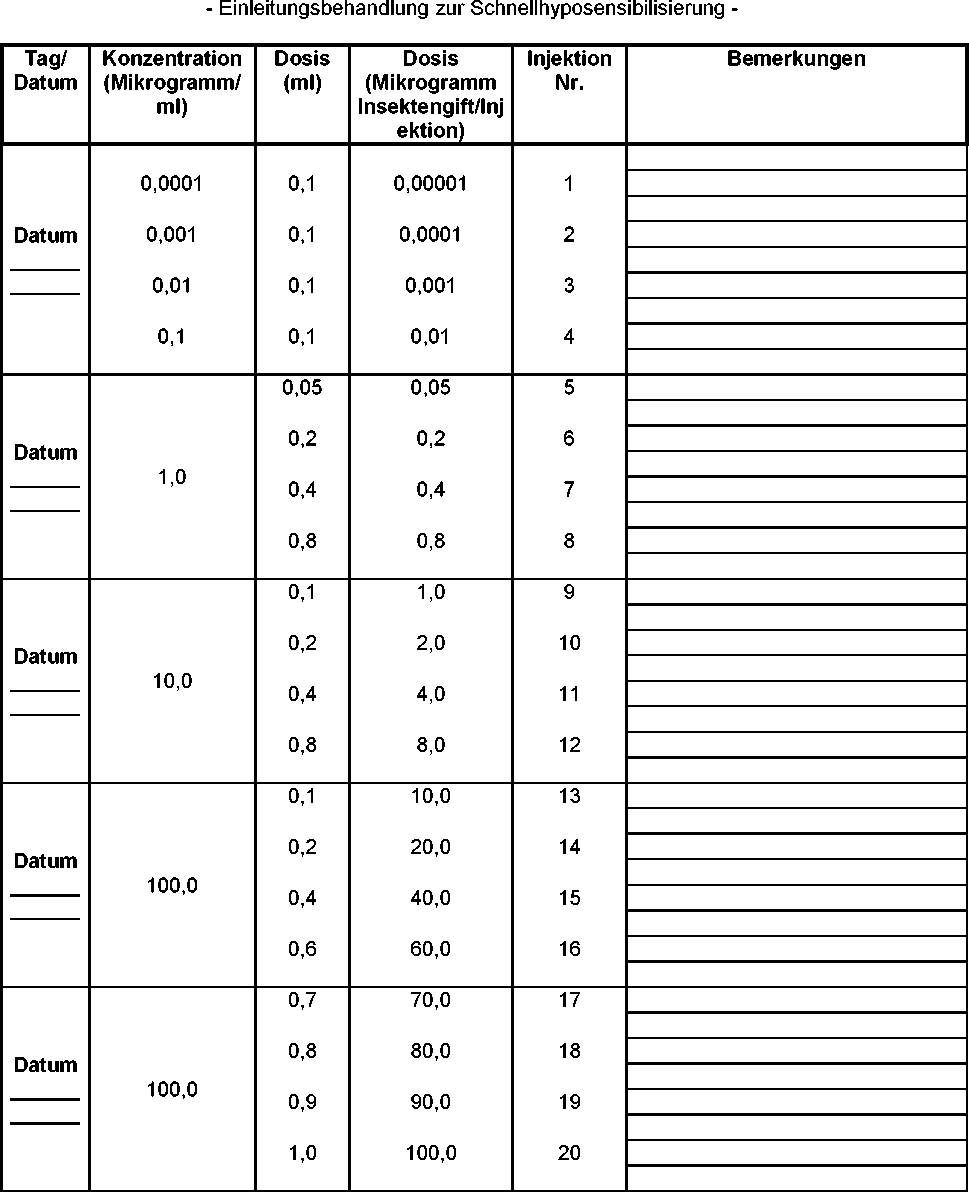
Die Behandlung beginnt mit einer Dosis von 0,1 ml der Konzentrationsstufe 0,0001 Mikrogramm Insektengift/ml. Vom ersten bis zum fünften Tag erhält der Patient täglich - jeweils im Abstand von zwei Stunden - 4 Injektionen in steigenden Konzentrationen. Die Erhaltungsdosis von 1 ml der Konzentration 100 Mikrogramm Insektengift/ml wird am fünften Tag erreicht (siehe Dosierungsschema: Einleitungsbehandlung zur Schnellhyposensibilisierung).
Die Therapie wird als Fortsetzungsbehandlung mit dieser Erhaltungsdosis ambulant weitergeführt, wobei das Injektionsintervall stufenweise von 7 über 14 und 21 auf 28 Tage ausgedehnt wird (siehe Dosierungsschema: Fortsetzungsbehandlung mit der individuell vertragenen Erhaltungsdosis).
Dosierung bei ambulanter Einleitungsbehandlung mit wöchentlichen Injektionen
Kommt eine stationäre Behandlung nicht in Betracht, kann die Immuntherapie auch ambulant erfolgen, das heißt, mit je einer subkutanen Injektion alle 7 Tage in langsam steigenden Dosen (siehe Dosierungsschema: Einleitungsbehandlung mit wöchentlicher Dosissteigerung und Dosierungsschema: Fortsetzungsbehandlung mit der individuell vertragenen Erhaltungsdosis).
Die Wahl der Anfangsdosis orientiert sich immer am Sensibilisierungsgrad des Patienten, ist also abhängig von der Anamnese und vom Ergebnis der Endpunkttitration.
Anfangsdosis bei Bestimmung des Endpunktes durch Pricktest:
Die Anfangsdosis beträgt 0,1 ml einer 1:1000-Verdünnung der im Pricktest ermittelten EndpunktKonzentration.
Anfangsdosis bei Bestimmung des Endpunktes durch Intrakutantest:
Doc name: Based on date chars pages
Die Anfangsdosis beträgt 0,1 ml einer 1:10-Verdünnung der im Intrakutantest ermittelten EndpunktKonzentration.
Zur Sicherstellung der kontinuierlichen Behandlung muss rechtzeitig vor Anbruch der letzten Flasche eine neue Packung mit 6 Flaschen gefriergetrocknetem Insektengift und 6 Durchstechflaschen mit Lösungsmittel bestellt werden.
Fortsetzungsbehandlung
Die Erhaltungsdosis von 1 ml der Konzentrationsstufe 100 Mikrogramm Insektengift/ml sollte angestrebt und möglichst erreicht werden, auch bei hoch sensibilisierten Patienten und Kindern. Werden bei einem Patienten nach Erreichen der empfohlen Erhaltungsdosis von 100 Mikrogramm Insektengift pro Injektion systemische allergische Reaktionen auf einen Insektenstich beobachtet, kann es nötig sein, die Erhaltungsdosis auf 200 Mikrogramm zu erhöhen. Exponierte Erwachsene (beispielsweise Imker mit Bienengiftallergie) oder Erwachsene mit schwerer Stichreaktion in der Anamnese, erhöhter basaler Serumtryptasekonzentration, Mastozytose u.a. können von Anfang an mit einer erhöhten Erhaltungsdosis von 200 Mikrogramm/ml behandelt werden.
Die Erhöhung der üblichen Erhaltungsdosis von 100 auf 200 Mikrogramm kann in 3 Schritten erfolgen (Injektion im Abstand von 30 Minuten):
Tag 1: 100 Mikrogramm/20 Mikrogramm/30 Mikrogramm Tag 2: 150 Mikrogramm/20 Mikrogramm/30 Mikrogramm Tag 3: 200 Mikrogramm
Dosisanpassung bei gesteigerter Reaktion
Das Auftreten lokaler oder systemischer Reaktionen im Zusammenhang mit der Injektion von VENOMENHAL Biene oder VENOMENHAL Wespe erfordert eine unverzügliche Behandlung (siehe Tabelle: „Behandlung von Nebenwirkungen“) und macht eine Anpassung der Dosierung erforderlich.
Dosisanpassung bei gesteigerter Reaktion
|
Maximaler Durchmesser der Schwellung | ||
|
Kinder |
Erwachsene |
Empfohlene Dosisreduktion |
|
< 5 cm |
< 8 cm |
Dosis weiter gemäß Dosierungsschema steigern |
|
5-7 cm |
8-12 cm |
Dosis der letzten Injektion wiederholen |
|
7-12 cm |
12-20 cm |
Eine Dosisstufe im Schema zurückgehen |
|
12-17 cm |
> 20 cm |
Zwei Dosisstufen im Schema zurückgehen |
|
>17 cm |
Drei Dosisstufen im Schema zurückgehen | |
|
Milde Allgemeinreaktion |
Dosisreduktion auf 1/2 der letzten Dosis, die Therapie ggf. mit Zwischenschritten fortsetzen | |
|
Schwere Allgemeinreaktion |
Dosisreduktion auf 1/10 der letzten Dosis, die Therapie ggf. mit Zwischenschritten fortsetzen | |
Mehrmalige schwere Allgemeinreaktionen oder anaphylaktischer Schock erfordern eine Überprüfung der Therapieindikation. Sicherheitshalber sollte die Therapie im Falle der Weiterbehandlung neu eingeleitet werden.
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
3 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5_clean |
Intervallüberschreitung
War die Einhaltung der empfohlenen Intervalle im Rahmen der ambulanten Immuntherapie nicht möglich (z. B. wegen einer akuten Erkrankung oder einer Schutzimpfung, siehe Abschnitt 4.5), kann eine Änderung der Dosierung notwendig werden.
Intervallüberschreitung in der Einleitungsbehandlung mit wöchentlichen Injektionen
Wird in Ausnahmefällen ein Intervall von 1 Woche überschritten, so darf die Dosis nicht weiter
gesteigert, sondern nur wie folgt angepasst werden:
|
Intervallüberschreitung von bis zu 1 Woche (max. 2 Wochen seit der letzten Injektion) |
Dosis nicht steigern. Wiederholung der letzten Dosis |
|
Intervallüberschreitung von bis zu 2 Wochen (2 bis 3 Wochen seit der letzten Injektion) |
Reduktion auf 1/2 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von bis zu 3 Wochen (3 bis 4 Wochen seit der letzten Injektion) |
Reduktion auf 1/10 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von mehr als 3 Wochen (mehr als 4 Wochen seit der letzten Injektion) |
Neubeginn der Therapie (mit individueller Anfangsdosis) |
Intervallüberschreitung in der Fortsetzungsbehandlung mit monatlichen Injektionen
Wird in Ausnahmefällen ein Intervall von 4 Wochen überschritten, so muss die Dosis wie folgt
reduziert werden.
|
Reguläres Intervall von 4 Wochen |
Reguläres Intervall von 6 Wochen (nur nach einjähriger Behandlung) |
Dosisreduktion |
|
Intervallüberschreitung von bis zu 2 Wochen (4 bis 6 Wochen seit der letzten Injektion) |
Intervallüberschreitung von bis zu 2 Wochen (6 bis 8 Wochen seit der letzten Injektion) |
Reduktion auf 3/4 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von 2 bis 4 Wochen (6 bis 8 Wochen seit der letzten Injektion) |
Intervallüberschreitung von 2-4 Wochen (8 bis 10 Wochen seit der letzten Injektion) |
Reduktion auf 1/2 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von 4 bis 6 Wochen (8 bis 10 Wochen seit der letzten Injektion) |
Intervallüberschreitung von 4-6 Wochen (10 bis 12 Wochen seit der letzten Injektion) |
Reduktion auf 1/4 der zuletzt verabreichten Dosis |
|
Intervallüberschreitung von mehr als 6 Wochen (mehr als 10 Wochen seit der letzten Injektion) |
Intervallüberschreitung von mehr als 6 Wochen (mehr als 12 Wochen seit der letzten Injektion) |
Neubeginn der Therapie (mit individueller Anfangsdosis) |
Nach einer Dosisreduktion wird wiederum bis zur individuellen Erhaltungsdosis gesteigert. Die Steigerung erfolgt mit Injektionsintervallen von (3 bis) 7 Tagen und entspricht dem Dosierungsschema für die Einleitungsbehandlung mit wöchentlicher Dosissteigerung.
Dauer der Anwendung
Die Immuntherapie mit VENOMENHAL Biene oder VENOMENHAL Wespe sollte 3-5 Jahre lang ohne Unterbrechung durchgeführt werden. Dies gilt in besonderem Maße für Patienten, bei denen nach einem Insektenstich lebensbedrohliche systemische Reaktionen aufgetreten sind. Bei besonderen Risikofaktoren ist eine Therapie über mehr als 5 Jahre angezeigt, vor allem Patienten mit Mastozytose oder erhöhtem basalem Serum-Tryptasespiegel sind ggf. lebenslang zu hyposensibilisieren.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von VENOMENHAL Biene und VENOMENHAL Wespe bei Kindern unter 5 Jahren wurden nicht untersucht. Es liegen keine Daten vor.
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
4 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5_clean |
Bei Kindern ab 5 Jahren liegen nur wenige klinische Daten über die Effektivität vor. Zur Dosisanpassung nach dem Auftreten von Nebenwirkungen siehe Tabelle „Dosisanpassung bei gesteigerter Reaktion“.
Für Kinder ab 5 Jahren und Jugendliche wird dieselbe Dosierung wie für Erwachsene empfohlen.
Bei Kindern im Vorschulalter wird eine zusätzliche Intrakutantestung nach einem negativen Pricktest nicht empfohlen.
Ältere Patienten
Bei älteren Patienten ist eine generelle Dosisanpassung nicht erforderlich. Dennoch sollten spezifische Umstände, die in dieser Personengruppe häufiger vorkommen können, berücksichtigt werden (siehe hierzu auch Abschnitt 4.4).
Art der Anwendung
Angaben zur Zubereitung und Verdünnung und zu speziellen Maßnahmen vor und nach der Injektion siehe Abschnitt 6.6. Nach der Rekonstitution ist das Produkt eine klare Lösung.
Hauttest
Testort ist die Innenseite des Unterarmes. Die Hauttestung beginnt immer mit einem Pricktest, um zusätzliche Anhaltspunkte für den Sensibilisierungsgrad des Patienten zu erhalten. Bei Patienten mit schweren Stichreaktionen oder anderen Risikofaktoren müssen besondere Vorsichtsmaßnahmen getroffen werden (siehe Abschnitt 4.4). Die Hauttests sollten in jedem Fall sowohl mit Bienengift als auch mit Wespengift durchgeführt werden.
■ Die Hauttests sollten möglichst bald, aber frühestens 2 Wochen nach dem Insektenstich vorgenommen werden. Möglicherweise könnte eine zweimalige Hauttestung unmittelbar nach dem Stich und nach 4 - 6 Wochen zuverlässiger sein. Neben einer Refraktärperiode durch die anaphylaktische Reaktion (die Empfindlichkeit des Patienten nach einem Stich ist häufig für eine gewisse Zeit herabgesetzt) ist auch die möglicherweise notfallmäßig verabreichte Medikation bei der Testung zu berücksichtigen.
■ Beim Pricktest wird ein Tropfen des aufgelösten und verdünnten Insektengiftes auf die Haut aufgebracht. Die Tropfen sollten einen Abstand von mindestens 3 cm voneinander haben. Durch den Tropfen hindurch wird mit einer Pricklanzette die Haut oberflächlich senkrecht durchstochen. Es sollen keine Blutungen entstehen.
■ Die Intrakutantestung erfolgt durch langsame Injektion von 0,02-0,05 ml des aufgelösten und verdünnten Insektengiftes mit einer Tuberkulinspritze in die oberste Hautschicht am Unterarm des Patienten. Die Injektionen sollten einen Abstand von mindestens 5 cm voneinander haben.
■ Die Hautreaktion wird bei beiden Tests nach 15 - 20 Minuten beurteilt. Während dieser Zeit sollte der Patient am Testort nicht reiben oder sich kratzen. Zur Erfassung von verzögerten oder späten Reaktionen ist eine weitere Ablesung am Folgetag angezeigt.
■ Pricktest und Intrakutantest machen für jeden Patienten die Verwendung neuer Lanzetten bzw. Spritzen mit Kanülen erforderlich.
■ Bei beiden Testmethoden ist immer eine Negativ-Kontrolle mit dem HSA-haltigen Verdünnungsmittel durchzuführen. Eine Positiv-Kontrolle mit einer Histaminlösung (1%ig im Falle des Pricktests bzw. 0,01%ig im Falle des Intrakutantests) sollte ebenfalls bei beiden Testmethoden immer vorgenommen werden.
■ Diagnostisch verwertbar sind die Hauttestergebnisse nur, wenn auf die Negativkontrolle keine (maximaler Quaddeldurchmesser < 2 mm), auf die Histaminkontrolle eine eindeutige Reaktion (Quaddeldurchmesser beim Pricktest mindestens 3 mm, beim Intrakutantest mindestens 5 mm Durchmesser) auftritt. Falls doch, könnte dies auf eine Überreagibilität der Haut hindeuten. In diesem Fall sollte der Test zu einem späteren Zeitpunkt wiederholt werden. Wenn der Quaddeldurchmesser der Negativkontrolle mehr als 2 mm beträgt, ist der Hauttest nicht auswertbar.
■ Die Hauttests werden im Allgemeinen schrittweise mit ansteigender Konzentration der aufgelösten und verdünnten Insektengifte zur Erfassung der Reaktionsschwelle durchgeführt (Endpunkttitration).
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
5 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5 clean |
■ Die Schwellenkonzentration ist die niedrigste Giftkonzentration, auf die eine eindeutige Soforttypreaktion auftritt. Bis zum Auftreten einer eindeutig positiven Reaktion (Quaddeldurchmesser im Pricktest > 3 mm, im Intrakutantest > 5 mm) wird die Giftkonzentration je nach Testart gesteigert.
Immuntherapie
Für die Injektionen des aufgelösten und verdünnten Insektengiftes werden entsprechend graduierte Einmalspritzen verwendet. Die Injektion ist streng subkutan an der Außenseite des Oberarmes ca. handbreit oberhalb des Ellenbogens zu verabreichen.
4.3 Gegenanzeigen Pricktest und Intrakutantest
■ Sekundärinfektionen der Haut (Keimverschleppung).
■ Akute und chronische Ekzeme, z. B. atopische Dermatitis im Testbereich, sekundär entzündliche oder sekundär degenerative Dermatitis (z. B. Ichthyosis, Sklerodermie). Generalisierte Urtikaria und Urtikaria factitia können die Reagibilität der Haut verändern und die Aussagekraft von Hauttestungen stark beeinflussen.
■ Akute schwere allergische Reaktion im Testbereich.
■ Schweres therapeutisch nicht adäquat eingestelltes Asthma bronchiale, insbesondere bei einem FEV1 unter 70 % des Sollwertes.
■ Wesentliche Erkrankungen, die den Allgemeinzustand stark beeinträchtigen.
■ Überempfindlichkeit gegen einen der sonstigen Bestandteile (siehe Abschnitt 6.1).
Immuntherapie
■ Akute Entzündungsprozesse/fieberhafte Infektionskrankheiten.
■ Sekundärveränderungen (z. B. Emphysem, Bronchiektasen).
■ Autoimmunerkrankungen (z. B. der Niere, des Nervensystems, der Schilddrüse und rheumatische Erkrankungen).
■ Immundefekte, auch durch Immunsuppressiva induziert (siehe Abschnitt 4.5).
■ Schweres, therapeutisch nicht adäquat eingestelltes Asthma bronchiale, insbesondere bei einem FEV1 unter 70% des Sollwertes.
■ Herz- und Kreislauferkrankungen mit erhöhtem Risiko bei der Anwendung von Adrenalin.
■ Behandlung mit ß-Blockern (auch ß-Blocker enthaltenden Augentropfen) und mit ACE-Hemmern (siehe Abschnitt 4.5).
■ Maligne Tumorerkrankungen mit aktuellem Krankheitswert.
■ Überempfindlichkeit gegen einen der sonstigen Bestandteile (siehe Abschnitt 6.1).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Hyposensibilisierungsimpfstoffe zur subkutanen Immuntherapie dürfen nur durch allergologisch weitergebildete bzw. allergologisch erfahrene Ärzte verschrieben und angewendet werden.
Eine Immuntherapie mit Insektengiften sollte bei Patienten mit den oben aufgeführten Erkrankungen möglichst nicht durchgeführt werden. Es sollte eine individuelle Nutzen-Risiko-Abwägung erfolgen. Wiederholte lebensbedrohliche Stichreaktionen können beispielsweise ungeachtet bestehender Begleiterkrankungen oder bei einer Begleiterkrankung ohne weiteres wesentliches Progressionsrisiko für eine Immuntherapie sprechen.
Besondere Vorsicht ist erforderlich beim Pricktest und Intrakutantest im Falle von:
■ Behandlung mit ß-Blockern (auch ß-Blocker enthaltenden Augentropfen),
■ Herz- und Kreislauferkrankungen mit erhöhtem Risiko bei der Anwendung von Adrenalin,
■ Schwangerschaft.
Der Prick- und Intrakutantest sollten an schwangeren Patienten oder Patienten, die BetaRezeptorenblocker einnehmen, nur durchgeführt werden, wenn vom Testresultat eine wichtige therapeutische Entscheidung abhängt und eine systemische anaphylaktische Reaktion aufgrund der
Doc name: Based on date chars pages
Gesamtumstände mit hoher Wahrscheinlichkeit nicht zu erwarten ist.
Bei Patienten mit schweren Stichreaktionen oder anderen Risikofaktoren sollten die Hauttests stationär mit einer intravenösen Kanüle und Überwachung bis zum nächsten Tag erfolgen.
Besondere Vorsicht ist erforderlich bei einer Immuntherapie im Falle von:
■ Schwangerschaft (siehe Abschnitt 4.6),
■ symptomatischer Anwendung von Antiallergika (z. B. Antihistaminika, Mastzelldegranulationshemmern oder Corticosteroiden, siehe Abschnitt 4.5),
■ deutlich beeinträchtigtem Allgemeinzustand,
■ Anwendung von Immunsuppressiva.
Besondere Maßnahmen vor der Injektion:
■ Befragen des Patienten nach Reaktionen auf die vorausgegangene Injektion, Ausschluss akuter Erkrankungen.
■ Befragen des Patienten nach Änderung der Einnahme von Medikamenten.
■ Dosis überprüfen, ggf. Dosisanpassung vornehmen.
■ Ängstlichen oder vegetativ labilen Patienten wird die Injektion zweckmäßigerweise im Liegen verabreicht.
■ Eine intravasale Injektion ist durch Aspirationskontrolle unbedingt auszuschließen. Besondere Maßnahmen nach der Injektion:
■ Der Patient ist darauf hinzuweisen, sich bei später auftretenden Anzeichen einer Nebenreaktion sofort mit dem behandelnden Arzt oder dessen Vertretung in Verbindung zu setzen.
■ Nach der Injektion muss der Patient mindestens 30 Minuten unter ärztlicher Aufsicht bleiben.
Gleichzeitige Behandlung einer Bienen- und Wespengiftallergie: VENOMENHAL Biene und VENOMENHAL Wespe dürfen nicht gemischt werden! Die Behandlung sollte bei Patienten die auf beide Insektengifte allergisch reagieren, zuerst nur mit einem Gift begonnen werden. Nach Erreichen der Erhaltungsdosis kann dann die Einleitungsbehandlung mit dem anderen Insektengift erfolgen. In der Fortsetzungsbehandlung ist es empfehlenswert, einen Abstand von mindestens 2 - 3 Tagen zwischen den verschiedenen Insektengiftinjektionen einzuhalten.
Der Arzt befragt den Patienten zu bestehenden Begleiterkrankungen und Reaktionen auf frühere Injektionen.
Die Therapie mit VENOMENHAL Biene oder VENOMENHAL Wespe wird mit selbst hergestellten Verdünnungen aus dem zuvor aufgelösten Insektengift durchgeführt. Eine sorgfältige und umgehende Beschriftung der Verdünnungsstufen ist unbedingt zu beachten. Vor jeder Anwendung sollte immer geprüft werden, ob die richtige Konzentration ausgewählt wurde, ob das angegebene Haltbarkeitsdatum der Konzentrationsstufe ggf. abgelaufen ist (siehe Abschnitt 6.3) und welches Volumen injiziert werden soll.
Da schon geringfügige Überdosierungen zu lokalen und systemischen Begleitreaktionen führen können, muss zu jeder Zeit eine Notfallapotheke mit allen erforderlichen Medikamenten und Geräten zum sofortigen Einsatz bereit stehen.
Der Patient ist prinzipiell darauf hinzuweisen, dass er sich vor und nach jeder Injektion keiner schweren körperlichen Belastung (z. B. Sport, schwere körperliche Arbeit, auch Sauna oder heißes Duschen) unterziehen sollte.
VENOMENHAL Biene und VENOMENHAL Wespe enthalten Natrium, jedoch weniger als 1 mmol (23 mg) Natrium pro ml.
Kinder und Jugendliche
Bei Kindern unter 5 Jahren sollte eine besonders sorgfältige Nutzen- / Risikoabwägung erfolgen. Bei Kindern ab 5 Jahren liegen nur wenige klinische Daten über die Effektivität vor, Sicherheitsdaten deuten jedoch auf kein erhöhtes Risiko im Vergleich zu Erwachsenen hin.
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
7 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5 clean |
Ältere Patienten
Bei älteren Patienten sollte eine erhöhte Wahrscheinlichkeit für das Vorliegen einer Begleiterkrankung (z.B. Herz-Kreislauf- oder Atemwegserkrankungen, erhöhte Serumtryptase) oder anderer Risikofaktoren (z.B. höheres Risiko, eine schwere systemische Stichreaktion zu erleiden) beachtet werden, die zu Kontraindikationen, Wechselwirkungen mit anderen Medikamenten führen und/oder Dosisanpassungen erforderlich machen könnten. Siehe hierzu auch die Abschnitte 4.2, 4.3 und 4.5.
4.5 Wechselwirkungen mit anderen Arzneimitteln und andere Wechselwirkungen
Es wurden keine Studien zu Wechselwirkungen durchgeführt.
Eine begleitende Immuntherapie könnte die Toleranzgrenze des Patienten für VENOMENHAL Biene oder VENOMENHAL Wespe verändern.
Eine Immuntherapie sollte grundsätzlich nicht parallel zu einer Behandlung mit Immunsuppressiva (siehe Abschnitt 4.4), ß-Blockern (inklusive ß-Blocker enthaltender Augentropfen) und ACE-Hemmern durchgeführt werden (siehe Abschnitt 4.3).
Bei einer begleitenden Therapie mit symptomatischen Antiallergika (z. B. Antihistaminika, Mastzelldegranulationshemmer oder Corticosteroiden) ist mit einer Beeinflussung der Reagibilität der Haut zur rechnen, so dass Hauttestergebnisse verfälscht werden können.
Eine Dosisreduktion oder das Absetzen symptomatischer Antiallergika kann die Toleranzgrenze des Patienten beeinflussen, so dass die bis dahin erreichte Dosis bei der Immuntherapie gegebenenfalls verringert werden muss, um allergische Nebenwirkungen zu vermeiden (siehe Abschnitt 4.4).
Schutzimpfungen sollten frühestens 7 Tage nach der letzten Injektion von VENOMENHAL Biene oder VENOMENHAL Wespe durchgeführt werden (außer bei lebensbedrohlichen Situationen). Die nächste Injektion von VENOMENHAL Biene oder VENOMENHAL Wespe sollte erst nach vollständigem Abklingen der Impfreaktion, frühestens jedoch 14 Tage nach der Impfung erfolgen (siehe Abschnitt 4.2).
VENOMENHAL Biene darf niemals mit VENOMENHAL Wespe gemischt werden!
Anwendung von VENOMENHAL Biene und VENOMENHAL Wespe zusammen mit Nahrungsmitteln und alkoholischen Getränken
Wechselwirkungen mit Nahrungsmitteln und alkoholischen Getränken sind unbekannt und in Anbetracht der Wirkungsweise von VENOMENHAL Biene oder VENOMENHAL Wespe nicht zu erwarten.
4.6 Fertilität, Schwangerschaft und Stillzeit Fertilität
Es liegen keine Daten über den Einfluss von VENOMENHAL Biene oder VENOMENHAL Wespe auf die Fertilität vor.
Schwangerschaft
Es liegen keine ausreichenden tierexperimentellen Studien in Bezug auf die Reproduktionstoxizität vor (siehe Abschnitt 5.3).
Die Anwendung von VENOMENHAL Biene und VENOMENHAL Wespe während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, wird nicht empfohlen.
Nach sorgfältiger Abwägung und im Einverständnis mit der Patientin könnte eine etablierte und gut vertragene Behandlung mit VENOMENHAL Biene oder VENOMENHAL Wespe fortgesetzt werden.
Stillzeit
VENOMENHAL Biene und VENOMENHAL Wespe zeigte keine Auswirkungen auf gestillte Neugeborene/Kinder von behandelten Müttern.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von
|
Maschinen | ||||
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
8 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5_clean |
VENOMENHAL Biene und VENOMENHAL Wespe haben einen geringen Einfluss auf die Verkehrstüchtigkeit und das Bedienen von Maschinen. In sehr seltenen Fällen kann eine leichte Müdigkeit auftreten, was beim Führen von Kraftfahrzeugen und beim Bedienen von Maschinen zu berücksichtigen ist.
4.8 Nebenwirkungen
Auch bei korrekter Anwendung sind Nebenwirkungen nicht völlig auszuschließen. Neben Lokalreaktionen können bei der Hauttestung und der Therapie systemische Reaktionen unterschiedlicher Schweregrade auftreten.
Insbesondere bei hochgradig sensibilisierten Patienten kann es zu folgenden verstärkten allergischen Reaktionen kommen, die in der Regel innerhalb von 30 Minuten nach der Injektion auftreten. Nebenwirkungen können auch mehrere Stunden nach der Injektion auftreten (verzögerte Reaktionen). In solchen Fällen ist über die Fortsetzung der Therapie individuell zu entscheiden.
Ein erhöhtes Risiko für systemische Reaktionen besteht während der Einleitungsbehandlung insbesonders bei Patienten mit Mastozytose bei erhöhter basaler Serumtryptase-Konzentration und bei Behandlung mit Bienengift. Bei Frauen ist das Risiko systemischer Reaktionen erhöht.
In seltenen Fällen ist auch ein anaphylaktischer Schock möglich. Typische Alarmsymptome sind Brennen, Jucken und Hitzegefühl auf und unter der Zunge, im Rachen und vor allem an den Handinnenflächen und Fußsohlen.
Die nachstehenden Angaben sind nach MedDRA-Systemorganklassen geordnet.
Die aufgeführten Nebenwirkungen können generell bei spezifischer Immuntherapie mit Insektengiftpräparaten auftreten. Zur Häufigkeit von Nebenwirkungen liegen keine aussagekräftigen Angaben aus klinischen Studien mit den VENOMENHAL Insektengiftpräparaten vor.
Erkrankungen des Immunsystems
Anaphylaktischer Schock
Erkrankungen des Nervensystems Kopfschmerz
Gefäßerkrankungen
Gesichtsrötung (Flush)
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Husten, Dyspnoe, Giemen
Erkrankungen des Gastrointestinaltraktes
Diarrhö, Dyspepsie, Übelkeit, Erbrechen
Erkrankungen der Haut und des Unterhautzellgewebes
Juckreiz, Ausschlag, Urtikaria Angioödem, Ekzem, Erythem
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Arthralgie
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Schwellung an der Injektionsstelle
Unwohlsein, Müdigkeit, Pruritus an der Injektionsstelle, Urtikaria an der Injektionsstelle Krankheitsgefühl, Schmerzen, Fieber, Schwellung
|
Untersuchungen | ||||
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
9 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5 clean |
Pulsanomalien, Blutdruckanomalien
Beim Auftreten von Nebenwirkungen, auch solchen, die nicht in dieser Packungsbeilage aufgeführt sind, soll der Patient diese umgehend dem Arzt mitteilen.
Die Höhe der Erhaltungsdosis sollte sich in erster Linie an der individuellen Verträglichkeit des Patienten orientieren. Treten Nebenwirkungen auf, sind ggf. Dosisanpassungen notwendig.
Bei der Behandlung einer verstärkten lokalen Reaktion, einer leichten bis verstärkten systemischen Reaktion oder bei einer schweren systemischen Reaktion und anaphylaktischem Schock sollte der Arzt sich nach den jeweils gültigen Leitlinien richten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen,Tel: +49 6103 77 0, Fax: +49 6103 77 1234, Website: www.pei.de, anzuzeigen.
4.9 Überdosierung
Eine Überdosierung kann zu allergischen Reaktionen bis hin zum anaphylaktischen Schock führen. Zur Behandlung von Nebenwirkungen siehe Abschnitt 4.8.
5 PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Insektengift-Allergenextrakt ATC-Code: V01AA07 (Insekten)
Gefriergetrocknetes Bienen- oder Wespengift für die Hauttestung und spezifische Immuntherapie (Hyposensibilisierung).
Hauttestung
Die in der Testlösung enthaltenen Allergene reagieren bei entsprechender Sensibilisierung des Patienten mit allergenspezifischem Immunglobulin E, das sich auf den Mastzellen der Haut befindet. Diese Antigen-Antikörper-Reaktion führt zur Freisetzung von verschiedenen Mediatorsubstanzen (u. a. Histamin) aus den Mastzellen. Dadurch bildet sich an der Haut eine Quaddel und lokale Hautrötung (Erythem).
Immuntherapie
Die spezifische Immuntherapie mit VENOMENHAL Biene bzw. VENOMENHAL Wespe erhöht die Toleranzschwelle des allergischen Patienten gegenüber Insektengiften von Bienen oder Wespen. Die durch einen Stich ausgelösten systemischen Reaktionen oder eine anaphylaktische Reaktion treten nach der spezifischen Immuntherapie üblicherweise seltener auf. Auf Basis von immunologischen Befunden werden folgende Wirkmechanismen der spezifischen Immuntherapie diskutiert:
• Langfristiger Abfall des IgE-Spiegels
• Anstieg von insektengiftspezifischem IgG
• Toleranzinduktion
• Abnahme der Reaktionsbereitschaft Mediator-sezernierender Zellen
• Umorientierung der T-Zell-Antwort
5.2 Pharmakokinetische Eigenschaften
Keine Angaben.
5.3 Präklinische Daten zur Sicherheit
In einer kleinen nicht-klinischen Studie bei Kaninchen und Mäusen wurden nur dann Auswirkungen beobachtet, wenn deutlich höhere Dosen als die Höchstdosis für den Menschen angewendet wurden, die für die klinische Anwendung unbedeutend sind.
Doc name: Based on date chars pages
6.1 Liste der sonstigen Bestandteile Pulver
Humanserumalbumin (HSA)
Mannitol
Lösungsmittel/Verdünnungsmittel
Natriumchlorid
Phenol
Humanserumalbumin (HSA)
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Lyophilisiertes Insektengift: 36 Monate
Lösungsmittel: 36 Monate
Gelöstes Bienen- oder Wespengift:
100 Mikrogramm/ml: maximal 6 Monate.
Nach weiterer Verdünnung beträgt die Haltbarkeitsdauer maximal 1 Tag.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Bei 2 °C - 8 °C in der Originalverpackung lagern. Nicht einfrieren.
Lösungen, die einmal eingefroren waren, dürfen nicht mehr verwendet werden.
6.5 Art und Inhalt des Behältnisses
Eine Packung VENOMENHAL Biene bzw. VENOMENHAL Wespe enthält:
• 6 Klarglasflaschen (Ph. Eur. Typ I) zu je 3 ml mit einem durchstechbaren Brombutylstopfen und jeweils 120 ^g reinem, gefriergetrocknetem Insektengift und
• 6 Klarglasflaschen (Ph. Eur. Typ I) zu je 3 ml mit einem durchstechbaren Brombutylstopfen mit jeweils 1,2 ml Lösungsmittel zum Auflösen des gefriergetrockneten Insektengiftes. Die Stopfen sind mit einer Aluminiumkappe verschlossen.
VERDÜNNUNGSMITTEL (separat erhältlich)
Eine Packung VERDÜNNUNGSMITTEL zur Verdünnung der gelösten Insektengifte enthält 10 Klarglasflaschen (Ph. Eur. Typ I) zu je 6 ml mit einem durchstechbaren Brombutylstopfen mit jeweils
4.5 ml Verdünnungsmittel. Die Stopfen sind mit einer Aluminiumkappe verschlossen.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu entsorgen.
Herstellung der gebrauchsfertigen Lösungen zur Hauttestung und Behandlung (ambulant oder als stationäre Schnellhyposensibilisierung)
Nach der Rekonstitution ist das Produkt eine klare Lösung.
Auflösung des gefriergetrockneten Insektengiftes
Die Insektengifte der Präparate VENOMENHAL Biene und VENOMENHAL Wespe sind gefriergetrocknet und vakuumverschlossen abgefüllt. Vor Gebrauch erfolgt die Auflösung des gefriergetrockneten Insektengiftes.
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
11 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5 clean |
Dazu werden mittels steriler Spritze und Kanüle aus einer Flasche mit Lösungsmittel 1,2 ml entnommen und in eine der Flaschen mit dem gefriergetrockneten Insektengift (120 Mikrogramm) gegeben. Gleichmäßig einfließen lassen! Anschließend sollte die Flasche mit dem Insektengift leicht hin und her bewegt werden, bis eine vollständige Auflösung des Insektengiftes erreicht ist. Nicht schütteln! Auf vollständige, rückstandslose Auflösung achten!
Nach erfolgter Auflösung enthält diese Flasche eine Lösung mit der Konzentration 100 Mikrogramm Insektengift/ml. Die Lösung von 1,2 ml einer Konzentration von 100 Mikrogramm Insektengift/ml kann zur Herstellung der Verdünnungen für die Hauttests und für die Einleitungsbehandlung (siehe Schema Nr. 1), aber auch direkt für die Fortsetzungsbehandlung (siehe Schema Nr. 2) verwendet werden. Es wird empfohlen, die Herstellung der gebrauchsfertigen Lösung unmittelbar vor der Behandlung vorzunehmen.
Das Etikett der Flasche mit dem Insektengift enthält:
■ die Chargenbezeichnung (Ch.-B.)
■ das Verfallsdatum des gefriergetrockneten Insektengiftes
■ zwei Leerfelder zum Eintragen folgender Angaben:
• dem Datum der Auflösung des Insektengiftes
• dem Verfallsdatum des gelösten Insektengiftes.
Die für die Leerfelder vorgesehenen Daten trägt der behandelnde Arzt selbst ein.
Herstellung der Verdünnungsstufen für die Hauttestung und Einleitungsbehandlung
Aus dem gelösten Insektengift wird eine Verdünnungsreihe hergestellt. Für diesen Zweck ist für VENOMENHAL Biene bzw. VENOMENHAL Wespe eine Packung Verdünnungsmittel mit 10 Flaschen zu je 4,5 ml einer Verdünnungslösung separat erhältlich.
In die vorgedruckten Felder erfolgt die Eintragung von:
■ Insektenart (Biene oder Wespe)
■ Konzentration (in Mikrogramm/ml)
■ Datum der Herstellung der Verdünnung
■ Verfallsdatum der Verdünnung.
Um Verwechslungen zu vermeiden, sollten die Flaschen bereits vor der Verdünnung mit den beschrifteten Haftetiketten versehen werden. Das Verfallsdatum der Verdünnungen darf die Haltbarkeitsdauer des gelösten Insektengiftes und des gefriergetrockneten Insektengiftes nicht überschreiten.
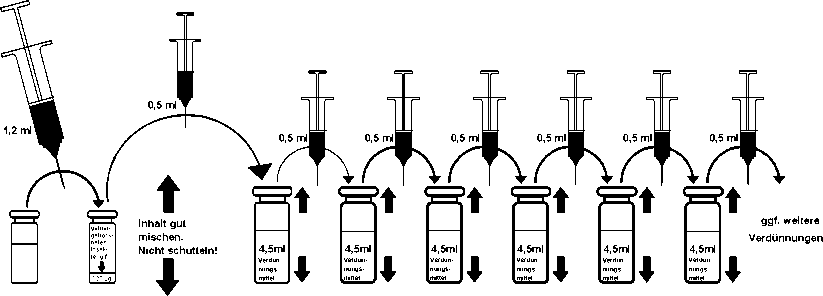
Eine Verdünnungsreihe wird auf die folgende Weise hergestellt:
1. Aus der Flasche mit dem gelösten Insektengift (Stammlösung mit 100 Mikrogramm Insektengift/ml) unter Verwendung einer sterilen und entsprechend graduierten Spritze mit Kanüle 0,5 ml entnehmen und in eine Flasche mit 4,5 ml Verdünnungsmittel geben ^ Konzentration: 10 Mikrogramm Insektengift/ml.
2. Aus dieser Flasche wie beschrieben 0,5 ml entnehmen und in eine weitere Flasche mit 4,5 ml Verdünnungsmittel geben;
^ Konzentration: 1 Mikrogramm Insektengift/ml.
3. Aus dieser Flasche wiederum 0,5 ml entnehmen und in eine weitere Flasche mit 4,5 ml Verdünnungsmittel geben; Konzentration: 0,1 Mikrogramm Insektengift/ml.
4. So wird weiter verfahren, bis eine Konzentration von 0,0001 Mikrogramm Insektengift/ml oder eine noch geringere Konzentration erreicht ist (vgl. Schema Nr. 1).
Die Verdünnungsstufen jeweils vor dem nächsten Verdünnungsschritt durch vorsichtiges Schwenken gut mischen. Nicht schütteln!
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
12 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5_clean |
Lösungs- mit 100 pg/ml mittel Insektengift
Stammlösung
Konz.: 10 p. g/ml
Konz.: 1 p. g/ml
Konz.: Konz.: Konz.: Konz.:
0,1 Mg/ml 0,01 m g/ml 0,001 pg/ml 0,0001 pg/ml
Schema 1: Herstellung der gebrauchsfertigen Lösungen für die Hauttestung und Einleitungsbehandlung (ambulante Immuntherapie oder stationäre Schnellhyposensibilisierung)
D C
Insektengift
auflösen
T
|
gefrierge trocknetes Insekten gift | |||
|
♦ 120 pg |
1,2 ml Lösungsmittel
Durchstechflasche mit Insektengift
Behandlungslösung mit 100 pg/ml Insektengift
Inhalt gut mischen. Nicht schütteln!
ml zur
andlung
fziehen
Schema 2: Herstellung der gebrauchsfertigen Lösungen für die Fortsetzungsbehandlung 7 NAME UND ANSCHRIFT DES INHABERS DER ZULASSUNG
Zulassungsinhaber für Deutschland:
HAL Allergie GmbH Poststraße 5-6 40213 Düsseldorf Postfach 13 04 50 40554 Düsseldorf
Telefon: +49 (0)2 11 9 77 65-0, Telefax: +49 (0)2 11 9 77 65-49 E-Mail: info@hal-allergie.de
Pharmazeutischer Unternehmer für Österreich:
HAL Allergy Handels-GmbH Johnstrasse 4 1150 Wien
Telefon: +43 (0)1-4893100, Telefax: +43 (0) 1-4893110 E-Mail: info@hal-allergy.at
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
13 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5 clean |
|
Zul.-Nr. Deutschland | |
|
VENOMENHAL Biene |
191a/96 b |
|
VENOMENHAL Wespe |
192a/96 b |
9 DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
|
Zulassung Deutschland |
Verlängerung Deutschland | |
|
VENOMENHAL Biene |
23.10.1997 |
05.03.2008 |
|
VENOMENHAL Wespe |
23.10.1997 |
05.03.2008 |
10 STAND DER INFORMATION
Juli 2015
11 VERKAUFSABGRENZUNG
Die Präparate VENOMENHAL Biene und VENOMENHAL Wespe sind verschreibungs- und apothekenpflichtig.
Doc name:
Based on date
chars
pages
Die Fortsetzung der Therapie folgt den Dosierungsempfehlungen für die Fortsetzungsbehandlung mit der Konzentration von 100 Mikrogramm Insektengift/ml (siehe Dosierungsschema).
Doc name: Based on date chars pages
20150804-SPC-VEN-de-de-
MAB41510-Reg-Nat-CL.docx
35121
15 / 18
- Einleitungsbehandlung mit wöchentlicher Dosissteigerung -
|
Konzentration (Mikrogramm/ ml) |
Dosis (ml) |
Dosis (Mikrogramm Insektengift/In jektion) |
Injektion Nr. |
Datum |
Bemerkungen |
|
0,0001 0,001 0,01 0,1 |
0,1 0,1 0,1 0.1 |
0,00001 0,0001 0,001 0,01 |
1 2 3 4 | ||
|
1,0 |
0,05 0,1 0,2 0,4 |
0,05 0,1 0,2 0,4 |
5 6 7 8 | ||
|
10,0 |
0,05 0,1 0,2 0,4 |
0,5 1,0 2,0 4,0 |
9 10 11 12 | ||
|
100,0 |
0,05 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 1,0 |
5.0 10.0 20,0 30.0 40.0 50.0 60.0 70.0 80.0 100,0 |
13 14 15 16 17 18 19 20 21 22 | ||
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
16 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5 clean |
Begonnen wird mit 0,1 ml einer Konzentration, die 1000-fach (Prick) bis 10-fach (Intrakutan) niedriger ist als diejenige, die im Hauttest ein positives Ergebnis auslöste. Vorsicht bei der Dosissteigerung! Die individuelle Verträglichkeit ist immer zu beachten!
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
17 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5_clean |
- Fortsetzungsbehandlung mit der individuell vertragenen Erhaltungsdosis -Die Erhaltungsdosis sollte möglichst 100 Mikrogramm Insektengift/ml betragen (Erreichte Erhaltungsdosis:_ml der Konzentration_Mikrogramm/ml)
|
Injektionsinter vall |
Dosis (ml) |
Dosis (Mikrogramm Insektengift/ Injektion) |
Injektion Nr. |
Datum |
Bemerkungen |
|
1 Woche nach Ende der Einleitungsbeha ndlung/ Schnellhyposen sibilisierung |
1,0* |
100,0* | |||
|
2 Wochen nach vorausgegange ner Injektion |
1,0* |
100,0* | |||
|
3 Wochen nach vorausgegange ner Injektion |
1,0* |
100,0* | |||
|
4 Wochen nach vorausgegange ner Injektion |
1,0* |
100,0* | |||
|
Weiter alle 4 Wochen Nach dem ersten Behandlungsjah r können die Intervalle auf 4 bis 6 Wochen ausgedehnt werden |
1,0* |
100,0* | |||
|
1,0* |
100,0* | ||||
|
1,0* |
100,0* | ||||
|
1,0* |
100,0* | ||||
|
1,0* |
100,0* | ||||
|
1,0* |
100,0* | ||||
* Die individuelle Erhaltungsdosis kann niedriger als 1,0 ml der Stammlösung (100 Mikrogramm Insektengift/ml) sein.
Angaben zur Erhöhung der Dosis auf mehr als 100 Mikrogramm siehe Abschnitt 4.2.
|
Doc name: |
Based on |
date |
chars |
pages |
|
20150804-SPC-VEN-de-de- |
20140814 DE |
201508045 |
35121 |
18 / 18 |
|
MAB41510-Reg-Nat-CL.docx |
SPC VEN 4.5_clean |