Viatim, Suspension Und Lösung Zur Injektion In Einer Doppelkammer-Fertigspritze
alt informationenGEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
ViATIM
Suspension und Lösung zur Injektion in einer Doppelkammer-Fertigspritze
Inaktivierter Hepatitis A-Adsorbat- und Typhus-Polysaccharid-Impfstoff
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem Impfstoff geimpft werden.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker.
- Dieser Impfstoff wurde Ihnen persönlich verschrieben. Geben Sie ihn nicht an Dritte weiter.
- Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
Diese Packungsbeilage beinhaltet:
1. Was ist ViATIM und wofür wird es angewendet?
2. Was müssen Sie vor der Anwendung von ViATIM beachten?
3. Wie ist ViATIM anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist ViATIM aufzubewahren?
6. Weitere Informationen
1. WAS IST ViATIM UND WOFÜR WIRD ES ANGEWENDET?
ViATIM ist ein Kombinationsimpfstoff aus gereinigtem Typhus Vi-Kapselpolysaccharid- und inaktiviertem Hepatitis A-Adsorbat-Impfstoff. Er schützt vor einer Erkrankung an Typhus und Hepatitis A, da Antikörper gegen den Typhus- und Hepatitis A-Erreger gebildet werden.
ViATIM wird angewendet zur gleichzeitigen aktiven Immunisierung (Impfung) gegen Infektionen mit Typhus und dem Hepatitis A-Virus ab dem vollendeten 16. Lebensjahr.
Die aktuellen Empfehlungen der Ständigen Impfkommission (STIKO) sollten beachtet werden.
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON ViATIM BEACHTEN?
ViATIM darf nicht verabreicht werden,
- wenn Sie überempfindlich (allergisch) gegen die Wirkstoffe oder einen der sonstigen Bestandteile oder gegen Neomycin sind. (Neomycin wird während der Herstellung verwendet; Spuren davon können im Impfstoff enthalten sein.)
Besondere Vorsicht bei der Verabreichung von ViATIM ist erforderlich,
- wenn Sie eine akute, evtl. fieberhafte Erkrankung haben. Ihr Arzt wird dann entscheiden, ob die Impfung auf einen späteren Zeitpunkt verschoben wird
- wenn Ihr körpereigenes Abwehrsystem durch medikamentöse oder sonstige Behandlungen geschwächt ist oder Sie an einer Krebserkrankung oder an einer Erkrankung des körpereigenen Abwehrsystems leiden. In diesen Fällen kann die durch die Impfung erwünschte Antikörperbildung eingeschränkt sein. Die Impfung sollte deshalb verschoben werden, bis die Behandlung beendet oder die Krankheit überwunden ist. Wenn Sie HIV-infiziert sind oder an einer chronischen Immunschwächekrankheit wie z. B. AIDS leiden, sollten Sie aber geimpft werden, auch wenn die Antikörperbildung möglicherweise nur in begrenztem Umfang erfolgt.
Aufgrund der langen Inkubationszeit der Hepatitis A (zwischen 20 und 50 Tagen) kann nicht ausgeschlossen werden, dass zum Zeitpunkt der Impfung bereits eine Infektion mit dem Virus vorliegt, die noch keine Krankheitssymptome aufweist. Es ist nicht bekannt, ob ViATIM in diesen Fällen den Ausbruch einer Hepatitis A verhindern kann.
ViATIM schützt nicht vor Infektionen der Leber, die durch andere Erreger wie beispielsweise Hepatitis B-Virus, Hepatitis C-Virus und Hepatitis E-Virus ausgelöst werden.
ViATIM schützt nur vor Infektionen, die durch Salmonella typhi ausgelöst werden; ein Schutz vor Infektionen durch andere Salmonellen-Serotypen besteht nicht.
Wie alle Impfstoffe schützt ViATIM möglicherweise nicht alle Geimpften vollständig.
Anwendung von ViATIM mit anderen Arzneimitteln
ViATIM darf nicht mit anderen Impfstoffen, Impfstoffkomponenten oder Arzneimitteln gemischt werden.
ViATIM ist ein Kombinationsimpfstoff aus gereinigtem Typhus Vi-Kapselpolysaccharid-Impfstoff und inaktiviertem Hepatitis A-Impfstoff. Auch wenn keine spezifischen Untersuchungen zu einer gleichzeitigen Verabreichung von anderen inaktivierten Impfstoffen an unterschiedlichen Körperstellen und mit separaten Spritzen durchgeführt wurden, ist nicht zu erwarten, dass eine gleichzeitige Verabreichung mit anderen inaktivierten Impfstoffen die Immunantwort beeinträchtigt.
Die gleichzeitige Verabreichung von ViATIM mit Gelbfieber-Impfstoff wurde nicht gezielt untersucht. Aufgrund der vorliegenden Daten bezüglich der gleichzeitigen Verabreichung der Einzelimpfstoffe (gereinigter Typhus Vi-Kapselpolysaccharid-Impfstoff und inaktivierter Hepatitis A-Impfstoff) mit Impfstoff gegen Gelbfieber ist bei gleichzeitiger Verabreichung von ViATIM mit einem Gelbfieber-Impfstoff jedoch keine Beeinträchtigung der Immunantwort gegen die einzelnen Antigene zu erwarten.
Ob die gleichzeitige Verabreichung von Immunglobulinen Auswirkungen auf die Wirksamkeit von ViATIM hat, wurde nicht untersucht. Eine Beeinträchtigung der Immunantwort kann daher nicht ausgeschlossen werden. Bei gleichzeitiger Verabreichung von Immunglobulinen und dem inaktivierten Hepatitis A-Einzelimpfstoff war der Anteil der geschützten Personen nicht verändert, jedoch können die Antikörperspiegel möglicherweise niedriger sein als nach alleiniger Verabreichung des Einzelimpfstoffs.
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden bzw. vor kurzem angewendet haben, auch wenn es sich um nicht verschreibungspflichtiges Arzneimittel handelt.
Schwangerschaft und Stillzeit
Daten über eine begrenzte Anzahl von geimpften Schwangeren (mehr als 150 Fälle mit Typhus Vi-Kapselpolysaccharid-Einzelimpfstoff, mehr als 40 Fälle mit inaktiviertem Hepatitis A-Einzelimpfstoff und mehr als 10 Fälle mit ViATIM bzw. den beiden gleichzeitig verabreichten Einzelimpfstoffen) lassen nicht auf Nebenwirkungen von ViATIM auf die Schwangerschaft oder die Gesundheit des Fetus/Neugeborenen schließen.
Tierversuche lassen nicht auf direkte oder indirekte schädliche Auswirkungen auf Schwangerschaft, vorgeburtliche Entwicklung, Geburtsverlauf oder Entwicklung nach der Geburt schließen.
Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten. Besteht für die zu impfende Person ein Risiko, nur mit Hepatitis A- oder Typhuserregern in Kontakt zu kommen, sollte der jeweilige Einzelimpfstoff verabreicht werden.
Ob ViATIM in die Muttermilch ausgeschieden wird, ist nicht bekannt. Dies wurde im Tierversuch nicht untersucht. Die Entscheidung, ob weiter gestillt oder abgestillt werden sollte bzw. mit ViATIM zu impfen oder nicht, sollte sorgfältig abgewogen werden. Dabei sind der Vorteil des Stillens für das Kind und der mögliche Nutzen der Impfung für die Mutter in Betracht zu ziehen.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Es ist nicht untersucht worden, ob die Verabreichung von ViATIM Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen haben kann. Gelegentlich (bei weniger als 1 von 100, aber mehr als 1 von 1.000 Geimpften) wurde Schwindel nach Verabreichung von ViATIM beobachtet (siehe Abschnitt 4).
3. WIE IST ViATIM ANZUWENDEN?
Dosierung
Die empfohlene Dosis für Personen ab dem vollendeten 16. Lebensjahr ist 1 ml des gemischten Impfstoffs.
Ein Impfschutz wird bereits nach Verabreichung einer Dosis ViATIM erreicht. Schützende Antikörperspiegel sind jedoch erst 14 Tage nach Verabreichung des Impfstoffs zu erwarten.
Serologische Daten zeigen, dass Personen, die eine Immunantwort auf die erste Impfung gezeigt haben, bis zu 36 Monate nach dieser Impfung gegen Hepatitits A geschützt sind.
Zum Aufbau eines Langzeitschutzes gegen Hepatitis A-Virusinfektionen wird die Verabreichung einer zweiten Dosis eines inaktivierten Hepatitis A-Impfstoffs empfohlen. Diese Auffrischimpfung sollte vorzugsweise 6 bis 12 Monate nach der ersten Impfung (Grundimmunisierung) verabreicht werden, kann aber auch bis zu 36 Monate nach der Grundimmunisierung erfolgen. Antikörper gegen das Hepatitis A-Virus bleiben vermutlich für einen langen Zeitraum (mindestens 10 Jahre) nach der zweiten Impfung (Auffrischimpfung) bestehen.
Der Kombinationsimpfstoff kann auch gegeben werden, wenn die zweite Impfung (Auffrischimpfung) gegen Hepatitis A gleichzeitig mit einer Impfung gegen Typhus verabreicht werden soll. In diesem Falle sollte der Kombinationsimpfstoff vorzugsweise 6 bis 12 Monate nach der ersten Dosis eines (Einfach-) Impfstoffs gegen Hepatitis A verabreicht werden, die Impfung kann aber auch bis zu 36 Monate nach der Grundimmunisierung erfolgen.
Wenn die Grundimmunisierung gegen Hepatitis A mit einem Typhus-Hepatitis A-Kombinationsimpfstoff durchgeführt wurde, kann eine zweite Dosis des Kombinationsimpfstoffs ungefähr 36 Monate nach der ersten Dosis verabreicht werden, sofern gleichzeitig eine Wiederimpfung gegen Typhus gewünscht ist.
Personen, bei denen weiterhin die Gefahr einer Typhus-Infektion besteht, sollten alle 3 Jahre mit einer Dosis eines gereinigten Typhus Vi-Polysaccharid-Impfstoffs wieder geimpft werden. Wenn bei diesen Personen eine gleichzeitige Auffrischimpfung gegen Hepatitis A erforderlich sein sollte, kann ViATIM verabreicht werden.
Art der Anwendung
ViATIM ist in einer Doppelkammer-Fertigspritze erhältlich. Die beiden Einzelkomponenten dürfen erst unmittelbar vor Verabreichung des Impfstoffs gemischt werden. Den Impfstoff vor dem Mischen und noch einmal vor der Verabreichung sorgfältig schütteln, um eine homogene Suspension zu erhalten. Der Inhalt der beiden Kammern wird durch langsames Vorschieben des Kolbens gemischt. Nach Mischen erhält man 1 ml Impfstoff.
Vor der Verabreichung sollte der Impfstoff visuell auf Fremdpartikel untersucht werden.
ViATIM wird langsam in den Muskel (intramuskulär), vorzugsweise in den Deltamuskel (am Oberarm) verabreicht. ViATIM darf nicht in ein Blutgefäß bzw. eine Vene (intravasal bzw. intravenös) gegeben werden. ViATIM sollte aufgrund der variierenden Mengen von Fettgewebe im Bereich des Gesäßes nicht in die Gesäßregion und auch nicht in die Haut (intradermal) verabreicht werden, da diese Arten der Anwendung zu einer abgeschwächten Immunantwort führen können. ViATIM kann bei Patienten mit Thrombozytopenie (Verminderung der Anzahl der Blutplättchen) oder bei Patienten mit Blutungsneigung unter die Haut (subkutan) verabreicht werden.
Handhabungshinweise
Für Ärzte und medizinisches Personal bestimmte Anweisungen für die Handhabung der Doppelkammer-Fertigspritze befindet sich am Ende dieser Gebrauchsinformation.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann ViATIM Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
|
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt: | |
|
Sehr häufig: |
mehr als 1 von 10 Geimpften |
|
Häufig: |
weniger als 1 von 10, aber mehr als 1 von 100 Geimpften |
|
Gelegentlich: |
weniger als 1 von 100, aber mehr als 1 von 1.000 Geimpften |
|
Selten: |
weniger als 1 von 1.000, aber mehr als 1 von 10.000 Geimpften |
|
Sehr selten: |
weniger als 1 von 10.000 Geimpften, einschließlich Einzelfälle |
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Daten aus klinischen Studien
Die Verträglichkeit von ViATIM wurde in fünf klinischen Studien mit ca. 1.100 Teilnehmern untersucht. Am häufigsten wurde über Reaktionen am Injektionsort berichtet.
Folgende Nebenwirkungen wurden nach Verabreichung von ViATIM berichtet:
Nervensystem
Sehr häufig: Kopfschmerzen
Gelegentlich: Schwindel
Verdauungssystem
Häufig: Übelkeit, Durchfall
Haut und Unterhautzellgewebe Gelegentlich: Juckreiz, Ausschlag
Skelettmuskulatur, Bindegewebe und Knochen Sehr häufig: Muskelschmerzen
Häufig: Gelenkschmerzen
Allgemeine Reaktionen und Beschwerden am Injektionsort
Sehr häufig: Unwohlsein, Abgeschlagenheit, Beschwerden an der Injektionsstelle (Schmerzen,
Verhärtung, Schwellung und Rötung)
Häufig: Fieber
Über Schmerzen am Injektionsort nach Verabreichung von ViATIM berichteten 89,9 % der Geimpften (starke Schmerzen bei 4,5 %). Bei gleichzeitiger Verabreichung der Einzelimpfstoffe an unterschiedlichen Körperstellen gaben 83,2 % der Geimpften Schmerzen am Injektionsort an (starke Schmerzen bei 5 %). 79,3 % berichteten über Schmerzen an der Typhus-Injektionsstelle (starke Schmerzen bei 5 %) und 50,3 % an der Hepatitis A-Injektionsstelle (starke Schmerzen bei 0,6 %).
Über Schmerzen an der Injektionsstelle von mehr als 3 Tagen Dauer nach Verabreichung von ViATIM berichteten 17,4 % der Geimpften. Nach Verabreichung des Typhus Vi-Einzelimpfstoffs waren es 2,8 %, nach Verabreichung des Hepatitis A-Einzelimpfstoffs 0,6 % der Geimpften.
7,9 % der mit ViATIM Geimpften berichteten über starke Ödeme/Verhärtungen (> 5 cm) an der Injektionsstelle. Wenn die beiden monovalenten Impfstoffe gleichzeitig an unterschiedlichen Körperstellen verabreicht wurden, berichteten 1,7 % der Geimpften über starke Ödeme/Verhärtungen (1,1 % an der Injektionsstelle des Typhus Vi-Impfstoffs und 0,6 % an der Injektionsstelle des Hepatitis A-Impfstoffs).
Die Häufigkeit von Allgemeinreaktionen nach Verabreichung von ViATIM war vergleichbar mit der bei gleichzeitiger Verabreichung der Einzelimpfstoffe an unterschiedlichen Körperstellen.
Alle Reaktionen bildeten sich ohne Folgeerscheinungen zurück.
Daten aus breiter Anwendung
Basierend auf Spontanmeldungen wurden nach breiter Anwendung der beiden Einzelimpfstoffe zusätzlich die nachstehend aufgeführten Nebenwirkungen beobachtet.
Nach Verabreichung des gereinigten Typhus Vi-Kapselpolysaccharid-Einzelimpfstoffs wurde über folgende Nebenwirkungen, die nicht für ViATIM (siehe oben) aufgeführt sind, berichtet:
Immunsystem
Sehr selten: allergische Reaktionen, eventuell mit Kreislaufbeteiligung; Serumkrankheit
Nervensystem
Sehr selten: Missempfindungen
Atemwege, Brustraum und Mediastinum Sehr selten: Verschlimmerung von Asthma
Verdauungstrakt
Selten: Erbrechen, Bauchschmerzen
Haut und Unterhautzellgewebe Sehr selten: Nesselsucht
Nach Verabreichung des inaktivierten Hepatitis A-Einzelimpfstoffs wurde über folgende Nebenwirkungen, die nicht für ViATIM (siehe oben) aufgeführt sind, berichtet:
Haut und Unterhautzellgewebe Sehr selten: Nesselsucht
Allgemeine Reaktionen und Beschwerden am Injektionsort Sehr selten: Knötchen am Injektionsort
Untersuchungen
Selten: leichter, vorübergehender Anstieg der Leberwerte
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie Nebenwirkungen beobachten, die nicht in dieser Packungsbeilage aufgeführt sind.
Gegenmaßnahmen
Im Falle des Auftretens von Unverträglichkeitsreaktionen oder allergischen Erscheinungen sind, abhängig vom Schweregrad, vom Arzt geeignete Maßnahmen einzuleiten.
5. WIE IST ViATIM AUFZUBEWAHREN?
Im Kühlschrank lagern (2 °C - 8 °C). Nicht einfrieren.
Impfstoffe, die versehentlich falsch gelagert oder eingefroren wurden, sind zu verwerfen.
In der Faltschachtel aufbewahren, um den Inhalt vor Licht zu schützen.
Arzneimittel für Kinder unzugänglich aufbewahren!
Der zubereitete Impfstoff ist unmittelbar nach dem Mischen der beiden Komponenten zu verabreichen.
Das Verfalldatum des Impfstoffs ist auf der Doppelkammer-Fertigspritze und auf der Faltschachtel mit Monat und Jahr aufgedruckt. Nach Ablauf des angegebenen Monats darf der Impfstoff nicht mehr verwendet werden.
Nicht verwendeter Impfstoff oder Abfallmaterial ist gemäß den lokalen Vorschriften zu entsorgen.
6. WEITERE INFORMATIONEN Was ViATIM enthält
Eine Doppelkammer-Fertigspritze enthält 0,5 ml gereinigten Typhus Vi-Kapselpolysaccharid-Impfstoff und 0,5 ml inaktivierten Hepatitis A-Impfstoff, die vor Verabreichung gemischt werden.
Der gereinigte Typhus Vi-Polysaccharid-Impfstoff (Injektionslösung) befindet sich in der vorderen Kammer der Fertigspritze, der inaktivierte Hepatitis A-Impfstoff (Injektionssuspension) in der hinteren Kammer.
Die Wirkstoffe für 1 Dosis (1 ml) des gemischten Impfstoffs sind:
Bestandteil aus der Suspension:
Inaktiviertes Hepatitis A-Virus, Stamm GBM1’ 2 160 Einheiten3
1 gezüchtet in humanen diploiden MRC-5 Zellen
2 adsorbiert an hydratisiertes Aluminiumhydroxid (enthält 0,3 mg Aluminium)
3 In Ermangelung eines international gültigen Referenz-Standards für den Antigengehalt wird ein In-house-Referenzwert angegeben.
Bestandteil aus der Lösung:
Salmonella typhi (Stamm Ty 2) Vi-Kapselpolysaccharid 25 Mikrogramm
Die sonstigen Bestandteile nach Mischen der Einzelkomponenten sind: gelöster Phosphatpuffer bestehend aus Natriumchlorid, Dinatriumhydrogenphosphat-Dihydrat, Natriumdihydrogenphosphat-Dihydrat, Wasser für Injektionszwecke; Phenoxyethanol; Formaldehyd; Medium 199 Hanks (ohne Phenolrot)4, ergänzt mit Polysorbat 80 sowie mengenmäßig nicht bestimmbare Spuren von Neomycin.
4 Medium 199 Hanks (ohne Phenolrot) ist ein Komplex aus Aminosäuren (einschließlich Phenylalanin), Mineralsalzen, Vitaminen und anderen Bestandteilen (einschließlich Glukose), gelöst in Wasser für Injektionszwecke und einem durch Zusatz von Salzsäure oder Natriumhydroxid angepassten pH-Wert.
Wie ViATIM aussieht und Inhalt der Packung
Die inaktivierte, adsorbierte Hepatitis A-Komponente ist eine weißlich trübe Suspension (hintere Kammer), die Typhus Vi-Polysaccharid-Komponente ist eine klare, farblose Lösung (vordere Kammer).
Nach dem Mischen der Einzelkomponenten von ViATIM entsteht eine weißlich trübe Suspension. Hat der Impfstoff ein anderes Aussehen, darf er nicht verwendet werden.
Es sind folgende Packungen zugelassen:
1x1 Doppelkammer-Fertigspritze mit oder ohne beigepackte Kanüle 10x1 Doppelkammer-Fertigspritze mit oder ohne beigepackte Kanüle
Nicht alle zugelassenen Packungsgrößen und Handelsformen müssen erhältlich sein.
Pharmazeutischer Unternehmer und Hersteller
EMRA-MED Arzneimittel GmbH Otto-Hahn-Straße 11 22946 Trittau Telefon: (04154) 806-0 Telefax: (04154) 806-114
Für das Inverkehrbringen in der Bundesrepublik Deutschland freigegeben durch MPA Pharma GmbH, 22946 Trittau.
Dieses Arzneimittel ist in den Mitgliedstaaten des Europäischen Wirtschaftsraums (EWR) unter den folgenden Bezeichnungen im Verfahren der gegenseitigen Anerkennung zugelassen:
|
Name des Mitgliedstaats |
Name des Arzneimittels |
|
Dänemark, Finnland, Griechenland, Irland, |
ViATIM |
|
Island, Italien, Luxemburg, Niederlande, Norwegen, Österreich, Portugal, Schweden, Vereinigtes Königreich | |
|
Belgien |
VACCIN COMBINE TYPHOIDIQUE POLYOSIDIQUE VI PURIFIE ET HEPATITE A |
|
Frankreich, Spanien |
TYAVAX |
Stand der Information
März 2007
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Gemäß § 22 Infektionsschutzgesetz müssen alle Schutzimpfungen vom Impfarzt mit dem Impfdatum, Handelsnamen, der Chargen-Bezeichnung sowie der Angabe der Krankheiten, gegen die geimpft wurde, in einen Impfausweis eingetragen werden.
Häufig unterbleiben notwendige Impfungen, weil bestimmte Situationen irrtümlicherweise als Impfhindernisse angesehen werden. Einzelheiten hierzu finden Sie in den jeweils aktuellen STIKO-Empfehlungen (Ständige Impfkommission am Robert Koch-Institut, aktuell abrufbar über www.rki.de).
Anweisungen für die Handhabung der Doppelkammer-Fertigspritze
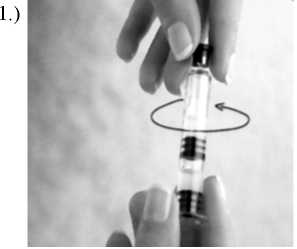
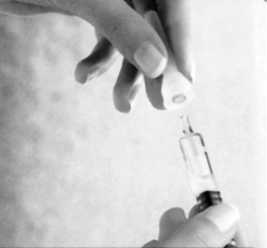
Entfernen Sie durch Drehen in Pfeilrichtung den Gummistopfen. Dabei zerreißt das Plastiksiegel entlang der gestrichelten Linie.
Bringen Sie eine Kanüle inkl. Kanülenschutz auf der Spritze an.
3.)
4.)
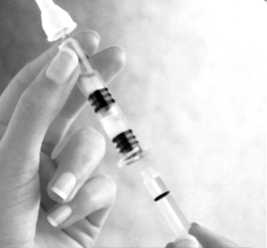
Schrauben Sie den Spntzen-kolben in den Stopper.
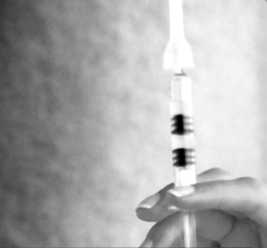
Mischen Sie die Impfstoffkomponenten, indem Sie den Kolben langsam nach oben drücken, wobei Sie die Spritze senkrecht halten.
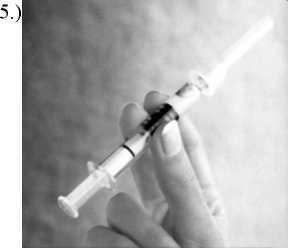
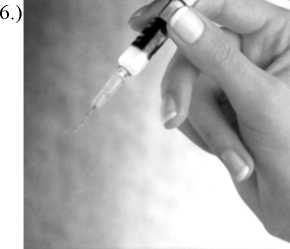
Entfernen Sie den Kanülenschutz.
Schütteln Sie die Spritze, bis Sie eine homogene Suspension erhalten.
9/9