Yvidually
FACHINFORMATION
(ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS)
1. BEZEICHNUNG DES ARZNEIMITTELS
Yvidually 0,02 mg/3 mg Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Filmtablette enthält 0,020 mg Ethinylestradiol (als Betadex-Clathrat) und 3 mg Drospirenon. Sonstiger Bestandteil: 46 mg Lactose
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette
Die Tablette ist hellrosa, rund mit gewölbten Oberflächen und einseitiger Prägung „DS“ in einem regelmäßigen Sechseck.
Die Tablette hat einen Durchmesser von 6 mm und ist 3 mm dick.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Orale Kontrazeption.
Bei der Entscheidung, Yvidually zu verschreiben, sollten die aktuellen, individuellen Risikofaktoren der einzelnen Frauen, insbesondere im Hinblick auf venöse Thromboembolien (VTE), berücksichtigt werden. Auch sollte das Risiko für eine VTE bei Anwendung von Yvidually mit dem anderer kombinierter hormonaler Kontrazeptiva (KHK) verglichen werden (siehe Abschnitte 4.3 und 4.4).
4.2 Dosierung und Art der Anwendung
Art der Anwendung: zum Einnehmen.
Einnahme von Yvidually
Yvidually kann nur in Kombination mit dem Clyk-Tablettenspender angewendet werden. Der Tablettenspender führt die Anwenderin durch das Einnahmeschema.
Die Gebrauchsanweisung des Clyk-Tablettenspenders sollte vor Gebrauch aufmerksam durchgelesen und zum späteren Nachschlagen aufbewahrt werden.
Anweisungen zur Vorbereitung des Clyk-Tablettenspenders für die Anwendung und zur Entnahme einer Tablette, siehe Abschnitt 6.6.
Es muss jeden Tag etwa zur gleichen Zeit eine Tablette eingenommen werden, falls erforderlich mit etwas Flüssigkeit. Die Tabletten müssen immer mindestens 24 Tage lang ununterbrochen eingenommen werden.
Yvidually-Tabletten können über einen Zeitraum von bis zu 120 Tagen durchgehend eingenommen werden, danach muss eine 4-tägige Einnahmepause eingelegt werden.
Die Tabletteneinnahme erfolgt in zwei Phasen:
1. Eine obligatorische Phase (Tag 1 bis Tag 24):
Zu Beginn der Einnahme von Yvidually müssen die Tabletten mindestens 24 Tage lang ununterbrochen eingenommen werden.
Der Clyk-Spender zeigt an, ob eine 4-tägige Einnahmepause möglich ist. Während der ersten 24 Tage (obligatorische Phase) erlaubt der Tablettenspender keinen Beginn einer 4-tägigen Einnahmepause.
2. Eine flexible Phase (Tag 25 bis Tag 120):
Während der Tage 25-120 können die Tabletten bis zu maximal 120 Tage lang durchgehend eingenommen werden. Innerhalb dieses Zeitraums kann die Anwenderin selbst entscheiden, ob Sie eine 4-tägige Einnahmepause einlegen möchte oder nicht.
Diese 4-tägige Einnahmepause darf erst begonnen werden, wenn die Tabletten 24 Tage lang ununterbrochen eingenommen wurden.
Während der flexiblen Phase gestattet der Clyk-Tablettenspender der Anwenderin jederzeit, eine 4-tägige Einnahmepause einzulegen.
Eine 4-tägige Einnahmepause sollte niemals später als nach 120 Tagen durchgehender Tabletteneinnahme eingelegt werden. Eine Einnahmepause sollte niemals länger als 4 Tage dauern.
Der Clyk-Spender veranlasst automatisch eine 4-tägige Einnahmepause nach einer durchgehenden Tabletteneinnahme von 120 Tagen.
Während der 4-tägigen Einnahmepause setzt üblicherweise eine Blutung ein, die möglicherweise noch nicht beendet ist, bevor die nächste Tablette eingenommen werden muss.
Nach jeder 4-tägigen Einnahmepause beginnt ein neuer Einnahmezyklus von mindestens 24 Tagen bis zu maximal 120 Tagen.
Nach der 4-tägigen Einnahmepause erinnert der Clyk-Tablettenspender die Anwenderin automatisch daran, dass ein neuer Zyklus beginnt und wieder täglich eine Tablette einzunehmen ist.
Während der obligatorischen Phase, in der die Tabletten mindestens 24 Tage lang eingenommen werden müssen, darf niemals eine 4-tägige Einnahmepause eingelegt werden.
Falls es während der flexiblen Phase (Tage 25-120) an drei aufeinander folgenden Tagen zu Blutungen und/oder Schmierblutungen kommt, wird empfohlen, eine 4-tägige Einnahmepause einzulegen. Dadurch kann die Gesamtzahl von Blutungstagen reduziert werden.
Diese 4-tägige Einnahmepause darf nur dann eingelegt werden, wenn die Tabletten zuvor mindestens 24 Tage lang ununterbrochen eingenommen wurden.
Beginn der Einnahme von Yvidually
• Keine vorangegangene Einnahme von hormonalen Kontrazeptiva (im letzten Monat)
Die Tabletteneinnahme muss am 1. Tag des natürlichen Zyklus beginnen (d. h. am ersten Tag der Menstruationsblutung). Ein Einnahmebeginn an den Tagen 2-5 ist erlaubt, während des ersten Zyklus wird jedoch in den ersten 7 Tagen der Tabletteneinnahme zusätzlich eine nicht-hormonale Verhütungsmethode (Barrieremethode) empfohlen.
• Wechsel von einem kombinierten hormonalen Kontrazeptivum (kombiniertes orales Kontrazeptivum (KOK), Vaginalring oder transdermales Pflaster)
Mit der Einnahme von Yvidually sollte vorzugsweise am Tag nach Einnahme der letzten wirkstoffhaltigen Tablette des zuvor eingenommenen KOKs begonnen werden, spätestens aber am Tag nach dem üblichen einnahmefreien oder Placebotabletten-Intervall des zuvor eingenommenen KOKs. Für den Fall, dass ein Vaginalring oder ein transdermales Pflaster angewendet wurde, sollte die Einnahme von Yvidually vorzugsweise nach der Entfernung begonnen werden, spätestens aber, wenn die nächste Applikation fällig wäre.
• Wechsel von einem Gestagenmonopräparat („Minipille“, Injektionspräparat, Implantat) oder einem gestagenfreisetzenden Intrauterinpessar (IUP)
Bei vorheriger Einnahme der „Minipille“ kann an jedem beliebigen Tag gewechselt werden (die Umstellung von einem Implantat oder IUP muss am Tag der Entfernung erfolgen, die Umstellung von einem Injektionspräparat zu dem Zeitpunkt, an dem die nächste Injektion fällig wäre). In jedem Fall ist jedoch während der ersten 7 Tage der Tabletteneinnahme zusätzlich die Anwendung einer Barrieremethode erforderlich.
• Nach einem Abort im ersten Trimenon
Es kann sofort mit der Einnahme begonnen werden. In diesem Fall sind keine zusätzlichen empfängnisverhütenden Maßnahmen erforderlich.
• Nach einer Geburt oder einem Abort im zweiten Trimenon
Den Anwenderinnen sollte empfohlen werden, an den Tagen 21 bis 28 nach einer Geburt oder nach einem Abort im zweiten Trimenon mit der Einnahme zu beginnen. Bei einem späteren Einnahmebeginn sollte während der ersten 7 Tage der Tabletteneinnahme zusätzlich eine Barrieremethode angewendet werden. Wenn jedoch bereits Geschlechtsverkehr stattgefunden hat, muss vor dem tatsächlichen Beginn der KOK-Einnahme eine Schwangerschaft ausgeschlossen oder die erste Menstruationsblutung abgewartet werden.
Zur Anwendung bei stillenden Frauen siehe Abschnitt 4.6.
Vorgehen bei vergessener Tabletteneinnahme
Wird innerhalb von 24 Stunden nach dem üblichen Einnahmezeitpunkt bemerkt, dass die Einnahme einer Tablette vergessen wurde, ist der kontrazeptive Schutz nicht eingeschränkt. Die Tablette sollte sofort eingenommen werden. Alle darauf folgenden Tabletten sind dann wieder zur gewohnten Zeit einzunehmen.
Wenn der Einnahmezeitpunkt um mehr als 24 Stunden überschritten wurde, ist der kontrazeptive Schutz nicht mehr voll gewährleistet. Für das Vorgehen bei vergessener Einnahme gelten die folgenden zwei Grundregeln:
1. Die empfohlene Dauer der Einnahmepause beträgt 4 Tage, die Tabletteneinnahme darf nie länger als 7 Tage unterbrochen werden.
2. Eine ununterbrochene Einnahme der Tabletten über mindestens 7 Tage ist erforderlich, um wirkungsvoll die Hypothalamus-Hypophysen-Ovar-Achse zu unterdrücken.
Entsprechend können für die tägliche Praxis folgende Empfehlungen gegeben werden:
• Tag 1-7
Die Einnahme der letzten vergessenen Tablette sollte so bald wie möglich nachgeholt werden, auch wenn dies bedeutet, dass zwei Tabletten zur gleichen Zeit eingenommen werden. Die weitere Tabletteneinnahme erfolgt dann zur gewohnten Zeit. Während der nächsten 7 Tage sollte jedoch zusätzlich eine Barrieremethode, z. B. ein Kondom, verwendet werden. Wenn in den vergangenen 7 Tagen Geschlechtsverkehr stattgefunden hat, sollte die Möglichkeit einer Schwangerschaft in Betracht gezogen werden. Je mehr Tabletten vergessen wurden und je näher dies zeitlich an der Einnahmepause liegt, desto höher ist das Risiko einer Schwangerschaft.
• Tag 8-24
Die Einnahme der letzten vergessenen Tablette sollte so bald wie möglich nachgeholt werden, auch wenn dies bedeutet, dass zwei Tabletten zur gleichen Zeit eingenommen werden. Die weitere Einnahme der Tabletten erfolgt dann zur üblichen Zeit. Vorausgesetzt, dass die Einnahme der Tabletten an den 7 Tagen vor der ersten vergessenen Tablette korrekt erfolgt ist, besteht keine Notwendigkeit, zusätzliche Empfängnisverhütungsmaßnahmen anzuwenden. Ist dies jedoch nicht der Fall oder wurde mehr als 1 Tablette vergessen, sollte die Anwendung zusätzlicher Schutzmaßnahmen empfohlen werden bis die Tabletten fortlaufend ohne Unterbrechung über mindestens 7 Tage eingenommen wurden.
• Tag 25-120
Das Risiko eines verringerten kontrazeptiven Schutzes kann aufgrund der Möglichkeit einer bevorstehenden hormonfreien Einnahmepause gegeben sein. Jedoch lässt sich durch eine Anpassung des Tabletteneinnahmeschemas ein herabgesetzter Empfängnisverhütungsschutz dennoch vermeiden. Bei Einhalten einer der beiden folgenden Vorgehensweisen besteht daher keine Notwendigkeit zusätzlicher kontrazeptiver Maßnahmen, vorausgesetzt, die Tabletteneinnahme an den 7 Tagen vor der ersten vergessenen Tablette erfolgte korrekt. Wenn dies nicht der Fall ist, sollte der Anwenderin empfohlen werden, die erste der beiden Vorgehensweisen zu befolgen und außerdem in den nächsten 7 Tagen zusätzliche Empfängnisverhütungsmaßnahmen anzuwenden.
1. Die Anwenderin sollte die Einnahme der letzten vergessenen Tablette so bald wie möglich nachholen, auch wenn dies bedeutet, dass zwei Tabletten zur gleichen Zeit eingenommen werden. Die Einnahme der Tabletten wird dann wieder zur üblichen Zeit fortgesetzt bis mindestens 7 Tabletten in Folge ohne Unterbrechung eingenommen wurden.
2. Die Anwenderin kann auch entscheiden, eine Einnahmepause von 4 Tagen, einschließlich der Tage, an denen die Tabletteneinnahme vergessen wurde, einzulegen, um eine Entzugsblutung herbeizuführen und anschließend einen neuen Yvidually-Einnahmezyklus zu beginnen.
Bei vergessener Tabletteneinnahme und anschließendem Ausbleiben einer Entzugsblutung in der Einnahmepause sollte die Möglichkeit einer Schwangerschaft in Betracht gezogen werden.
Verhalten bei gastrointestinalen Störungen
Bei schweren gastrointestinalen Störungen (z. B. Erbrechen oder Durchfall) werden die Wirkstoffe möglicherweise nicht vollständig aufgenommen und zusätzliche kontrazeptive Maßnahmen sind erforderlich.
Bei Erbrechen in den ersten 3-4 Stunden nach der Einnahme einer Tablette ist der in Abschnitt 4.2 gegebenen Empfehlung zum Vorgehen bei vergessener Tabletteneinnahme zu folgen. Wenn die
Anwenderin ihr Tabletteneinnahmeschema nicht ändern möchte, muss sie die zusätzlich benötigte(n) Tablette(n) aus dem Tablettenspender entnehmen.
Zusätzliche Informationen für besondere Anwendergruppen
Kinder und Jugendliche
Yvidually ist nur nach der Menarche indiziert.
Geriatrische Patienten
Nicht zutreffend. Yvidually ist nach der Menopause nicht indiziert.
Patienten mit Leberfunktionsstörungen
Yvidually ist für Frauen mit schweren Lebererkrankungen kontraindiziert. Siehe auch Abschnitte 4.3 und 5.2.
Patienten mit Nierenfunktionsstörungen
Yvidually ist für Frauen mit schwerer Niereninsuffizienz oder akutem Nierenversagen kontraindiziert. Siehe auch Abschnitte 4.3 und 5.2.
4.3 Gegenanzeigen
Kombinierte hormonale Kontrazeptiva (KHK) dürfen unter den folgenden Bedingungen nicht
angewendet werden. Wenn eine dieser Erkrankungen während der KHK-Anwendung zum ersten Mal
auftritt, muss das Arzneimittel sofort abgesetzt werden.
• Vorliegen einer oder Risiko für eine venöse Thromboembolie (VTE)
o Venöse Thromboembolie - bestehende VTE (auch unter Therapie mit
Antikoagulanzien) oder VTE in der Vorgeschichte (z. B. tiefe Venenthrombose [TVT] oder Lungenembolie [LE])
o Bekannte erbliche oder erworbene Prädisposition für eine venöse Thromboembolie, wie z. B. APC-Resistenz (einschließlich Faktor-V-Leiden), Antithrombin-III-Mangel, Protein-C-Mangel oder Protein-S-Mangel o Größere Operationen mit längerer Immobilisierung (siehe Abschnitt 4.4) o Hohes Risiko für eine venöse Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4)
• Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE)
o Arterielle Thromboembolie - bestehende ATE, ATE in der Vorgeschichte (z. B.
Myokardinfarkt) oder Erkrankung im Prodromalstadium (z. B. Angina pectoris) o Zerebrovaskuläre Erkrankung - bestehender Schlaganfall, Schlaganfall oder prodromale Erkrankung (z. B. transitorische ischämische Attacke [TIA]) in der Vorgeschichte
o Bekannte erbliche oder erworbene Prädisposition für eine arterielle Thromboembolie, wie z. B. Hyperhomocysteinämie und Antiphospholipid-Antikörper (Anticardiolipin-Antikörper, Lupusantikoagulans) o Migräne mit fokalen neurologischen Symptomen in der Vorgeschichte o Hohes Risiko für eine arterielle Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4) oder eines schwerwiegenden Risikofaktors wie:
• Diabetes mellitus mit Gefäßschädigung
• Schwere Hypertonie
• Schwere Dyslipoproteinämie
• Bestehende oder vorausgegangene schwere Lebererkrankung, solange sich die Leberfunktionswerte nicht normalisiert haben
• Schwere Niereninsuffizienz oder akutes Nierenversagen
• Bestehende oder vorausgegangene Lebertumoren (benigne oder maligne)
• Bekannte oder vermutete sexualhormonabhängige maligne Tumoren (z. B. der Genitalorgane oder der Brust)
Diagnostisch nicht abgeklärte vaginale Blutungen • Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile von Yvidually-Filmtabletten
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Warnhinweise
Die Eignung von Yvidually sollte mit der Frau besprochen werden, falls eine der im Folgenden aufgeführten Erkrankungen oder Risikofaktoren vorliegt.
Bei einer Verschlechterung oder dem ersten Auftreten einer dieser Erkrankungen oder Risikofaktoren ist der Anwenderin anzuraten, sich an Ihren Arzt zu wenden, um zu entscheiden, ob die Anwendung von Yvidually beendet werden sollte.
Bei vermuteter oder bestätigter Thrombose ist das KHK abzusetzen. Wegen der Teratogenität der antikoagulatorischen Therapie (Kumarine) ist auf geeignete alternative Empfängnisverhütung umzusteigen.
• Kreislauferkrankungen
Risiko für eine venöse Thromboembolie (VTE)
Die Anwendung jedes kombinierten hormonalen Kontrazeptivums (KHK) erhöht das Risiko für eine venöse Thromboembolie (VTE) im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat oder Norethisteron enthalten, sind mit dem geringsten Risiko für eine VTE verbunden. Andere Arzneimittel, wie Yvidually, können ein bis zu doppelt so hohes Risiko aufweisen. Die Entscheidung, ein Arzneimittel anzuwenden, das nicht zu denen mit dem geringsten VTE-Risiko gehört, sollte nur nach einem Gespräch mit der Frau getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht:
• das Risiko für eine VTE bei Anwendung von Yvidually,
• wie ihre vorliegenden individuellen Risikofaktoren dieses Risiko beeinflussen, und
• dass ihr Risiko für VTE in ihrem allerersten Anwendungsjahr am höchsten ist.
Es gibt zudem Hinweise, dass das Risiko erhöht ist, wenn die Anwendung eines KHK nach einer Unterbrechung von 4 oder mehr Wochen wieder aufgenommen wird.
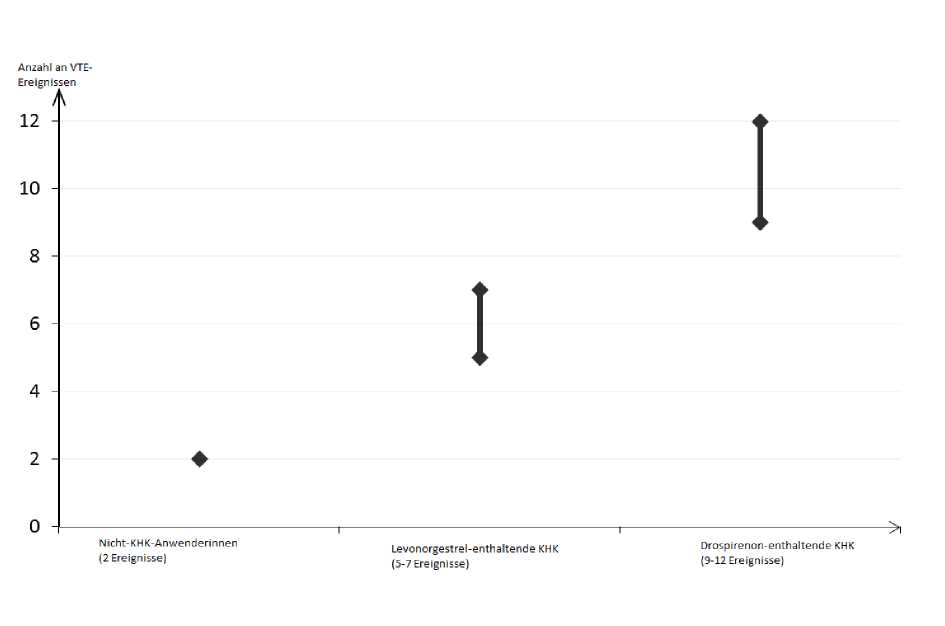
Ungefähr 2 von 10.000 Frauen, die kein KHK anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Bei einer einzelnen Frauen kann das Risiko jedoch in Abhängigkeit von ihren zugrunde liegenden Risikofaktoren bedeutend höher sein (siehe unten). Es wird geschätzt1, dass im Verlauf eines Jahres 9 bis 12 von 10.000 Frauen, die ein Drospirenon-haltiges KHK anwenden, eine VTE erleiden; im Vergleich hierzu kommt es pro Jahr bei ungefähr 62 von 10.000 Frauen, die ein Levonorgestrel-haltiges KHK anwenden, zu einer VTE.
In beiden Fällen ist die Anzahl an VTE pro Jahr geringer als die erwartete Anzahl während der Schwangerschaft oder in der Zeit nach der Geburt.
VTE verlaufen in 1-2 % der Fälle tödlich.
Jährliche Anzahl an VTE-Ereignissen pro 10.000 Frauen
Äußerst selten wurde bei Anwenderinnen von KHK über eine Thrombose in anderen Blutgefäßen berichtet, wie z. B. in Venen und Arterien von Leber, Mesenterium, Nieren oder Retina.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von KHK kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, insbesondere wenn mehrere Risikofaktoren vorliegen (siehe Tabelle).
Yvidually ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die sie insgesamt einem hohen Risiko für eine Venenthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt. In diesem Fall muss ihr Gesamtrisiko für eine VTE in Betracht gezogen werden. Wenn das Nutzen/Risiko-Verhältnis als ungünstig erachtet wird, darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für VTE
|
Risikofaktor |
Anmerkung |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig, wenn weitere Risikofaktoren vorliegen. |
|
Längere Immobilisierung, größere Operationen, jede Operation an Beinen oder Hüfte, neurochirurgische Operation oder schweres Trauma |
In diesen Fällen ist es ratsam, die Anwendung der Tablette (bei einer geplanten Operation mindestens vier Wochen vorher) zu unterbrechen und erst zwei Wochen nach der kompletten Mobilisierung wieder aufzunehmen. Es ist eine andere Verhütungsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern. |
|
Hinweis: Eine vorübergehende Immobilisierung einschließlich einer Flugreise von > 4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine |
Eine antithrombotische Therapie muss erwogen werden, wenn Yvidually nicht vorab abgesetzt wurde. |
|
VTE darstellen, insbesondere bei Frauen mit weiteren Risikofaktoren. | |
|
Familiäre Vorbelastung (jede venöse Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, z. B. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Andere Erkrankungen, die mit einer VTE verknüpft sind. |
Krebs, systemischer Lupus erythematodes, hämolytisches urämisches Syndrom, chronisch entzündliche Darmerkrankung (Morbus Crohn oder Colitis ulcerosa) und Sichelzellkrankheit |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
Es besteht kein Konsens über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose.
Das erhöhte Risiko einer Thromboembolie in der Schwangerschaft und insbesondere während der 6-wöchigen Dauer des Wochenbetts muss berücksichtigt werden (Informationen zur „Schwangerschaft und Stillzeit“ siehe Abschnitt 4.6).
Symptome einer VTE (tiefe Beinvenenthrombose und Lungenembolie)
Beim Auftreten von Symptomen ist den Anwenderinnen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einer tiefen Beinvenenthrombose (TVT) können folgende Symptome auftreten:
- unilaterale Schwellung des Beins und/oder Fußes oder entlang einer Beinvene;
- Schmerz oder Druckschmerz im Bein, der möglicherweise nur beim Stehen oder Gehen bemerkt wird,
- Erwärmung des betroffenen Beins; gerötete oder entfärbte Haut am Bein.
Bei einer Lungenembolie (LE) können folgende Symptome auftreten:
- plötzliches Auftreten unerklärlicher Kurzatmigkeit oder schnellen Atmens;
- plötzlich auftretender Husten möglicherweise in Verbindung mit Hämoptyse;
- stechender Brustschmerz;
- starke Benommenheit oder Schwindelgefühl;
- schneller oder unregelmäßiger Herzschlag.
Einige dieser Symptome (z. B. „Kurzatmigkeit“, „Husten“) sind unspezifisch und können als häufiger vorkommende und weniger schwerwiegende Ereignisse fehlinterpretiert werden (z. B. als Atemwegsinfektionen).
Andere Anzeichen für einen Gefäßverschluss können plötzlicher Schmerz sowie Schwellung und leicht bläuliche Verfärbung einer Extremität sein.
Tritt der Gefäßverschluss im Auge auf, können die Symptome von einem schmerzlosen verschwommenen Sehen bis zu einem Verlust des Sehvermögens reichen. In manchen Fällen tritt der Verlust des Sehvermögens sehr plötzlich auf.
Risiko für eine arterielle Thromboembolie (ATE)
Epidemiologische Studien haben die Anwendung von KHK mit einem erhöhten Risiko für arterielle Thromboembolie (Myokardinfarkt) oder apoplektischen Insult (z. B. transitorische ischämische Attacke, Schlaganfall) in Verbindung gebracht. Arterielle thromboembolische Ereignisse können tödlich verlaufen.
Risikofaktoren für ATE
Das Risiko für arterielle thromboembolische Komplikationen oder einen apoplektischen Insult bei Anwenderinnen von KHK erhöht sich bei Frauen, die Risikofaktoren aufweisen (siehe Tabelle). Yvidually ist kontraindiziert bei Frauen, die einen schwerwiegenden oder mehrere Risikofaktoren für eine ATE haben, die sie einem hohen Risiko für eine Arterienthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt. In diesem Fall muss ihr
Gesamtrisiko betrachtet werden. Bei Vorliegen eines ungünstigen Nutzen/Risiko-Verhältnis darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für ATE
|
Risikofaktor |
Anmerkung |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
|
Rauchen |
Frauen ist anzuraten, nicht zu rauchen, wenn Sie ein KHK anwenden möchten. Frauen über 35 Jahren, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Verhütungsmethode anzuwenden. |
|
Hypertonie | |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig bei Frauen mit zusätzlichen Risikofaktoren. |
|
Familiäre Vorbelastung (jede arterielle Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, d. h. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Migräne |
Ein Anstieg der Häufigkeit oder des Schweregrads der Migräne während der Anwendung von KHK (die einem zerebrovaskulären Ereignis vorausgehen kann) kann ein Grund für ein sofortiges Absetzen sein. |
|
Andere Erkrankungen, die mit unerwünschten Gefäßereignissen verknüpft sind. |
Diabetes mellitus, Hyperhomocysteinämie, Erkrankung der Herzklappen und Vorhofflimmern, Dyslipoproteinämie und systemischer Lupus erythematodes. |
Symptome einer ATE
Beim Auftreten von Symptomen ist den Frauen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einem apoplektischen Insult können folgende Symptome auftreten:
- plötzliche Taubheitsgefühl oder Schwäche in Gesicht, Arm oder Bein, besonders auf einer Körperseite;
- plötzliche Gehschwierigkeiten, Schwindelgefühl, Gleichgewichtsverlust oder Koordinationsstörungen;
- plötzliche Verwirrtheit, Sprech- oder Verständnisschwierigkeiten;
- plötzliche Sehstörungen in einem oder beiden Augen;
- plötzliche, schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
- Verlust des Bewusstseins oder Ohnmacht mit oder ohne Krampfanfall.
Vorübergehende Symptome deuten auf eine transitorische ischämische Attacke (TIA) hin.
Bei einem Myokardinfarkt (MI) können folgende Symptome auftreten:
- Schmerz, Unbehagen, Druck, Schweregefühl, Enge- oder Völlegefühl in Brust, Arm oder unterhalb des Sternums;
- in den Rücken, Kiefer, Hals, Arm, Magen ausstrahlende Beschwerden;
- Völlegefühl, Indigestion oder Erstickungsgefühl;
- Schwitzen, Übelkeit, Erbrechen oder Schwindelgefühl;
- extreme Schwäche, Angst oder Kurzatmigkeit;
- schnelle oder unregelmäßige Herzschläge.
Tumoren
In einigen epidemiologischen Studien wurde über ein erhöhtes Zervixkarzinom-Risiko bei Langzeitanwendung von KOK (> 5 Jahre) berichtet. Kontrovers diskutiert wird nach wie vor, in welchem Ausmaß dieses Ergebnis durch das Sexualverhalten und andere Faktoren, wie eine Infektion mit dem humanen Papillomavirus (HPV), beeinflusst wird.
Eine Metaanalyse von 54 epidemiologischen Studien hat ein leicht erhöhtes Brustkrebsrisiko (RR = 1,24) bei Frauen ergeben, die aktuell KOK anwenden. Das erhöhte Risiko geht innerhalb von 10 Jahren nach dem Absetzen von KOK allmählich wieder zurück. Da Brustkrebs bei Frauen unter 40 Jahren selten auftritt, ist die Anzahl zusätzlicher Brustkrebserkrankungen bei Anwenderinnen von KOK oder solchen, die früher KOK eingenommen haben, gering im Vergleich zum Gesamtrisiko an Brustkrebs zu erkranken. Ein Kausalzusammenhang wurde mit diesen Studien nicht bewiesen. Das beobachtete erhöhte Risiko kann an einer früheren Diagnose des Brustkrebses bei KOK-Anwenderinnen, den biologischen Wirkungen von KOK oder einer Kombination beider Faktoren liegen. Brustkrebs, der bei Frauen diagnostiziert wird, die irgendwann einmal ein KOK angewendet haben, scheint klinisch weniger weit fortgeschritten zu sein als Krebs bei Frauen, die noch nie ein KOK angewendet haben.
In seltenen Fällen sind bei Anwenderinnen von KOK gutartige und noch seltener bösartige Lebertumoren beobachtet worden. In Einzelfällen führten diese Tumoren zu lebensbedrohlichen intraabdominellen Blutungen. Wenn starke Oberbauchbeschwerden, eine Lebervergrößerung oder Anzeichen einer intraabdominellen Blutung bei Frauen auftreten, die KOK einnehmen, sollte ein Lebertumor in die differentialdiagnostischen Überlegungen einbezogen werden.
Mit der Anwendung höher dosierter KOK (50 pg Ethinylestradiol) verringert sich das Risiko eines Endometrium- und Ovarialkarzinoms. Ob dies auch für niedriger dosierte KOK gilt, muss noch nachgewiesen werden.
• Sonstige Erkrankungen
Die Gestagenkomponente in Yvidually ist ein Aldosteronantagonist mit kaliumsparenden Eigenschaften. In den meisten Fällen wird kein Anstieg des Kaliumspiegels erwartet. In einer klinischen Studie wurde von manchen Patientinnen mit leichter bis mittlerer Einschränkung der Nierenfunktion bei der gleichzeitigen Einnahme von Drospirenon und einem kaliumsparenden Arzneimittel ein leichter, jedoch nicht signifikanter Anstieg des Kaliumspiegels beobachtet. Aus diesem Grund ist es ratsam, bei Patientinnen mit Niereninsuffizienz und Serumkaliumwerten im oberen Referenzbereich vor der Behandlung und insbesondere bei gleichzeitiger Einnahme von kaliumsparenden Arzneimitteln die Serumkaliumwerte im ersten Behandlungszyklus zu kontrollieren. Siehe auch Abschnitt 4.5.
Frauen mit einer Hypertriglyzeridämie oder einer diesbezüglich positiven Familienanamnese können ein erhöhtes Risiko für die Entwicklung einer Pankreatitis haben, wenn sie KOK einnehmen.
Obwohl bei vielen Frauen, die KOK einnehmen, ein geringer Blutdruckanstieg berichtet wurde, sind klinisch relevante Blutdruckerhöhungen selten. Nur in diesen seltenen Fällen ist eine sofortige Unterbrechung der Einnahme des KOKs gerechtfertigt. Wenn es bei einer bereits existierenden Hypertonie und der gleichzeitigen Einnahme eines KOKs zu ständig erhöhten Blutdruckwerten oder einer signifikanten Erhöhung des Blutdrucks kommt, und in diesen Fällen eine antihypertensive Therapie keine Wirkung zeigt, muss das KOK abgesetzt werden. Wenn es angemessen erscheint, kann die Einnahme des KOKs wieder begonnen werden, sobald sich die Blutdruckwerte unter der antihypertensiven Therapie normalisiert haben.
Die folgenden Erkrankungen sollen Berichten zufolge sowohl in der Schwangerschaft als auch unter Anwendung eines KOKs auftreten bzw. sich verschlechtern. Jedoch konnte ein Zusammenhang mit der Anwendung von KOK nicht bewiesen werden: cholestatischer Ikterus und/oder Pruritus; Gallensteine; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Sydenham-Chorea; Herpes gestationis; Otosklerose-bedingte Schwerhörigkeit.
Bei Frauen mit hereditärem Angioödem können exogen zugeführte Estrogene Symptome eines Angioödems auslösen oder verschlimmern.
Akute oder chronische Leberfunktionsstörungen können eine Unterbrechung der Anwendung des KOKs erforderlich machen, bis sich die Leberfunktionswerte wieder normalisiert haben. Auch ein Rezidiv eines in einer vorausgegangenen Schwangerschaft oder während einer früheren Anwendung von steroidalen Geschlechtshormonen aufgetretenen cholestatischen Ikterus und/oder eines cholestasebedingten Pruritus macht das Absetzen des KOKs erforderlich.
Obwohl KOK einen Einfluss auf die periphere Insulinresistenz und Glucosetoleranz haben können, liegen keine Hinweise auf die Notwendigkeit einer Änderung des Therapieregimes bei Diabetikerinnen vor, die niedrig dosierte KOK anwenden (mit < 0,05 mg Ethinylestradiol). Diabetikerinnen müssen jedoch sorgfältig überwacht werden, insbesondere in der ersten Zeit der Anwendung eines KOKs.
Bei Anwendung von KOK wurde über eine Verschlechterung endogener Depressionen, Epilepsie, Morbus Crohn und Colitis ulcerosa berichtet.
Chloasmen können gelegentlich auftreten, insbesondere bei Frauen mit Chloasma gravidarum in der Anamnese. Frauen mit dieser Veranlagung sollten sich daher während der Einnahme von KOK nicht direkt der Sonne oder ultraviolettem Licht aussetzen.
Jede Tablette dieses Arzneimittels enthält 46 mg Lactose pro Tablette. Anwenderinnen mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption, die eine lactosefreie Diät einhalten, sollten diese Menge beachten.
Ärztliche Untersuchung/Beratung
Vor der Einleitung oder Wiederaufnahme der Behandlung mit Yvidually muss eine vollständige Anamnese (inklusive Familienanamnese) erhoben und eine Schwangerschaft ausgeschlossen werden. Der Blutdruck sollte gemessen und eine körperliche Untersuchung durchgeführt werden, die sich an den Gegenanzeigen (siehe Abschnitt 4.3) und Warnhinweisen (siehe Abschnitt 4.4) orientiert. Es ist wichtig, die Frau auf die Informationen zu venösen und arteriellen Thrombosen hinzuweisen, einschließlich des Risikos von Yvidually im Vergleich zu anderen KHK, die Symptome einer VTE und ATE, die bekannten Risikofaktoren und darauf, was im Falle einer vermuteten Thrombose zu tun ist.
Die Anwenderin ist zudem anzuweisen, die Packungsbeilage sorgfältig zu lesen und die darin gegebenen Ratschläge zu befolgen. Die Häufigkeit und Art der Untersuchungen sollte den gängigen Untersuchungsleitlinien entsprechen und individuell auf die Frau abgestimmt werden.
Die Anwenderinnen sind darüber aufzuklären, dass hormonale Kontrazeptiva nicht vor HIV-Infektionen (AIDS) und anderen sexuell übertragbaren Krankheiten schützen.
Verminderte Wirksamkeit
Die Wirksamkeit von KOK kann beeinträchtigt sein, wenn z. B. wirkstoffhaltige Tabletten vergessen wurden (siehe Abschnitt 4.2), bei gastrointestinalen Störungen während der Tabletteneinnahme (siehe Abschnitt 4.2) oder wenn gleichzeitig bestimmte andere Arzneimittel eingenommen werden (siehe Abschnitt 4.5).
Das flexible Regime wurde entwickelt, um die Menstruation hinausschieben zu können. Bei vielen Frauen wird das Verschieben der Menstruation durch auftretende Schmier- oder Durchbruchblutungen eingeschränkt. Das Auftreten solcher Blutungen ist unplanmäßig und kann nicht vorhergesagt werden. Lediglich die hormonelle Entzugsblutung, die auf die 4-tägige Einnahmepause folgt, lässt sich planen. Das flexible Regime von Yvidually gestattet eine Planung der Entzugsblutung während der flexiblen Phase zwischen Tag 25 und Tag 120 des Einnahmezyklus.
Wie bei allen KOK kann es zu unregelmäßigen Blutungen (Schmier- oder Durchbruchblutungen) kommen, sogar während der obligatorischen Phase des Einnahmezyklus zwischen den Tagen 1-24, insbesondere in den ersten Monaten der Anwendung. Daher ist eine Beurteilung unregelmäßiger Blutungen erst nach einer Anpassungsphase von etwa drei Monaten aussagekräftig.
Falls Blutungsunregelmäßigkeiten auch noch nach Auslösen einer Entzugsblutung anhalten, d. h. wenn Blutungsepisoden nach der 4-tägigen Einnahmepause deutlich verlängert sind oder die Blutungsintensität über das übliche Maß hinaus erhöht ist, sollten nicht-hormonelle Ursachen in Erwägung gezogen werden. Zum Ausschluss einer malignen Erkrankung oder einer Schwangerschaft sind angemessene diagnostische Maßnahmen angezeigt. Dies kann auch eine Kürettage beinhalten.
Bei einigen Frauen kommt es während der Einnahmepause möglicherweise nicht zu einer Entzugsblutung. Wenn das KOK entsprechend den in Abschnitt 4.2 beschriebenen Anweisungen eingenommen wurde, ist eine Schwangerschaft unwahrscheinlich. Wenn das KOK jedoch vor der ersten ausgebliebenen Entzugsblutung nicht vorschriftsmäßig eingenommen wurde oder wenn zwei Entzugsblutungen ausgeblieben sind, muss eine Schwangerschaft ausgeschlossen werden, bevor die Einnahme des KOKs fortgesetzt wird.
Während der Einnahme von Yvidually kommt es nicht notwendigerweise alle 4 Wochen zu einer Entzugsblutung, sondern mit verminderter Häufigkeit in Abständen von bis zu 120 Tagen (je nach dem, wann die Anwenderin entscheidet, eine 4-tägige Einnahmepause einzulegen). Daher kann das Ausbleiben einer Entzugsblutung nicht als Zeichen einer unerwarteten Schwangerschaft gewertet werden. Eine unerwartete Schwangerschaft kann daher schwer zu erkennen sein. Dies kann insbesondere bedeutsam sein bei Frauen, die Arzneimittel mit teratogenen Wirkungen anwenden. Obwohl eine Schwangerschaft bei vorschriftsmäßiger Einnahme von Yvidually unwahrscheinlich ist, sollte bei Verdacht auf eine Schwangerschaft - aus welchem Grund auch immer - ein Schwangerschaftstest durchgeführt werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Hinweis: Die Fachinformationen gleichzeitig verordneter Arzneimittel sollten auf mögliche Wechselwirkungen überprüft werden.
• Einfluss anderer Arzneimittel auf Yvidually
Wechselwirkungen zwischen oralen Kontrazeptiva und anderen Arzneimitteln können zu Durchbruchblutungen und/oder Versagen der Empfängnisverhütung führen. Die folgenden Wechselwirkungen sind in der Literatur beschrieben.
Leberstoffwechsel
Wechselwirkungen können mit Arzneimitteln auftreten, die Leberenzyme induzieren; dies kann eine erhöhte Clearance von Sexualhormonen zur Folge haben (z. B. Phenytoin, Barbiturate, Primidon, Carbamazepin, Rifampicin, Bosentan und Arzneimittel zur Behandlung einer HIV-Infektion (z. B. Ritonavir, Nevirapin) und möglicherweise auch Oxcarbazepin, Topiramat, Felbamat, Griseofulvin und Produkte, die das pflanzliche Heilmittel Johanniskraut (Hypericumperforatum) enthalten). Die
maximale Enzyminduktion wird in der Regel nach ungefähr 10 Tagen erreicht, kann aber nach Absetzen des Arzneimittelbehandlung noch 4 Wochen oder länger anhalten.
Wechselwirkungen mit dem enterohepatischen Kreislauf
Ein Versagen der Empfängnisverhütung wurde auch unter der Gabe von Antibiotika wie Penicillinen und Tetrazyklinen berichtet. Der Mechanismus dieser Wechselwirkung ist bislang nicht geklärt.
Vorgehensweise
Frauen, die kurzzeitig mit Arzneimitteln irgendeiner der oben genannten Substanzklassen oder mit einzelnen Wirkstoffen (Leberenzym-induzierende Arzneimitteln) mit Ausnahme von Rifampicin behandelt werden, sollten während dieser Zeit neben dem KOK zusätzlich eine Barrieremethode anwenden, d. h. während der Einnahme der Begleitmedikation und noch 7 Tage nach dem Absetzen.
Mit Rifampicin behandelte Frauen sollten zusätzlich zu dem KOK eine Barrieremethode für die Dauer der Rifampicin-Behandlung und weitere 28 Tage darüber hinaus anwenden.
Bei Frauen, die längerfristig mit Leberenzym-induzierenden Wirkstoffen behandelt werden, wird die Anwendung einer anderen zuverlässigen, nicht-hormonellen Verhütungsmethode empfohlen.
Frauen, die mit Antibiotika behandelt werden (mit Ausnahme von Rifampicin, siehe oben), sollten bis einschließlich 7 Tage nach Behandlungsende eine Barrieremethode anwenden.
Für die Zeit der Anwendung einer Barrieremethode sollte die Tabletteneinnahme nicht durch eine Einnahmepause unterbrochen werden.
Die Hauptmetaboliten von Drospirenon im menschlichen Plasma entstehen ohne Beteiligung des Zytochrom-P450-Systems. Es ist daher unwahrscheinlich, dass Inhibitoren dieses Enzymsystems den Metabolismus von Drospirenon beeinflussen.
• Einfluss von Yvidually auf andere Arzneimittel
Orale Kontrazeptiva können den Stoffwechsel bestimmter anderer Wirkstoffe beeinflussen. Entsprechend können Plasma- und Gewebekonzentrationen entweder erhöht (z. B. Ciclosporin) oder erniedrigt (z. B. Lamotrigin) werden.
In-vitro-Hemmstudien und In-vivo-Studien zu Wechselwirkungen bei Frauen, die Omeprazol, Simvastatin und Midazolam als Markersubstrat erhielten, zeigten, dass eine Wechselwirkung von Drospirenon in Dosen von 3 mg mit dem Metabolismus anderer Wirkstoffe unwahrscheinlich ist.
• Sonstige Wechselwirkungen
Bei nierengesunden Patientinnen zeigte die gleichzeitige Einnahme von Drospirenon und ACE-Hemmern oder NSARs keinen signifikanten Effekt auf den Kaliumspiegel im Serum. Die gleichzeitige Einnahme von Yvidually mit Aldosteronantagonisten oder kaliumsparenden Diuretika wurde jedoch nicht untersucht. In diesem Fall sollte im ersten Behandlungszyklus das Serumkalium kontrolliert werden (siehe auch Abschnitt 4.4).
• Laboruntersuchungen
Die Anwendung von steroidalen Kontrazeptiva kann die Ergebnisse bestimmter Labortests beeinflussen, einschließlich der biochemischen Parameter der Leber-, Schilddrüsen-, Nebennieren-und Nierenfunktion sowie der Plasmaspiegel von (Träger-)Proteinen, z. B. des kortikosteroidbindenden Globulins und der Lipid-/Lipoprotein-Fraktionen, der Parameter des Kohlenhydratstoffwechsels sowie die Gerinnungs- und Fibrinolyseparameter. Im Allgemeinen bleiben diese Veränderungen jedoch innerhalb des Normbereichs. Drospirenon führt aufgrund seiner leichten antimineralokortikoiden Wirkung zu einem Anstieg der Reninaktivität im Plasma und zu einem Anstieg des Plasmaaldosterons.
4.6 Fertilität, Schwangerschaft und Stillzeit
Yvidually ist während einer Schwangerschaft nicht indiziert. Bei Patientinnen, die eventuell Symptome einer Schwangerschaft wahrnehmen, sollte die Möglichkeit einer Schwangerschaft in Betracht gezogen werden, insbesondere, wenn sie sich nicht an das vorgeschriebene Einnahmeschema gehalten haben. Falls unter der Einnahme von Yvidually eine Schwangerschaft eintritt, ist das Arzneimittel sofort abzusetzen. In umfangreichen epidemiologischen Untersuchungen fand sich weder ein erhöhtes Risiko für Missbildungen bei Kindern, deren Mütter vor der Schwangerschaft KOK eingenommen hatten, noch eine teratogene Wirkung bei versehentlicher Einnahme von KOK in der Schwangerschaft.
Tierstudien zeigten unerwünschte Wirkungen während der Trächtigkeit und Laktation (siehe Abschnitt 5.3). Aufgrund dieser Ergebnisse bei Tieren können hormonelle Nebenwirkungen der Wirkstoffe nicht ausgeschlossen werden. Allgemeine Erfahrungen mit KOK während der Schwangerschaft ergaben jedoch keine Hinweise auf unerwünschte Wirkungen beim Menschen.
Die verfügbaren Daten zur Anwendung von Yvidually während der Schwangerschaft sind zu begrenzt, um Schlussfolgerungen hinsichtlich negativer Auswirkungen von Yvidually auf die Schwangerschaft und die Gesundheit des Fetus oder des Neugeborenen zu erlauben. Bisher sind keine einschlägigen epidemiologischen Daten verfügbar.
Während der Einnahme von Yvidually kommt es normalerweise nicht alle 4 Wochen zu einer Entzugsblutung, sondern mit verminderter Häufigkeit in Abständen von bis zu 120 Tagen. Eine unerwartete Schwangerschaft kann daher schwer zu erkennen sein. Wenn aus irgendeinem Grund bei einer Anwenderin von Yvidually eine Schwangerschaft vermutet wird, sollte ein Schwangerschaftstest durchgeführt werden.
Das erhöhte VTE-Risiko in der Zeit nach der Geburt sollte vor der erneuten Anwendung nach einer Anwendungspause bedacht werden (siehe Abschnitte 4.2 und 4.4).
KOK können die Laktation beeinflussen, da sie die Menge der Muttermilch vermindern und ihre Zusammensetzung verändern können. Daher wird die Anwendung von KOK generell nicht empfohlen, solange eine Mutter ihr Kind nicht vollständig abgestillt hat. Geringe Mengen der kontrazeptiven Steroide und/oder ihrer Metaboliten können während der KOK-Anwendung in die Muttermilch ausgeschieden werden. Diese Mengen könnten das Kind beeinträchtigen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Es wurden keine Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen bei Anwenderinnen von KOK beobachtet.
Zusammenfassung des Sicherheitsprofils
Die am häufigsten beobachteten Nebenwirkungen von Yvidually sind Übelkeit und Brustschmerzen. Sie treten bei mehr als 3 % der Anwenderinnen auf.
Schwerwiegende Nebenwirkungen sind arterielle und venöse Thromboembolie, Brustkrebs und fokale noduläre Hyperplasie.
Tabellarische Zusammenfassung der Nebenwirkungen
In der nachfolgenden Tabelle sind die Häufigkeiten der Nebenwirkungen, die für YAZ bekannt sind sowie in klinischen Studien mit Yvidually (N = 2623) berichtet wurden, zusammengefasst. In den Fällen, in denen Nebenwirkungen in den Studien beider klinischer Entwicklungsprogramme berichtet wurden, und die Häufigkeit unter Yvidually höher war, ist die Häufigkeit unter Yvidually aufgeführt.
|
Systemorganklasse (MedDRA Version 9.1) |
Häufig (> 1/100, < 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
Selten (> 1/10.000, < 1/1.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Infektionen und parasitäre Erkrankungen |
Candidose | |||
|
Erkrankungen des Blutes und des Lymphsystems |
Anämie Thrombozythämie | |||
|
Erkrankungen des Immunsystems |
Allergische Reaktion |
Überempfindlich keitsreaktionen | ||
|
Endokrine Erkrankungen |
Endokrine Erkrankungen | |||
|
Stoffwechsel- und Ernährungsstörungen |
Zunahme des Appetits Anorexie Hyperkaliämie Hyponatriämie | |||
|
Psychiatrische Erkrankungen |
Stimmungsschwankungen Depression Abnahme der Libido |
Nervosität Somnolenz |
Anorgasmie Insomnie | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
Benommenheit Parästhesie |
Schwindel Tremor | |
|
Augenerkrankun gen |
Konjunktivitis Augentrockenheit Augen erkrankungen | |||
|
Herzerkrankun gen |
Tachykardie | |||
|
Gefäßerkrankun gen |
Migräne |
Varizen Hypertonie |
Phlebitis Gefäßerkrankung Epistaxis Synkope Venöse |
|
Systemorganklasse (MedDRA Version 9.1) |
Häufig (> 1/100, < 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
Selten (> 1/10.000, < 1/1.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Thromboembolie (VTE) Arterielle Thromboembolie (ATE) | ||||
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit |
Bauchschmerzen Erbrechen Dyspepsie Flatulenz Gastritis Diarrhoe |
Abdomenvergrößerung Gastrointestinale Erkrankung Gastrointestinales Völlegefühl Hiatushernie Orale Candidose Obstipation Mundtrockenheit | |
|
Leber- und Gallenerkrankungen |
Gallenschmerzen Cholezystitis | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Akne Pruritus Hautausschlag |
Chloasma Ekzem Alopezie Akneiforme Dermatitis Trockene Haut Erythema nodosum Hypertrichosis Erkrankung der Haut Striae der Haut Kontaktdermatitis Photosensible Dermatitis Hautknötchen |
Erythema multiforme | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Rückenschmerzen Schmerzen in den Extremitäten Muskelkrämpfe | |||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Brustschmerzen Metrorrhagie* Amenorrhoe |
Vaginale Candidose Beckenschmerzen Vergrößerung der Brust Fibrozystische Brust Uterus-/Vaginal- blutungen* Genitalfluor Hitzewallungen Vaginitis Zyklusstörungen |
Dyspareunie Vulvovaginitis Postkoitale Blutung Entzugsblutung Brustzysten Brusthyperplasie Neoplasie der Brust Zervixpolyp Endometriumatrophie Ovarialzysten Vergrößerung des Uterus |
|
Systemorganklasse (MedDRA Version 9.1) |
Häufig (> 1/100, < 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
Selten (> 1/10.000, < 1/1.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Dysmenorrhoe Hypomenorrhoe Menorrhagie Vaginale Trockenheit Auffälliger Papanicolaou- Abstrich | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Asthenie Vermehrtes Schwitzen Ödeme (Ödemkrankheit, peripheres Ödem, Gesichtsödem) |
Unwohlsein | ||
|
Untersuchungen |
Gewichtszunahme |
Gewichtsabnahme | ||
|
* Unregelmäßige Blutungen lassen während |
fortgesetzter Behandlung üblicherweise nach. | |||
Zu venösen thromboembolischen Ereignissen (tiefen Venenthrombosen, Lungenembolie) und arteriellen thromboembolischen Ereignissen (Myokardinfarkt, zerebrovaskulärem Insult), Brustkrebs, fokaler nodulärer Hyperplasie (benignen Lebertumoren) und Migräne siehe auch Abschnitte 4.3 und 4.4.
Beschreibung ausgewählter Nebenwirkungen
Bei Anwenderinnen von KHK wurde ein erhöhtes Risiko für arterielle und venöse thrombotische und thromboembolische Ereignisse einschließlich Myokardinfarkt, Schlaganfall, transitorische ischämische Attacken, Venenthrombose und Lungenembolie beobachtet, die in Abschnitt 4.4 eingehender behandelt werden.
Nebenwirkungen mit sehr geringer Häufigkeit oder mit verzögertem Einsetzen von Symptomen, die in Zusammenhang mit der Gruppe der kombinierten oralen Kontrazeptiva berücksichtigt werden müssen, sind nachfolgend aufgelistet (siehe auch Abschnitte 4.3 und 4.4):
Tumoren
• Die Diagnosehäufigkeit von Brustkrebs unter Anwenderinnen von KOK ist geringfügig erhöht. Da bei Frauen unter 40 Jahren Brustkrebs selten auftritt, ist das zusätzliche Risiko im Verhältnis zum Gesamtrisiko, an Brustkrebs zu erkranken, gering. Eine Kausalität mit der Anwendung von KOK ist nicht bekannt.
• Lebertumoren (benigne und maligne)
Sonstige Erkrankungen
• Erythema nodosum, Erythema multiforme
• Frauen mit Hypertriglyzeridämie (erhöhtes Risiko für die Entwicklung einer Pankreatitis bei Einnahme von KOK)
• Hypertonie
• Auftreten oder Verschlechterung von Erkrankungen, für die ein Zusammenhang mit der Einnahme von KOK nicht eindeutig nachgewiesen ist: cholestatischer Ikterus und/oder Pruritus, Gallensteinbildung, Porphyrie, systemischer Lupus erythematodes, hämolytisch-urämisches Syndrom, Sydenham-Chorea, Herpes gestationis, Otosklerose-bedingte Schwerhörigkeit
• Bei Frauen mit hereditärem Angioödem können exogen zugeführte Estrogene Symptome eines Angioödems auslösen oder verschlimmern.
• Leberfunktionsstörungen
• Veränderungen der Glucosetoleranz oder Einfluss auf die periphere Insulinresistenz
• Morbus Crohn, Colitis ulcerosa
• Chloasma
• Überempfindlichkeit (einschließlich Symptomen wie Hautausschlag, Urtikaria) Wechselwirkungen
Wechselwirkungen anderer Arzneimittel (Enzyminduktoren, manche Antibiotika) mit oralen Kontrazeptiva können Durchbruchblutungen und/oder ein Versagen der kontrazeptiven Wirksamkeit zur Folge haben (siehe Abschnitt 4.5).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Für Yvidually liegen bislang keine Erfahrungen zur Überdosierung vor. Ausgehend von den mit kombinierten oralen Kontrazeptiva gesammelten allgemeinen Erfahrungen können möglicherweise folgende Symptome auftreten, wenn eine Überdosis an hormonhaltigen Tabletten eingenommen wurde: Übelkeit, Erbrechen und bei jungen Mädchen leichte vaginale Blutungen. Es gibt kein Antidot, und die weitere Behandlung sollte symptomatisch erfolgen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe (ATC): Gestagene und Estrogene, fixe Kombinationen ATC-Code: G03AA12
In klinischen Studien, die mit Yvidually in der Europäischen Union/Kanada und in den USA durchgeführt wurden, wurden die folgenden Pearl-Indices berechnet:
EU/Kanada: Pearl-Index für Methodenversagen: 0,59 (oberes zweiseitiges 95 %-Konfidenzlimit: 1,22).
Gesamt-Pearl-Index (Methodenversagen + Anwendungsfehler): 0,63 (oberes zweiseitiges 95 %-Konfidenzlimit: 1,24).
USA: Gesamt-Pearl-Index (Methodenversagen + Anwendungsfehler): 1,65 (oberes zweiseitiges 95 %-Konfidenzlimit: 2,65).
Die kontrazeptive Wirkung von Yvidually beruht auf dem Zusammenspiel verschiedener Faktoren, wobei die Ovulationshemmung und die Endometriumveränderungen als die wichtigsten Faktoren anzusehen sind.
Yvidually ist ein kombiniertes orales Kontrazeptivum mit Ethinylestradiol und dem Gestagen Drospirenon. In therapeutischer Dosierung hat Drospirenon auch antiandrogene und leichte antimineralokortikoide Eigenschaften. Es zeigt keinerlei estrogene, glukokortikoide und antiglukokortikoide Wirkungen. Dies verleiht Drospirenon ein pharmakologisches Profil, das dem des natürlichen Hormons Progesteron sehr ähnlich ist.
Aus klinischen Studien geht hervor, dass die leichten antimineralokortikoiden Eigenschaften von Yvidually zu einem leichten antimineralokortikoiden Effekt führen.
Yvidually ist ein KOK mit einem flexiblen verlängerten Einnahmeregime, das auf dem konventionellen KOK YAZ basiert. Daher betragen die minimale Dauer der ununterbrochenen Tabletteneinnahme 24 Tage und die Länge der Einnahmepause 4 Tage.
Eine multizentrische, offen randomisierte Parallelgruppen-Studie (EU/Kanada), die Yvidually mit YAZ verglich, hat gezeigt, dass das flexible Einnahmeregime, wenn es dazu verwendet wurde, eine maximale Länge eines blutungsfreien Intervalls zu erzielen, die Gesamtzahl an Menstruationsblutungstagen pro Jahr von durchschnittlich 66 Tagen (YAZ) auf durchschnittlich 41 Tage (Yvidually) reduzieren konnte.
Zwei multizentrische, doppelblinde, randomisierte, placebokontrollierte Studien wurden durchgeführt, um die Wirksamkeit und Sicherheit von YAZ bei Frauen mit moderater Akne vulgaris zu beurteilen.
Nach sechs Monaten Behandlung zeigte YAZ im Vergleich zu Placebo eine statistisch signifikant stärkere Verminderung von entzündlichen Läsionen um 15,6 % (49,3 % versus 33,7 %), von nichtentzündlichen Läsionen um 18,5 % (40,6 % versus 22,1 %) sowie der Anzahl der Läsionen insgesamt um 16,5 % (44,6 % versus 28,1 %). Darüber hinaus erreichte ein um 11,8 % höherer prozentualer Anteil von Probandinnen (18,6 % versus 6,8 %) die Einstufung „rein“ oder „nahezu rein“ auf der Skala Investigator’s Static Global Assessment (ISGA).
5.2 Pharmakokinetische Eigenschaften
• Drospirenon Resorption
Oral verabreichtes Drospirenon wird rasch und fast vollständig resorbiert. Nach einmaliger Einnahme werden nach etwa 1-2 Stunden maximale Wirkstoffkonzentrationen im Serum von etwa 38 ng/ml erreicht. Die Bioverfügbarkeit liegt zwischen 76 % und 85 %. Eine gleichzeitige Nahrungsaufnahme hat keinen Einfluss auf die Bioverfügbarkeit von Drospirenon.
Verteilung
Nach oraler Gabe sinken die Drospirenonspiegel im Serum mit einer terminalen Halbwertszeit von 31 Stunden. Drospirenon wird an Serumalbumin gebunden und bindet nicht an sexualhormonbindendes Globulin (SHBG) oder kortikosteroidbindendes Globulin (CBG). Nur 3-5 % der Gesamtkonzentration des Wirkstoffs im Serum liegen als freies Steroid vor. Der Ethinylestradiolinduzierte Anstieg des SHBG beeinflusst die Serumproteinbindung von Drospirenon nicht. Das mittlere scheinbare Verteilungsvolumen von Drospirenon beträgt 3,7 ± 1,2 l/kg.
Metabolismus
Drospirenon wird nach oraler Gabe weitgehend metabolisiert. Die Hauptmetaboliten im Plasma sind die Säureform von Drospirenon, die durch eine Öffnung des Lactonrings entsteht, und das 4,5-Dihydro-Drospirenon-3-sulfat. Beide Metaboliten werden ohne Beteiligung des P450-Systems gebildet. Drospirenon wird in geringem Ausmaß durch Cytochrom P450 3A4 metabolisiert. In vitro konnte gezeigt werden, dass Drospirenon Cytochrom P450 3A4, Cytochrom P450 1A1, Cytochrom P450 2C9 und Cytochrom P450 2C19 hemmt.
Ausscheidung
Die metabolische Clearance-Rate von Drospirenon im Serum beträgt 1,5 ± 0,2 ml/min/kg.
Drospirenon wird unverändert nur in Spuren ausgeschieden. Die Metaboliten von Drospirenon werden mit dem Stuhl und Urin bei einem Exkretionsverhältnis von ungefähr 1,2 bis 1,4 ausgeschieden. Die Halbwertszeit der Metabolitenausscheidung über Urin und Stuhl beträgt ungefähr 40 Stunden.
Steady-State-Bedingungen
Im Verlauf eines Behandlungszyklus werden die maximalen Steady-State-Konzentrationen von Drospirenon im Serum von ungefähr 70 ng/ml nach etwa 8 Behandlungstagen erreicht. Die Serum-Drospirenonspiegel akkumulierten um einen Faktor von etwa 2-3 als Folge des Verhältnisses von terminaler Halbwertszeit und Dosisintervall.
Besondere Gruppen von Anwenderinnen
Auswirkungen einer Niereninsuffizienz
Die Serumspiegel von Drospirenon im Fließgleichgewicht bei Frauen mit leichter Niereninsuffizienz (Kreatinin-Clearance CLcr, 50-80 ml/min) waren vergleichbar mit denen von Frauen mit normaler Nierenfunktion. Bei Frauen mit mäßiger Niereninsuffizienz (CLcr, 30-50 ml/min) waren die Serumspiegel von Drospirenon im Mittel um 37 % höher als bei Frauen mit normaler Nierenfunktion. Die Behandlung mit Drospirenon wurde auch von Frauen mit leichter bis mäßiger Niereninsuffizienz gut vertragen. Die Drospirenon-Behandlung zeigte keinen klinisch signifikanten Einfluss auf die Kaliumkonzentration im Serum.
Auswirkungen einer Leberinsuffizienz
In einer Einzeldosisstudie nahm bei Probandinnen mit mäßiger Leberinsuffizienz die orale Clearance (CL/f) um ca. 50 % ab im Vergleich zu denen mit normaler Leberfunktion. Die beobachtete Abnahme der Drospirenon-Clearance bei Probandinnen mit mäßiger Leberinsuffizienz führte nicht zu erkennbaren Änderungen der Kaliumkonzentrationen im Serum. Selbst bei Diabetes und begleitender Behandlung mit Spironolacton (zwei prädisponierenden Faktoren für eine Hyperkaliämie) war kein Anstieg der Kaliumkonzentrationen im Serum über die obere Grenze des Normalbereichs zu beobachten. Es kann daher festgestellt werden, dass Drospirenon von Patienten mit leichter bis mäßiger Leberinsuffizienz (Child-Pugh B) gut vertragen wird.
Ethnische Gruppen
Zwischen japanischen und kaukasischen Frauen wurden keine klinisch bedeutsamen Unterschiede in der Pharmakokinetik von Drospirenon und Ethinylestradiol beobachtet.
• Ethinylestradiol
Resorption
Oral verabreichtes Ethinylestradiol wird schnell und vollständig resorbiert. Das Konzentrationsmaximum im Serum von ca. 33 pg/ml wird innerhalb von 1-2 Stunden nach oraler Einzelgabe erreicht. Infolge der präsystemischen Konjugation und des First-Pass-Metabolismus liegt die absolute Bioverfügbarkeit bei ca. 60 %. Bei ca. 25 % der untersuchten Probandinnen verringerte die gleichzeitige Nahrungsaufnahme die Bioverfügbarkeit von Ethinylestradiol, während bei den übrigen Probandinnen keine Änderung zu beobachten war.
Verteilung
Serumspiegel von Ethinylestradiol sinken in zwei Phasen. Die terminale Dispositionsphase ist von einer Halbwertszeit von ca. 24 Stunden gekennzeichnet. Ethinylestradiol wird stark (zu ca. 98,5 %) aber unspezifisch an Serumalbumin gebunden. Ethinylestradiol induziert einen Anstieg der Konzentrationen von Sexualhormon-bindendem Globulin (SHBG) und Kortikosteroid-bindendem Globulin (CBG) im Serum. Das scheinbare Verteilungsvolumen wurde mit ca. 5 l/kg bestimmt.
Metabolismus
Ethinylestradiol unterliegt der präsystemischen Konjugation sowohl in der Mukosa des Dünndarms als auch in der Leber. Der primäre Metabolisierungsweg von Ethinylestradiol besteht in einer aromatischen Hydroxylierung. Jedoch werden zahlreiche hydroxylierte und methylierte Metabolite gebildet, die in freier Form und in Form von Glukuronid- und Sulfatkonjugaten vorliegen. Die metabolische Clearance-Rate von Ethinylestradiol beträgt ca. 5 ml/min/kg.
Ausscheidung
Ethinylestradiol wird nicht in signifikantem Ausmaß in unveränderter Form ausgeschieden. Die Metaboliten von Ethinylestradiol werden über den Urin und die Galle im Verhältnis 4:6 ausgeschieden. Die Halbwertszeit der Metabolitenausscheidung liegt bei ungefähr 1 Tag.
Steady-State-Bedingungen
Steady-State-Bedingungen werden nach ungefähr 14 Tagen durchgehender täglicher Tabletteneinnahme erreicht. Die Serumspiegel von Ethinylestradiol akkumulieren um einen Faktor von ungefähr 1,5 bis 2,3.
5.3 Präklinische Daten zur Sicherheit
In Tierversuchen beschränkten sich die Effekte von Drospirenon und Ethinylestradiol auf diejenigen, die mit den bekannten pharmakologischen Wirkungen in Verbindung gebracht werden. Insbesondere zeigten reproduktionstoxikologische Studien bei Versuchstieren embryotoxische und fetotoxische Wirkungen, die als speziesspezifische Effekte bewertet wurden. Unter Exposition in Dosen, die über denen liegen, die mit Yvidually eingenommen werden, wurden Veränderungen in der Differenzierung der Sexualorgane von Rattenfeten, nicht aber bei Feten von Affen beobachtet.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Tablettenkern:
Lactose-Monohydrat
Maisstärke
Magnesiumstearat (Ph. Eur.) [pflanzlich] (E470b)
Tablettenfilmüberzug:
Hypromellose (E464)
Talkum (E553b)
Titandioxid (E171)
Eisen(III)-oxid (E172)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
Haltbarkeit nach Anbruch: 40 Tage.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Sobald die Patrone aus der Blisterpackung entnommen wurde, muss die Patrone in den Tablettenspender eingesetzt werden, und die Tabletten müssen sofort verwendet werden.
6.5 Art und Inhalt des Behältnisses
Startpackung:
1 x 30 Filmtabletten und ein Tablettenspender
Nachfüllpackungen:
1 x 30 Filmtabletten
3 x 30 Filmtabletten
4 x 30 Filmtabletten 12 x 30 Filmtabletten
Die Filmtabletten werden in einer Patrone geliefert. Jede Patrone enthält 30 hellrosa Tabletten und ist in eine Blisterpackung verpackt, die aus zwei mehrschichtigen Folien (OPA/Al/PE) durch Kaltumformung hergestellt ist.
Die Patronen sind weiß/transparent und bestehen aus einem Methyl-Methacrylat/Acrylonitril/ Butadien/Styren-Polymer (MABS), Polybutylen-Terephtalat (PBT) und Polyoxymethylen (POM).
Das Gehäuse des Tablettenspenders (nur in der Startpackung) ist aus MABS mit weichen Griffen auf Grundlage eines Styren/Ethylen/Butylen/Styren-Block-Copolymers (SEBS). Die Patrone wird in einen Kanal der inneren Gehäusekonstruktion geschoben, das aus Polyarylamid mit Glasfasern hergestellt ist.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Yvidually kann nur in Kombination mit dem Clyk-Tablettenspender verwendet werden.
Die Gebrauchsanweisung des Spenders sollte vor und während der Verwendung des Tablettenspenders sorgfältig durchgelesen werden.
Der Spender im Überblick:
Anzeige der Referenzzeit
|
Anzeige |
.......... * | |
|
OK-Taste | ||
|
MENÜ-Taste |
.............se) (ok | |
|
Weiche Seite |
Weiche Seite |
o
Tablettenausgabe Patronenauswurf
Anzeige der Referenzzeit Weiche Seiten
Zeigt den Zeitpunkt an, zu dem eine Tablette Hier drücken Sie, um eine Tablette zu
eingenommen werden sollte. entnehmen.
Anzeige
Patronenauswurf
Wirft die Patrone aus. Tablettenausgabe
Hier werden die Tabletten ausgeworfen.
Zeigt den Startbildschirm und die zugehörigen MENÜ-Bildschirme.
Menütaste
Zum Navigieren durch die MENÜ-Bildschirme.
OK-Taste
Zur Bestätigung von Aktionen, wie z. B. dem Beginn einer 4-tägigen Pause und dem Ändern des Erinnerungstonstatus.
Die wichtigsten Funktionen:
Die wichtigsten Funktionen des Clyk-Tablettenspenders sind in einer kurzen Übersicht in der Kurzanleitungskarte erklärt.
Aktivieren des neuen Tablettenspenders:
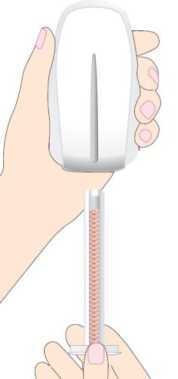
Die Patrone (mit 30 Tabletten) wird aus der Verpackung entnommen und sollte UNVERZÜGLICH in den Tablettenspender eingesetzt werden. Setzen Sie die Patrone mit dem schmalen Ende so in den Spender, dass das Sichtfenster des Spenders (sowie die Tabletten in der Patrone) zu sehen sind (siehe Abb. 1). Die Patrone MUSS ganz hinein geschoben werden.
Abb. 1: Vorbereitung des Tablettenspenders für den Gebrauch
Der Spender speichert automatisch den Zeitpunkt der ersten Tablettenabgabe, indem diese Zeit als Referenzzeit festgelegt wird. Daher muss die Anwenderin
> sicherstellen, dass sie die Patrone erst an dem Tag auspackt und einsetzt, an dem sie mit der Tabletteneinnahme beginnen möchte
> sicher sein, dass sie ihre erste Tablette zu einem Zeitpunkt entnimmt, zu dem sie die Pille jeden Tag bequem einnehmen kann.
Die Anzeige des Spenders zeigt nun alle 24 Stunden an, dass es Zeit für die nächste Tabletteneinnahme ist.
Entnahme einer Tablette:
Die beiden weichen Seiten des Spenders werden gleichzeitig mit einer Hand gedrückt, um eine Tablette in die andere Hand auszuwerfen.
Austauschen einer Patrone:
Bei routinemäßiger Verwendung kann eine Patrone nur entfernt werden, wenn sie leer ist. Durch Drücken der Patronenauswurftaste wird die leere Patrone ausgeworfen. Der Spender speichert alle Informationen über den aktuellen Einnahmezyklus. Nun kann eine neue vollständig gefüllte Patrone wie oben beschrieben eingesetzt werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Bayer Vital GmbH D - 51368 Leverkusen Telefon: (0214) 30-5 13 48 Telefax: (0214) 30-5 16 03
E-Mail-Adresse: bayer-vital@bayerhealthcare.com
8. ZULASSUNGSNUMMER
83235.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 01. Februar 2013
10. STAND DER INFORMATION
06/2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
25
Diese Inzidenzen wurden aus der Gesamtheit der epidemiologischen Studiendaten abgeleitet, wobei relative Risiken der verschiedenen Arzneimittel im Vergleich zu Levonorgestrel-haltigen KHK verwendet wurden.
Mittelwert der Spannweite 5-7 pro 10.000 Frauenjahre, auf der Grundlage eines relativen Risikos für Levonorgestrel-haltige KHK versus Nichtanwendung von ungefähr 2,3 bis 3,6