Zoledronsäure Sun 4 Mg/5 Ml Konzentrat Zur Herstellung Einer Infusionslösung
FACHINFORMATION
1. Bezeichnung des Arzneimittels
Zoledronsäure SUN 4 mg/5 ml Konzentrat zur Herstellung einer Infusionslösung
2. Qualitative und quantitative Zusammensetzung
1 Durchstechflasche mit 5 ml Konzentrat enthält 4 mg Zoledronsäure, entsprechend 4,264 mg Zoledronsäure-Monohydrat.
1 ml des Konzentrats enthält 0,8 mg Zoledronsäure (als Monohydrat).
1 Durchstechflasche enthält weniger als 1 mmol Natrium.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Konzentrat zur Herstellung einer Infusionslösung.
Klare, farblose, sterile Lösung mit pH zwischen 5,7 und 6,7 und einer Osmolalität zwischen 280 und 340 mOsm/kg.
4. Klinische Angaben
4.1 Anwendungsgebiete
- Prävention skelettbezogener Komplikationen (pathologische Frakturen,
Wirbelkompressionen, Bestrahlung oder Operation am Knochen oder tumorinduzierte Hyperkalzämie) bei erwachsenen Patienten mit fortgeschrittenen, auf das Skelett ausgedehnten, Tumorerkrankungen.
- Behandlung erwachsener Patienten mit tumorinduzierter Hyperkalzämie
(TIH).
4.2 Dosierung und Art der Anwendung
Zoledronsäure SUN darf Patienten nur von Ärzten mit Erfahrung bei der Anwendung von intravenösen Bisphosphonaten verschrieben und verabreicht werden.
Dosierung
Prävention skelettbezogener Komplikationen bei Patienten mit fortgeschrittenen, auf das Skelett ausgedehnten, Tumorerkrankungen Erwachsene und ältere Patienten
Die empfohlene Dosis zur Prävention skelettbezogener Ereignisse bei Patienten mit fortgeschrittenen, auf das Skelett ausgedehnten, Tumorerkrankungen beträgt 4 mg Zoledronsäure in Abständen von 3-4 Wochen.
Patienten sollten zusätzlich 500 mg Kalzium und 400 I.E. Vitamin D pro Tag oral erhalten.
Bei der Entscheidung, Patienten mit Knochenmetastasen zur Prävention skelettbezogener Komplikationen zu behandeln, sollte berücksichtigt werden, dass die Wirkung nach 2-3 Monaten eintritt.
Behandlung der TIH Erwachsene und ältere Patienten
Die empfohlene Dosierung bei Hyperkalzämie (Albumin-korrigierter Serum-KalziumSpiegel > 12,0 mg/dl oder 3,0 mmol/l) beträgt eine Einzeldosis 4 mg Zoledronsäure.
Nierenfunktionsstörungen
TIH
Die Behandlung mit Zoledronsäure SUN bei Patienten mit TIH und einer schweren Nierenfunktionsstörung sollte nur nach vorheriger Nutzen-Risiko-Beurteilung der Behandlung erwogen werden. In den klinischen Studien waren Patienten mit einem Serum-Kreatinin > 400 pmol/l oder 4,5 mg/dl ausgeschlossen. Bei Patienten mit TIH und einem Serum-Kreatinin < 400 pmol/l oder < 4,5 mg/dl sind keine Dosisanpassungen erforderlich (siehe Abschnitt 4.4).
Prävention skelettbezogener Komplikationen bei Patienten mit fortgeschrittenen, auf das Skelett ausgedehnten, Tumorerkrankungen Zu Beginn der Behandlung mit Zoledronsäure SUN sollte bei Patienten mit multiplem Myelom oder metastatischen Knochenläsionen aufgrund solider Tumore das Serum-Kreatinin und die Kreatinin-Clearance (CrCl) bestimmt werden. Die CrCl wird aus dem Serum-Kreatinin unter Verwendung der Cockroft-Gault-Formel berechnet. Bei Patienten, die bereits vor Beginn der Behandlung eine schwere Nierenfunktionsstörung aufweisen, die für diese Patientenpopulation als CrCl < 30 ml/min definiert ist, wird Zoledronsäure SUN nicht empfohlen. In den klinischen Studien mit Zoledronsäure waren Patienten mit einem Serum-Kreatinin >265 pmol/l oder >3.0 mg/dl ausgeschlossen.
Die Patienten mit Kochenmetastasen, die vor Beginn der Therapie eine leichte bis mittelschwere Nierenfunktionsstörung aufweisen, die bei dieser Patientenpopulation als CLcr30-60 ml/min definiert ist, werden die folgenden Dosierungen von Zoledronsäure SUN empfohlen (siehe auch Abschnitt 4.4):
|
Kreatinin-Clearance zu Beginn der Behandlung (ml/min) |
Empfohlene Dosierung Zoledronsäure1 |
|
>60 |
4,0 mg Zoledronsäure |
|
50-60 |
3,5 mg1 Zoledronsäure |
|
40-49 |
3,3 mg1 Zoledronsäure |
|
30-39 |
3,0 mg1 Zoledronsäure |
Nach Beginn der Behandlung sollte vor jeder Gabe von Zoledronsäure SUN das Serum-Kreatinin gemessen und auf die weitere Behandlung verzichtet werden, wenn sich die Nierenfunktion verschlechtert hat. In den klinischen Studien wurde eine Verschlechterung der Nierenfunktion wie folgt definiert:
- Bei Patienten mit normalem Serum-Kreatinin zu Beginn der Behandlung (<1,4
mg/dl oder <124 pmol/l) ein Anstieg um 0,5 mg/dl oder 44 pmol/l.
- Bei Patienten mit erhöhtem Serum-Kreatinin zu Beginn der Behandlung (>1,4
mg/dl oder >124 pmol/l) ein Anstieg um 1,0 mg/dl oder 88 pmol/l.
In klinischen Studien wurde die Behandlung mit Zoledronsäure erst dann erneut aufgenommen, wenn die Kreatinin-Werte nur noch maximal 10% über dem Ausgangswert lagen (siehe Abschnitt 4.4). Die Therapie mit Zoledronsäure sollte mit der gleichen Dosis wie vor der Unterbrechung der Behandlung wieder aufgenommen werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Zoledronsäure bei Kindern im Alter von 1 bis 17 Jahren ist nicht erwiesen. Zurzeit vorliegende Daten werden in Abschnitt 5.1 beschrieben; eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
Art der Anwendung Intravenöse Anwendung.
Das in 100 ml weiterverdünnte Zoledronsäure SUN 4 mg/5 ml Konzentrat zur Herstellung einer Infusionslösung (siehe Abschnitt 6.6) sollte auf einmal als intravenöse Infusion über mindestens 15 Minuten gegeben werden.
Bei Patienten mit leichter bis mittelschwerer Nierenfunktionstörung werden verringerte Dosen von Zoledronsäure SUN empfohlen (siehe oben Abschnitt „Dosierung" und Abschnitt 6.3).
Anweisungen zur Zubereitung der verminderten Dosen von Zoledronsäure SUN Entnehmen Sie das jeweils entsprechende Volumen des Infusionslösungskonzentrates :
- 4,4 ml für eine Dosis von 3,5 mg
- 4,1 ml für eine Dosis von 3,3 mg
- 3,8 mg für eine Dosis von 3,0 mg
Die entnommene Menge des Infusionslösungskonzentrates muss in 100 ml steriler 0,9% Natriumchlorid-Lösung oder 5% Glucose-Lösung verdünnt werden. Die Dosis muss in einer einzigen intravenösen Infusion über mindestens 15 Minuten verabreicht werden.
Zoledronsäure SUN Konzentrat darf nicht mit kalziumhaltigen Lösungen oder anderen Infusionslösungen mit bivalenten Kationen wie Ringer-Laktat-Lösung gemischt werden und sollte als intravenöse Einzellösung über eine eigene Infusionslinie gegeben werden.
Vor und nach der Gabe von Zoledronsäure SUN müssen die Patienten ausreichend hydratisiert sein.
Hinweise zur Verdünnung des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff, andere Bisphosphonate oder einen der
in Abschnitt 6.1 genannten sonstigen Bestandteile
- Stillen (siehe Abschnitt 4.6)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Allgemein
Vor der Applikation von Zoledronsäure SUN muss eingeschätzt werden, ob die Patienten in einem adäquaten Hydratationszustand sind.
Eine Hyperhydratation ist bei Patienten mit einem Risiko für eine Herzinsuffizienz zu vermeiden.
Die üblicherweise mit einer Hyperkalzämie in Zusammenhang stehenden metabolischen Parameter wie z.B. die Serumspiegel von Kalzium, Phosphat und Magnesium sollten nach Einleitung der Therapie mit Zoledronsäure SUN sorgfältig überwacht werden. Bei Auftreten von Hypokalzämie, Hypophosphatämie oder Hypomagnesiämie kann eine kurzzeitige Substitution notwendig werden. Unbehandelte Patienten mit Hyperkalzämie weisen im Allgemeinen eine Nierenfunktionsstörung auf. Deshalb sollte eine sorgfältige Überwachung der Nierenfunktion in Betracht gezogen werden.
Patienten, die mit Zoledronsäure SUN behandelt werden, sollten nicht gleichzeitig andere Zoledronsäure-haltigen Arzneimittel (zur Behandlung der Osteoporose oder einer anderen nicht krebsbedingten Knochenerkrankung) oder andere Bisphosphonate erhalten, weil die kombinierte Wirkung dieser Stoffe nicht bekannt ist.
Niereninsuffizienz
Bei Patienten mit TIH und Hinweisen auf eine Verschlechterung der Nierenfunktion ist darauf zu achten, dass der potenzielle Nutzen einer Behandlung mit Zoledronsäure gegenüber möglichen Risiken überwiegt.
Bei der Entscheidung zur Behandlung von Patienten mit Knochenmetastasen zur Prävention skelettbezogener Ereignisse sollte berücksichtigt werden, dass der Behandlungseffekt nach 2-3 Monaten einsetzt.
Zoledronsäure wurde mit Berichten über Nierenfunktionsstörungen in Zusammenhang gebracht. Faktoren, die die Wahrscheinlichkeit einer Verschlechterung der Nierenfunktion erhöhen können, sind unter anderem Dehydratation, vorbestehende Nierenfunktionsstörungen, mehrere Behandlungszyklen mit Zoledronsäure und anderen Bisphosphonaten sowie die Anwendung anderer nephrotoxischer Arzneimittel. Auch wenn das Risiko bei einer Dosierung von 4 mg Zoledronsäure, gegeben über 15 Minuten, verringert ist, kann dennoch eine Verschlechterung der Nierenfunktion auftreten. Über eine Verschlechterung der Nierenfunktion, einschließlich der weiteren Zunahme bis zur Niereninsuffizienz und Notwendigkeit einer Dialysebehandlung, wurde bei Patienten nach der Initialdosis oder nach einmaliger Dosis von 4 mg Zoledronsäure berichtet. Ein Anstieg des Serum-Kreatinins tritt bei einigen Patienten auch unter chronischer Anwendung von Zoledronsäure in der empfohlenen Dosis zur Prävention skelettbezogener Ereignisse auf, wenngleich weniger häufig.
Vor jeder Gabe von Zoledronsäure sollten die Serum-Kreatinin-Werte der Patienten bestimmt werden. Zu Beginn der Behandlung von Patienten mit Knochenmetastasen mit leichten und mittelschweren Nierenfunktionsstörungen werden niedrigere Dosen von Zoledronsäure empfohlen. Bei Hinweis auf eine Verschlechterung der Nierenfunktion während der Behandlung sollte Zoledronsäure abgesetzt werden. Zoledronsäure sollte erst dann erneut gegeben werden, wenn die Serum-Kreatininwerte nur noch maximal 10% über dem Ausgangswert liegen. Die Behandlung mit Zoledronsäure sollte mit der gleichen Dosierung wie vor der Behandlungsunterbrechung wieder aufgenommen werden.
Angesichts eines möglichen Einflusses von Zoledronsäure auf die Nierenfunktion kann wegen des Fehlens von Daten zur klinischen Verträglichkeit bei Patienten mit schweren Nierenfunktionsstörungen zu Beginn der Behandlung (in klinischen Studien definiert als Serum-Kreatinin >400 mmol/l oder >4,5 mg/dl bei Patienten mit TIH bzw. >265 ^mol/l oder >3,0 mg/dl bei Patienten mit Tumoren und Knochenmetastasen) sowie nur begrenzter pharmakokinetischer Daten bei Patienten mit schweren Niereunfunktionsstörungen zu Beginn der Behandlung (Kreatinin-Clearance <30 ml/min) die Anwendung von Zoledronsäure bei Patienten mit schweren Nierenfunktionsstörungen nicht empfohlen werden.
Leberinsuffizienz
Da für die Behandlung von Patienten mit schweren Leberfunktionsstörungen nur wenige klinische Daten verfügbar sind, können für diese Patienten keine speziellen Empfehlungen gegeben werden.
Osteonekrosen im Kieferbereich
Über Osteonekrosen im Kieferbereich (ONJ) wurde bei Patienten berichtet. Dies betraf in erster Linie Tumorpatienten, die mit Arzneimitteln, die die Knochenresorption hemmen wie Zoledronsäure, behandelt wurden. Viele dieser Patienten erhielten zusätzlich eine Chemotherapie und Kortikosteroide. Die Mehrzahl der berichteten Fälle trat bei gleichzeitiger dentaler Behandlung wie z.B. Zahnextraktion auf. Viele Patienten hatten Anzeichen einer lokalen Infektion, einschließlich Osteomyelitis.
Die folgenden Risikofaktoren sollten in Betracht gezogen werden, wenn das individuelle Risiko für das Auftreten einer ONJ bestimmt wird:
- Potenz des Bisphosphonats (höheres Risiko für hoch potente Substanzen), Art
der Anwendung (höheres Risiko bei parenteraler Anwendung) und kumulative Dosis
- Krebs, Chemotherapie, Strahlentherapie, Kortikosteroide, Rauchen
- Zahnerkrankungen in der Vorgeschichte, mangelhafte Mundhygiene, peridontale
Erkrankung, invasive Zahnbehandlungen und schlecht sitzende Zahnprothese.
Vor der Behandlung mit Bisphosphonaten sollte bei Patienten mit gleichzeitig vorhandenen Risikofaktoren eine zahnärztliche Untersuchung mit angemessenen prophylaktischen zahnmedizinischen Maßnahmen erwogen werden.
Während der Behandlung sollten bei diesen Patienten invasive dentale Eingriffe möglichst vermieden werden. Bei Patienten, bei denen während der Behandlung mit Bisphosphonaten eine Osteonekrose im Kieferbereich auftritt, kann ein dentaler Eingriff zur Verschlechterung des Zustandes führen. Für Patienten, bei denen invasive dentale Eingriffe erforderlich sind, gibt es keine Daten, die darauf hinweisen, ob eine Unterbrechung der Bisphosphonat-Behandlung das Risiko einer Osteonekrose im Kieferbereich vermindert. Für den Behandlungsplan eines jeden Patienten sollte die klinische Beurteilung des behandelnden Arztes, basierend auf der individuellen Nutzen-Risiko-Abwägung, ausschlaggebend sein.
Muskel- und Skelettschmerzen
Seit der Markteinführung wurden starke und gelegentlich zur Einschränkung der Beweglichkeit führende Knochen-, Gelenk-, und Muskelschmerzen berichtet bei Patienten, die Zoledronsäure angewendet haben. Diese Berichte waren jedoch selten. Der Zeitpunkt des Auftretens der Symptome variierte vom ersten Tag nach Beginn der Behandlung bis zu mehreren Monaten später. Bei den meisten Patienten besserten sich die Symptome nach Beendigung der Behandlung. Bei einem Teil der Patienten traten die Symptome nach Reexposition mit Zoledronsäure oder einem anderen Bisphosphonat wieder auf.
Atypische Femurfrakturen
Atypische subtrochantäre und diaphysäre Femurfrakturen wurden unter Bisphosphonat-Therapie berichtet, vor allem bei Patienten unter Langzeitbehandlung gegen Osteoporose. Diese transversalen oder kurzen Schrägfrakturen können überall entlang des Oberschenkelknochens auftreten, direkt unterhalb des Trochanter minor bis direkt oberhalb der Femurkondylen. Diese Frakturen entstehen nach einem minimalen Trauma oder ohne Trauma und manche Patienten verspüren Oberschenkel- oder Leistenschmerzen oft im Zusammenhang mit Anzeichen einer Niedrig-Energie-Fraktur in bildgebenden Verfahren Wochen bis Monate vor dem Auftreten einer manifesten Femurfraktur. Frakturen treten häufig bilateral auf. Aus diesem Grund sollte bei Patienten, die mit Bisphosphonaten behandelt werden und eine Femurschaftfraktur hatten, der kontralaterale Femur ebenfalls untersucht werden. Über eine schlechte Heilung dieser Frakturen ist ebenfalls berichtet worden. Bei Patienten mit Verdacht auf eine atypische Femurfraktur sollte ein Absetzen der Bisphosphonat-Therapie, vorbehaltlich einer Beurteilung des Patienten, auf Grundlage einer individuellen Nutzen-RisikoBewertung in Betracht gezogen werden.
Während einer Behandlung mit Bisphosphonaten sollte den Patienten geraten werden, über jegliche Oberschenkel-, Hüft- oder Leistenschmerzen zu berichten und jeder Patient mit diesen Symptomen sollte auf eine unvollständige Femurfraktur hin untersucht werden.
Hypokalzämie
Bei Patienten, die mit Zoledronsäure behandelt wurden, wurde Hypokalzämie berichtet. Als Folge einer schweren Hypokalzämie wurde über Herzrhythmusstörungen und neurologische Nebenwirkungen (einschließlich Krampfanfälle, Taubheitsgefühl und Tetanie) berichtet. Es wurde über Fälle schwerer Hypokalzämie berichtet, die eine Hospitalisierung erforderlich machten. In einigen Fällen kann die Hypokalzämie lebensbedrohlich sein (siehe Abschnitt 4.8).
Dieses Arzneimittel enthält Natrium, aber weniger als 0,26 mmol (6 mg) Natrium in der maximalen Einzeldosis, d.h. es ist nahezu „natriumfrei“.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
In klinischen Studien wurde Zoledronsäure gemeinsam mit häufig verwendeten antitumorösen Arzneimitteln sowie mit Diuretika, Antibiotika und Analgetika angewandt, ohne dass klinisch erkennbare Wechselwirkungen aufgetreten wären.
Zoledronsäure wird nur unwesentlich an Plasmaproteine gebunden und hemmt in vitro keine humanen P450-Enzyme (siehe Abschnitt 5.2). Spezielle klinische Studien zu Wechselwirkungen wurden jedoch nicht durchgeführt. Vorsicht ist geboten, wenn Bisphosphonate gleichzeitig mit Aminoglykosiden angewendet werden, weil beide Substanzklassen einen additiven Effekt zeigen können, der zu einem niedrigeren Serum-Kalzium-Spiegel über einen länger als erforderlichen Zeitraum führen kann. Vorsicht ist geboten, wenn Zoledronsäure zusammen mit anderen Arzneimitteln gegeben wird, die möglicherweise ebenfalls die Nierenfunktion beeinträchtigen könnten. Es ist auch auf eine möglicherweise während der Behandlung auftretende Hypomagnesiämie zu achten.
Bei Patienten mit multiplem Myelom kann das Risiko für eine Verschlechterung der Nierenfunktion erhöht sein, wenn Zoledronsäure zusammen mit Thalidomid angewendet wird.
Vorsicht ist angezeigt, wenn Zoledronsäure gleichzeitig mit anti-angiogenetischen Arzneimitteln angewendet wird, da bei Patienten, die mit diesen Arzneimitteln gleichzeitig behandelt wurden, ein Anstieg der Häufigkeit des Auftretens von Osteonekrosen des Kiefers beobachtet wurde.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Es liegen keine hinreichenden Daten über die Verwendung von Zoledronsäure bei Schwangeren vor. Tierexperimentelle Studien mit Zoledronsäure haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Das potenzielle Risiko für den Menschen ist nicht bekannt. Zoledronsäure sollte nicht während der Schwangerschaft angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Zoledronsäure in die Muttermilch übergeht. Zoledronsäure ist in der Stillzeit kontraindiziert (siehe Abschnitt 4.3).
Fertilität
Zoledronsäure wurde bei Ratten hinsichtlich möglicher unerwünschter Wirkungen auf die Fertilität der Eltern und der F1-Generation untersucht. Dabei kam es zu einem übersteigerten pharmakologischen Effekt, der auf die hemmende Wirkung der Substanz auf den Kalziummetabolismus im Knochen zurückgeführt wurde. Dies führte zu peripartaler Hypokalzämie, einem Klasseneffekt von Bisphosphonaten, Dystokie und einer frühzeitigen Beendigung der Studie. Die Ergebnisse lassen daher keinen definitiven Schluss auf die Wirkung von Zoledronsäure auf die Fertilität beim Menschen zu.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nebenwirkungen wie Schwindel und Müdigkeit können einen Einfluss auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen haben, daher ist bei der Anwendung von Zoledronsäure zusammen mit Autofahren oder dem Bedienen von Maschinen Vorsicht geboten.
4.8 Nebenwirkungen Zusammenfassung des Sicherheitsprofils
Innerhalb von 3 Tagen nach Gabe von Zoledronsäure wird häufig über eine AkutePhase-Reaktion, mit Symptomen wie Knochenschmerzen, Fieber, Müdigkeit, Arthralgie, Myalgie und Rigor berichtet. Diese Symptome verschwinden
üblicherweise innerhalb einiger Tage (siehe Beschreibung ausgewählter Nebenwirkungen).
Nachfolgend sind die wichtigen identifizierten Risiken mit Zoledronsäure in den zugelassenen Anwendungsgebieten aufgeführt:
Nierenfunktionsstörung, Osteonekrose des Kieferknochens, Akute-Phase-Reaktion, Hypokalzämie, unerwünschte Ereignisse am Auge, Vorhofflimmern, Anaphylaxie. Die Häufigkeiten jedes dieser identifizierten Risiken sind in der Tabelle 1 aufgeführt.
Tabellarische Aufführung von Nebenwirkungen
Die folgenden in Tabelle 1 aufgeführten Nebenwirkungen sind in klinischen Studien und nach Markteinführung hauptsächlich bei chronischer Behandlung mit Zoledronsäure 4 mg aufgetreten.
Tabelle 1
Die Nebenwirkungen sind entsprechend ihrer Häufigkeit geordnet. Die häufigste Nebenwirkung wird zuerst genannt. Folgende Beschreibung wird verwendet:
Sehr häufig (>1/10), häufig (>1/100, <1/10), gelegentlich (>1/1.000, <1/100), selten (>1/10.000, <1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Erkrankungen des Blutes und des Lymphsystems | |
|
Häufig: Gelegentlich: Selten: |
Anämie Thrombozytopenie, Leukopenie Panzytopenie |
|
Erkrankungen des Immunsystems | |
|
Gelegentlich: Selten: |
Überempfindlichkeitsreaktionen Angioneurotisches Ödem |
|
Psychiatrische Erkrankungen | |
|
Gelegentlich: Selten: |
Unruhe, Schlafstörungen Verwirrung |
|
Erkrankungen des Nervensystems | |
|
Häufig: Gelegentlich: |
Kopfschmerzen Schwindel, Parästhesien, Geschmacksstörungen, Hypästhesie, Hyperästhesie, Tremor, Somnolenz |
|
Sehr selten: |
Krampfanfälle, Taubheitsgefühl und Tetanie (in Folge einer Hypokalzämie) |
|
Augenerkrankungen | |
|
Häufig: Gelegentlich: Sehr selten: |
Konjunktivitis Verschwommenes Sehen, Skleritis, Augenhöhlenentzündung Uveitis, Episkleritis |
|
Herzerkrankungen | |
|
Gelegentlich: |
Hypertonie, Hypotonie, Vorhofflimmern, Hypotonie, die zu Synkope oder Keislaufkollaps führt |
|
Selten: |
Bradykardie |
|
Sehr selten: |
Herzrhthmusstörungen (in Folge einer Hypokalzämie) |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
Gelegentlich: Selten: |
Dyspnoe, Husten, Bronchokonstriktion Interstitielle Lungenerkrankung |
|
Erkrankungen des Gastrointestinaltraktes | |
|
Häufig: Gelegentlich: |
Übelkeit, Erbrechen, Appetitlosigkeit Durchfall, Verstopfung, abdominale Schmerzen, Dyspepsie, Stomatitis, trockener Mund |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Gelegentlich: |
Pruritus, Ausschlag (einschließlich erythematöser und makulärer Ausschlag), verstärktes Schwitzen |
|
Skelettmuskulatur-, Bindegewebs-, und Knochenerkrankungen | |
|
Häufig: Gelegentlich: |
Knochenschmerzen, Myalgie, Arthralgie, generalisierte Schmerzen Muskelkrämpfe, Osteonekrose des Kieferknochens |
|
Erkrankungen der Nieren und Harnwege | |
|
Häufig: Gelegentlich: |
Nierenfunktionsstörungen Akutes Nierenversagen, Hämaturie, Proteinurie |
|
Allgemeine Erkrankungen |
und Beschwerden am Verabreichungsort |
|
Häufig: Gelegentlich: |
Fieber, grippeähnliche Symptome (einschließlich Müdigkeit, Frösteln, Krankheitsgefühl, Flush) Asthenie, periphere Ödeme, Reaktionen an der Infusionsstelle (einschließlich Schmerz, Irritationen, Schwellung, Induration), Thoraxschmerzen, Gewichtszunahme, anaphylaktische Reaktion/Schock, Urtikaria |
|
Selten: |
Arthritis und Gelenkschwellung als Symptom einer Akute-Phase-Reaktion |
|
Untersuchungen | |
|
Sehr häufig: Häufig: Gelegentlich: Selten: |
Hypophosphatämie Erhöhung des Serum-Kreatinins und -Harnstoffs, Hypokalzämie Hypomagnesiämie, Hypokaliämie Hyperkaliämie, Hypernatriämie |
Beschreibung ausgewählter Nebenwirkungen Nierenfunktionsstörung
Zoledronsäure wurde mit Berichten über Nierenfunktionsstörungen in Zusammenhang gebracht. In einer gemeinsamen Auswertung der Sicherheitsdaten aus den Zoledronsäure-Zulassungsstudien zur Prävention skelettbezogener Komplikationen bei Patienten mit fortgeschrittenen, auf das Skelett ausgedehnten Tumorerkrankungen war die Häufigkeit von Nierenfunktionsstörungen als unerwünschtes Ereignis mit einem Verdacht auf einen Zusammenhang mit Zoledronsäure (Nebenwirkung) wie folgt: Multiples Myelom (3,2%), Prostatakrebs (3,1%), Brustkrebs (4,3%), Lunge und andere solide Tumore (3,2%). Faktoren, die die Möglichkeit einer Verschlechterung der Nierenfunktion erhöhen, sind: Dehydratation, vorbestehende Nierenfunktionsstörung, die mehrfache Anwendung von Zoledronsäure oder von anderen Bisphosphonaten sowie die gleichzeitige Anwendung nephrotoxischer Arzneimittel oder eine kürzere Infusionszeit als derzeit empfohlen. Eine Verschlechterung der Nierenfunktion, ein Fortschreiten bis hin zum Nierenversagen und zur Dialyse wurde bei Patienten nach der einmaligen Gabe von 4 mg Zoledronsäure berichtet (siehe Abschnitt 4.4).
Osteonekrose des Kieferknochens
Über Osteonekrosen (vorwiegend im Kieferbereich) wurde in erster Linie bei Tumorpatienten berichtet, die mit Arzneimitteln, die die Knochenresorption hemmen wie Zoledronsäure, behandelt wurden. Viele dieser Patienten hatten Anzeichen einer lokalen Infektion einschließlich Osteomyelitis. Die Mehrzahl der Berichte bezieht sich auf Tumorpatienten nach Zahnextraktion oder anderen dentalen Eingriffen. Es gibt zahlreiche dokumentierte Risikofaktoren für Osteonekrosen der Kieferknochen einschließlich einer Tumordiagnose, verschiedene Begleittherapien (z.B. Chemo-oder Radiotherapie, Behandlung mit Kortikosteroiden) sowie gleichzeitig bestehender Erkrankungen (z.B. Anämien, Koagulopathien, Infektionen, vorbestehende Erkrankungen im Mundbereich). Obwohl keine Kausalität festgestellt wurde, wird empfohlen bei Patienten, die mit Zoledronsäure behandelt werden, vorsichtshalber dentale Eingriffe zu vermeiden, da es zu einer verzögerten Genesung kommen kann (siehe Abschnitt 4.4).
Vorhofflimmern
In einer randomisierten, doppelblind-kontrollierten Studie über 3 Jahre zur Bewertung der Sicherheit und Wirksamkeit von Zoledronsäure 5 mg einmal jährlich vs. Placebo zur Behandlung von postmenopausaler Osteoporose (PMO) betrug der Gesamthäufigkeit an Vorhofflimmern 2,5% (96 von 3.862) bzw. 1,9% (75 von 3.852) bei Patienten, die 5 mg Zoledronsäure bzw. Placebo erhielten. Die Häufigkeit von als schwerwiegende Ereignisse gemeldeten Fällen von Vorhofflimmern war bei Patienten, die Zoledronsäure 5 mg erhielten, 1,3% (51 von 3.862) im Vergleich zu 0,6% bei Patienten, die Placebo erhielten (22 von 3.852).
Die in dieser Studie beobachtete Unausgewogenheit wurde in anderen Studien mit Zoledronsäure nicht beobachtet, einschließlich solcher Studien, die mit Zoledronsäure 4 mg alle 3-4 Wochen bei onkologischen Patienten durchgeführt wurden. Der Mechanismus hinter der vermehrten Häufigkeit an Vorhofflimmern in dieser einzelnen Studie ist unbekannt.
Akute-Phase-Reaktion
Diese Nebenwirkung beinhaltet eine Reihe von Symptomen wie Fieber, Myalgie, Kopfschmerzen, Schmerzen in den Extremitäten, Übelkeit, Erbrechen, Diarrhö, Arthralgie und Arthritis mit darauf folgenden Gelenkschwellungen. Diese treten innerhalb von 3 Tagen nach der Infusion von Zoledronsäure auf. Die Reaktion wird auch als „grippeähnlich“ oder als „Postinfusions-Symptom“ beschrieben.
Atypische Femurfrakturen
Über die folgenden Reaktionen wurde nach der Markteinführung berichtet (Häufigkeit:selten): atypische subtrochantäre und diaphysäre Femurfrakturen (unerwünschte Wirkung der Substanzklasse Bisphosphonate).
Unerwünschte Arzneimittelwirkungen in Zusammenhang mit einer Hypokalzämie Hypokalzämie ist ein wichtiges identifiziertes Risiko der Anwendung von Zoledronsäure in den zugelassenen Indikationen. Die Auswertung von Fällen aus klinischen Studien und Berichten nach der Marktzulassung liefert ausreichend Hinweise, um einen Zusammenhang zwischen der Behandlung mit Zoledronsäure, dem Auftreten einer Hypokalzämie und der Entwicklung von Herzrhythmusstörungen in der Folge zu belegen. Darüber hinaus gibt es Belege für den Zusammenhang zwischen Hypokalzämie und in diesen Fällen berichteten sekundären neurologischen Ereignissen einschließlich Krampfanfällen, Taubheitsgefühl und Tetanie (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des NutzenRisiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Klinische Erfahrungen über akute Überdosierungen mit Zoledronsäure sind begrenzt. Die versehentliche Anwendung von Dosen bis zu 48 mg Zoledronsäure wurde berichtet. Patienten, die eine höhere als die empfohlene Dosierung (siehe Abschnitt 4.2) erhalten haben, müssen sorgfältig überwacht werden, da eine eingeschränkte Nierenfunktion (einschließlich Nierenversagen) und Veränderungen der Elektrolyte im Serum (einschließlich Kalzium, Phosphor und Magnesium) beobachtet wurden. Im Fall einer Hypokalziämie müssen Kalziumgluconat-Infusionen wie klinisch angezeigt verabreicht werden.
5. Pharmakologische Eigenschaften 5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mittel zur Behandlung von Knochenerkrankungen, Bisphosphonate, ATC-Code: M05BA08
Zoledronsäure gehört zur Gruppe der Bisphosphonate und wirkt primär am Knochen. Sie ist ein Inhibitor der Knochenresorption.
Die selektive Wirkung von Bisphosphonaten auf das Knochengewebe ist durch ihre hohe Affinität zum Knochenmineral bedingt. Der genaue molekulare Wirkmechanismus, der zur Hemmung der Osteoklastenaktivität führt, ist bisher jedoch nicht bekannt. In Langzeituntersuchungen am Tier hemmte Zoledronsäure die Knochenresorption, ohne die Neubildung, die Mineralisation oder die mechanischen Eigenschaften des Knochens nachteilig zu beeinflussen.
Zusätzlich zu ihrer Eigenschaft als potenter Inhibitor der Knochenresorption besitzt Zoledronsäure verschiedene Anti-Tumor-Eigenschaften, die zur Gesamtwirkung der Substanz bei der Behandlung von metastatischen Knochenveränderungen beitragen könnten. Die folgenden Eigenschaften wurden in präklinischen Studien nachgewiesen:
- In vivo: Hemmung der durch Osteoklasten verursachten Knochenresorption,
wodurch das Mikro-Milieu des Knochenmarks verändert und dadurch weniger anfällig für das Wachstum von Tumorzellen wird. Außerdem: Anti-Angiogenese-Aktivität und analgetischer Effekt.
- In vitro: Hemmung der Osteoblastenproliferation; direkte zytostatische und
proapopatotische Aktivität auf Tumorzellen; synergistischer zytostatischer Effekt mit anderen anti-tumorösen Arzneimitteln und Anti-Adhäsions/In-vasions-Wirkung.
Ergebnisse klinischer Studien bei der Prävention skelettbezogener Komplikationen bei Patienten mit fortgeschrittenen, auf das Skelett ausgedehnten Tumorerkrankungen
In der ersten randomisierten, doppelblinden, plazebokontrollierten Studie wurden Zoledronsäure 4 mg und Plazebo zur Prävention von Skelettkomplikationen („Skeletal Related Events" = SREs) bei Patienten mit Prostatakarzinom verglichen. Zoledronsäure 4 mg reduzierte signifikant den Anteil der Patienten, die mindestens eine SRE erlitten, verzögerte die Zeit (median) bis zum Auftreten der ersten SRE um mehr als 5 Monate und verringerte die skelettale Morbiditätsrate (Anzahl der SREs pro Patient und Jahr). Eine Multiple Event-Analyse zeigte in der
Zoledronsäure 4 mg-Gruppe eine 36%ige Risikoreduktion für das Auftreten von SREs im Vergleich zu Placebo. Unter Zoledronsäure 4 mg berichteten die Patienten über eine geringere Schmerzzunahme als unter Placebo. Dieser Unterschied war nach 3, 9, 21 und 24 Monaten signifikant. Weniger Zoledronsäure 4 mg-Patienten erlitten pathologische Frakturen. Die Behandlungseffekte waren bei Patienten mit blastischen Läsionen weniger ausgeprägt. Die Ergebnisse zur Wirksamkeit sind in Tabelle 2 zusammengefasst.
In einer zweiten Studie zu anderen soliden Tumoren als Mamma- oder Prostatakarzinomen reduzierte Zoledronsäure 4 mg signifikant den Anteil der Patienten mit einer SRE, verlängerte im Median die Zeit bis zum ersten Auftreten einer SRE um mehr als 2 Monate und verringerte die skelettale Morbiditätsrate. Eine Multiple-Event-Analyse zeigte in der Zoledronsäure 4 mg-Gruppe eine 30,7%ige Risikoreduktion für SREs im Vergleich zu Plazebo. Die Ergebnisse zur Wirksamkeit sind in Tabelle 3 zusammengefasst.
Tabelle 2: Ergebnisse zur Wirksamkeit (Patienten mit Prostatakarzinom unter hormoneller Therapie)_
|
SRE (+TIH) |
Frakturen* |
Radiother Knoc |
apie am hen | |||
|
Zoledronsäure 4 mg |
Plazebo |
Zoledronsäure 4 mg |
Plazebo |
Zoledronsäure 4 mg |
Plazebo | |
|
Anzahl (N) |
214 |
208 |
214 |
208 |
214 |
208 |
|
Anteil Patienten mit SREs (%) |
38 |
49 |
17 |
25 |
26 |
33 |
|
p-Wert |
0,028 |
0,052 |
0,119 | |||
|
Zeit bis zum Auftreten der ersten SRE in Tagen (median) |
488 |
321 |
NE |
NE |
NE |
640 |
|
p-Wert |
0,009 |
0,020 |
0,055 | |||
|
Skelettale Morbiditätsrate |
0,77 |
1,47 |
0,20 |
0,45 |
0,42 |
0,89 |
|
p-Wert |
0,005 |
0,023 |
0,060 | |||
|
Risikoreduktion gemäß Multiple-Event-Analyse** (%) |
36 |
NZ |
NZ |
NZ |
NZ | |
|
p-Wert |
0,002 |
NZ |
NZ | |||
* vertebrale und nicht-vertebrale Frakturen
** alle skelettalen Ereignisse, sowohl gesamte Anzahl als auch Zeit bis
zum Erreichen jedes Ereignisses während der Studie NE nicht erreicht
NZ nicht zutreffend
Tabelle 3: Ergebnisse zur Wirksamkeit (solide Tumoren außer Mammakarzinom und Prostatakarzinom)
|
SRE (+TIH) |
Frakturen* |
Radiotherapie am Knochen | ||||
|
Zoledron- |
Plazebo |
Zoledron- |
Plaze- |
Zoledron- |
Plazbo | |
zum Erreichen jedes Ereignisses während der Studie NE nicht erreicht
|
säure 4 mg |
säure 4 mg |
bo |
säure 4 mg | |||
|
Anzahl (N) |
257 |
250 |
257 |
250 |
257 |
250 |
|
Anteil Patienten mit SREs (%) |
39 |
48 |
16 |
22 |
29 |
34 |
|
p-Wert |
0,039 |
0,064 |
0,173 | |||
|
Zeit bis zum Auftreten der ersten SRE in Tagen (median) |
236 |
155 |
NE |
NE |
424 |
307 |
|
p-Wert |
0,009 |
0,020 |
0,079 | |||
|
Skelettale Morbiditätsrate |
1,74 |
2,71 |
0,39 |
0,63 |
1,24 |
1,89 |
|
p-Wert |
0.012 |
0.066 |
0.099 | |||
|
Risikoreduktion gemäß Multiple-Event-Analyse** (%) |
30,7 |
NZ |
NZ |
NZ |
NZ | |
|
p-Wert |
0,003 |
NZ |
NZ | |||
* vertebrale und nicht-vertebrale Frakturen
** alle skelettalen Ereignisse, sowohl gesamte Anzahl als auch Zeit bis
NZ nicht zutreffend
In einer dritten doppelblinden, randomisierten Phase III-Studie wurde die Anwendung von Zoledronsäure 4 mg oder 90 mg Pamidronsäure jeweils alle 3 bis 4 Wochen bei Patienten mit multiplem Myelom oder Mammakarzinom und mindestens einer Knochenläsion verglichen. Die Ergebnisse zeigen, dass Zoledronsäure 4 mg in der Prävention skelettbezogener Ereignisse eine vergleichbare Wirksamkeit aufweist wie 90 mg Pamidronsäure. Die Multiple-Event-Analyse zeigte in der Zoledronsäure 4 mg-Gruppe eine signifikante 16%ige Risikoreduktion im Vergleich zu Patienten, die Pamidronsäure erhalten hatten. Die Ergebnisse zur Wirksamkeit sind in Tabelle 4 zusammengefasst.
Tabelle 4: Ergebisse zur Wirksamkeit (Patienten mit Mammakarzinom oder multiplem Myelom)
|
SRE (+TIH) |
Frakturen* |
Radiotherapie am Knochen | ||||
|
Zoledronsäure 4 mg |
Pam 90 mg |
Zoledronsäure 4 mg |
Pam 90 mg |
Zoledronsäure 4 mg |
Pam 90 mg | |
|
Anzahl (N) |
561 |
555 |
561 |
555 |
561 |
555 |
|
Anteil Patienten mit SREs (%) |
48 |
52 |
37 |
39 |
19 |
24 |
|
p-Wert |
0,198 |
0,653 |
0,037 | |||
|
Zeit bis zum Auftreten der ersten SRE in Tagen (median) |
376 |
356 |
NE |
714 |
NE |
NE |
|
p-Wert |
0,151 |
0,672 |
0,026 | |||
|
Skelettale Morbiditätsrate |
1,04 |
1,39 |
0,53 |
0,60 |
0,47 |
0,71 |
zum Erreichen jedes Ereignisses während der Studie NE nicht erreicht
|
p-Wert |
0.084 |
0.614 |
0.015 | |||
|
Risikoreduktion gemäß Multiple-Event-Analyse** (%) |
16 |
NZ |
NZ |
NZ |
NZ | |
|
p-Wert |
0,03 |
NZ |
NZ | |||
* vertebrale und nicht-vertebrale Frakturen
** alle skelettalen Ereignisse, sowohl gesamte Anzahl als auch Zeit bis
NZ nicht zutreffend
Zoledronsäure 4 mg wurde auch in einer doppelblinden, randomisierten, plazebokontrollierten Studie an 228 Patienten mit dokumentierten Knochenmetastasen nach Mammaturmor untersucht, um die Wirkung von 4 mg Zoledronsäure auf die Skelettkomplikationen (SRE) zu bewerten, berechnet als Gesamtzahl der SRE-Ereignisse (mit Ausnahme von Hyperkalzämie und an vorhergehende Frakturen angepasst), geteilt durch den gesamten Risikozeitraum. Die Patienten erhielten für ein Jahr alle 4 Wochen entweder 4 mg Zoledronsäure oder Placebo. Die Patienten wurden gleichmässig zwischen den Zoledronsäure-behandelten und Plazebogruppen aufgeteilt.
Die SRE-Rate (Ereignisse/Personenjahre) beträgt für Zoledronsäure 0,628 und für Plazebo 1,096. Das Verhältnis von Patienten mit zumindest 1 SRE (mit Ausnahme von Hyperkalzämie) betrug 29,8% in der mit Zoledronsäure behandelten Gruppe versus 49,6% in der Plazebo-Gruppe (p=0,003). In dem mit Zoledronsäure behandelten Arm wurde am Ende der Studie die mediane Zeit bis zum Auftreten des ersten SRE nicht erreicht und war im Vergleich zu Plazebo signifikant verzögert (p=0,007). In einer Analyse von Mehrfachereignissen verringerte Zoledronsäure 4 mg das Risiko für SRE’s um 41% (Risiko-Verhältnis 0,59, p=0,019) im Vergleich zu Placebo.
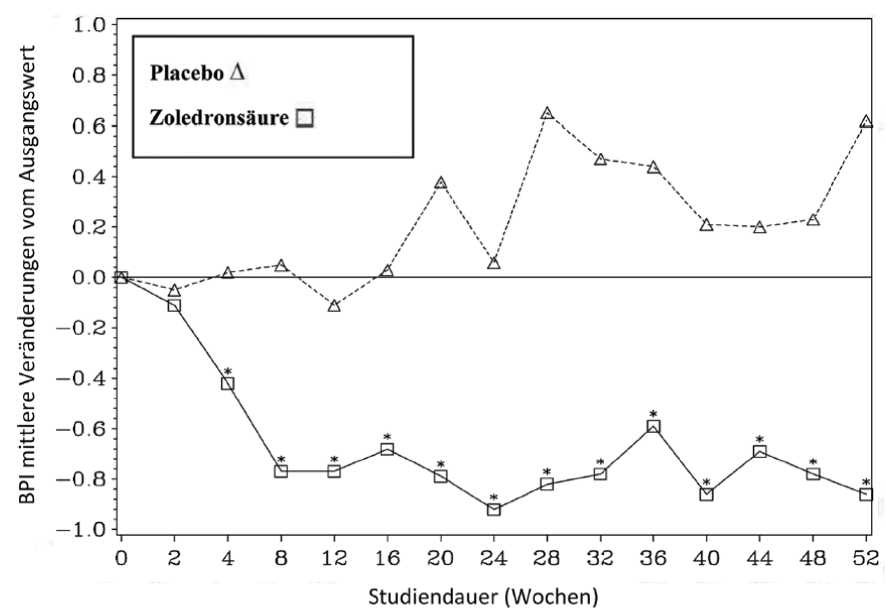
In der mit Zoledronsäure behandelten Gruppe wurde eine statistisch signifikante Verbesserung des Schmerz-Scores (unter Verwendung des Brief Pain Inventory, BPI) nach 4 Wochen gesehen und zu jedem nachfolgenden Zeitpunkt während der Studie, wenn mit Plazebo verglichen wurde (Abbildung 1). Für Zoledronsäure lag der Schmerz-Score durchweg unterhalb des Ausgangswertes und die Schmerzverminderung wurde tendenziell von einer Reduktion des SchmerzmittelScores begleitet.
Abbildung 1: Mittlere Veränderungen der BPI-Scores vom Ausgangswert. Statistisch signifikante Unterschiede sind gekennzeichnet (*p<0.05) für den Vergleich der Behandlung (4 mg Zoledronsäure versus Plazebo)
Ergebnisse klinischer Studien in der Behandlung der TIH Klinische Studien bei tumorinduzierter Hyperkalzämie (TIH) zeigten, dass die Wirkung der Zoledronsäure durch eine Abnahme des Serum-Kalziums und der Kalzium-Ausscheidung im Urin gekennzeichnet ist. In Phase-I-Dosisfindungs-studien an Patienten mit leichter bis mittelschwerer tumorinduzierter Hyperkalzämie (TIH) lagen die untersuchten wirksamen Dosierungen im Bereich von ca. 1,2-2,5 mg.
Zum Nachweis der Wirksamkeit von 4 mg Zoledronsäure im Vergleich zu 90 mg Pamidronsäure wurden die Ergebnisse von zwei pivotalen, multizentrischen Studien an Patienten mit TIH in einer vorher geplanten Analyse kombiniert. Es erfolgte eine schnellere Normalisierung des korrigierten Serum-Kalziums am Tag 4 mit 8 mg Zoledronsäure und am Tag 7 mit 4 mg und 8 mg Zoledronsäure. Die folgenden Ansprechraten wurden beobachtet:
Tabelle 5: Komplette Ansprechraten pro Tag in den kombinierten TIH-Studien
|
Tag 4 |
Tag 7 |
Tag 10 | |
|
Zoledronsäure 4 mg (N=86) |
45,3% (p=0.104) |
82,6% (p=0.005)* |
88,4% (p=0.002)* |
|
Zoledronsäure 8 mg (N=90) |
55,6% (p=0.021)* |
83,3% (p=0.010)* |
86,7% (p=0.015)* |
|
Pamidronsäure 90 mg (N=99) |
33,3% |
63,6% |
69,7% |
|
*p-Werte im Vergleich zu Pamidronat | |||
Im Median betrug die Zeit bis zum Erreichen normokalzämischer Werte 4 Tage. Die mediane Dauer bis zum Rezidiv (Wiederanstieg der Albumin-korrogierten SerumKalzium-Spiegel auf > 2,9 mmol/l) betrug 30-40 Tage bei Patienten, die mit Zoledronsäure behandelt wurden, gegenüber 17 Tagen bei denjenigen, die mit 90 mg Pamidronsäure behandelt wurden (p-Werte: 0,001 für 4 mg und 0,007 für 8 mg Zoledronsäure). Zwischen beiden Zoledronsäure-Dosierungen gab es keine statistisch signifikanten Unterschiede.
In klinischen Studien erhielten 69 Patienten, die gegenüber der ersten Behandlung (4 mg oder 8 mg Zoledronsäure oder 90 mg Pamidronat) refraktär waren, eine Wiederbehandlung mit 8 mg Zoledronsäure. Die Ansprechrate betrug bei diesen Patienten ca. 52%. Da diese Patienten ausschließlich mit der 8 mg-Dosis wiederbehandelt wurden, sind keine Daten verfügbar, die einen Vergleich mit der 4 mg-Zoledronsäure-Dosis erlauben würden.
In klinischen Studien an Patienten mit tumorinduzierter Hyperkalzämie (TIH) war das gesamte Sicherheitsprofil zwischen allen drei Behandlungsgruppen (4 mg und 8 mg Zoledronsäure und 90 mg Pamidronsäure) hinsichtlich Art und Schweregrad vergleichbar.
Kinder und Jugendliche
Ergebnisse der klinischen Studien zur Behandlung der schweren Osteogenesis imperfecta bei Kindern und Jugendlichen im Alter von 1 bis 17 Jahren Die Wirkung von intravenöser Zoledronsäure zur Behandlung von Kindern und Jugendlichen (Alter 1 bis 17 Jahre) mit schwerer Osteogenesis imperfecta (Typ I, III und IV) wurde im Vergleich zu intravenösem Pamidronat in einer internationalen, multizentrischen, randomisierten, offenen Studie mit 74 bzw. 76 Patienten in der jeweiligen Behandlungsgruppe untersucht. Der Behandlungszeitraum in der Studie betrug 12 Monate. Diesem ging eine 4- bis 9-wöchige Screening-Phase voraus, während der über mindestens 2 Wochen Vitamin D und Kalzium eingenommen wurden. In klinischen Studien erhielten Patienten im Alter von 1 bis < 3 Jahren 0,025 mg/kg Zoledronsäure (bis zu einer maximalen Einzeldosis von 0,35 mg) alle 3 Monate. Patienten im Alter von 3 bis 17 Jahren wurden 0,05 mg/kg Zoledronsäure (bis zu einer maximalen Einzeldosis von 0,83 mg) alle 3 Monate verabreicht. Es wurde eine Extensionsstudie durchgeführt, um die allgemeine und renale Langzeitsicherheit einer einmal bzw. zweimal jährlichen Gabe von Zoledronsäure während der 12-monatigen Extension bei Kindern, die die Behandlung in der 1-Jahres-Hauptstudie mit Zoledronsäure oder Pamidronat abgeschlossen hatten, zu untersuchen.
Der primäre Endpunkt der Studie war die prozentuale Änderung der Knochendichte (BMD) der Lendenwirbelsäule nach 12 Monaten der Behandlung. Die geschätzte Wirkung auf die BMD war ähnlich, aber das Studiendesign war nicht ausreichend robust, um eine „Nicht-Unterlegenheit" der Wirksamkeit von Zoledronsäure nachzuweisen. Vor allem gab es keine eindeutigen Beweise einer Wirksamkeit auf die Frakturhäufigkeit und bei Schmerzen. An den langen Knochen der unteren Extremitäten wurden Frakturen als unerwünschte Ereignisse bei ca. 24% (Femur) und 14% (Tibia) der mit Zoledronsäure und bei 12% bzw. 5% der mit Pamidronat behandelten Patienten mit schwerer Osteogenesis imperfecta, unabhängig von der Grunderkrankung, oder eines Kausalzusammenhangs, beobachtet. Die Gesamthäufigkeit für Frakturen war bei Zoledronsäure- bzw. bei Pamidronat-Patienten gleich, nämlich 43% (32/74) bzw. 41% (31/76). Die Interpretation des Frakturrisikos wird durch die Tatsache erschwert, dass Frakturen aufgrund des Fortschreitens der Grunderkrankung häufige Ereignisse bei Patienten mit schwerer Osteogenesis imperfecta sind.
Die Art der Nebenwirkungen, die in dieser Population beobachtet wurden, waren ähnlich wie bei Erwachsenen mit fortgeschrittenen Tumorerkrankungen unter Beteiligung der Knochen (siehe Abschnitt 4.8). Die Nebenwirkungen sind in Tabelle 6 nach ihrer Häufigkeit geordnet aufgeführt. Folgende Beschreibung wird verwendet: sehr häufig (>1/10), häufig (>1/100, <1/10), gelegentlich (>1/1.000, <1/100), selten (>1/10.000, <1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der vorhandenen Daten nicht abschätzbar).
Tabelle 6: Nebenwirkungen bei Kindern und Jugendlichen mit schwerer Osteogenesis imperfecta1
|
Erkrankungen des Nervensystems Häufig: |
Kopfschmerzen |
|
Herzerkrankungen Häufig: |
Tachykardie |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums Häufig: |
Nasopharyngitis |
|
Erkrankungen des Gastrointestinaltraktes Sehr häufig: |
Übelkeit, Erbrechen |
|
Häufig: |
Abdominale Schmerzen |
|
Skelettmuskulatur-, Bindegewebs-, und Knochenerkrankungen Häufig: |
Schmerzen in den Extremitäten, Arthralgie, muskuloskelettale Schmerzen |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Sehr häufig: Häufig: |
Fieber, Müdigkeit Akute-Phase-Reaktion, Schmerzen |
|
Untersuchungen Sehr häufig: Häufig: |
Hypokalzämie Hypophosphatämie |
Unerwünschte Ereignisse mit einer Häufigkeit <5% wurden medizinisch bewertet und es wurde gezeigt, dass diese Fälle mit dem gut bekannten Sicherheitsprofil von Zoledronsäure übereinstimmen (siehe Abschnitt 4.8).
Bei Kindern und Jugendlichen mit schwerer Osteogenesis imperfecta scheint Zoledronsäure im Vergleich zu Pamidronat mit einem höheren Risiko für AkutePhase-Reaktionen, Hypokalzämie und ungeklärte Tachykardien verbunden zu sein. Dieser Unterschied verringert sich nach den weiteren Infusionen.
Die Europäische Arzneimittel-Agentur hat für Zoledronsäure eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen für die Behandlung der tumorinduzierten Hyperkalzämie und zur Prävention skelettbezogener Komplikationen bei Patienten mit fortgeschrittenen, auf das Skelett ausgedehnten, Tumorerkrankungen gewährt (siehe Abschnitt 4.2 bezüglich Informationen zur Anwendung bei Kindern und Jugendlichen ).
5.2 Pharmakokinetische Eigenschaften
Eine einmalige oder mehrfache 5- bis 15-minütige Infusion von 2,4,8 und 16 mg Zoledronsäure bei 64 Patienten mit Knochenmetastasen ergab die folgenden dosisunabhängigen pharmakokinetischen Daten:
Nach Start der Zoledronsäure-Infusion erhöht sich die Plasmakonzentration von Zoledronsäure schnell, wobei die Plasmaspitzenkonzentration am Ende der Infusionszeit erreicht wird. Es folgt ein schneller Rückgang auf <10% der Plasmaspitzenkonzentration nach 4 Stunden und auf <1% nach 24 Stunden, gefolgt von einem längeren Zeitraum mit sehr niedrigen Konzentrationen, die nicht über 0,1% der Plasmaspitzenkonzentration hinausgehen, bevor am Tag 28 die zweite Infusion von Zoledronsäure erfolgt.
Die Ausscheidung von intravenöse verabreichter Zoledronsäure verläuft triphasisch: eine schnelle biphasische Elimination aus der systemischen Zirkulation mit Halbwertszeiten von t1/2a0,24 und t1/2p1,87 Stunden, gefolgt von einer langandauernden Eliminationsphase mit einer terminalen Eliminationshalbwertszeit von t1/2y 146 Stunden. Auch nach Mehrfachgabe (alle 28 Tage) kommt es nicht zur Akkumulation von Zoledronsäure im Plasma. Zoledronsäure wird nicht metabolisiert, sondern unverändert über die Nieren ausgeschieden. Innerhalb der ersten 24 Stunden werden 39 + 16% der verabreichten Dosis im Urin wiedergefunden, während die Restmenge prinzipiell am Knochengewebe gebunden ist. Aus dem Knochengewebe wird Zoledronsäure sehr langsam zurück in den systemischen Kreislauf abgegeben und über die Nieren ausgeschieden. Die Gesamtkörper-Clearance beträgt unabhängig von der Dosierung 5,04 + 2,5 l/h und wird durch Geschlecht, Alter, Rasse und Körpergewicht nicht beeinflusst. Eine Erhöhung der Infusionszeit von 5 auf 15 Minuten führte am Ende der Infusion zu einer Abnahme der Zoledronsäure-Konzentration um 30%, hatte aber keinen Einfluss auf das AUC-Zeit-Diagramm.
Wie bei anderen Bisphosphonaten ist die Variabilität der pharmakokinetischen Parameter von Zoledronsäure zwischen den Patienten hoch.
Pharmakokinetische Daten zu Zoledronsäure bei Patienten mit Hyperkalzämie sowie bei Patienten mit Leberinsuffizienz liegen nicht vor. Zoledronsäure hemmt in vitro keine humanen P450-Enzyme und wird nicht metabolisiert. In Tierstudien wurden <3% der verabreichten Dosis in den Fäzes wiedergefunden. Dies deutet darauf hin, dass die Leberfunktion keine relevante Rolle für die Pharmakokinetik von Zoledronsäure spielt.
Die renale Clearance von Zoledronsäure korreliert mit der Kreatinin-Clearance. Die renale Clearance entspricht 75 + 33% der Kreatinin-Clearance, die bei den 64 untersuchten Tumorpatienten im Mittel bei 84 + 29 ml/min (von 22 bis 143 ml/min) lag. Eine Populationsanalyse zeigte für Patienten mit einer Kreatinin-Clearance von 20 ml/min (schwere Niereninsuffizinenz) bzw. 50 ml/min (mittelschwere Niereninsuffizienz), dass die voraussagbare Clearance von Zoledronsäure 37% bzw. 72% derjenigen eines Patienten mit einer Kreatinin-Clearance von 84 ml/min betragen würde. Für Patienten mit schweren Nierenfunktionsstörungen (Kreatinin-Clearance < 30 ml/min) liegen nur wenige pharmakokinetische Daten vor.
Zoledronsäure zeigt keine Affinität zu Blutzellen. Die Plasmaproteinbindung ist gering (ca. 56%) und unabhängig von der Zoledronsäure-Konzentration.
Spezielle Patientengruppen Pädiatrische Patienten
Begrenzte phamakokinetische Daten bei Kindern und Jugendlichen mit schwerer Osteogenesis imperfecta legen nahe, dass die Pharmakokinetik von Zoledronsäure bei Kindern und Jugendlichen im Alter von 3 bis 17 Jahren bei ähnlicher mg/kg-Dosis vergleichbar mit derjenigen von Erwachsenen ist. Alter, Körpergewicht, Geschlecht und Kreatinin-Clearance haben offensichtlich keinen Effekt auf die systemische Exposition von Zoledronsäure.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die höchste nicht letal wirkende intravenöse Einzeldosis betrug bei Mäusen 10 mg/kg Körpergewicht und bei Ratten 0,6 mg/kg Körpergewicht.
Subchronische und chronische Toxizität
Bis zu einer täglichen Dosis von 0,02 mg/kg Körpergewicht über 4 Wochen wurde Zoledronsäure bei subkutaner Gabe von Ratten und bei intravenöser Gabe von Hunden gut vertragen. Die subkutane Gabe von 0,001 mg/kg/Tag an Ratten und die intravenöse Gabe von 0,005 mg/kg einmal alle 2-3 Tage an Hunden über einen Zeitraum von bis zu 52 Wochen wurde ebenfalls gut vertragen.
In den Studien mit wiederholter Gabe war bei nahezu allen Dosierungen der häufigste Befund eine Zunahme der primären Spongiosa in der Metaphyse langer Knochen bei wachsenden Tieren. Dieser Befund spiegelt die pharmakologische, antiresorptive Wirkung der Substanz wieder.
In den Langzeitstudien mit wiederholter parenteraler Gabe am Tier zeigte sich, dass der Sicherheitsabstand hinsichtlich der renalen Effekte klein ist. Die kumulativen NOAELs („no observed adverse effect levels") in den Studien mit Einzelgabe (1,6 mg/kg) und Mehrfachgabe bis zu einem Monat (0,06 -0,6 mg/kg/Tag) ergaben jedoch keine Hinweise auf renale Effekte bei Dosierungen, die der höchsten vorgesehenen therapeutischen Humandosis entsprachen oder diese übertrafen. Wiederholte Gaben über einen längeren Zeitraum bei Dosierungen rund um die höchste vorgesehene therapeutische Humandosis von Zoledronsäure führten zu toxikologischen Wirkungen in anderen Organen, einschließlich Gastrointestinaltrakt, Leber, Milz, Lunge und an der intravenösen Injektionsstelle.
Reproduktionstoxikologie
Zoledronsäure war teratogen bei der Ratte bei subkutanen Dosen von >0,2 mg/kg. Obwohl beim Kaninchen keine Teratogenität oder Fetotoxizität beobachtet wurden, wurde maternale Toxizität gefunden. Bei Ratten wurde bei der niedrigsten untersuchten Dosis (0,01 mg/kg Körpergewicht) erschwerte Geburt (Dystokie) beobachtet.
Mutagenität und Kanzerogenität
In den durchgeführten Mutagenitätstests erwies sich Zoledronsäure als nicht mutagen. Studien zur Kanzerogenität lieferten keine Hinweise auf ein kanzerogenes Potential.
6. Pharmazeutische Angaben 6.1 Liste der sonstigen Bestandteile
Mannitol (Ph.Eur)
Natriumcitrat (Ph.Eur)
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Dieses Arzneimittel darf nur mit den in Abschnitt 6.6. aufgeführten anderen Arzneimitteln gemischt werden.
Dieses Arzneimittel darf nicht mit kalziumhaltigen Lösungen oder anderen Infusionslösungen mit bivalenten Kationen wie Ringer-Laktat-Lösung gemischt werden und sollte als gesonderte intravenöse Lösung in einer getrennten Infusionslinie verabreicht werden.
6.3 Dauer der Haltbarkeit 2 Jahre.
Nach der Verdünnung:
Die chemisch-physikalische Stabilität der gebrauchsfertigen Infusionslösung wurde nach Verdünnung mit 100 ml isotonischer Natriumchloridlösung oder mit einer 5% w/v Glucoselösung für 24 Stunden bei 2-8°C nachgewiesen.
Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden.
Falls es nicht sofort verwendet wird, ist der Anwender für die Dauer und Bedingungen der Aufbewahrung verantwortlich, die normalerweise 24 Stunden bei 2°-8°C nicht überschreiten sollte. Vor der Anwendung ist die gekühlte Lösung dann wieder auf Raumtemperatur zu bringen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Zoledronsäure SUN 4 mg/5 ml Konzentrat zur Herstellung einer Infusionslösung ist in eine farblose Glasdurchstechflasche mit einem grauen Bromobutyl-Kautschukstopfen und Aluminiumbördelkappe mit einem hellblauen Schnappdeckel verpackt.
Die Durchstechflaschen sind in Packungen mit 1,4 oder 10 Durchstechflaschen verpackt.
Eine Durchstechflasche enthält 5 ml Konzentrat.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Vor der Anwendung müssen 5 ml Konzentrat aus einer Durchstechflasche oder die erforderliche entnommene Menge an Konzentrat mit 100 ml einer 0,9%igen Natriumchlorid-Lösung oder 5%igen Glucose-Lösung weiter verdünnt werden.
Falls sie im Kühlschrank aufbewahrt wurde, ist die Lösung vor der Anwendung wieder auf Raumtemperatur zu bringen.
Weitere Informationen zur Handhabung von Zoledronsäure, einschließlich einer Anweisung zur Herstellung verringerter Dosierungen, werden in Abschnitt 4.2 beschrieben.
Die Infusion ist unter aseptischen Bedingungen herzustellen. Nur zur einmaligen Anwendung.
Es dürfen nur klare Lösungen ohne Partikel und Verfärbungen verwendet werden.
Das medizinische Fachpersonal ist anzuweisen, nicht verwendete Zoledronsäure nicht über das lokale Abwassersystem zu entsorgen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Studien mit Glasflaschen, sowie verschiedenen Arten von Infusionsbeuteln und Infusionslinien aus Polyvinylchlorid, Polyethylen und Polypropylen (zuvor befüllt mit 0,9%iger Natriumchloridlösung oder 5%iger Glucoselösung) lieferten keine Hinweise auf Inkompatibilitäten mit Zoledronsäure.
7. Inhaber der Zulassung
Sun Pharmaceuticals Germany GmbH Kandelstr. 7 79199 Kirchzarten Deutschland
8. Zulassungsnummer 85170.00.00
9. Datum der Erteilung der Zulassung 11.Januar 2013
10. Stand der Information Dezember 2014
11. Verkaufsabgrenzung Verschreibungspflichtig
Die Dosierungen wurden berechnet unter Annahme einer Ziel-AUC von 0,66 (mgh/l) (CrCl=75 ml/min). Die verminderten Dosen für Patienten mit Nierenfunktionsstörungen lassen erwarten, dass die gleiche AUC erreicht wird, wie sie bei Patienten mit einer Kreatinin-Clearance von 75 ml/min beobachtet wird.