Berinin P 600
CSL Behring
Berinin® P 600
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Berinin® P 600
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung. Konzentrat des Blutgerinnungsfaktors IX vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
dieses Arzneimittels beginnen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese dieselben Symptome haben wie Sie.
• Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
Diese Packungsbeilage beinhaltet:
1. Was ist Berinin P 600 und wofür wird es angewendet?
2. Was müssen Sie vor der Anwendung von Berinin P 600 beachten?
3. Wie ist Berinin P 600 anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Berinin P 600 aufzubewahren?
6. Weitere Informationen
1. WAS IST BERININ P 600 UND WOFÜR WIRD ES ANGEWENDET?
Was ist Berinin P 600?
Berinin P 600 liegt als Pulver und Lösungsmittel vor. Die fertige Lösung wird als Injektion oder Infusion in eine Vene verabreicht.
Berinin P 600 wird aus menschlichem Blutplasma (dem flüssigen Teil des Blutes) gewonnen und enthält den Blutgerinnungsfaktor IX vom Menschen.
Wofür wird Berinin P 600 angewendet?
Berinin P 600 wird angewendet zur Therapie und Prophylaxe von Blutungen bei Patienten mit Hämophilie B (kongenitaler Faktor-IX-Mangel).
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON BERININ P 600 BEACHTEN?
Berinin P 600 darf NICHT angewendet werden,
• bei bekannter Überempfindlichkeit gegen jegliche Bestandteile des Präparates.
Besondere Vorsicht bei der Anwendung von Berinin P 600 ist erforderlich,
• bei Überempfindlichkeitsreaktionen. Wie bei jedem intravenös verabreichten Proteinpräparat sind allergieartige Überempfindlichkeitsreaktionen möglich.
Die Patienten sollen über Frühzeichen von Überempfindlichkeitsreaktionen informiert werden, wie quaddelartiger Hautausschlag, generalisierte Nesselsucht, Engegefühl in der Brust, pfeifendes Atemgeräusch, niedrigen Blutdruck und Anaphylaxie (schwerwiegende allergische Reaktion, die Atembeschwerden oder Schwindel bis hin zum Kollaps verursacht). Bei Auftreten dieser Symptome soll die Anwendung sofort unterbrochen und der Arzt aufgesucht werden. Bei einem Schock sollen die aktuellen medizinischen Richtlinien zur Schockbehandlung beachtet werden.
Wegen des Risikos von Überempfindlichkeitsreaktionen durch Faktor-IX-Konzentrate sollen die ersten Anwendungen von Faktor IX dort unter ärztlicher Beobachtung durchgeführt werden, wo eine geeignete medizinische Versorgung der allergischen Reaktionen sichergestellt werden kann.
• beim Auftreten von Hemmkörpern (Antikörpern) gegen Faktor IX. Nach wiederholter Behandlung mit Blutgerinnungsfaktor-IX-Produkten vom Menschen sollen die Patienten auf Entwicklung von neutralisierenden Hemmkörpern (Antikörpern) durch Bestimmung in Bethesda-Einheiten (BU) mittels geeigneter biologischer Tests überwacht werden.
In der Literatur finden sich Berichte über einen Zusammenhang zwischen dem Auftreten eines Faktor-IX-Hemmkörpers und Überempfindlichkeitsreaktionen. Daher sollen Patienten mit Überempfindlichkeitsreaktionen auf das Vorhandensein eines Hemmkörpers getestet werden. Es sollte beachtet werden, dass bei Patienten mit Faktor-IX-Hemmkörpern ein höheres Risiko schwerwiegender allergischer Reaktionen mit einem daraus entstehenden hohen Faktor-IX-Verbrauch besteht.
• wegen des möglichen Auftretens von Blutgerinnseln in einem Blutgefäß (thromboembolische Komplikationen).
Die Anwendung von Faktor-IX-Komplexkonzentraten ist in der Vergangenheit mit der Entwicklung von Blutgerinnseln in Verbindung gebracht worden. Hierbei ist das Risiko bei wenig reinen Präparaten erhöht. Die Anwendung von Faktor-IX-haltigen Präparaten ist daher bei Patienten mit Anzeichen von Blutgerinnungsstörungen (Fibrinolyse oder Verbrauchs-koagulopathie) potentiell gefährlich. Wegen der potentiellen Gefahr der Blutgerinnselbildung soll eine klinische Überwachung auf Frühzeichen von Blutgerinnungsstörungen (thrombotischer Koagulopathie bzw. Verbrauchskoagulopathie) mittels geeigneter biologischer Tests erfolgen. Dies gilt vor allem bei der Gabe des Präparates in den folgenden Situationen: Patienten mit Lebererkrankungen, nach Operationen, bei Neugeborenen oder bei Patienten mit Risiko von Blutgerinnungsstörungen. In jedem dieser Fälle soll der Nutzen
einer Therapie mit Berinin P 600 gegen das Risiko dieser Komplikationen abgewogen werden.
• bei erhöhter Gerinnungsneigung durch erhöhten Verbrauch an Blutplättchen oder Gerinnungsfaktoren. Berinin P enthält Heparin als Hilfsstoff. Heparin kann allergische Reaktionen und eine Senkung der Blutplättchenzahl verursachen und somit die Blutgerinnung beeinflussen. Patienten mit bekannten allergischen Reaktionen auf Heparin sollten die Anwendung von heparinhaltigen Medikamenten vermeiden.
Informationen zum Infektionsrisiko von Berinin P 600
Bei der Herstellung von Arzneimitteln aus menschlichem Blut oder Plasma werden bestimmte Maßnahmen ergriffen, um eine Übertragung von Infektionen auf den Patienten zu verhindern. Diese Maßnahmen umfassen die sorgfältige Auswahl von Blut- und Plasmaspendern um sicherzustellen, dass diejenigen ausgeschlossen werden, die ein infektiöses Risiko tragen, sowie die Testung jeder einzelnen Spende und jedes Plasmapools auf Anzeichen für Viren/Infektionen. Des weiteren werden in den Verarbeitungsprozess von Blut und Plasma Abläufe zur Inaktivierung und Entfernung von Viren eingebunden. Trotz dieser Maßnahmen kann die Übertragung von Erregern bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln nicht vollständig ausgeschlossen werden. Dies gilt auch für bisher unbekannte Viren und andere Pathogene.
Die getroffenen Maßnahmen werden als wirksam angesehen für umhüllte Viren wie z.B. HIV, Hepatitis B- und Hepatitis C-Virus, und für das nicht umhüllte Hepatitis A-Virus.
Für andere nicht-umhüllte Viren, wie z. B. Parvovirus B19, können die getroffenen Maßnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen haben für schwangere Frauen (Infektionen des ungeborenen Kindes) und für Personen, deren Immunsystem unterdrückt ist, oder die an bestimmten Formen von Blutarmut leiden (z. B. Sichelzellenerkrankung oder hämolytische Anämie).
Eine Impfung gegen Hepatitis A und B sollte in Betracht gezogen werden, falls regelmäßig Präparate aus menschlichem Blut oder Plasma angewendet werden.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen, d.h. der Patient sollte in seinem Patiententagebuch das Datum der Anwendung, die Chargenbezeichnung und die verabreichte Menge genau dokumentieren.
Bei Anwendung von Berinin P 600 mit anderen Arzneimitteln
• Wechselwirkungen von Blutgerinnungsfaktor-IX-Konzentrat vom Menschen mit anderen Arzneimitteln sind bisher nicht bekannt.
Dieses Arzneimittel darf nicht mit anderen Arzneimitteln, außer physiologischer Kochsalzlösung, vermischt werden.
Schwangerschaft und Stillzeit
• Studien zur Fortpflanzung am Tier wurden mit Faktor IX nicht durchgeführt. Aufgrund des seltenen Vorkommens der Hämophilie B bei Frauen liegen keine Erfahrungen über die Anwendung von Faktor IX während der Schwangerschaft und Stillzeit vor.
• Daher soll Faktor IX in der Schwangerschaft und Stillzeit nur bei klarer Indikationsstellung angewendet werden.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Es wurden keine Auswirkungen auf die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beobachtet.
Wichtige Informationen über bestimmte sonstige Bestandteile von Berinin P 600
Berinin P 600 enthält bis zu 24 mg Natrium pro 600 I.E. Dies sollte bei Patienten, die eine salzarme Diät einhalten müssen, berücksichtigt werden.
3. WIE IST BERININ P 600 ANZUWENDEN?
Nehmen Sie Berinin P 600 immer genau nach den Anweisungen des Arztes ein. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Die Therapie soll unter der Aufsicht eines in der Hämophilie-Behandlung erfahrenen Arztes erfolgen.
Dosierung, soweit nicht anders verordnet
Dosierung und Dauer der Substitutionstherapie richten sich nach dem Schweregrad des Faktor-IX-Mangels, nach Ort und Ausmaß der Blutung und nach dem klinischen Zustand des Patienten. Weitere Informationen zur Dosierung finden Sie am Ende dieser Packungsbeilage.
Überdosierung
Es wurden keine Symptome von Überdosierung mit Blutgerinnungsfaktor IX vom Menschen berichtet.
Zubereitung und Anwendung
Allgemeine Hinweise:
- Berinin P 600 darf nach Ablauf des auf Packung und Behältnis angegebenen Verfallsdatums nicht mehr angewendet werden.
- In der Regel ist die Lösung klar oder leicht opaleszent, d.h. sie kann leicht schillern, wenn sie gegen das Licht gehalten wird, darf aber keine deutlich sichtbaren Partikel enthalten. Das gelöste Produkt sollte nach der Filtrierung/Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf Partikel und Verfärbungen visuell überprüft werden. Trübe Lösungen oder Lösungen mit Rückständen (Niederschlägen/Partikeln) sind nicht zu verwenden.
- Zubereitung und Entnahme der Lösung müssen unter aseptischen Bedingungen erfolgen.
- Nicht verwendetes Arzneimittel oder Abfallmaterial sind entsprechend den lokalen Anforderungen zu entsorgen.
Zubereitung:
Das Lösungsmittel auf Raumtemperatur erwärmen. Vor dem Öffnen der Mix2Vial Packung die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernen und die Stopfen mit einer aseptischen Lösung behandeln und anschließend trocknen lassen.

1
1. Das Deckpapier von der Mix2Vial Packung entfernen.
3


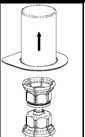
2. Die Lösungsmittelflasche auf eine ebene und saubere Fläche stellen und festhalten. Das Mix2Vial Set mit der Packung greifen und mit der blauen Seite auf die Lösungsmittelflasche fest aufstecken.
3. Vorsichtig die Verpackung vom Mix2Vial Set entfernen. Dabei ist darauf zu achten, dass nur die Packung und nicht das Mix2Vial entfernt wird.
4. Die Produktflasche auf eine feste Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten Set herumdrehen und den transparenten Adapter auf die Produktflasche fest aufstecken. Das Lösungsmittel läuft automatisch in die Produktflasche über.
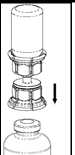
5. Die Produktflasche mit aufgesetztem Set und Lösungsmittelflasche vorsichtig schwenken, um das Produkt vollständig aufzulösen. Nicht schütteln!
6. Mit der einen Hand die Produktseite und mit der anderen Hand die Lösungsmittelseite des Mix2Vial greifen und das Set auseinander schrauben. Luft in eine leere, sterile Spritze aufziehen. Die Produktflasche aufrecht halten, die Spritze mit dem Mix2Vial Set verbinden und die Luft in die Produktflasche injizieren.
Aufziehen der Lösung in die Spritze und Anwendung:
|
L o a |
) i |
7. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und das Produkt durch langsames Zurückziehen des Stempels in die Spritze aufziehen. |
|
(C 2 |
> 8 |
8. Nachdem das Produkt vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei den Spritzenstempel nach unten gedrückt lassen) und die Spritze vom Mix2Vial Set abdrehen. |
Zur Injektion von Berinin P 600 werden Kunststoff-Einmalspritzen empfohlen, da geschliffene Oberflächen von Glasspritzen zur Verklebung bei derartigen Lösungen neigen.
Die Lösung soll vor der Anwendung auf Raum- oder Körpertemperatur angewärmt und langsam intravenös mit einer vom Patienten als angenehm empfundenen Geschwindigkeit injiziert oder infundiert werden. Sorgfältig darauf achten, dass kein Blut in die mit Produkt gefüllte Spritze gelangt. Die Injektions- / Infusionsgeschwindigkeit sollte nicht mehr als 2 ml pro Minute betragen.
Der Patient ist auf jegliche Sofortreaktionen zu beobachten. Wenn eine solche Reaktion erfolgt, die mit der Verabreichung von Berinin P 600 in Zusammenhang gebracht werden könnte, soll - in Abhängigkeit vom klinischen Zustand des Patienten - die Infusionsgeschwindigkeit gesenkt bzw. die Infusion abgebrochen werden (siehe auch Kapitel „2. Was müssen Sie vor der Anwendung von BerininP 600 beachten?“).
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wenn Sie Nebenwirkungen bei sich beobachten, insbesondere solche, die nicht in dieser Packungsbeilage aufgeführt sind, teilen Sie diese bitte Ihrem Arzt oder Apotheker mit.
Die folgenden Informationen zu Unverträglichkeitsreaktionen basieren auf der Erfahrung von Spontanmeldungen. Die folgenden Standardkategorien von Häufigkeiten werden verwendet:
Sehr häufig Häufig Gelegentlich Selten Sehr selten
> 1/10
> 1/100 und < 1/10
> 1/1000 und < 1/100
> 1/10 000 und < 1/1000 < 1/10 000
Erkrankungen des Immunsystems
Überempfindlichkeitsreaktionen oder allergische Reaktionen (die auch Gefäßödem, Brennen und Stechen an der Injektions-/Infusionsstelle, Schüttelfrost, Hautrötung mit Hitzegefühl, generalisierte (am ganzen Körper) Nesselsucht, Kopfschmerzen, quaddelartiger Hautausschlag, niedrigen Blutdruck, Antriebsarmut, Übelkeit, Unruhe, Pulsanstieg, Engegefühl in der Brust, Zittern, Erbrechen oder pfeifendes Atemgeräusch mit einschließen können) wurden in sehr seltenen Fällen bei Patienten beobachtet, die mit Faktor-IX-haltigen Präparaten behandelt wurden. In sehr seltenen Fällen entwickelten sich diese Reaktionen zu schwerer Anaphylaxie (einschließlich Schock), und diese sind in engem zeitlichen Zusammenhang mit der Entwicklung von Faktor-IX-Hemmkörpern aufgetreten (s. auch Kapitel „2. Was müssen Sie vor der Anwendung von Berinin P 600 beachten?“).
Patienten mit Hämophilie B können in sehr seltenen Fällen neutralisierende Antikörper (Hemmkörper) gegen Faktor IX entwickeln. Wenn solche Hemmkörper auftreten, manifestiert sich der Zustand als unzureichende klinische Antwort. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophilie-Zentrum aufzusuchen. Die Erfahrungen aus klinischen Studien mit Berinin P 600 bei zuvor unbehandelten Patienten (PUPs) sind sehr begrenzt. Daher können keine zuverlässigen Zahlen über die Häufigkeit klinisch relevanter, spezifischer Hemmkörper genannt werden.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
In sehr seltenen Fällen wurde Fieber beobachtet.
Erkrankungen der Nieren und Harnwege
Es liegt ein Bericht über das Auftreten eines nephrotischen Syndroms (Nierenkrankheit) nach versuchter Herbeiführung einer Immuntoleranz bei Hämophilie-B-Patienten mit Faktor-IXHemmkörpern und bekannter allergischer Reaktion vor.
Gefäßsystemerkrankungen
In sehr seltenen Fällen besteht ein potentielles Risiko von Blutgerinnselbildung nach Anwendung von Faktor-IX-Produkten, mit einem höheren Risiko bei wenig reinen Präparaten. Die Anwendung von wenig reinen Faktor-IX-Produkten wurde mit dem Vorkommen von Herzinfarkt,
Gerinnungssteigerung (Verbrauchskoagulopathie), Blutgerinnsel im Bein (venöser Thrombose) und Blutgerinnsel in der Lunge (Lungenembolie) in Verbindung gebracht. Die Anwendung von hochreinem Faktor IX ist selten mit solchen Nebenwirkungen verbunden.
Erkrankungen des Blutes und des Lymphsystems
Sehr selten wird ein Heparin-Antikörper-vermittelter Abfall der Zahl der Blutplättchen (HAT Typ II) mit Werten deutlich unter 100.000/pl oder auf weniger als 50 % des Ausgangswertes beobachtet. Bei Patienten ohne vorbestehende Überempfindlichkeit gegen Heparin beginnt der Abfall der Zahl der Blutplättchen in der Regel 6-14 Tage nach Behandlungsbeginn. Bei Patienten mit Überempfindlichkeit gegen Heparin tritt dieser Abfall unter Umständen innerhalb von Stunden auf.
Die schwere Form der Verminderung der Blutplättchenzahl kann verbunden sein mit Blutpfropfbildung (arteriellen und venösen Thrombosen/Thrombembolien), Gerinnungssteigerung (Verbrauchskoagulopathie), zum Teil Absterben von Hautgewebe (Hautnekrosen) an der Injektionsstelle, flohstichartigen Blutungen (Petechien, Purpura), und Teerstuhl (Meläna). Dabei kann die blutgerinnungshemmende Wirkung des Heparins vermindert sein (Heparintoleranz). In solchen Fällen ist Berinin P 600 sofort abzusetzen. Der Patient muß darüber informiert werden, dass bei ihm auch in Zukunft keine heparinhaltigen Arzneimittel mehr angewendet werden dürfen.
Informationen zum Infektionsrisiko siehe Kapitel „2. Was müssen Sie vor der Anwendung von Berinin P 600 beachten?“
5. WIE IST BERININ P 600 AUFZUBEWAHREN?
Berinin P 600 ist bei +2 °C bis +25 °C aufzubewahren. Nicht einfrieren. Flasche in der geschlossenen Faltschachtel aufbewahren, um den Inhalt vor Licht zu schützen!
Berinin P 600 darf nach Ablauf des auf Packung und Behältnis angegebenen Verfallsdatums nicht mehr angewendet werden.
Nach Auflösung ist die physiko-chemische Stabilität für 16 Stunden bei Raumtemperatur (max. +25 °C) belegt. Aus mikrobiologischer Sicht, und da Berinin P 600 kein Konservierungsmittel enthält, sollte das gelöste Produkt sofort verbraucht werden. Falls es nicht sofort angewendet wird, soll eine Aufbewahrung 8 Stunden bei Raumtemperatur nicht überschreiten.
Arzneimittel für Kinder unzugänglich aufbewahren!
6. WEITERE INFORMATIONEN Was Berinin P 600 enthält
Berinin P 600 enthält nominal 600 I.E. Blutgerinnungsfaktor IX vom Menschen pro Injektionsflasche. Die fertige Lösung wird injiziert oder infundiert.
Das mit 5 ml Wasser für Injektionszwecke rekonstituierte Produkt enthält ca. 120 I.E./ml (600 I.E./5ml) Blutgerinnungsfaktor IX vom Menschen.
Die Aktivität (I.E.) wird mittels Einphasen-Gerinnungstest gemäß Europäischem Arzneibuch bestimmt. Die spezifische Aktivität von Berinin P 600 beträgt mindestens 50 I.E. Faktor IX pro mg Gesamtprotein.
Die sonstigen Bestandteile sind:
Aminoessigsäure, Antithrombin III, Calciumchlorid, Heparin, Natriumchlorid, Natriumcitrat, HCl bzw. NaOH (in geringen Mengen zur Einstellung des pH-Wertes).
Lösungsmittel: Wasser für Injektionszwecke 5 ml
Wie Berinin P 600 aussieht und Inhalt der Packung
Berinin P 600 ist ein weißes Pulver und wird mit Wasser für Injektionszwecke geliefert.
Packungsgrößen
Eine Packung mit 600 I.E. enthält:
- 1 Vakuumflasche mit Trockensubstanz
- 1 Flasche mit 5 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (5 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 Pflaster
Pharmazeutischer Unternehmer und Hersteller
CSL Behring GmbH
- Emil-von-Behring-Str. 76 35041 Marburg
- Verkauf Deutschland Philipp-Reis-Str.2 65795 Hattersheim
Diese Gebrauchsinformation wurde zuletzt genehmigt im Juli 2011 Zul.-Nr.: Berinin® P 600 6121.01.00
Herkunftsländer des Blutplasmas: Deutschland, Österreich, Polen, USA
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Stoff- oder Indikationsgruppe
Mittel zur Blutstillung (Antihämorrhagika)/Blutgerinnungsfaktor IX ATC code: B02B D04
Dosierung
Die Menge des verabreichten Blutgerinnungsfaktors IX wird in Internationalen Einheiten (I.E.) angegeben, die dem gegenwärtigen WHO-Standard für Faktor-IX-Produkte entsprechen. Die Faktor-IX-Aktivität im Plasma wird entweder als Prozentsatz (in Bezug zu normalem Humanplasma) oder in Internationalen Einheiten (in Bezug zu einem internationalen Standard für Faktor IX im Plasma) angegeben.
Eine Internationale Einheit (I.E.) Faktor-IX-Aktivität entspricht dem Faktor-IX-Gehalt von 1 ml normalem Humanplasma. Die Berechnung der benötigten Dosierung von Faktor IX basiert auf dem empirischen Ergebnis, dass 1 I.E. Faktor IX pro kg Körpergewicht (KG) die Faktor-IXAktivität im Plasma um 1,0 % der normalen Aktivität anhebt. Die benötigte Dosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] x gewünschter Faktor-IX-Anstieg [% oder I.E./dl]
X 1,01.
Dosierung, Art und Dauer der Anwendung sollen sich stets an der klinischen Wirksamkeit im Einzelfall orientieren. Faktor-IX-Produkte müssen selten mehr als einmal täglich verabreicht werden.
Bei den folgenden Blutungsereignissen soll die Faktor-IX-Aktivität im Plasma (in % der Norm oder I.E./dl) im entsprechenden Zeitraum nicht unterschritten werden. Die folgende Tabelle dient als Empfehlung für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
|
Schweregrad der Blutung/Art des chirurgischen Eingriffs |
Benötigter Faktor-IXSpiegel (% oder I.E./dl) |
Häufigkeit der Dosen (Stunden)/Dauer der Behandlung (Tage) |
|
Blutung | ||
|
Beginnende Hämarthrosen, Muskelblutungen oder Blutungen in der Mundhöhle |
20 - 40 |
Wiederholung alle 24 Stunden. Mind. 1 Tag, bis Beendigung des Blutungsereignisses (durch Schmerz angezeigt) oder bis Abschluß der Wundheilung. |
|
Ausgedehntere Hämarthrosen, Muskelblutungen oder Hämatome |
30 - 60 |
Wiederholung alle 24 Stunden für 3 - 4 Tage oder länger, bis zur Beseitigung des Schmerzzustandes und der akuten Bewegungseinschränkung |
|
Lebensbedrohliche Blutungen |
60 - 100 |
Wiederholung alle 8 bis 24 Stunden bis zur Aufhebung des lebensbedrohlichen Zustandes. |
|
Chirurgische Eingriffe | ||
|
Kleinere Eingriffe einschließlich Zahnextraktion |
30 - 60 |
Alle 24 Stunden, mind. 1 Tag bis Abschluß der Wundheilung. |
|
Größere Eingriffe |
80 - 100 (prä- und postoperativ) |
Wiederholung alle 8 bis 24 Stunden bis zum adäquaten Abschluß der Wundheilung, dann Behandlung für mind. weitere 7 Tage zur Erhaltung einer Faktor-IX-Aktivität bei 30 bis 60 % (I.E./dl). |
Während der Behandlung sollten die Faktor-IX-Spiegel entsprechend bestimmt werden, um die zu verabreichende Dosis und die Häufigkeit wiederholter Infusionen zu steuern. Vor allem bei größeren chirurgischen Eingriffen ist eine genaue gerinnungsanalytische Überwachung (Faktor-IX-Aktivität im Plasma) der Substitutionstherapie unerläßlich. Einzelne Patienten können in ihrem Ansprechen auf Faktor IX variieren, wobei unterschiedliche Werte der In-vivo-Recovery erreicht und unterschiedliche Halbwertszeiten gemessen werden.
Bei der Langzeitprophylaxe von Blutungen bei schwerer Hämophilie B betragen die üblichen Dosen 20 bis 40 I.E. Faktor IX/kg KG in Intervallen von 3 bis 4 Tagen. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen notwendig sein.
Die Patienten sollen bezüglich einer Entwicklung von Antikörpern gegen Faktor IX (Hemmkörper) überwacht werden. Wenn die erwarteten Spiegel der Faktor-IX-Aktivität im Plasma nicht erreicht werden, oder wenn die Blutung nicht mit einer entsprechenden Dosis beherrscht wird, soll ein biologischer Test durchgeführt werden, um zu bestimmen, ob Faktor-IXHemmkörper vorhanden sind. Bei Patienten mit hohen Hemmkörperspiegeln kann die Faktor-IXBehandlung unwirksam sein und sollten andere Behandlungsmöglichkeiten erwogen werden.
Die Behandlung solcher Patienten soll von Ärzten durchgeführt werden, die in der Behandlung von Hämophilie-Patienten erfahren sind. Siehe auch Kapitel „2. Was müssen Sie vor der Anwendung von Berinin P 600 beachten?“
Dosierung bei Kindern
Es liegen keine Daten aus klinischen Studien zur Dosierung von Berinin P 600 bei Kindern vor.
Kehrwert der gemessenen Recovery