Berinin P 600
CSL Behring
Berinin® P
1. BEZEICHNUNG DES ARZNEIMITTELS
Berinin® P 300/600/1200
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Berinin P 300/600/1200 liegt als Pulver und Lösungsmittel zur Herstellung einer Injektionsoder Infusionslösung vor und enthält nominal 300/600/1200 I.E. Blutgerinnungsfaktor IX vom Menschen pro Injektionsflasche.
Das mit 2,5/5/10 ml Wasser für Injektionszwecke rekonstituierte Produkt enthält ca.
120 I.E./ml (300 I.E./2,5 ml, 600 I.E./5 ml, 1200 I.E./10 ml) Blutgerinnungsfaktor IX vom Menschen.
Die Aktivität (I.E.) wird mittels Einphasen-Gerinnungstest gemäß Europäischem Arzneibuch bestimmt. Die spezifische Aktivität von Berinin P 300/600/1200 beträgt mindestens 50 I.E. Faktor IX pro mg Gesamtprotein.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Therapie und Prophylaxe von Blutungen bei Patienten mit Hämophilie B (kongenitaler Faktor-IX-Mangel).
4.2 Dosierung, Art und Dauer der Anwendung
Die Therapie soll unter der Aufsicht eines in der Hämophilie-Behandlung erfahrenen Arztes erfolgen.
Dosierung
Dosierung und Dauer der Substitutionstherapie richten sich nach dem Schweregrad des Faktor-IX-Mangels, nach Ort und Ausmaß der Blutung und nach dem klinischen Zustand des Patienten.
Die Menge des verabreichten Blutgerinnungsfaktors IX wird in Internationalen Einheiten (I.E.) angegeben, die dem gegenwärtigen WHO-Standard für Faktor-IX-Produkte entsprechen. Die Faktor-IX-Aktivität im Plasma wird entweder als Prozentsatz (in Bezug zu normalem Humanplasma) oder in Internationalen Einheiten (in Bezug zu einem internationalen Standard für Faktor IX im Plasma) angegeben.
Eine Internationale Einheit (I.E.) Faktor-IX-Aktivität entspricht dem Faktor-IX-Gehalt von 1 ml normalem Humanplasma. Die Berechnung der benötigten Dosierung von Faktor IX basiert auf dem empirischen Ergebnis, dass 1 I.E. Faktor IX pro kg Körpergewicht (KG) die Faktor-IX-Aktivität im Plasma um 1,0 % der normalen Aktivität anhebt. Die benötigte Dosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] x gewünschter Faktor-IX-Anstieg [% oder I.E./dl] x 1,01.
Dosierung, Art und Dauer der Anwendung sollen sich stets an der klinischen Wirksamkeit im Einzelfall orientieren. Faktor-IX-Produkte müssen selten mehr als einmal täglich verabreicht werden.
Bei den folgenden Blutungsereignissen soll die Faktor-IX-Aktivität im Plasma (in % der Norm oder I.E./dl) im entsprechenden Zeitraum nicht unterschritten werden. Die folgende Tabelle dient als Empfehlung für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
|
Schweregrad der Blutung/Art des chirurgischen Eingriffs |
Benötigter Faktor-IXSpiegel (% oder I.E./dl) |
Häufigkeit der Dosen (Stunden)/Dauer der Behandlung (Tage) |
|
Blutung | ||
|
Beginnende Hämarthrosen, Muskelblutungen oder Blutungen in der Mundhöhle |
20 - 40 |
Wiederholung alle 24 Stunden. Mind. 1 Tag, bis Beendigung des Blutungsereignisses (durch Schmerz angezeigt) oder bis Abschluss der Wundheilung. |
|
Ausgedehntere Hämarthrosen, Muskelblutungen oder Hämatome |
30 - 60 |
Wiederholung alle 24 Stunden für 3 - 4 Tage oder länger, bis zur Beseitigung des Schmerzzustandes und der akuten Bewegungseinschränkung |
|
Lebensbedrohliche Blutungen |
60 - 100 |
Wiederholung alle 8 bis 24 Stunden bis zur Aufhebung des lebensbedrohlichen Zustandes. |
|
Chirurgische Eingriffe | ||
|
Kleinere Eingriffe einschließlich Zahnextraktion |
30 - 60 |
Alle 24 Stunden, mind. 1 Tag bis Abschluss der Wundheilung. |
|
Größere Eingriffe |
80 - 100 (prä- und postoperativ) |
Wiederholung alle 8 bis 24 Stunden bis zum adäquaten Abschluss der Wundheilung, dann Behandlung für mind. weitere 7 Tage zur Erhaltung einer Faktor-IX-Aktivität bei 30 bis 60 % (I.E./dl). |
Während der Behandlung sollten die Faktor-IX-Spiegel entsprechend bestimmt werden, um die zu verabreichende Dosis und die Häufigkeit wiederholter Infusionen zu steuern. Vor allem bei größeren chirurgischen Eingriffen ist eine genaue gerinnungsanalytische Überwachung (Faktor-IX-Aktivität im Plasma) der Substitutionstherapie unerlässlich. Einzelne Patienten können in ihrem Ansprechen auf Faktor IX variieren, wobei unterschiedliche Werte der In-vivo-Recovery erreicht und unterschiedliche Halbwertszeiten gemessen werden.
Bei der Langzeitprophylaxe von Blutungen bei schwerer Hämophilie B betragen die üblichen Dosen 20 bis 40 I.E. Faktor IX/kg KG in Intervallen von 3 bis 4 Tagen. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen notwendig sein.
Die Patienten sollen bezüglich einer Entwicklung von Antikörpern gegen Faktor IX (Hemmkörper) überwacht werden. Wenn die erwarteten Spiegel der Faktor-IX-Aktivität im Plasma nicht erreicht werden, oder wenn die Blutung nicht mit einer entsprechenden Dosis beherrscht wird, soll ein biologischer Test durchgeführt werden, um zu bestimmen, ob Faktor-IX-Hemmkörper vorhanden sind. Bei Patienten mit hohen Hemmkörperspiegeln kann die Faktor-IX-Behandlung unwirksam sein und sollten andere Behandlungsmöglichkeiten erwogen werden.
Die Behandlung solcher Patienten soll von Ärzten durchgeführt werden, die in der Behandlung von Hämophilie-Patienten erfahren sind. Siehe auch Kapitel 4.4.
Dosierung bei Kindern
Es liegen keine Daten aus klinischen Studien zur Dosierung von Berinin P 300/600/1200 bei Kindern vor.
Art und Dauer der Anwendung
Das Pulver wird wie unter Kapitel „ 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung “ beschrieben aufgelöst.
Die rekonstituierte Lösung soll vor der Anwendung auf Raum- oder Körpertemperatur angewärmt und langsam intravenös mit einer vom Patienten als angenehm empfundenen Geschwindigkeit injiziert oder infundiert werden. Sorgfältig darauf achten, dass kein Blut in die mit Produkt gefüllte Spritze gelangt. Die Injektions- / Infusionsgeschwindigkeit sollte nicht mehr als 2 ml pro Minute betragen.
Der Patient ist auf jegliche Sofortreaktionen zu beobachten. Wenn eine solche Reaktion erfolgt, die mit der Verabreichung von Berinin P 300/600/1200 in Zusammenhang gebracht werden könnte, soll - in Abhängigkeit vom klinischen Zustand des Patienten - die Infusionsgeschwindigkeit gesenkt bzw. die Infusion abgebrochen werden (s. auch Kapitel „4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“).
4.3 Gegenanzeigen
Bekannte Überempfindlichkeit gegen jegliche Bestandteile des Präparates.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wie bei jedem intravenös verabreichten Proteinpräparat sind allergieartige Überempfindlichkeitsreaktionen möglich.
Die Patienten sollen über Frühzeichen von Überempfindlichkeitsreaktionen informiert werden, wie quaddelartiger Hautausschlag, generalisierte Nesselsucht, Angina pectoris, Stridor, Hypotension und Anaphylaxie. Bei Auftreten dieser Symptome soll ihnen geraten werden, die Anwendung sofort zu unterbrechen und ihren Arzt aufzusuchen.
Bei einem Schock sollen die aktuellen medizinischen Richtlinien zur Schockbehandlung beachtet werden.
Nach wiederholter Behandlung mit Blutgerinnungsfaktor-IX-Produkten vom Menschen sollen die Patienten auf Entwicklung von neutralisierenden Antikörpern (Hemmkörper) durch Bestimmung in Bethesda-Einheiten (BU) mittels geeigneter biologischer Tests überwacht werden.
In der Literatur finden sich Berichte über eine Korrelation zwischen dem Auftreten eines Faktor-IX-Hemmkörpers und allergischen Reaktionen. Daher sollen Patienten mit allergischen Reaktionen auf das Vorhandensein eines Hemmkörpers getestet werden. Es sollte beachtet werden, dass bei Patienten mit Faktor-IX-Hemmkörpern ein höheres Risiko anaphylaktischer Reaktionen mit einem daraus entstehenden hohen Faktor-IX-Verbrauch besteht.
Wegen des Risikos allergischer Reaktionen durch Faktor-IX-Konzentrate sollen die initialen Anwendungen von Faktor IX dort unter ärztlicher Beobachtung durchgeführt werden, wo eine geeignete medizinische Versorgung der allergischen Reaktionen sichergestellt werden kann.
Die Anwendung von Faktor-IX-Komplexkonzentraten ist in der Vergangenheit mit der Entwicklung thromboembolischer Komplikationen in Verbindung gebracht worden. Hierbei ist das Risiko bei wenig reinen Präparaten höher. Die Anwendung von Faktor-IX-haltigen Produkten ist daher bei Patienten mit Anzeichen von Fibrinolyse und bei Patienten mit Verbrauchskoagulopathie potentiell gefährlich. Wegen der potentiellen Gefahr thrombotischer Komplikationen soll eine klinische Überwachung auf Frühzeichen thrombotischer Koagulopathie bzw. Verbrauchskoagulopathie mittels geeigneter biologischer Tests erfolgen. Dies gilt vor allem bei der Gabe des Präparates in den folgenden Situationen: Patienten mit Lebererkrankungen, nach Operationen, bei Neugeborenen oder bei Patienten mit Risiko thrombotischer Ereignisse oder Verbrauchskoagulopathie. In jedem dieser Fälle soll der Nutzen einer Therapie mit Berinin P 300/600/1200 gegen das Risiko dieser Komplikationen abgewogen werden.
Berinin P 300/600/1200 enthält bis zu 48 mg Natrium pro 1200 I.E. Dies sollte bei Patienten, die eine salzarme Diät einhalten müssen, berücksichtigt werden.
Berinin P enthält Heparin als Hilfsstoff. Heparin kann allergische Reaktionen und eine Senkung der Blutplättchenzahl verursachen und somit die Blutgerinnung beeinflussen. Patienten mit bekannten allergischen Reaktionen auf Heparin sollten die Anwendung von heparinhaltigen Medikamenten vermeiden.
Standardmethoden zur Vermeidung von Infektionskrankheiten, die im Rahmen der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln auftreten können, umfassen die Auswahl der Spender, die Prüfung jeder einzelnen Spende und jedes Plasmapools auf spezifische Marker für Infektionen sowie die Einbeziehung effektiver Herstellungsschritte zur Inaktivierung/Eliminierung von Viren. Trotz dieser Maßnahmen kann die Möglichkeit der Übertragung von Erregern bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln nicht vollständig ausgeschlossen werden. Dies gilt auch für bisher unbekannte Viren und andere Pathogene.
Die getroffenen Maßnahmen werden als wirksam angesehen für umhüllte Viren, wie z.B. HIV, HBV und HCV und für das nicht-umhüllte Virus HAV.
Für andere nicht-umhüllte Viren, wie z.B. Parvovirus B19, können die getroffenen Maßnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen für schwangere Frauen (fetale Infektion) und für Personen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) haben.
Für Patienten, die regelmäßig Präparate aus menschlichem Blut oder Plasma einschließlich Faktor IX Präparate erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und Hepatitis B empfohlen.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungen von Blutgerinnungsfaktor-IX-Produkten vom Menschen mit anderen Arzneimitteln sind nicht bekannt.
4.6 Schwangerschaft und Stillzeit
Reproduktionsstudien am Tier wurden mit Faktor IX nicht durchgeführt. Aufgrund des seltenen Vorkommens der Hämophilie B bei Frauen liegen keine Erfahrungen über die Anwendung von Faktor IX während der Schwangerschaft und Stillzeit vor.
Daher soll Faktor IX in der Schwangerschaft und Stillzeit nur bei klarer Indikationsstellung angewendet werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Auswirkungen auf die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beobachtet.
4.8 Nebenwirkungen
Die folgenden Informationen zu Unverträglichkeitsreaktionen basieren auf der Erfahrung von Spontanmeldungen. Die folgenden Standardkategorien von Häufigkeiten werden verwendet:
Sehr häufig Häufig Gelegentlich Selten Sehr selten
> 1/10
> 1/100 und < 1/10 >1/1000 und < 1/100
> 1/10 000 und < 1/1000 < 1/10 000
Erkrankungen des Immunsystems
Überempfindlichkeitsreaktionen oder allergische Reaktionen (die auch Angioödem,
Brennen und Stechen an der Injektions-/Infusionsstelle, Schüttelfrost, Hautrötung mit Hitzegefühl, generalisierte Nesselsucht, Kopfschmerzen, quaddelartiger Hautausschlag, Hypotension, Lethargie, Übelkeit, Unruhe, Tachykardie, Angina pectoris, Zittern, Erbrechen oder Stridor mit einschließen können) wurden in sehr seltenen Fällen bei Patienten beobachtet, die mit Faktor-IX-haltigen Präparaten behandelt wurden. In sehr seltenen Fällen entwickelten sich diese Reaktionen zu schwerer Anaphylaxie, und diese sind in engem zeitlichen Zusammenhang mit der Entwicklung von Faktor-IX-Hemmkörpern aufgetreten (s. auch Kap. 4.4).
Patienten mit Hämophilie B können in sehr seltenen Fällen neutralisierende Antikörper (Hemmkörper) gegen Faktor IX entwickeln. Wenn solche Hemmkörper auftreten, manifestiert sich der Zustand als unzureichende klinische Antwort. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophilie-Zentrum aufzusuchen. Die Erfahrungen aus klinischen Studien mit Berinin P 300/600/1200 bei zuvor unbehandelten Patienten (PUPs) sind sehr begrenzt. Daher können keine zuverlässigen Zahlen über die Häufigkeit klinisch relevanter, spezifischer Hemmkörper genannt werden.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
In sehr seltenen Fällen wurde Fieber beobachtet.
Erkrankungen der Nieren und Harnwege
Es liegt ein Bericht über das Auftreten eines nephrotischen Syndroms nach versuchter Induktion einer Immuntoleranz bei Hämophilie-B-Patienten mit Faktor-IX-Hemmkörpern und bekannter allergischer Reaktion vor.
Gefäßsystemerkrankungen
In sehr seltenen Fällen besteht ein potentielles Risiko thromboembolischer Ereignisse nach Anwendung von Faktor-IX-Produkten, mit einem höheren Risiko bei wenig reinen Präparaten. Die Anwendung von wenig reinen Faktor-IX-Produkten wurde mit dem Vorkommen von Myokardinfarkt, Verbrauchskoagulopathie, venöser Thrombose und Lungenembolie in Verbindung gebracht. Die Anwendung von hochreinem Faktor IX ist selten mit solchen Nebenwirkungen verbunden.
Erkrankungen des Blutes und des Lymphsystems
Sehr selten werden Heparin-Antikörper-vermittelte schwere Thrombozytopenien (HAT Typ II) mit Thrombozytenwerten deutlich unter 100.000/gl oder einem schnellen Abfall auf weniger als 50 % des Ausgangswertes beobachtet. Bei nicht Sensibilisierten beginnt der Thrombozytenabfall in der Regel 6-14 Tage nach Behandlungsbeginn, bei Sensibilisierten unter Umständen innerhalb von Stunden.
Die schwere Form der Thrombozytopenie kann verbunden sein mit arteriellen und venösen Thrombosen/Thrombembolien, Verbrauchskoagulopathie, evtl. Hautnekrosen an der Injektionsstelle, Petechien, Purpura und Meläna. Dabei kann die blutgerinnungshemmende Wirkung des Heparins vermindert sein (Heparintoleranz). In solchen Fällen ist Berinin P 300/600/1200 sofort abzusetzen. Der Patient muss darüber informiert werden, dass bei ihm auch in Zukunft keine heparinhaltigen Arzneimittel mehr angewendet werden dürfen.
Informationen zum Infektionsrisiko siehe Kapitel „4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“.
4.9 Überdosierung
Es wurden keine Symptome von Überdosierung mit Blutgerinnungsfaktor IX vom Menschen berichtet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe Antihämorrhagika: Blutgerinnungsfaktor IX.
ATC-Code: B02B D04
Faktor IX ist ein einkettiges Glykoprotein mit einem Molekulargewicht von etwa 68.000 Dalton. Er ist ein Vitamin-K-abhängiger Gerinnungsfaktor, der in der Leber gebildet wird. Faktor IX wird durch Faktor XIa im endogenen Gerinnungssystem, und durch Faktor VII/Gewebefaktorkomplex im exogenen Gerinnungssystem aktiviert.
Aktivierter Faktor IX aktiviert seinerseits im Zusammenwirken mit aktiviertem Faktor VIII den Faktor X. Aktivierter Faktor X wandelt Prothrombin in Thrombin um. Thrombin wandelt dann Fibrinogen in Fibrin um, und ein Gerinnsel kann gebildet werden.
Hämophilie B ist eine geschlechtsspezifische erbliche Blutgerinnungsstörung aufgrund niedriger Faktor-IX-Spiegel und mündet in schwere Blutungen in Gelenke, Muskeln oder innere Organe, entweder spontan oder als Folge akzidenteller oder chirurgischer Traumen. Durch Substitutionstherapie werden die Faktor-IX-Plasmaspiegel angehoben, wobei eine vorübergehende Korrektur des Faktor-IX-Mangels und Behebung der Blutungsneigungen herbeigeführt wird.
5.2 Pharmakokinetische Eigenschaften
In einer Pharmakokinetik Studie mit 14 Patienten betrug die mediane Halbwertszeit 23 Stunden (10 - 43 Stunden), die mediane IVR 1,1 (IU/dl)/(IU/kg) (0,57 - 1,69 (IU/dl)/(IU/kg). Die mediane MRT betrug 27 Stunden (18 - 40 Stunden) und die mediane clearance wurde mit 4,5 ml/h/kg (2,5 - 12,5 ml/h/kg) berechnet.
5.3 Präklinische Daten zur Sicherheit
Der in Berinin P enthaltene arzneilich wirksame Bestandteil FIX wird aus humanem Plasma gewonnen und verhält sich wie die körpereigenen Plasmabestandteile. Die einmalige Verabreichung von Berinin P an verschiedenen Tierspezies gab keine Hinweise auf toxische Auswirkungen auf die Labortiere. Präklinische Studien mit wiederholten Dosisgaben (chronische Toxizität, Kanzerogenität, Reproduktionstoxizität) können in herkömmlichen Tiermodellen nicht sinnvoll durchgeführt werden, da aufgrund der Verabreichung heterologer humaner Proteine Antikörper gebildet werden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Aminoessigsäure, Antithrombin III, Calciumchlorid, Heparin, Natriumchlorid, Natriumcitrat, HCl bzw. NaOH (in geringen Mengen zur Einstellung des pH-Wertes).
Beigefügtes Lösungsmittel:
Wasser für Injektionszwecke 2,5/5/10 ml
6.2 Inkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen Arzneimitteln, außer physiologischer Kochsalzlösung, vermischt werden.
6.3 Dauer der Haltbarkeit
Die Haltbarkeit von Berinin P 300/600/1200 im Behältnis beträgt 3 Jahre.
Nach Rekonstitution ist die physiko-chemische Stabilität für 16 Stunden bei Raumtemperatur (max. +25 °C) belegt. Aus mikrobiologischer Sicht, und da Berinin P 300/600/1200 kein Konservierungsmittel enthält, sollte das gelöste Produkt sofort verbraucht werden. Falls es nicht sofort angewendet wird, soll eine Aufbewahrung 8 Stunden bei Raumtemperatur nicht überschreiten.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Berinin P 300/600/1200 ist bei +2 °C bis +25 °C aufzubewahren. Nicht einfrieren. In der geschlossenen Faltschachtel aufbewahren.
6.5 Art und Inhalt des Behältnisses Primärbehältnisse
Substanzflaschen:
Berinin P 300:
6 ml Injektionsflasche, farblos, Glastyp I Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
Berinin P 600:
10 ml Injektionsflasche, farblos, Glastyp I Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
Berinin P 1200:
17 ml Injektionsflasche, farblos, Glastyp II Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
Lösungsmittelflaschen (für Wasser für Injektionszwecke):
2,5 ml und 5 ml Wasser für Injektionszwecke für Berinin P 300 und 600:
6 ml Injektionsflasche, farblos, Glastyp I Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
10 ml Wasser für Injektionszwecke für Berinin P 1200:
10 ml Injektionsflasche, farblos, Glastyp I Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
Packungsgrößen
Berinin P 300:
Eine Packung mit 300 I.E. enthält:
- 1 Vakuumflasche mit Trockensubstanz
- 1 Flasche mit 2,5 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (5 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 Pflaster
Berinin P 600:
Eine Packung mit 600 I.E. enthält:
- 1 Vakuumflasche mit Trockensubstanz
- 1 Flasche mit 5 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (5 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 Pflaster
Berinin P 1200:
Eine Packung mit 1200 I.E. enthält:
- 1 Vakuumflasche mit Trockensubstanz
- 1 Flasche mit 10 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (10 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 Pflaster
Es werden möglicherweise werden nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Allgemeine Hinweise
- Berinin P 300/600/1200 darf nach Ablauf des auf Packung und Behältnis angegebenen Verfalldatums nicht mehr angewendet werden.
- In der Regel ist die Lösung klar oder leicht opaleszent. Rekonstituiertes Produkt sollte nach der Filtrierung/Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf Partikel und Verfärbungen visuell überprüft werden. Trübe Lösungen oder Lösungen mit Rückständen (Niederschlägen/Partikeln) sind nicht zu verwenden.
- Zubereitung und Verabreichung müssen unter aseptischen Bedingungen erfolgen.
- Abfallmaterial oder nicht verwendetes Arzneimittel sind entsprechend den lokalen Anforderungen zu entsorgen.
Zubereitung:
Erwärmen Sie das Lösungsmittel auf Raumtemperatur. Vor dem Öffnen der Mix2Vial
Packung die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernen und die
Stopfen mit einer aseptischen Lösung behandeln und anschließend trocknen lassen.
1. Das Deckpapier von der Mix2Vial Packung entfernen.
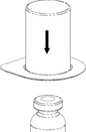
2. Die Lösungsmittelflasche auf eine ebene, saubere Fläche stellen und festhalten. Das Mix2Vial Set mit der Packung greifen und mit der blauen Seite auf die Lösungsmittelflasche fest aufstecken.
|
Jjj |
3 |
3. Vorsichtig die Verpackung vom Mix2Vial Set entfernen. Dabei ist darauf zu achten, dass nur die Packung und nicht das Mix2Vial entfernt wird. | |
|
w ' • |
4 _ |
4. Die Produktflasche auf eine feste Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten Set herumdrehen und den transparenten Adapter auf die Produktflasche fest aufstecken. Das Lösungsmittel läuft automatisch in die Produktflasche über. | |
|
i |
5. Die Produktflasche mit aufgesetztem Set und Lösungsmittelflasche vorsichtig schwenken, um das Produkt vollständig aufzulösen. Nicht schütteln. | ||
|
c ^ & |
i 6 |
6. Mit der einen Hand die Produktseite und mit der anderen Hand die Lösungsmittelseite des Mix2Vial greifen und das Set auseinander schrauben. Luft in eine leere, sterile Spritze aufziehen. Die Produktflasche aufrecht halten, die Spritze mit dem Mix2Vial Set verbinden und die Luft in die Produktflasche injizieren. |
Aufziehen der Lösung in die Spritze:
|
q 1 |
f Pt |
7. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und das Produkt durch langsames Zurückziehen des Stempels in die Spritze aufziehen. |
|
I |
8 |
8. Nachdem das Produkt vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei den Spritzenstempel nach unten gedrückt lassen) und die Spritze vom Mix2Vial Set abdrehen. |
Zur Injektion von Berinin P 300/600/1200 werden Kunststoff-Einmalspritzen empfohlen, da geschliffene Oberflächen von Glasspritzen zur Verklebung bei derartigen Lösungen neigen.
7. INHABER DER ZULASSUNG
CSL Behring GmbH
- Emil-von-Behring-Str. 76 35041 Marburg
- Verkauf Deutschland Philipp-Reis-Str. 2 65795 Hattersheim Tel.: (069) 305 - 8 44 37 Fax: (069) 305 - 1 71 29
8. ZULASSUNGSNUMMERN
Berinin® P 300 Zul.-Nr. 6121.00.00
Berinin® P 600 Zul.-Nr. 6121.01.00
Berinin® P 1200 Zul.-Nr. 6121.02.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Erstzulassung: 10. August 1993
Letzte Verlängerung der Zulassung: 16. Mai 2005
10. STAND DER INFORMATION
Juli 2011
11. HERKUNFTSLÄNDER DES BLUTPLASMAS
Deutschland, Österreich, Polen, USA
12. VERSCHREIBUNGSSTATUS
Verschreibungspflichtig
Kehrwert der gemessenen Recovery