Berinin P 600
CSL Behring
Berinin® P 600
Gebrauchsinformation: Information für den Anwender
Berinin® P 600
600 I.E.
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung. Konzentrat des Blutgerinnungsfaktors IX vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
• Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht:
1. Was ist Berinin und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Berinin beachten?
3. Wie ist Berinin anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Berinin aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Berinin und wofür wird es angewendet?
Was ist Berinin ?
Berinin liegt als Pulver und Lösungsmittel vor. Die fertige Lösung wird als Injektion oder Infusion in eine Vene verabreicht.
Berinin wird aus menschlichem Blutplasma (dem flüssigen Teil des Blutes) gewonnen und enthält den Blutgerinnungsfaktor IX vom Menschen.
Wofür wird Berinin angewendet?
Berinin wird angewendet zur Therapie und Prophylaxe von Blutungen bei Patienten mit Hämophilie B (kongenitaler Faktor-IX-Mangel).
2. Was sollten Sie vor der Anwendung von Berinin beachten?
Berinin darf nicht angewendet werden,
• wenn Sie allergisch gegen Blutgerinnungsfaktor IX vom Menschen oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker bevor Sie Berinin anwenden.
• Überempfindlichkeitsreaktionen.
Allergieartige Überempfindlichkeitsreaktionen sind möglich. Die Patienten sollen angewiesen werden, dass sie bei Auftreten dieser Symptome die Anwendung sofort unterbrechen und ihren Arzt aufsuchen.
Die Patienten sollen über Frühzeichen von Überempfindlichkeitsreaktionen informiert werden, wie quaddelartiger Hautausschlag, generalisierte Nesselsucht, Engegefühl in der Brust, pfeifendes Atemgeräusch, niedrigen Blutdruck und Anaphylaxie (schwerwiegende allergische Reaktion, die Atembeschwerden oder Schwindel bis hin zum Kollaps verursacht). Bei einem Schock sollen die aktuellen medizinischen Richtlinien zur Schockbehandlung beachtet werden.
• Hemmkörper(Antikörper) gegen Faktor IX.
Nach wiederholter Behandlung mit Blutgerinnungsfaktor-IX-Produkten vom Menschen sollen die Patienten auf Entwicklung von neutralisierenden Hemmkörpern (Antikörpern) durch Bestimmung in Bethesda-Einheiten (BU) mittels geeigneter biologischer Tests überwacht werden.
In der Literatur finden sich Berichte über einen Zusammenhang zwischen dem Auftreten eines Faktor-IX-Hemmkörpers und Überempfindlichkeitsreaktionen. Daher sollen Patienten mit Überempfindlichkeitsreaktionen auf das Vorhandensein eines Hemmkörpers getestet werden. Es sollte beachtet werden, dass bei Patienten mit Faktor-IX-Hemmkörpern ein höheres Risiko schwerwiegender allergischer Reaktionen mit einem daraus entstehenden hohen Faktor-IX-Verbrauch besteht.
Wegen des Risikos von Überempfindlichkeitsreaktionen durch Faktor-IX-Konzentrate sollen die ersten Anwendungen von Faktor IX dort unter ärztlicher Beobachtung durchgeführt werden, wo eine geeignete medizinische Versorgung der allergischen Reaktionen sichergestellt werden kann.
• Blutgerinnsel in einem Blutgefäß (thromboembolische Komplikationen).
Wegen der potentiellen Gefahr der Blutgerinnselbildung soll eine klinische Überwachung auf Frühzeichen von Blutgerinnungsstörungen (thrombotischer Koagulopathie bzw. Verbrauchskoagulopathie) mittels geeigneter biologischer Tests erfolgen. Dies gilt vor allem bei der Gabe des Präparates in den folgenden Situationen: Patienten mit Lebererkrankungen, nach Operationen, bei Neugeborenen oder bei Patienten mit Risiko von Blutgerinnungsstörungen. In jedem dieser Fälle soll der Nutzen einer Therapie mit Berinin gegen das Risiko dieser Komplikationen abgewogen werden.
• Kardiovaskuläre Ereignisse
Bei Patienten mit vorhandenen kardiovaskulären Risikofaktoren, kann eine Substitutionstherapie mit Faktor IX das kardiovaskuläre Risiko erhöhen.
• Katheter-assoziierte Komplikationen
Wenn ein zentraler Venenkatheter erforderlich ist, sollte das Risiko von Katheter-assoziierten Komplikationen einschließlich lokaler Infektionen, Bakteriämie und Thrombosen an der Stelle des Katheters berücksichtigt werden.
Informationen zum Infektionsrisiko von Berinin
Bei der Herstellung von Arzneimitteln aus menschlichem Blut oder Plasma werden bestimmte Maßnahmen ergriffen, um eine Übertragung von Infektionen auf den Patienten zu verhindern. Diese Maßnahmen umfassen
• die sorgfältige Auswahl von Blut- und Plasmaspendern um sicherzustellen, dass diejenigen ausgeschlossen werden, die ein infektiöses Risiko tragen,
• die Testung jeder einzelnen Spende und jedes Plasmapools auf Anzeichen für Viren/Infektionen.
• die Durchführung von Schritten zur Inaktivierung und Entfernung von Viren während der Verarbeitung von Blut oder Plasma.
Trotz dieser Maßnahmen kann die Möglichkeit der Übertragung von Erregern bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln nicht vollständig ausgeschlossen werden. Dies gilt auch für bisher unbekannte oder neu auftretende Viren und andere Arten von Krankheitserregern.
Die getroffenen Maßnahmen werden als wirksam angesehen für umhüllte Viren wie z.B. das humane Immunschächevirus (HIV, das AIDS-Virus), das Hepatitis B- und das Hepatitis C-Virus (Leberentzündung), und für das nicht umhüllte Hepatitis A-Virus (Leberentzündung).
Für andere nicht-umhüllte Viren, wie z. B. Parvovirus B19 (Ringelröteln), können die getroffenen Maßnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen haben für schwangere Frauen (Infektionen des ungeborenen Kindes) und für Personen, deren Immunsystem unterdrückt ist, oder die an bestimmten Formen von Blutarmut leiden (z. B. Sichelzellenerkrankung oder hämolytische Anämie).
Ihr Arzt wird Ihnen empfehlen, eine Impfung gegen Hepatitis A und B in Betracht zu ziehen, falls Sie regelmäßig Präparate aus menschlichem Blut oder Plasma erhalten (z.B. Faktor IX).
Jedes Mal wenn Sie eine Dosis Berinin erhalten, sollte der Name und die Chargennummer des Arzneimittels dokumentiert werden, um die Rückverfolgbarkeit der Chargen zu gewährleisten.
Kinder und Jugendliche
Die aufgeführten Warnhinweise und Vorsichtsmaßnahmen gelten für Erwachsene und Kinder.
Anwendung von Berinin zusammen mit anderen Arzneimitteln
• Informieren Sie Ihren Arzt oder Apotheker wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden.
• Wechselwirkungen von Blutgerinnungsfaktor-IX-Konzentrat vom Menschen mit anderen Arzneimitteln wurden nicht berichtet.
• Das Arzneimittel darf, außer mit den unter Abschnitt 6. aufgeführten Lösungsmitteln, nicht mit anderen Arzneimitteln, Lösungs- oder Verdünnungsmitteln gemischt werden.
Schwangerschaft , Stillzeit und Fortpflanzungsfähigkeit
• Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
• Studien zur Fortpflanzung am Tier wurden mit Faktor IX nicht durchgeführt.
• Aufgrund des seltenen Vorkommens der Hämophilie B bei Frauen liegen keine Erfahrungen über die Anwendung von Faktor IX während der Schwangerschaft und Stillzeit vor.
Daher soll Faktor IX in der Schwangerschaft und Stillzeit nur bei klarer Indikationsstellung angewendet werden.
• Es liegen keine Daten über die Beeinflussung der Zeugungs-/Gebärfähigkeit vor.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Berinin hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Berinin enthält Natrium und Heparin
Berinin enthält bis zu 64 mg Natrium pro 2000 I.E. Dies sollte bei Patienten, die eine salzarme Diät einhalten müssen, berücksichtigt werden.
Berinin enthält Heparin als Hilfsstoff. Heparin kann allergische Reaktionen und eine Senkung der Blutplättchenzahl verursachen und somit die Blutgerinnung beeinflussen. Patienten mit bekannten allergischen Reaktionen auf Heparin sollten die Anwendung von heparinhaltigen Medikamenten vermeiden
3. Wie ist Berinin anzuwenden?
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt an. Fragen Sie bei Ihrem Arzt nach, wenn Sie sich nicht sicher sind.
Die Therapie soll unter der Aufsicht eines in der Hämophilie-Behandlung erfahrenen Arztes erfolgen.
Dosierung
Die benötigte Menge an Faktor IX sowie die Behandlungsdauer hängen von verschiedenen Faktoren ab, wie z.B. Körpergewicht, Schweregrad Ihrer Erkrankung, Ort und Ausmaß der Blutung oder der Notwendigkeit, Blutungen bei Operationen oder Untersuchungen vorzubeugen. Im Falle von Heimtherapie wird Ihr Arzt Sie entsprechend anleiten, wie Sie Berinin anwenden und wie viel Sie sich verabreichen müssen.
Folgen Sie den Anweisungen Ihres Arztes oder Ihrer Krankenschwester des HämophilieZentrums.
Wenn sie eine größere Menge von Berinin angewendet haben, als Sie sollten
Es wurden keine Symptome von Überdosierung mit Blutgerinnungsfaktor IX vom Menschen
berichtet.
Zubereitung und Anwendung
Allgemeine Hinweise:
- In der Regel ist die Lösung klar oder leicht opaleszent, d.h. sie kann leicht schillern, wenn sie gegen das Licht gehalten wird, darf aber keine deutlich sichtbaren Partikel enthalten. Das gelöste Produkt sollte nach der Filtrierung/Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf Partikel und Verfärbungen visuell überprüft werden. Trübe Lösungen oder Lösungen mit Rückständen (Niederschlägen/Partikeln) sind nicht zu verwenden.
- Zubereitung und Entnahme der Lösung müssen unter aseptischen Bedingungen erfolgen.
Zubereitung:
Das Lösungsmittel auf Raumtemperatur erwärmen. Vor dem Öffnen der Mix2Vial Packung die
Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernen und die Stopfen mit einer
antiseptischen Lösung behandeln und anschließend trocknen lassen.
1
3
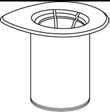
1. Entfernen Sie das Deckpapier von der Mix2Vial Packung. Das Mix2Vial nicht aus der Blisterpackung entnehmen!
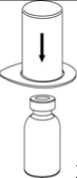
2. Die Lösungsmittelflasche auf eine ebene und saubere Fläche stellen und festhalten. Das Mix2Vial Set mit der Blisterpackung greifen und den Dorn des blauen Adapters senkrecht in den Stopfen der Lösungsmittelflasche einstechen.
3. Vorsichtig die Verpackung vom Mix2Vial Set entfernen, indem man die Blisterpackung am Siegelrand fasst und senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nur die Blisterpackung und nicht das Mix2Vial entfernt wird.
4. Die Produktflasche auf eine feste Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten Mix2Vial Set herumdrehen und den Dorn des transparenten Adapters senkrecht in den Stopfen der Produktflasche einstechen. Das Lösungsmittel läuft
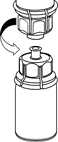
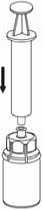
automatisch in die Produktflasche über._
5. Mit der einen Hand die Produktseite und
mit der anderen Hand die Lösungsmittelseite des Mix2Vial greifen und das Set vorsichtig gegen den Uhrzeigersinn auseinander schrauben. Entsorgen Sie die Lösungsmittelflasche mit dem blauen Mix2Vial Adapter._
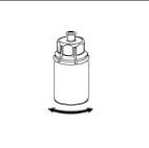
6. Die Produktflasche mit dem transparenten Adapter vorsichtig schwenken, bis das Produkt vollständig gelöst ist. Nicht schütteln!
6__
7. Luft in eine leere, sterile Spritze aufziehen. Die Produktflasche aufrecht halten, die Spritze mit dem Luer Lock Anschluss des Mix2Vial Set verbinden indem man sie im Uhrzeigersinn aufschraubt und die Luft in die Produktflasche injizieren.
7
Aufziehen der Lösung in die Spritze und Anwendung:
|
< |
I |
k |
8. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und die Lösung durch langsames Zurückziehen der Kolbenstange in die Spritze aufziehen. |
|
A |
9 |
9. Nachdem die Lösung vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei die Kolbenstange in ihrer Position halten) und die Spritze vom transparenten Mix2Vial Adapter gegen den Uhrzeigersinn abdrehen. |
Zur Injektion von Berinin werden Kunststoff-Einmalspritzen empfohlen, da geschliffene Oberflächen von Glasspritzen zur Verklebung bei derartigen Lösungen neigen.
Die Lösung soll vor der Anwendung auf Raum- oder Körpertemperatur angewärmt und langsam intravenös mit einer vom Patienten als angenehm empfundenen Geschwindigkeit injiziert oder infundiert werden. Sorgfältig darauf achten, dass kein Blut in die mit Produkt gefüllte Spritze gelangt. Die Injektions- / Infusionsgeschwindigkeit sollte nicht mehr als 2 ml pro Minute betragen.
Beobachten Sie sich auf jegliche sofort eintretende Überempfindlichkeitsreaktion . Wenn eine solche Reaktion erfolgt, die mit der Verabreichung von Berinin in Zusammenhang gebracht werden könnte, müssen Sie die Injektion/Infusion abbrechen (siehe auch Abschnitt 2.).
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Wenden Sie sich sofort an Ihren Arzt, die Notaufnahme oder das Hämophilie-Zentrum in Ihrem nächstgelegenen Krankenhaus, wenn eine der folgenden Reaktionen auftritt:
• Eine plötzliche allergische Reaktion (wie z.B. Hautrötung oder quaddelartiger Nesselausschlag, Jucken, Schwellung im Gesicht, der Lippen, Zunge oder anderer Körperteile,
• Kurzatmigkeit, pfeifendes Atemgeräusch oder Atemprobleme,
• Krampfanfälle,
• Mangelnde Wirksamkeit (anhaltende Blutung).
Andere Nebenwirkungen sind:
• Allergische (Überempfindlichkeit-) Reaktionen wie z.B.:
> Brennen und Stechen an der Injektions-/Infusionsstelle
> Schwellungen des Gesichtes, Halses oder an anderen Stellen des Körpers, Schüttelfrost, Hitzewallung, Hautrötung generalisiert am ganzen Körper, quaddelartiger Hautausschlag
> Kopfschmerzen
> Blutdruckabfall, Unruhe, Herzrasen, Engegefühl in der Brust, pfeifendes Atemgeräusch
> Müdigkeit (Lethargie)
> Übelkeit, Erbrechen
> Prickeln
Diese Nebenwirkungen wurden sehr selten beobachtet. In sehr seltenen Fällen entwickelten sich diese Reaktionen zu schwerwiegenden allergischen Reaktionen (Anaphylaxie) einschließlich Schock (was in einem engen zeitlichen Zusammenhang mit der Entwicklung von Faktor-IX-Hemmkörpern steht).
• In sehr seltenen Fällen wurde Fieber beobachtet.
• Das Auftreten einer speziellen Form von Nierenentzündung (nephrotisches Syndrom) wurde nach der Behandlung von Patienten berichtet, die Faktor-IX-Hemmkörper bilden und eine bekannte Neigung zu allergischen Reaktionen haben.
• Sehr selten besteht ein potentielles Risiko nach Anwendung von Faktor-IX-Produkten einer erhöhten Blutgerinnselbildung die zu einem Herzinfarkt, einem Blutgerinnsel im Bein (venöse Thrombose) oder zu einem Blutgerinnsel in der Lunge (Lungenembolie) führen kann.
• Sehr selten können Sie Hemmkörper (neutralisierende Antikörper) gegen Faktor IX entwickeln, wodurch Faktor IX nicht mehr richtig wirken kann. In solchen Fällen wird empfohlen ein spezialisiertes Hämophilie-Zentrum aufzusuchen.
• Sehr selten, wurde über eine Verminderung der Entwicklung von Blutplättchen durch Heparin (Heparin assoziierte Thrombozytopenie, HAT Typ II) berichtet. Heparin, ein Eiweiß das Blutgerinnsel auflösen kann, ist ein Bestandteil von Berinin. Die schwere Form einer Reduzierung der Blutplättchenzahl kann in Verbindung stehen mit
> einer vermehrten Bildung von Blutgerinnseln in Blutgefäßen
> abnormales Verklumpen des Blutes und daraus resultierende, schwere Blutungen
> in manchen Fällen mit einer Schädigung der Haut an der Injektionsstelle
> flohstichartige Blutungen und
> Teerstuhl oder Darmbewegungen.
Dabei kann die Wirkung des Heparins vermindert sein (Heparintoleranz). In solchen Fällen sollten Sie die Anwendung des Produktes sofort stoppen und Ihren Arzt benachrichtigen. In der Zukunft darf kein heparinhaltiges Produkt mehr angewendet werden.
Informationen zum Infektionsrisiko siehe Abschnitt 2.
Nebenwirkungen bei Kindern und Jugendlichen
Es wird erwartet, dass die Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern denen bei Erwachsenen entspricht.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen, Tel: +49 6103 770, Fax: +49 6103 77 1234, Webseite: www.pei.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dies es Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Berinin aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf Packung und Behältnis angegebenen Verfallsdatum nicht mehr verwenden.
Berinin ist bei +2 °C bis +25 °C aufzubewahren. Nicht einfrieren. Flasche in der geschlossenen Faltschachtel aufbewahren, um den Inhalt vor Licht zu schützen!
Die physiko-chemische Stabilität ist für 16 Stunden bei <25 °C belegt. Aus mikrobiologischer Sicht sollte das gelöste Produkt sofort verbraucht werden. Falls es nicht sofort angewendet wird, soll eine Aufbewahrung 8 Stunden bei Raumtemperatur nicht überschreiten.
6. Inhalt der Packung und weitere Informationen Was Berinin enthält
Berinin enthält nominal 600 I.E. Blutgerinnungsfaktor IX vom Menschen pro Injektionsflasche.
Nach Auflösen der Trockensubstanz mit 5 ml Wasser für Injektionszwecke enthält das Produkt ca. 120 I.E./ml Blutgerinnungsfaktor IX vom Menschen.
Die Aktivität (I.E.) wird mittels Einphasen-Gerinnungstest gemäß Europäischem Arzneibuch bestimmt. Die spezifische Aktivität von Berinin beträgt mindestens 50 I.E. Faktor IX pro mg Gesamtprotein.
Die sonstigen Bestandteile sind:
Aminoessigsäure, Antithrombin III, Calciumchlorid, Heparin, Natriumchlorid, Natriumcitrat, HCl bzw. NaOH (in geringen Mengen zur Einstellung des pH-Wertes).
Lösungsmittel: Wasser für Injektionszwecke 5 ml
Wie Berinin aussieht und Inhalt der Packung
Berinin ist ein weißes Pulver und wird mit einem klaren, farblosen Lösungsmittel (Wasser für Injektionszwecke) zur Herstellung einer Injektions- oder Infusionslösung geliefert.
Packungsgrößen
Eine Packung mit 600 I.E. enthält:
- 1 Vakuumflasche mit Trockensubstanz
- 1 Flasche mit 5 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (5 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 Pflaster
Pharmazeutischer Unternehmer und Hersteller
CSL Behring GmbH
- Emil-von-Behring-Str. 76 35041 Marburg
- Verkauf Deutschland Philipp-Reis-Str.2 65795 Hattersheim
Diese Packungsbeilage wurde zuletzt überarbeitet im September 2015. Zul.-Nr.: Berinin® P 600 6121.01.00
Herkunftsländer des Blutplasmas: Deutschland, Österreich, Polen, Ungarn, USA
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Stoff- oder Indikationsgruppe
Mittel zur Blutstillung (Antihämorrhagika)/Blutgerinnungsfaktor IX ATC code: B02B D04
Dosierung und Art der Anwendung Kontrolle der Behandlung
Während der Behandlung sollten die Faktor-IX-Spiegel entsprechend bestimmt werden, um die zu verabreichende Dosies und die Häufigkeit wiederholter Infusionen zu steuern. Einzelne Patienten können in ihrem Ansprechen auf Faktor IX variieren, wobei unterschiedliche Halbwertszeiten gemessen und unterschiedliche Werte in der Recovery erreicht werden. Dosierungen auf Grund des Körpergewichtes benötigen eventuell eine Anpassung bei unter- oder übergewichtigen Patienten. Vor allem bei größeren chirurgischen Eingriffen ist eine genaue gerinnungsanalytische Überwachung (Faktor-IX-Aktivität im Plasma) der Substitutionstherapie unerlässlich.
Dosierung
Die Menge des verabreichten Blutgerinnungsfaktors IX wird in Internationalen Einheiten (I.E.) angegeben, die dem gegenwärtigen WHO-Standard für Faktor-IX-Produkte entsprechen. Die Faktor-IX-Aktivität im Plasma wird entweder als Prozentsatz (in Bezug zu normalem Humanplasma) oder in Internationalen Einheiten (in Bezug zu einem internationalen Standard für Faktor IX im Plasma) angegeben.
Eine Internationale Einheit (I.E.) Faktor-IX-Aktivität entspricht dem Faktor-IX-Gehalt von 1 ml normalem Humanplasma.
Bedarfsbehandlung
Die Berechnung der benötigten Dosis von Faktor IX basiert auf dem empirischen Ergebnis, dass 1 I.E. Faktor IX pro kg Körpergewicht (KG) die Faktor-IX-Aktivität im Plasma um 1,0 % der normalen Aktivität anhebt. Die benötigte Dosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] x gewünschter Faktor-IX-Anstieg [% oder I.E./dl]
X 1,0.
Dosierung, Art und Dauer der Anwendung sollen sich stets an der klinischen Wirksamkeit im Einzelfall orientieren
Bei den folgenden Blutungsereignissen soll die Faktor-IX-Aktivität im Plasma (in % der Norm oder I.E./dl) im entsprechenden Zeitraum nicht unterschritten werden. Die folgende Tabelle dient als Empfehlung für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
|
Schweregrad der Blutung/Art des chirurgischen Eingriffs |
Benötigter Faktor-IXSpiegel (% oder I.E./dl) |
Häufigkeit der Dosen (Stunden)/Dauer der Behandlung (Tage) |
|
Blutung | ||
|
Beginnende Hämarthrosen, Muskelblutungen oder Blutungen in der Mundhöhle |
20 - 40 |
Wiederholung alle 24 Stunden. Mind. 1 Tag, bis Beendigung des Blutungsereignisses (durch Schmerz angezeigt) oder bis Abschluß der Wundheilung. |
|
Ausgedehntere Hämarthrosen, Muskelblutungen oder Hämatome |
30 - 60 |
Wiederholung alle 24 Stunden für 3 - 4 Tage oder länger, bis zur Beseitigung des Schmerzzustandes und der akuten Bewegungseinschränkung |
|
Lebensbedrohliche Blutungen |
60 - 100 |
Wiederholung alle 8 bis 24 Stunden bis zur Aufhebung des lebensbedrohlichen Zustandes. |
|
Chirurgische Eingriffe | ||
|
Kleinere Eingriffe einschließlich Zahnextraktion |
30 - 60 |
Alle 24 Stunden, mind. 1 Tag bis Abschluß der Wundheilung. |
|
Größere Eingriffe |
80 - 100 (prä- und postoperativ) |
Wiederholung alle 8 bis 24 Stunden bis zum adäquaten Abschluß der Wundheilung, dann Behandlung für mind. weitere 7 Tage zur Erhaltung einer Faktor-IX-Aktivität bei 30 bis 60 % (I.E./dl). |
Prophylaxe
Bei der Langzeitprophylaxe von Blutungen bei schwerer Hämophilie B betragen die üblichen Dosen 20 bis 40 I.E. Faktor IX/kg KG in Intervallen von 3 bis 4 Tagen. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen notwendig sein.
Die Patienten sollen bezüglich einer Entwicklung von Antikörpern gegen Faktor IX (Hemmkörper) überwacht werden.
Siehe auch Abschnitt 2.
Kinder und Jugendliche
Es liegen keine Daten aus klinischen Studien zur Dosierung von Berinin bei Kindern vor.