Berinin P 600
CSL Behring
Berinin® P
1. BEZEICHNUNG DES ARZNEIMITTELS
Berinin® P 600/1200, 600 I.E./1200 I.E.
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Flasche enthält nominal:
600/1200 I.E. Blutgerinnungsfaktor IX (FIX) vom Menschen.
Berinin 600/1200 enthält ca. 120 I.E./ml Faktor IX nach Rekonstitution mit 5/10 ml Wasser für Injektionszwecke.
Die Aktivität (I.E.) wird mittels Einphasen-Gerinnungstest gemäß Europäischem Arzneibuch bestimmt. Die spezifische Aktivität von Berinin beträgt mindestens 50 I.E. Faktor IX pro mg Gesamtprotein.
Hergestellt aus Plasma humaner Spender.
Sonstige Bestandteile mit bekannter Wirkung:
Natrium etwa 167 mmol/l (3,84 mg/ml).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung.
Weißes Pulver und klares, farbloses Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Therapie und Prophylaxe von Blutungen bei Patienten mit Hämophilie B (kongenitaler Faktor-IX-Mangel).
4.2 Dosierung und Art der Anwendung
Die Therapie soll unter der Aufsicht eines in der Hämophilie-Behandlung erfahrenen Arztes erfolgen.
Kontrolle der Behandlung
Während der Behandlung sollten die Faktor-IX-Spiegel entsprechend bestimmt werden, um die zu verabreichende Dosis und die Häufigkeit wiederholter Infusionen zu steuern.
Einzelne Patienten können in ihrem Ansprechen auf Faktor IX variieren, wobei unterschiedliche Halbwertszeiten gemessen und unterschiedliche Werte in der Recovery erreicht werden. Dosierungen aufgrund des Körpergewichtes benötigen eventuell eine Anpassung bei unter- oder übergewichtigen Patienten. Vor allem bei größeren chirurgischen Eingriffen ist eine genaue gerinnungsanalytische Überwachung (Faktor-IX-Aktivität im Plasma) der Substitutionstherapie unerlässlich.
Dosierung
Dosierung und Dauer der Substitutionstherapie richten sich nach dem Schweregrad des Faktor-IX-Mangels, nach Ort und Ausmaß der Blutung und nach dem klinischen Zustand des Patienten.
Die Menge des verabreichten Blutgerinnungsfaktors IX wird in Internationalen Einheiten (I.E.) angegeben, die dem gegenwärtigen WHO-Standard für Faktor-IX-Produkte entsprechen. Die Faktor-IX-Aktivität im Plasma wird entweder als Prozentsatz (in Bezug zu normalem Humanplasma) oder in Internationalen Einheiten (in Bezug zu einem internationalen Standard für Faktor IX im Plasma) angegeben.
Eine Internationale Einheit (I.E.) Faktor-IX-Aktivität entspricht dem Faktor-IX-Gehalt von 1 ml normalem Humanplasma.
Bedarfsbehandlung
Die Berechnung der benötigten Dosis von Faktor IX basiert auf dem empirischen Ergebnis, dass 1 I.E. Faktor IX pro kg Körpergewicht (KG) die Faktor-IX-Aktivität im Plasma um 1,0 % der normalen Aktivität anhebt. Die benötigte Dosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] x gewünschter Faktor-IX-Anstieg [% oder I.E./dl] x 1,0.
Dosierung, Art und Dauer der Anwendung sollen sich stets an der klinischen Wirksamkeit im Einzelfall orientieren.
Bei den folgenden Blutungsereignissen soll die Faktor-IX-Aktivität im Plasma (in % der Norm oder I.E./dl) im entsprechenden Zeitraum nicht unterschritten werden. Die folgende Tabelle dient als Empfehlung für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
|
Schweregrad der Blutung/Art des chirurgischen Eingriffs |
Benötigter Faktor-IXSpiegel (% oder I.E./dl) |
Häufigkeit der Dosen (Stunden)/Dauer der Behandlung (Tage) |
|
Blutung | ||
|
Beginnende Hämarthrosen, Muskelblutungen oder Blutungen in der Mundhöhle |
20 - 40 |
Wiederholung alle 24 Stunden. Mind. 1 Tag, bis Beendigung des Blutungsereignisses (durch Schmerz angezeigt) oder bis Abschluss der Wundheilung. |
|
Ausgedehntere Hämarthrosen, Muskelblutungen oder Hämatome |
30 - 60 |
Wiederholung alle 24 Stunden für 3 - 4 Tage oder länger, bis zur Beseitigung des Schmerzzustandes und der akuten Bewegungseinschränkung |
|
Lebensbedrohliche Blutungen |
60 - 100 |
Wiederholung alle 8 bis 24 Stunden bis zur Aufhebung des lebensbedrohlichen Zustandes. |
|
Chirurgische Eingriffe | ||
|
Kleinere Eingriffe einschließlich Zahnextraktion |
30 - 60 |
Alle 24 Stunden, mind. 1 Tag bis Abschluss der Wundheilung. |
|
Größere Eingriffe |
80 - 100 (prä- und postoperativ) |
Wiederholung alle 8 bis 24 Stunden bis zum adäquaten Abschluss der Wundheilung, dann Behandlung für mind. weitere 7 Tage zur Erhaltung einer Faktor-IX-Aktivität bei 30 bis 60 % (I.E./dl). |
Prophylaxe
Bei der Langzeitprophylaxe von Blutungen bei schwerer Hämophilie B betragen die üblichen Dosen 20 bis 40 I.E. Faktor IX/kg KG in Intervallen von 3 bis 4 Tagen. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen notwendig sein.
Die Patienten sollen bezüglich einer Entwicklung von Antikörpern gegen Faktor IX (Hemmkörper) überwacht werden.
Siehe auch Abschnitt 4.4.
Kinder und Jugendliche
Es liegen keine Daten aus klinischen Studien zur Dosierung von Berinin bei Kindern vor.
Art der Anwendung
Zur intravenösen Anwendung.
Das Pulver wird wie unter Abschnitt 6.6 beschrieben aufgelöst.
Die rekonstituierte Lösung soll vor der Anwendung auf Raum- oder Körpertemperatur angewärmt und langsam intravenös mit einer vom Patienten als angenehm empfundenen Geschwindigkeit injiziert oder infundiert werden. Sorgfältig darauf achten, dass kein Blut in die mit Produkt gefüllte Spritze gelangt. Die Injektions- / Infusionsgeschwindigkeit sollte nicht mehr als 2 ml pro Minute betragen.
Der Patient ist auf jegliche Sofortreaktionen zu beobachten. Wenn eine solche Reaktion erfolgt, die mit der Verabreichung von Berinin in Zusammenhang gebracht werden könnte, soll - in Abhängigkeit vom klinischen Zustand des Patienten - die Infusionsgeschwindigkeit gesenkt bzw. die Infusion abgebrochen werden (s. auch Abschnitt 4.4).
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Überempfindlichkeit
Allergieartige Überempfindlichkeitsreaktionen sind bei der Anwendung von Berinin möglich. Falls Symptome einer Überempfindlichkeit auftreten, sollte den Patienten geraten werden die Anwendung des Arzneimittels sofort zu unterbrechen und ihren Arzt aufzusuchen. Die Patienten sollen über Frühzeichen von Überempfindlichkeitsreaktionen informiert werden, wie quaddelartiger Hautausschlag, generalisierte Nesselsucht, Angina pectoris, Stridor, Hypotension und Anaphylaxie.
Bei einem Schock sollen die aktuellen medizinischen Richtlinien zur Schockbehandlung beachtet werden.
Eine Dosis von 2000 I.E. Berinin enthält bis zu 64 mg Natrium. Dies sollte bei Patienten, die eine salzarme Diät einhalten müssen, berücksichtigt werden.
Berinin enthält Heparin als Hilfsstoff. Heparin kann allergische Reaktionen und eine Senkung der Blutplättchenzahl verursachen und somit die Blutgerinnung beeinflussen. Patienten mit bekannten allergischen Reaktionen auf Heparin sollten die Anwendung von heparinhaltigen Medikamenten vermeiden.
Inhibitoren
Nach wiederholter Behandlung mit Blutgerinnungsfaktor-IX-Produkten vom Menschen sollen die Patienten auf Entwicklung von neutralisierenden Antikörpern (Hemmkörper) durch Bestimmung in Bethesda-Einheiten (BU) mittels geeigneter biologischer Tests überwacht werden.
In der Literatur finden sich Berichte über eine Korrelation zwischen dem Auftreten eines Faktor-IX-Hemmkörpers und allergischen Reaktionen. Daher sollen Patienten mit allergischen Reaktionen auf das Vorhandensein eines Hemmkörpers getestet werden. Es sollte beachtet werden, dass bei Patienten mit Faktor-IX-Hemmkörpern ein höheres Risiko anaphylaktischer Reaktionen mit einem daraus entstehenden hohen Faktor-IX-Verbrauch besteht.
Wegen des Risikos allergischer Reaktionen durch Faktor-IX-Konzentrate sollen die initialen Anwendungen von Faktor IX dort unter ärztlicher Beobachtung durchgeführt werden, wo eine geeignete medizinische Versorgung der allergischen Reaktionen sichergestellt werden kann.
Thromboembolie
Wegen der potentiellen Gefahr thrombotischer Komplikationen soll eine klinische Überwachung auf Frühzeichen thrombotischer Koagulopathie bzw.
Verbrauchskoagulopathie mittels geeigneter biologischer Tests erfolgen. Dies gilt vor allem bei der Gabe des Präparates in den folgenden Situationen: Patienten mit Lebererkrankungen, nach Operationen, bei Neugeborenen oder bei Patienten mit Risiko thrombotischer Ereignisse oder Verbrauchskoagulopathie. In jedem dieser Fälle soll der Nutzen einer Therapie mit Berinin gegen das Risiko dieser Komplikationen abgewogen werden.
Kardiovaskuläre Ereignisse
Bei Patienten mit vorhandenen kardiovaskulären Risikofaktoren, kann eine Substitutionstherapie mit Faktor IX das kardiovaskuläre Risiko erhöhen.
Katheter-assoziierte Komplikationen
Wenn ein zentraler Venenkatheter (ZVK) erforderlich ist, sollte das Risiko von ZVK-assoziierten Komplikationen einschließlich lokaler Infektionen, Bakteriämie und Thrombosen an der Stelle des Katheters berücksichtigt werden.
Virussicherheit
Standardmethoden zur Vermeidung von Infektionskrankheiten, die im Rahmen der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln auftreten können, umfassen die Auswahl der Spender, die Prüfung jeder einzelnen Spende und jedes Plasmapools auf spezifische Marker für Infektionen sowie die Einbeziehung effektiver Herstellungsschritte zur Inaktivierung/Eliminierung von Viren. Trotz dieser Maßnahmen kann die Möglichkeit der Übertragung von Erregern bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln nicht vollständig ausgeschlossen werden. Dies gilt auch für bisher unbekannte Viren und andere Pathogene.
Die getroffenen Maßnahmen werden als wirksam angesehen für umhüllte Viren, wie z.B. das humane Immundefizienzvirus (HIV), das Hepatitis-B Virus (HBV) und das Hepatitis-C Virus (HCV) und für das nicht-umhüllte Hepatitis-A Virus (HAV).
Für andere nicht-umhüllte Viren, wie z.B. Parvovirus B19, können die getroffenen Maßnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen für schwangere Frauen (fetale Infektion) und für Personen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) haben.
Für Patienten, die regelmäßig Präparate aus menschlichem Blut oder Plasma einschließlich Faktor IX Präparate erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und Hepatitis B empfohlen.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Kinder und Jugendliche
Die aufgeführten Warnhinweise und Vorsichtsmaßnahmen gelten für Erwachsene und für Kinder.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungen von Blutgerinnungsfaktor-IX-Produkten vom Menschen mit anderen Arzneimitteln wurden nicht berichtet.
4.6 Fertilität, Schwangerschaft und Stillzeit
Reproduktionsstudien am Tier wurden mit Faktor IX nicht durchgeführt.
Schwangerschaft und Stillzeit
Aufgrund des seltenen Vorkommens der Hämophilie B bei Frauen liegen keine Erfahrungen über die Anwendung von Faktor IX während der Schwangerschaft und Stillzeit vor.
Daher soll Faktor IX in der Schwangerschaft und Stillzeit nur bei klarer Indikationsstellung angewendet werden.
Fertilität
Es liegen keine Daten zur Fertilität vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Berinin hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Die folgenden Nebenwirkungen beruhen auf Analysen von postmarketing Daten sowie der wissenschaftlichen Literatur.
Zusammenfassung des Sicherheitsprofils
Überempfindlichkeitsreaktionen oder allergische Reaktionen (die auch Angioödem,
Brennen und Stechen an der Injektions-/Infusionsstelle, Schüttelfrost, Hautrötung mit Hitzegefühl, generalisierte Nesselsucht, Kopfschmerzen, quaddelartiger Hautausschlag, Hypotension, Lethargie, Übelkeit, Unruhe, Tachykardie, Angina pectoris, Zittern, Erbrechen oder Stridor mit einschließen können) wurden in sehr seltenen Fällen beobachtet. In sehr seltenen Fällen entwickelten sich diese Reaktionen zu schwerer Anaphylaxie (bis hin zum Schock), und diese sind in engem zeitlichen Zusammenhang mit der Entwicklung von Faktor-IX-Hemmkörpern aufgetreten (siehe auch Abschnitt 4.4). Das Auftreten eines nephrotischen Syndroms nach versuchter Induktion einer Immuntoleranz bei Hämophilie-B-Patienten mit Faktor-IX-Hemmkörpern und bekannter allergischer Reaktion wurde berichtet.
Patienten mit Hämophilie B können in sehr seltenen Fällen neutralisierende Antikörper (Hemmkörper) gegen Faktor IX entwickeln. Wenn solche Hemmkörper auftreten, manifestiert sich der Zustand als unzureichende klinische Antwort. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophilie-Zentrum aufzusuchen.
Es besteht ein potentielles Risiko thromboembolischer Ereignisse nach Anwendung von Faktor-IX-Produkten, mit einem höheren Risiko bei wenig reinen Präparaten. Die Anwendung von wenig reinen Faktor-IX-Produkten wurde mit dem Vorkommen von Myokardinfarkt, Verbrauchskoagulopathie, venöser Thrombose und Lungenembolie in Verbindung gebracht. Die Anwendung von hochreinem Faktor IX ist selten mit solchen Nebenwirkungen verbunden.
Informationen zur Virussicherheit siehe Abschnitt 4.4.
Tabellarische Aufstellung der Nebenwirkungen
Die unten aufgeführte Tabelle entspricht der MedDRA Systemorganklassifikation.
Die Häufigkeiten wurden entsprechend der nachfolgenden Konventionen berechnet: sehr häufig (> 1/10); häufig (> 1/100 und < 1/10); gelegentlich (> 1/1000 und < 1/100); selten (> 1/10000 und < 1/1000); sehr selten (< 1/10000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
MedDRA Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Erkrankungen der Nieren-und Harnwege |
Nephrotisches Syndrom |
Nicht bekannt |
|
Gefäßerkrankungen |
Thromboembolisches Ereignis |
Nicht bekannt |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Fieber |
Nicht bekannt |
|
Erkrankungen des Immunsystems |
Überempfindlichkeit (allergische Reaktionen) |
Nicht bekannt |
|
Erkrankungen des Blutes und des Lymphsystems |
FIX Hemmkörper Thrombozytopenie |
Nicht bekannt |
Beschreibung ausgewählter Nebenwirkungen
Sehr selten werden Heparin-Antikörper-vermittelte schwere Thrombozytopenien (HAT Typ II) mit Thrombozytenwerten deutlich unter 100.000/gl oder einem schnellen Abfall auf weniger als 50 % des Ausgangswertes beobachtet. Bei nicht Sensibilisierten beginnt der Thrombozytenabfall in der Regel 6-14 Tage nach Behandlungsbeginn, bei Sensibilisierten unter Umständen innerhalb von Stunden.
Die schwere Form der Thrombozytopenie kann verbunden sein mit arteriellen und venösen Thrombosen/Thrombembolien, Verbrauchskoagulopathie, evtl. Hautnekrosen an der Injektionsstelle, Petechien, Purpura und Meläna. Dabei kann die blutgerinnungshemmende Wirkung des Heparins vermindert sein (Heparintoleranz). In solchen Fällen ist Berinin sofort abzusetzen. Der Patient muss darüber informiert werden, dass bei ihm auch in Zukunft keine heparinhaltigen Arzneimittel mehr angewendet werden dürfen.
Kinder und Jugendliche
Es wird erwartet, dass die Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern denen bei Erwachsenen entspricht.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen, Tel: +49 6103 770, Fax: +49 6103 77 1234, Webseite: www.pei.de anzuzeigen.
4.9 Überdosierung
Es wurden keine Symptome von Überdosierung mit Blutgerinnungsfaktor IX vom Menschen berichtet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe Antihämorrhagika: Blutgerinnungsfaktor IX.
ATC-Code: B02B D04
Faktor IX ist ein einkettiges Glykoprotein mit einem Molekulargewicht von etwa 68.000 Dalton. Er ist ein Vitamin-K-abhängiger Gerinnungsfaktor, der in der Leber gebildet wird. Faktor IX wird durch Faktor XIa im endogenen Gerinnungssystem, und durch Faktor VII/Gewebefaktorkomplex im exogenen Gerinnungssystem aktiviert.
Aktivierter Faktor IX aktiviert seinerseits im Zusammenwirken mit aktiviertem Faktor VIII den Faktor X. Aktivierter Faktor X wandelt Prothrombin in Thrombin um. Thrombin wandelt dann Fibrinogen in Fibrin um, und ein Gerinnsel kann gebildet werden.
Hämophilie B ist eine geschlechtsspezifische erbliche Blutgerinnungsstörung aufgrund niedriger Faktor-IX-Spiegel und mündet in schwere Blutungen in Gelenke, Muskeln oder innere Organe, entweder spontan oder als Folge akzidenteller oder chirurgischer Traumen. Durch Substitutionstherapie werden die Faktor-IX-Plasmaspiegel angehoben, wobei eine vorübergehende Korrektur des Faktor-IX-Mangels und Behebung der Blutungsneigungen herbeigeführt wird.
5.2 Pharmakokinetische Eigenschaften
In einer Pharmakokinetik Studie mit 14 Patienten betrug die mediane Halbwertszeit 23 Stunden (10 - 43 Stunden), die mediane IVR 1,1 (IU/dl)/(IU/kg) (0,57 - 1,69 (IU/dl)/(IU/kg). Die mediane MRT betrug 27 Stunden (18 - 40 Stunden) und die mediane clearance wurde mit 4,5 ml/h/kg (2,5 - 12,5 ml/h/kg) berechnet.
Kinder und Jugendliche
Es liegen keine pharmakokinetische Daten vor.
5.3 Präklinische Daten zur Sicherheit
Der in Berinin enthaltene arzneilich wirksame Bestandteil FIX wird aus humanem Plasma gewonnen und verhält sich wie die körpereigenen Plasmabestandteile. Die einmalige Verabreichung von Berinin an verschiedenen Tierspezies gab keine Hinweise auf toxische Auswirkungen auf die Labortiere. Präklinische Studien mit wiederholten Dosisgaben (chronische Toxizität, Kanzerogenität, Reproduktionstoxizität) können in herkömmlichen Tiermodellen nicht sinnvoll durchgeführt werden, da aufgrund der Verabreichung heterologer humaner Proteine Antikörper gebildet werden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Aminoessigsäure, Antithrombin III, Calciumchlorid, Heparin, Natriumchlorid,
Natriumcitrat, HCl bzw. NaOH (in geringen Mengen zur Einstellung des pH-Wertes).
Beigefügtes Lösungsmittel:
Wasser für Injektionszwecke 5/10 ml
6.2 Inkompatibilitäten
Das Arzneimittel darf, außer mit den unter Abschnitt 6.1 aufgeführten Lösungsmitteln, nicht mit anderen Arzneimitteln, Lösungs- oder Verdünnungsmitteln gemischt werden.
6.3 Dauer der Haltbarkeit
3 Jahre.
Die physiko-chemische Stabilität wurde für 16 Stunden bei < 25 °C belegt. Aus mikrobiologischer Sicht sollte das gelöste Produkt sofort verbraucht werden. Falls es nicht sofort angewendet wird, soll eine Aufbewahrung 8 Stunden bei Raumtemperatur nicht überschreiten.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Berinin ist bei +2 °C bis +25 °C aufzubewahren. Nicht einfrieren. In der geschlossenen Faltschachtel aufbewahren.
6.5 Art und Inhalt des Behältnisses Primärbehältnisse
Substanzflaschen:
Berinin 600:
10 ml Injektionsflasche, farblos, Glastyp I Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
Berinin 1200:
17 ml Injektionsflasche, farblos, Glastyp II Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
Lösungsmittelflaschen (für Wasser für Injektionszwecke):
5 ml Wasser für Injektionszwecke für Berinin 600:
6 ml Injektionsflasche, farblos, Glastyp I Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
10 ml Wasser für Injektionszwecke für Berinin 1200:
10 ml Injektionsflasche, farblos, Glastyp I Ph. Eur., latexfreier Kautschukstopfen, Aluminium-Polypropylen-Kombinationsbördelkappe
Packungsgrößen
Berinin 600:
Eine Packung mit 600 I.E. enthält:
- 1 Vakuumflasche mit Trockensubstanz
- 1 Flasche mit 5 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (5 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 Pflaster
Berinin 1200:
Eine Packung mit 1200 I.E. enthält:
- 1 Vakuumflasche mit Trockensubstanz
- 1 Flasche mit 10 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (10 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 Pflaster
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Allgemeine Hinweise
- In der Regel ist die Lösung klar oder leicht opaleszent. Rekonstituiertes Produkt sollte nach der Filtrierung/Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf Partikel und Verfärbungen visuell überprüft werden. Trübe Lösungen oder Lösungen mit Rückständen (Niederschlägen/Partikeln) sind nicht zu verwenden. Zubereitung und Verabreichung müssen unter aseptischen Bedingungen erfolgen.
Zubereitung:
Erwärmen Sie das Lösungsmittel auf Raumtemperatur. Vor dem Öffnen der Mix2Vial Packung die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernen und die Stopfen mit einer antiseptischen Lösung behandeln und anschließend trocknen lassen.
1

1. Entfernen Sie das Deckpapier von der Mix2Vial Packung. Das Mix2Vial nicht aus der Blisterpackung entnehmen!
2. Die Lösungsmittelflasche auf eine ebene, saubere Fläche stellen und festhalten. Das Mix2Vial Set mit der Blisterpackung greifen und den Dorn des blauen Adapters senkrecht in den Stopfen der Lösungsmittelflasche einstechen.
3. Vorsichtig die Verpackung vom Mix2Vial Set entfernen, indem man die Blisterpackung am Siegelrand fasst und senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nur die Blisterpackung und nicht das Mix2Vial entfernt wird.

5
4. Die Produktflasche auf eine feste Unterlage
stellen. Die Lösungsmittelflasche mit dem aufgesetzten Mix2Vial Set herumdrehen und den Dorn des transparenten Adapters senkrecht in den Stopfen der Produktflasche einstechen. Das Lösungsmittel läuft automatisch in die Produktflasche über._
5. Mit der einen Hand die Produktseite und
mit der anderen Hand die Lösungsmittelseite des Mix2Vial greifen und das Set vorsichtig gegen den Uhrzeigersinn auseinander schrauben. Entsorgen Sie die Lösungsmittelflasche mit dem blauen Mix2Vial Adapter._
6. Die Produktflasche mit dem transparenten Adapter vorsichtig schwenken, bis das Produkt vollständig gelöst ist. Nicht schütteln.

6__
7. Luft in eine leere, sterile Spritze aufziehen. Die Produktflasche aufrecht halten, die Spritze mit dem Luer Lock Anschluss des Mix2Vial Set verbinden indem man sie im Uhrzeigersinn aufschraubt und die Luft in die Produktflasche injizieren.
7
Aufziehen der Lösung in die Spritze und Anwendung:
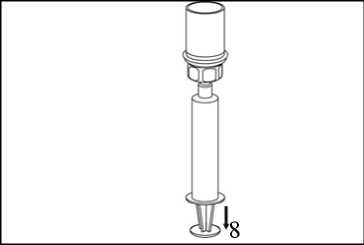
8. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und die Lösung durch langsames Zurückziehen der Kolbenstange in die Spritze aufziehen.
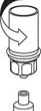

9
9. Nachdem die Lösung vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei die Kolbenstange in ihrer Position halten) und die Spritze vom transparenten Mix2Vial Adapter gegen den Uhrzeigersinn abdrehen.
Zur Injektion von Berinin werden Kunststoff-Einmalspritzen empfohlen, da geschliffene Oberflächen von Glasspritzen zur Verklebung bei derartigen Lösungen neigen.
Die Lösung langsam intravenös verabreichen (siehe Abschnitt 4.2). Sorgfältig darauf achten, dass kein Blut in die mit Produkt gefüllte Spritze gelangt.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
CSL Behring GmbH - Emil-von-Behring-Str. 76 35041 Marburg Verkauf Deutschland Philipp-Reis-Str. 2 65795 Hattersheim Tel.: (069) 305 - 8 44 37 Fax: (069) 305 - 1 71 29
8. ZULASSUNGSNUMMERN
Berinin® P 600 Zul.-Nr. 6121.01.00
Berinin® P 1200 Zul.-Nr. 6121.02.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Erstzulassung: 10. August 1993
Letzte Verlängerung der Zulassung: 16. Mai 2005
10. STAND DER INFORMATION
Oktober 2015
11. HERKUNFTSLÄNDER DES BLUTPLASMAS
Deutschland, Österreich, Polen, Ungarn, USA
12. VERSCHREIBUNGSSTATUS
Verschreibungspflichtig