Doxazosin Mylan 2Mg
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Doxazosin Mylan 2 mg
Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette Doxazosin Mylan 2 mg enthält: 2,43 mg Doxazosinmesilat, entsprechend 2 mg Doxazosin.
Sonstiger Bestandteil mit bekannter Wirkung: Lactose Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. DARREICHUNGSFORM
Tabletten
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Essentielle Hypertonie.
4.2 Dosierung und Art der Anwendung
Dosierung
Hypertonie
Zu Beginn der Behandlung wird 1 mg Doxazosin 1-mal täglich eingenommen. In Abhängigkeit von der Wirksamkeit kann die Dosis individuell bei Bedarf jeweils nach 1 bis 2 Wochen auf 2 mg Doxazosin 1-mal täglich, dann auf 4 mg Doxazosin 1-mal täglich und schließlich auf 8 mg Doxazosin 1-mal täglich gesteigert werden.
Ältere Patienten
Da die pharmakokinetischen Eigenschaften von Doxazosin bei älteren Patienten unverändert sind, wird im Allgemeinen die Anwendung der normalen Dosierungen empfohlen.
Patienten mit. Niereninsi.iffizienz
Da es bei Patienten mit Niereninsuffizienz keinen Hinweis darauf gibt, dass Doxazosin eine bestehende Niereninsuffizienz verschlimmert, wird allgemein die Anwendung der normalen Dosierungen empfohlen. Die Dosis sollte jedoch so niedrig wie möglich gehalten werden und eine Dosissteigerung nur unter genauer Beobachtung vorgenommen werden. Doxazosin unterliegt einer starken Proteinbindung. Daher kann es durch Dialyse nicht eliminiert werden.
Patienten mit Leberinsuffizienz
Bei Patienten mit eingeschränkter Leberfunktion sollte Doxazosin besonders vorsichtig dosiert werden.
Bei Patienten mit schwerwiegender Leberfunktionsstörung liegen keine klinischen
Erfahrungen vor (siehe Abschnitt 4.4).
Kinder und Jugendliche:
Die Sicherheit und Wirksamkeit von Doxazosinmesilat bei Kindern und Jugendlichen unter 18 Jahren sind nicht erwiesen.
Art der Anwendung Zum Einnehmen.
Die Einnahme von Doxazosin Mylan kann unabhängig von den Mahlzeiten mit ausreichend Flüssigkeit (z.B. 1 Glas Wasser) erfolgen.
4.3 Gegenanzeigen
Doxazosin Mylan darf nicht eingenommen werden bei:
- Überempfindlichkeit gegen den Wirkstoff und andere Chinazolinen (z.B. Prazosin, Terazosin) oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Stillzeit (Abstillen!).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Nach Therapiebeginn oder bei Dosiserhöhung kann es zu orthostatischer Dysregulation oder Synkope kommen. Deshalb müssen die Patienten zu Beginn der Therapie sorgfältig beobachtet werden. Da die Wahrscheinlichkeit einer solchen Nebenwirkung bei Verabreichung einer höheren als der empfohlenen Anfangsdosis größer ist, sollte die Dosierungsanleitung sorgfältig befolgt werden.
Besondere Vorsicht ist angebracht bei Patienten mit Hypotonie oder anamnestisch bekannter orthostatischer Dysregulation.
Bei Patienten mit schwerer koronarer Herzkrankheit kann ein zu rascher oder zu starker Blutdruckabfall zu einer Verschlechterung der Angina pectoris-Beschwerden führen.
Bei Patienten, die eine salzarme Diät einhalten oder die mit Diuretika behandelt werden, ist das Risiko von Kreislaufstörungen insbesondere bei Lagewechsel erhöht.
Doxazosin sollte nicht angewendet werden bei Patienten mit:
- benigner Prostathyperplasie, die gleichzeitig eine Stauung der oberen Harnwege,
einen chronischen Harnwegsinfekt oder Blasensteine aufweisen
- einer Überlaufblase, Anurie oder fortgeschrittenem Nierenversagen
Doxazosin sollte aufgrund der vasodilatatorischen Wirkung bei folgenden kardialen Notfallsituationen vorsichtig eingesetzt werden:
- Lungenödem durch Aorten- oder Mitralklappenstenose
- High-Output-Herzinsuffizienz
- Rechtsherzinsuffizienz durch Lungenembolie oder Pericarderguss
- Linksherzinsuffizienz mit niedrigem Füllungsdruck.
Die gleichzeitige Anwendung von Phosphodiesterase-5-Inhibitoren (z.B. Sildenafil, Tadalafil, und Vardenafil) und Doxazosin kann zu einer symptomatischen Hypotonie führen, da beide Arzneimittel gefäßerweiternd wirken. Um das Risiko einer orthostatischen Hypotonie zu verringern, wird empfohlen eine Begleitbehandlung mit Phosphodiesterase-5-Inhibitoren nur dann zu beginnen, wenn der Patient hämodynamisch stabil auf die Alpha-Blocker-Therapie eingestellt ist. Weiterhin wird empfohlen, mit der niedrigsten Dosis des Phosphodiesterase-5-Inhibitors zu beginnen und diesen in einem zeitlichen Abstand zur Gabe des Alpha-Blockers (mindestens 6 Stunden) einzunehmen.
Priapismus
Bei Alpha-1-Blockem, wie z. B. Doxazosin, wurde im Rahmen der Erfahrungen nach Markteinführung über Dauererektionen und Priapismus berichtet. Wenn ein Priapismus nicht umgehend behandelt wird, kann es zu einer Schädigung des Penisgewebes und dauerhaftem Potenzverlust kommen. Aus diesem Grund sollten betroffene Patienten umgehend ärztliche Hilfe in Anspruch nehmen.
Bei einigen Patienten, die gleichzeitig oder bis kurz vorher mit Tamsulosin behandelt wurden, trat während Katarakt-Operationen das sog. „Intraoperative Floppy Iris Syndrome“ (IFIS, eine Variante des Syndroms der engen Pupille) auf. Da auch bei Anwendung anderer Alpha-Blocker vereinzelt das Auftreten einer IFIS gemeldet wurde, kann ein Gruppeneffekt nicht ausgeschlossen werden. IFIS kann zu Komplikationen während der Operation führen. Deshalb sollten Kataraktchirurgen und Augenärzte vor einer Kataraktoperation darüber informiert werden, ob die Patienten aktuell AlphaBlocker anwenden oder diese früher erhielten.
Patienten mit Leberinsuffizienz
Doxazosin sollte bei Patienten mit eingeschränkter Leberfunktion besonders vorsichtig eingesetzt werden. Da keine klinischen Erfahrungen bei Patienten mit schwerwiegender Leberfunktionsstörung vorliegen, wird die Anwendung bei diesen Patienten nicht empfohlen.
Kinder und Jugendliche
Mangels ausreichender klinischer Erfahrungen bei Kindern wird die Anwendung von Doxazosin bei Kindern nicht empfohlen.
Doxazosin Mylan enthält Lactose.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Doxazosin Mylan nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen können bei gleichzeitiger Anwendung von Doxazosin Mylan und den nachfolgend genannten Arzneimitteln bzw. Substanzen auftreten:
Die blutdrucksenkende Wirkung von Doxazosin Mylan kann verstärkt werden durch:
• andere Antihypertensiva
• Vasodilatatoren und Nitrate.
• Phosphodiesterase-5-Inhibitoren (z.B. Sildenafil, Tadalafil, und Vardenafil)
(siehe Abschnitt 4.4).
Die blutdrucksenkende Wirkung von Doxazosin Mylan kann abgeschwächt werden durch:
• nichtsteroidale Antirheumatika und Östrogene
• Sympathomimetika.
Doxazosin kann die Wirkung von Dopamin, Ephedrin, Epinephrin, Metaraminol, Methoxamin und Phynylephrin auf Blutdruck und Gefäße abschwächen.
Da keine Untersuchungen zu Wechselwirkungen mit Substanzen, die den Leberstoffwechsel beeinflussen (z.B. Cimetidin), vorliegen, wird Vorsicht bei gleichzeitiger Anwendung mit Doxazosin Mylan empfohlen.
Doxazosin kann die Plasma-Renin-Aktivität und die Ausscheidung der Vanillinmandelsäure im Harn erhöhen. Dies ist bei der Interpretation von Labordaten zu berücksichtigen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Eine Anwendung von Doxazosin in der Schwangerschaft sollte nur nach sorgfältiger
Nutzen-Risiko-Abwägung erfolgen, da bisher keine ausreichenden Erfahrungen mit schwangeren Frauen vorliegen.
Stillzeit
Unter einer Doxazosin-Therapie darf nicht gestillt werden, da das Arzneimittel in der Milch laktierender Ratten konzentriert wird und keine Untersuchungen zur Ausscheidung in die menschliche Milch vorliegen.
4.7
4.8
Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung des Bluthochdrucks mit Doxazosin Mylan bedarf der regelmäßigen ärztlichen Kontrolle. Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen so weit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
Nebenwirkungen
Unter der Therapie mit Doxazosin Mylan können die nachfolgend genannten Nebenwirkungen auftreten.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig: > 1/10
Häufig: > 1/100 bis < 1/10
Gelegentlich: > 1/1.000 bis < 1/100
Selten: > 1/10.000 bis < 1/1.000
Sehr selten: < 1/10.000
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
Zu Beginn der Behandlung und insbesondere bei zu hoher Dosierung oder bei erneuter Einnahme nach kurzer Einnahmepause können Symptome einer orthostatischen Dysregulation und Synkopen auftreten. Dies kann auch auftreten, wenn die Therapie nach einer kurzen Unterbrechung wieder aufgenommen wird.
Herz- und Gefäßerkrankungen
Häufig: Blutdruckabfall bei Lagewechsel, Palpitationen, Schwindel,
Benommenheit, Ödeme.
Gelegentlich: Myokardinfarkt, Synkopen, Angina pectoris, Arrhythmie,
Tachykardie, periphere Ischämie.
Selten: Durchblutungsstörungen der Hirngefäße.
Erkrankungen der Atemwege, des Brustraums und Mediastinums Häufig: Dyspnoe, verstopfte Nase.
Gelegentlich: Bronchospasmus, Pharyngitis, Husten, Epistaxis.
Selten: Kehlkopfödem.
Sehr selten: Rhinitis.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Obstipation, Dyspepsie.
Gelegentlich: Appetitlosigkeit, gesteigerter Appetit, Mundtrockenheit.
Selten: Magenschmerzen, Diarrhoe, Erbrechen.
Leber- und Gallenerkrankungen
Gelegentlich: Erhöhung der Leberenzyme, Ikterus.
Sehr selten: Hepatitis, Cholestase.
Erkrankungen der Nieren und Harnwege
Häufig: Verstärkter Harndrang, häufigeres Wasserlassen,
Ej akulationsstörungen.
Gelegentlich: Inkontinenz, Miktionsstörungen, Dysurie.
Selten: Priapismus, Impotenz.
Sehr selten: Hämuturie, Anstieg von Harnstoff und Kreatinin im Plasma.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schläfrigkeit, Benommenheit, Schwindel,
Apathie, Erregtheit.
Gelegentlich: Tremor, Muskelsteifigkeit, Tinnitus, Geschmacksstörungen,
Alpträume, Gedächtnisverlust, emotionale Labilität.
Selten: Parästhesien, Depression, Agitiertheit.
Augenerkrankungen
Häufig:
Gelegentlich:
Selten:
Nicht bekannt:
Akkommodationsstörungen.
Abnormer Tränenfluss, Photophobie.
Verschwommenes Sehen.
IFIS (Intraoperative Floppy Iris Syndrome) (siehe 4.4 „Besondere Wamhinweise und Vorsichtsmaßnahmen für die Anwendung“)
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen Häufig: Muskelkrämpfe.
Gelegentlich. Muskelschmerzen, Muskelschwäche, Gelenkschmerzen.
Erkankungen der Haut und des Unterhautzellgewebes Gelegentlich: Haarausfall.
Selten: Hautausschlag, Pruritus, Purpura.
Stoffwechsel- und Ernaehrungsstoerungen Gelegentlich: Gicht, Hypokaliämie, Durstgefühl.
Selten: Hypoglykämie.
Erkrankungen des Blutes und des Lymphsystems
Sehr selten: Verminderung der roten und weißen Blutkörperchen und der
Blutplättchen
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig: Mügdigkeit, Schwäche.
Gelegentlich: Generalisierte Ödeme, Fieber, Schüttelfrost, Gesichtsödeme, Flush,
Blässe.
Selten: Verringerte Körpertemperatur bei älteren Patienten.
Sehr selten: Allergische Reaktionen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Eine Überdosierung von Doxazosin Mylan führt in der Regel zu Hypotonie, unter Umständen verbunden mit Synkopen.
Bei Hypotonie infolge einer Überdosierung sollte in erster Linie das kardiovaskuläre
System stabilisiert werden. Zur Normalisierung von Blutdruck und Herzfrequenz sollte der Patient auf dem Rücken in Kopftieflage gebracht werden. Bei Vorliegen einer schweren Hypotonie sollten Plasmaexpander und Vasopressoren gegeben werden. Die Nierenfunktion sollte überwacht und, falls erforderlich, unterstützt werden. Da Doxazosin im Plasma vorwiegend proteingebunden vorliegt, ist eine Dialyse als Therapiemaßnahme nicht indiziert.
5.
5.1
5.2
PHARMAKOLOGISCHE EIGENSCHAFTEN
Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihypertensivum ATC-Code: C02CA04
Pharmakotherapeutische Gruppe: Urologikum ATC-Code: G04CA
Wirkmechanismus
Doxazosin bewirkt durch selektive und kompetitive Blockade von postsynaptischen Alpha-1-Rezeptoren eine periphere Vasodilatation.
Die Anwendung von Doxazosin beim Hypertoniker führt zur Senkung des Blutdrucks durch Verminderung des peripheren Gefäßwiderstandes.
Pharmakodynamische Wirkungen
Bei einer einmal täglichen Dosierung ist die Wirkung noch 24 Stunden nach der Einnahme nachzuweisen. Nach Therapiebeginn kommt es zu einer allmählichen Senkung des Blutdrucks, orthostatische Reaktionen können auftreten. Die maximale Blutdrucksenkung wird normalerweise 2 bis 6 Stunden nach der Tabletteneinnahme erzielt. Bei Hypertonikern sind die Blutdruckwerte unter Doxazosin-Therapie im Liegen und im Stehen ähnlich.
Eine Toleranzentwicklung bezüglich der antihypertensiven Wirkung wurde bei Langzeittherapie mit Doxazosin bisher nicht beobachtet. Gelegentlich kommt es bei fortgesetzter Anwendung zum Anstieg der Plasmareninaktivität und zu Tachykardien.
Klinische Wirksamkeit und Sicherheit
Die Zwischenauswertung der ALLHAT-Studie (Antihypertensive and Lipid lowering Treatment to Prevent Heart Attack Trial) zeigte, dass das Risiko für eine schwerwiegende Herzinsuffizienz bei mit Doxazosin behandelten Bluthochdruckpatienten mit mindestens einem weiteren KHK-Risikofaktor im Vergleich zu den mit Chlorthalidon behandelten Patienten etwa doppelt so hoch war. Außerdem war bei diesen Patienten das Risiko für das Auftreten von schwerwiegenden kardiovaskulären Komplikationen um 25% höher als in der Gruppe der Chlorthalidon-Patienten.
Aufgrund dieser Ergebnisse wurde der Doxazosin-Arm der ALLHAT-Studie abgebrochen. Unterschiede im Hinblick auf die Mortalität waren zu diesem Zeitpunkt nicht vorhanden. Die Ergebnisse sind noch nicht abschließend ausgewertet.
Bei Patienten mit symptomatischer benigner Prostatahyperplasie werden die Urodynamik und die symptomatischen Beschwerden durch die Gabe von Doxazosin signifikant verbessert. Dieser Effekt beruht vermutlich auf einer selektiven Blockade der Alpha-1-Rezeptoren in der Muskulatur von Prostata und Blasenhals.
Unter Behandlung mit Doxazosin konnte eine Regression der linksventrikulären Hypertrophie festgestellt werden.
Pharmakokinetische Eigenschaften
Resorption
Nach oraler Applikation wird Doxazosin gut resorbiert, die
Plasmaspitzenkonzentrationen werden etwa nach 2 Stunden erreicht. Die absolute Bioverfügbarkeit beträgt nahezu 63 %.
Verteilung
98,3 % des Doxazosin im Plasma liegen in proteingebundener Form vor. Biotransformation und Elimination
Die Plasmaelimination verläuft biphasisch, die terminale Halbwertszeit beträgt 22 Stunden und ermöglicht somit eine tägliche Einmalgabe.
Der größte Anteil von Doxazosin wird metabolisiert (O-Demethylierung und Hydroxylierung); die Elimination erfolgt vorwiegend über die Faeces (nur 5 % der verabreichten Dosis werden unverändert ausgeschieden).
6-Hydroxy-Doxazosin ist ein potenter selektiver Alpha-Blocker und entspricht beim Menschen 5% der peroral aufgenommenen Dosis. Daher trägt 6-Hydroxy-Doxazosin wenig zur antihypertensiven Wirkung von Doxazosin bei.
Pharmakokinetische/pharmakodynamische Zusammenhänge
Eingeschränkte Nierenfunktion
Studien bei älteren Personen und Patienten mit Niereninsuffizienz haben keine relevanten pharmakokinetischen Unterschiede zu Patienten mit normaler Nierenfunktion ergeben.
Eingeschränkte Leberfunktion
Über den Einsatz bei Patienten mit Leberinsuffizienz und über die Wirkung von Arzneimitteln mit bekanntem Einfluss auf den Leberstoffwechsel (z.B. Cimetidin) liegen nur in begrenztem Umfang Daten vor. In einer klinischen Studie mit 12 Patienten mit geringgradiger Leberinsuffizienz war die Fläche unter der Kurve (AUC) um 43 % erhöht und die Clearance nach oraler einmaliger Applikation um 30 % vermindert.
Da Doxazosin nahezu vollständig in der Leber metabolisiert wird, sollte Doxazosin Mylan bei Patienten mit veränderter Leberfunktion vorsichtig angewendet werden (siehe auch 4.4).
Bioverfügb arkeit:
Die absolute Bioverfügbarkeit beträgt nahezu 63 %.
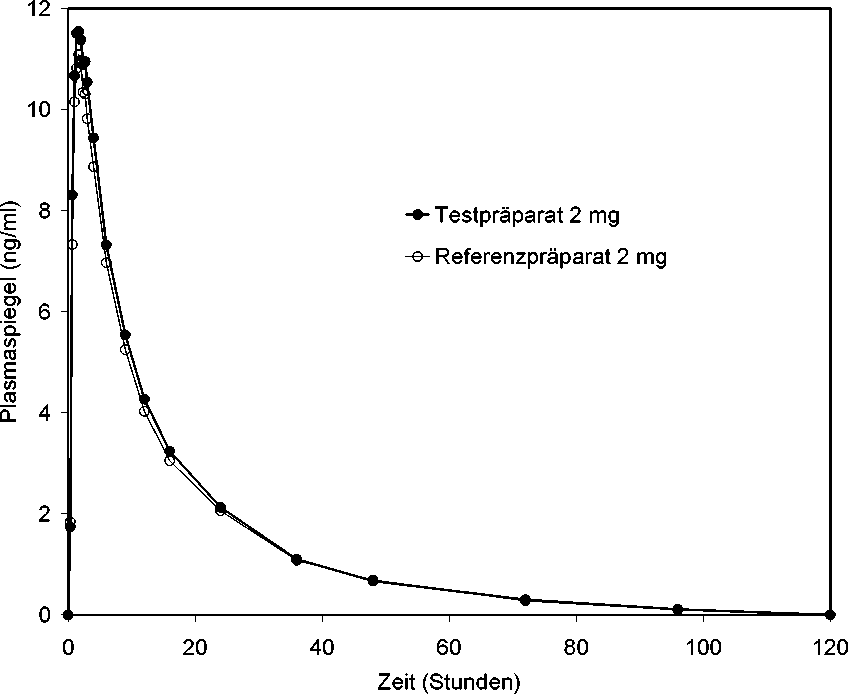
Eine im Jahr 1996/97 durchgeführte Bioverfügbarkeitsuntersuchung von Doxazosin Mylan 2 mg an 27 Probanden ergab im Vergleich zum Referenzpräparat:
Testpräparat
Referenzpräparat
Maximale
12,02 ± 2,81
1,53 ± 0,58
167,59 ± 41,71
Plasmakonzentration 1251 ± 255
(C max ) (ng/ml):
Zeitpunkt der maximalen Plasmakonzentration
1,57 ± 0,57
(tmax) ( Std.):
Fläche unter der Konzentrations-Zeit-Kurve
(AUC) (ng-Std/ml): 175,12 ± 44,38
Mittlere Plasmaspiegelverläufe im Vergleich zum Referenzpräparat in einem Konzentrations -Zeit-Diagramm:
5.3 Präklinische Daten zur Sicherheit
Tierversuche zur Sicherheitspharmakologie, chronischen Toxizität, Reproduktionstoxizität, Mutagenität und Kanzerogenität ergaben keine Hinweise auf ein erhöhtes Risiko für die Anwendung beim Menschen.
6.3
PHARMAZEUTISCHE ANGABEN Liste der sonstigen Bestandteile
Magnesiumstearat (Ph. Eur.), mikrokristalline Cellulose, Lactose, Carboxymethylstärke-Natrium (Typ A) (Ph. Eur.), Natriumdodecylsulfat
Inkompatibilitäten
Nicht zutreffend.
Dauer der Haltbarkeit
3 Jahre.
Keine
6.5 Art und Inhalt des Behältnisses
Tabletten in HDPE-Flaschen mit PP-Schraubdeckeln oder in PVC-ACLAR-Alu-Blisterpackungen
Packungen zu 20, 30, 50 und 100 Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Mylan dura GmbH Postfach 10 06 35 64206 Darmstadt
8. ZULASSUNGSNUMMER
41288.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
12.08.1999 / 22.12.2004
10. STAND DER INFORMATION
November 2016
11. VERSCHREIBUNGSSTATUS
Verschreibungspflichtig