Elumatic Iii, Technetium[(99M)Tc]Radionuklidgenerator

Radioaktives Arzneimittel
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Elumatic III,
Technetium (99mTc) Radionuklidgenerator, 2 - 20 GBq
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Die Wirkstoffe sind: Natriummolybdat (99Mo) und Natriumpertechnetat (99mTc).
1 Radionuklidgenerator enthält zum Kalibrierzeitpunkt (12.00 Uhr MEZ):
Natriummolybdat (99Mo) 2,4 - 24 GBq
(gebunden an eine Aluminiumoxid-Säule)
Natriumpertechnetat (99mTc) 2 - 20 GBq
(Maximal eluierbare Aktivität unter Gleichgewichtsbedingungen).
Sonstiger Bestandteil mit bekannter Wirkung: Natrium.
1 ml Natriumpertechnetat (99mTc) -Lösung enthält 3,6 mg Natrium.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Technetium (99mTc) wird durch radioaktiven Zerfall von Molybdän (99Mo) hergestellt. Technetium (99mTc) zerfällt unter Emission von Gamma-Strahlung mit einer charakteristischen Energie von 140 keV und einer Halbwertszeit von 6,02 Stunden zu Technetium (99Tc), das aufgrund der langen Halbwertszeit von 2,13 x 105 Jahren als nahezu stabil angesehen werden kann.
Der Generator Elumatic III ist ein System zur Elution einer Natriumpertechnetat (99mTc)-Lösung. Die somit erhaltene Technetium (99mTc)-Lösung ist steril und pyrogenfrei und entspricht den Anforderungen des Europäischen Arzneibuchs und der U.S. Pharmacopoeia, einschließlich denen für die radiochemische Reinheit (mindestens 95 %) und der Radionuklid-Reinheit (am Verfallsdatum: (99Mo) < 0,1 %, (131I) < 5x10-3 %, (103Ru) < 5x10-3 %, (89Sr) < 6x10-5 %, (90Sr) < 6x10-6 %, alpha-emittierende Verunreinigungen < 1x10-7%, andere gammaemittierende Unreinheiten < 0,01 %).
Die Lösung ist klar und farblos, mit einem pH-Wert zwischen 5,0 und 7,0 und enthält keine antimikrobiellen Konservierungsmittel. Sie wird aus einer Aluminiumoxid-Chromatographiesäule eluiert, auf der Spaltmolybdän (99Mo) (T1/2 = 66 h), das Mutternuklid von Technetium (99mTc) (T1/2 = 6,02 h), gebunden ist.
P4107nI
02/2014
Radionuklidgenerator
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Das Eluat (Natriumpertechnetat (99mTc)-Lösung) aus dem Radionuklidgenerator kann eingesetzt werden zur radioaktiven Markierung von einem Kit für ein radioaktives Arzneimittel, das speziell für die radioaktive Markierung mit diesem Radionuklid entwickelt und zugelassen wurde.
Bei direkter intravenöser Injektion wird die sterile Natriumpertechnetat (99mTc)-Injektionslösung in folgenden Fällen für diagnostische Zwecke angewendet:
a) Schilddrüsenszintigraphie
Direkte Darstellung und Messung der Schilddrüsenaufnahme zum Erhalt von Informationen
über die Größe, Lokalisation, Knötchenbildung und Funktion der Drüse bei Schilddrüsenerkrankungen.
b) Speicheldrüsenszintigraphie
Diagnostik chronischer Sialadenleiden (z. B. Sjögren-Syndrom) sowie Verlaufskontrolle der Speicheldrüsenfunktion bei Speicheldrüsenerkrankungen und therapeutischen Eingriffen (insbesondere Radioiodtherapie).
c) Lokalisation der ektopischen Magenschleimhaut (Meckel-Divertikel).
d) Szintigraphie des Tränengangs (nach Applikation in den Bindehautsack des Auges).
4.2 Dosierung und Art der Anwendung
Dosierung
Wenn Natriumpertechnetat (99mTc) intravenös verabreicht wird, kann die verabreichte Aktivität stark variieren, da sie von der erforderlichen klinischen Information und den verwendeten Geräten abhängt. Die Injektion von Aktivitäten, die über den lokalen diagnostischen Referenzwerten (DRLs) liegen, ist zu rechtfertigen.
Die nachstehend aufgeführten Dosierungen gelten nicht für Kits für ein radioaktives Arzneimittel, die mit Technetium (99mTc) markiert sind und der organspezifischen szintigraphischen Darstellung oder nuklearmedizinischen Funktionsdiagnostik dienen. Diesbezüglich sind die Zubereitungs-, Dosierungs- und Anwendungshinweise in der Fach- und Gebrauchsinformation des jeweiligen radioaktiv zu markierenden Arzneimittels zu beachten.
Folgende Aktivitäten werden empfohlen:
Erwachsene
Schilddrüsenszintigraphie: 20 - 80 MBq
Die Szintigraphie erfolgt 20 Minuten nach der intravenösen Injektion.
Speicheldrüsenszintigraphie: 30 - 150 MBq bei statischer Bildgebung und bis zu 370 MBq bei dynamischer Bildgebung
Die Szintigraphie erfolgt sofort nach der intravenösen Injektion und in regelmäßigen
Zeitabständen bis zu 15 Minuten.
Szintigraphie des Meckel Divertikels: 300 - 400 MBq (eine Vorbehandlung der Patienten mit Schilddrüsen-blockierenden Arzneimitteln kann notwendig sein)
Die Szintigraphie erfolgt sofort nach der intravenösen Injektion und in regelmäßigen
Zeitabständen bis zu 30 Minuten.
Szintigraphie der Tränengänge: 2 - 4 MBq pro Auge (eine Vorbehandlung der Patienten mit Schilddrüsen-blockierenden Arzneimitteln kann notwendig sein)
Die Tropfen werden in den Bindehautsack des Auges instilliert, und es werden 2 Minuten lang dynamische Bilder gemacht. Darauf folgen 20 Minuten lang in geeigneten Intervallen statische Bilder.
Eingeschränkte Nierenfunktion
Bei Patienten mit eingeschränkter Nierenfunktion ist eine sorgfältige Abwägung der zu verabreichenden Aktivität erforderlich, da bei diesen Patienten ein erhöhtes Strahlenexpositionsrisiko besteht.
Kinder und Jugendliche
Bei Kindern und Jugendlichen wird entsprechend den Empfehlungen der „Paediatric and Dosimetry Committees" der EANM die anzuwendende Aktivität mit einer je nach Indikation im Folgenden aufgeführten Formel und einem Faktor entsprechend dem Körpergewicht des Kindes oder Jugendlichen (siehe Tabelle 1) ermittelt:
Tabelle 1
|
3 kg = 1 |
22 kg = 5,29 |
42 kg = 9,14 |
|
4 kg = 1,14 |
24 kg = 5,71 |
44 kg = 9,57 |
|
6 kg = 1,71 |
26 kg = 6,14 |
46 kg = 10,00 |
|
8 kg = 2,14 |
28 kg = 6,43 |
48 kg = 10,29 |
|
10 kg = 2,71 |
30 kg = 6,86 |
50 kg = 10,71 |
|
12 kg = 3,14 |
32 kg = 7,29 |
52-54 kg = 11,29 |
|
14 kg = 3,57 |
34 kg = 7,72 |
56-58 kg = 12,00 |
|
16 kg = 4,00 |
36 kg = 8,00 |
60-62 kg = 12,71 |
|
18 kg = 4,43 |
38 kg = 8,43 |
64-66 kg = 13,43 |
|
20 kg = 4,86 |
40 kg = 8,86 |
68 kg = 14,00 |
Schilddrüsenszintigraphie
Zu injizierende Radioaktivität [MBq] = 5,6 MBq x Faktor (Tabelle 1)
Falls nach dieser Berechnung die zu injizierende Radioaktivität < 10 MBq beträgt, sollte die empfohlene Mindestaktivität von 10 MBq verabreicht werden, um Aufnahmen von ausreichender Qualität zu erzielen.
Speicheldrüsenszintigraphie
Zu injizierende Radioaktivität [MBq] = 10,5 MBq x Faktor (Tabelle 1)
Falls nach dieser Berechnung die zu injizierende Radioaktivität < 20 MBq beträgt, sollte die empfohlene Mindestaktivität von 20 MBq verabreicht werden, um Aufnahmen von ausreichender Qualität zu erzielen.
Szintigraphie des Meckel-Divertikels
Zu injizierende Radioaktivität [MBq] = 10,5 MBq x Faktor (Tabelle 1)
Falls nach dieser Berechnung die zu injizierende Radioaktivität < 20 MBq beträgt, sollte die empfohlene Mindestaktivität von 20 MBq verabreicht werden, um Aufnahmen von ausreichender Qualität zu erzielen.
Szintigraphie der Tränengänge
Die zu applizierende Radioaktivität pro Auge sollte 3,7 MBq betragen, um Aufnahmen von ausreichender Qualität zu erzielen.
Art der Anwendung
Zur intravenösen Anwendung (nach Elution und ggf. Radiomarkierung) und zur Anwendung am Auge (nach Elution).
Wiederholung der Anwendung
Die Verabreichung für die Szintigraphie des Meckel-Divertikels sollte frühestens nach 24 Stunden wiederholt werden.
Hinweise zur Zubereitung des Arzneimittels vor der Anwendung, siehe Abschnitt 12.
Zur Vorbereitung der Patienten, siehe Abschnitt 4.4.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Informationen über Gegenanzeigen für eine Anwendung von Technetium (99mTc)-markierten Kits für ein radioaktives Arzneimittel, die unter Verwendung von Natriumpertechnetat (99mTc)-Injektionslösung zubereitet werden, sind der Fach- und Gebrauchsinformation des radioaktiv zu markierenden Arzneimittels zu entnehmen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Potenzial für Überempfindlichkeitsreaktionen oder anaphylaktische Reaktionen Bei Auftreten von Überempfindlichkeitsreaktionen oder anaphylaktischen Reaktionen muss die Verabreichung des Arzneimittels sofort abgebrochen werden. Falls erforderlich, ist eine intravenöse Behandlung einzuleiten. Um sofortige Notfallmaßnahmen ergreifen zu können, müssen die erforderlichen Arzneimittel sowie die entsprechende Notfallausrüstung (z. B. Endotrachealtubus und Beatmungsgerät) griffbereit sein.
Individuelles Nutzen-Risiko-Verhältnis
Die Strahlenexposition muss bei jedem Patienten durch den erwarteten Nutzen gerechtfertigt sein. Die zu verabreichende Aktivität darf nicht höher bemessen werden als für den Erhalt der diagnostischen Information erforderlich ist.
Eingeschränkte Leber- oder Nierenfunktion
Bei diesen Patienten ist eine sorgfältige Abwägung des Nutzen-Risiko-Verhältnisses erforderlich, da ein erhöhtes Strahlenexpositionsrisiko vorliegen kann.
Kinder und Jugendliche
Angaben zur Anwendung bei Kindern und Jugendlichen, siehe Abschnitt 4.2.
Da die effektive Dosis pro MBq höher ist als bei Erwachsenen, ist eine besonders sorgfältige Indikationsstellung erforderlich (siehe Abschnitt 11).
Die Anwendung bei Kindern und Jugendlichen ist auf Grundlage der klinischen Notwendigkeit und unter Einschätzung des Risiko/Nutzen-Verhältnisses für diese Patientengruppe sorgfältig abzuwägen.
Patientenvorbereitung
Bei bestimmten Indikationen ist unter Umständen eine Vorbehandlung der Patienten mit Schilddrüsenblockern erforderlich.
Patienten sollten vor der Untersuchung gut hydriert sein und aufgefordert werden, in den ersten Stunden nach der Untersuchung so oft wie möglich die Blase zu entleeren, um die Strahlenexposition zu vermindern.
Vor der Verabreichung der Natriumpertechnetat (99mTc)-Injektionslösung zur Szintigraphie des Meckel-Divertikels muss der Patient 3 bis 4 Stunden vor der Untersuchung nüchtern bleiben, um die Dünndarmperistaltik so gering wie möglich zu halten.
Zur Vermeidung falsch positiver Werte oder zur Minimierung der Strahlung durch Reduktion der Kumulation von Natriumpertechnetat (99mTc) in Schilddrüse und Speicheldrüsen sollte vor einer Tränengang-Szintigraphie oder Szintigraphie des Meckel-Divertikels Kaliumperchlorat verabreicht werden.
Nach der Untersuchung
Enger Kontakt mit Säuglingen und schwangeren Frauen ist während 12 Stunden einzuschränken.
Besondere Warnhinweise
Natriumpertechnetat (99mTc)-Injektionslösung enthält 3,6 mg/ml Natrium.
Abhängig vom Zeitpunkt der Verabreichung der Injektion kann der dem Patienten verabreichte Natriumgehalt in manchen Fällen größer als 1 mmol sein. Bei Patienten, die eine kochsalzarme Diät einhalten müssen, ist dies zu berücksichtigen.
Bei der Kit-Markierung ist in Hinblick auf den Natriumgehalt der verabreichten Dosis das aus dem Eluat und dem Kit stammende Natrium zu berücksichtigen. Siehe Fach- und Gebrauchsinformation des betreffenden Kits.
Eine paravasale Injektion ist zu vermeiden.
Nach einer in-vivo Markierung der Erythrozyten mit Zinn als Reduktionsmittel wird Natriumpertechnetat (99mTc) primär in Erythrozyten eingebaut, daher sollte eine MeckelSzintigraphie vor oder erst einige Tage nach einer Blutpoolszintigraphie mit in-vivo markierten Erythrozyten erfolgen.
Bei der Speicheldrüsenszintigraphie muss mit einer geringeren Spezifität der Methode im Vergleich zu MR-Sialographie gerechnet werden.
Informationen bezüglich Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung von Natriumpertechnetat (99mTc)-markierten Pharmaka sind den Fach- und Gebrauchsinformationen des jeweiligen radioaktiv zu markierenden Arzneimittels zu entnehmen.
Hinweise zur Vermeidung von Gefahren für die Umwelt, siehe Abschnitt 6.6.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei bildgebenden Untersuchungen des Bauchraums können Wirkstoffe oder Arzneimittel wie Atropin, Isoprenalin und Analgetika die Magenentleerung und die Distribution des Natriumpertechnetats (99mTc) verlangsamen.
Die Aufnahme in die Schilddrüse wird nachweislich durch viele pharmakologische Substanzen modifiziert.
Schilddrüsenhormone, Iod, Iodid, Perchlorat, Thiocyanat, Aluminium enthaltende Antacida, Sulfonamide sowie Zinn(II)-Ionen enthaltende Substanzen führen zu erhöhter Natriumpertechnetat (99mTc)-Konzentration im vaskulären Raum, im Falle von Zinn(II)-Ionen und Sulfonamiden zu erhöhten Natriumpertechnetat (99mTc)-Konzentrationen in den roten Blutzellen, d. h. zu verminderter Anreicherung im Plasma und cerebralen Läsionen. Entsprechende Medikamente sollten, wenn nachfolgend nicht anders beschrieben, mehrere Tage vorher abgesetzt werden.
- Schilddrüsenblocker (z. B. Carbimazol oder andere Imidazolderivate wie Propylthiouracil), Salicylate, Steroide, Natrium-Nitroprussid, Natrium-Sulfobromophthalein, Perchlorat sollten 1 Woche vor der Schilddrüsen-Szintigraphie abgesetzt werden.
- Phenylbutazon und Expektoranzien sollten 2 Wochen zuvor abgesetzt werden.
- Natürliche oder synthetische Schilddrüsenhormone (z. B. Natriumthyroxin, Natriumliothyronin, Schilddrüsenextrakt) sollten 2-3 Wochen zuvor abgesetzt werden.
- Amiodaron, Benzodiazepine, Lithium sollten 4 Wochen zuvor abgesetzt werden.
- Intravenöse Kontrastmittel sollten innerhalb von 1-2 Monaten vor der Untersuchung nicht verabreicht worden sein.
lodhaltige Kontrastmittel und Perchlorat können die Aufnahme von Natriumpertechnetat (99mTc) in die Magenschleimhaut vermindern. Bariumsulfat absorbiert einen Großteil der Gammastrahlung des Tracers. Die Szintigraphie eines Meckel-Divertikels sollte daher frühestens 2 bis 3 Tage nach Anwendung dieser Substanzen erfolgen. Laxantien können den Abtransport von Natriumpertechnetat (99mTc) aus Magen und Darm beschleunigen und sollten vor Durchführung einer Meckel Szintigraphie vermieden werden.
Informationen über Wechselwirkungen bei der Anwendung von Kits für ein radioaktives Arzneimittel, markiert mit Technetium (99mTc) unter Verwendung von Natriumpertechnetat (99mTc)-Injektionslösung, sind der Fachinformation des jeweiligen zur Zubereitung des radioaktiven Arzneimittels verwendeten Kits zu entnehmen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Frauen im gebärfähigen Alter
Ist die Verabreichung eines radioaktiven Arzneimittels bei einer Frau im gebärfähigen Alter geplant, muss stets festgestellt werden, ob eine Schwangerschaft vorliegt. Grundsätzlich muss von einer Schwangerschaft ausgegangen werden, wenn eine Monatsblutung ausbleibt.
Bestehen Zweifel hinsichtlich einer möglichen Schwangerschaft (falls eine Monatsblutung ausgeblieben ist, falls die Blutungen sehr unregelmäßig sind usw.) sollten der Patientin alternative Untersuchungsmethoden ohne ionisierende Strahlung angeboten werden (sofern derartige Methoden zur Verfügung stehen).
Schwangerschaft
99mTc (als freies Pertechnetat) ist plazentagängig.
Bei Radionukliduntersuchungen an schwangeren Frauen kommt es auch zu einer Strahlenexposition des Fötus. Daher dürfen während der Schwangerschaft nur zwingend erforderliche Untersuchungen durchgeführt werden, bei denen der erwartete Nutzen weit größer als das Risiko für die Mutter und das ungeborene Kind ist.
Bei der direkten Verabreichung von 400 MBq Natriumpertechnetat (99mTc) beträgt die im Uterus resorbierte Dosis 3,2 mGy. Nach Vorbehandlung mit einer blockierenden Substanz beträgt die bei Verabreichung von 400 MBq Natriumpertechnetat (99mTc) im Uterus resorbierte Dosis
2,4 mGy.
Stillzeit
Weil Radioaktivität in die Muttermilch übertritt, ist vor der Verabreichung von Radiopharmaka an eine stillende Mutter zu erwägen, ob die Radionuklidverabreichung bis zum Abstillen verschoben werden kann und welche Radiopharmaka am besten eingesetzt werden. Wird die Verabreichung als notwendig erachtet, sollte 12 Stunden nach der Verabreichung nicht gestillt und die abgepumpte Milch verworfen werden.
Enger Kontakt mit Säuglingen ist während dieser Zeit einzuschränken.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien über die Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Nebenwirkungen, die auf Kits für ein radioaktives Arzneimittel zurückzuführen sind, die mit Natriumpertechnetat (99mTc)-Injektionslösung markiert wurden, sind den Fach- und Gebrauchsinformationen des jeweiligen radioaktiv zu markierenden Arzneimittels zu entnehmen.
Zusammenfassung des Sicherheitsprofils:Es liegen Angaben zu unerwünschten Wirkungen aus Spontanmeldungen vor. Bei den berichteten Wirkungen handelte es sich um
Überempfindlichkeits- oder anaphylaktoide Reaktionen, unspezifische systemische Reaktionen sowie Reaktionen am Verabreichungsort der Injektion.
Natriumperchtechnetat (99mTc) wird zur radioaktiven Markierung verschiedener Substanzen verwendet. Diese Arzneimittel haben im Allgemeinen ein höheres Nebenwirkungenspotential als 99mTc. Daher sind die berichteten Nebenwirkungen eher den markierten Substanzen als 99mTc zuzuschreiben. Welche Arten von Nebenwirkungen nach intravenöser Verabreichung des 99mTc-markierten Präparates auftreten können, hängt von der jeweiligen Substanz ab. Die entsprechenden Angaben sind in der Fachinformation des zur Zubereitung des radioaktiven Arzneimittels verwendeten Kits enthalten.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Häufigkeit gemäß MedDRA-Konvention Sehr häufig (> 1/10)
Häufig (> 1/100, < 1/10)
Gelegentlich (> 1/1000, < 1/100)
Selten (> 1/10 000, < 1/1000)
Sehr selten (< 1/10 000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Erkrankungen des Immunsystems
Häufigkeit nicht bekannt*: anaphylaktoide Reaktionen (z. B. Dyspnoe, Koma, Urtikaria, Erythem, Hautausschlag, Hautreizungen, Pruritus, Ödembildung an verschiedenen Stellen, z. B. im Gesicht)
Erkrankungen des Nervensystems
Häufigkeit nicht bekannt*: vasovagale Reaktionen (z. B. Synkope, Tachykardie, Bradykardie, Schwindelgefühl, Kopfschmerzen, verschwommenes Sehen, Gesichtsrötung/Hitzegefühl (Flushing))
Erkrankungen des Gastrointestinaltrakts
Häufigkeit nicht bekannt*: Erbrechen, Übelkeit, Diarrhoe
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufigkeit nicht bekannt*: Reaktionen am Verabreichungsort der Injektion (z. B. Cellulitis,
Schmerzen, Erythem, Schwellung)
* Unerwünschte Wirkungen aus Spontanmeldungen
Unspezifische systemische Reaktionen und gastrointestinale Reaktionen werden eher auf die Untersuchungssituation als auf Technetium (99mTc) zurückgeführt, vor allem bei ängstlichen Patienten.
Lokale Reaktionen am Verabreichungsort der Injektion werden durch Paravasation des radioaktiven Materials während der Injektion verursacht. Die beobachteten Reaktionen reichen von lokaler Schwellung bis hin zu Cellulitis.
Abhängig von der verabreichten Radioaktivität und der markierten Substanz kann eine größere Paravasation eine chirurgische Behandlung erfordern.
Ionisierende Strahlen können Krebs und Erbgutveränderungen verursachen. Da die effektive Strahlendosis bei Gabe der maximalen empfohlenen Aktivität von 400 MBq bei 5,2 mSv liegt, sind diese Effekte mit geringer Wahrscheinlichkeit zu erwarten.
Bei den meisten nuklearmedizinischen Untersuchungen beträgt die effektive Dosis weniger als 20 mSv. Höhere Strahlendosen können unter bestimmten klinischen Umständen gerechtfertigt sein.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger - Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Im Fall einer Strahlenüberdosis mit Natriumpertechnetat (99mTc) sollte die vom Patienten resorbierte Dosis, wenn möglich durch Erhöhung der Ausscheidung des Radionuklids aus dem Körper durch forcierte Diurese, häufige Blasenentleerung und Defäkation reduziert werden.
Die Anreicherung in Schilddrüse, Speicheldrüsen und Magenschleimhaut kann deutlich verringert werden, wenn sofort nach versehentlicher Gabe einer zu hohen Dosis von Natriumpertechnetat (99mTc) Kaliumperchlorat verabreicht wird.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Nuklearmedizinisches Diagnostikum ATC-Code: V09FX01
Bei den in diagnostischen Verfahren zur Anwendung kommenden geringen Substanzmengen sind keine pharmakodynamischen Wirkungen des Natriumpertechnetats (99mTc) zu erwarten.
5.2 Pharmakokinetische Eigenschaften
Im Blut liegen 70-80 % des intravenös injizierten Natriumpertechnetats (99mTc) an Proteine, hauptsächlich unspezifisch an Albumin, gebunden vor. Der ungebundene Anteil (20-30 %) reichert sich passager in Schilddrüse, Speicheldrüsen, Magen- und Nasenschleimhaut sowie Plexus chorioidei an. Die biologische Verteilung des Pertechnetat (99mTc) ähnelt der Verteilung von Iodid. Pertechnetat (99mTc) wird im Gegensatz zu Iodid jedoch weder in die thyreoidale Hormonsynthese eingeschleust (organifiziert) noch im Dünndarm resorbiert. In der Schilddrüse wird die maximale Anreicherung, abhängig von Funktionszustand und Iodsättigung (bei Euthyreose ca. 0,3-3 %, bei Hyperthyreose und lodmangel bis 25 %) etwa 20 Minuten nach Injektion erreicht und nimmt danach rasch wieder ab. Ähnliches gilt für die Belegzellen der Magenschleimhaut und die Azinuszellen der Speicheldrüsen.
Im Gegensatz zur Schilddrüse, die Pertechnetat (99mTc) wieder in die Blutbahn abgibt, wird es in den Speichel und Magensaft sezerniert. Die Anreicherung durch die Speicheldrüse liegt in der Größenordnung von 0,5 % der applizierten Aktivität, wobei das Maximum nach etwa 20 Minuten erreicht wird. Eine Stunde nach Injektion liegt die Konzentration im Speichel um das 10-30fache höher als im Plasma. Die Exkretion kann durch Zitronensaft oder über eine Reizung des Parasympathikus beschleunigt werden, die Aufnahme wird durch Perchlorat vermindert.
Bei intakter Blut-Hirn-Schranke dringt Pertechnetat (99mTc) nicht in das Hirngewebe ein. Die Halbwertszeit der Plasmaclearance beträgt ungefähr 3 Stunden. Pertechnetat (99mTc) erfährt im Organismus keine nennenswerte Metabolisierung. Ein Teil wird sehr schnell renal, der Rest langsamer über Faeces, Speichel- und Tränenflüssigkeit eliminiert. Die Ausscheidung erfolgt während der ersten 24 Stunden nach Injektion hauptsächlich über die Nieren (ca. 30 %) und während der folgenden 48 Stunden über den Stuhl. Ca. 50 % der verabreichten Aktivität werden innerhalb der ersten 50 Stunden ausgeschieden. Wenn die selektive Pertechnetat (99mTc)-Aufnahme in die Drüsenstrukturen durch Vorbehandlung mit Blockern gehemmt ist, erfolgt die Ausscheidung auf dem gleichen Wege, aber die Nierenclearance ist erhöht.
Bei Verwendung von Natriumpertechnetat (99mTc)-Injektionslösung zur Herstellung von Technetium (99mTc)-Komplexen können sich sowohl die pharmakologischen als auch die toxikologischen Eigenschaften, abhängig von der Art der jeweiligen Technetium-Liganden, ändern.
5.3 Präklinische Daten zur Sicherheit
Angaben zur akuten, subakuten und chronischen Toxizität von Natriumpertechnetat (99mTc) liegen nicht vor.
Aufgrund der verwendeten geringen Substanzmengen (Piko-Nanogramm-Bereich) sind toxische Wirkungen nicht zu erwarten.
Natriumpertechnetat (99mTc) ist plazentagängig. Bei Mäusen wurde im trächtigen Uterus bis zu 60 % der verabreichten Dosis nachgewiesen. Die Gabe von Pertechnetat (99mTc) an Mäuse während der Trächtigkeit und/oder Laktation führte bei den Nachkommen zu vermindertem Gewicht, Haarlosigkeit und Sterilität.
Untersuchungen zur Mutagenität und Kanzerogenität liegen nicht vor.
6.1 Liste der sonstigen Bestandteile
Natriumchlorid,
Natriumnitrat,
Wasser für Injektionszwecke.
Bakteriostatische Lösung: Lauryldimethylbenzylammonium-bromid (0,02 %)
6.2 Inkompatibilitäten
Das Arzneimittel darf, außer zur Verwendung mit Kits, nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Radionuklidgenerator: 20 Tage nach dem Herstellungsdatum.
Die eluierte Natriumpertechnetat (99mTc)-Lösung ist bis zu 10 Stunden nach der Elution haltbar.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Elumatic III darf nicht über 25 °C gelagert werden.
Die eluierte Natriumpertechnetat (99mTc)-Lösung ist bei einer Temperatur von 2 °C bis 8 °C (im Kühlschrank) zu lagern.
Die Lagerung muss in Übereinstimmung mit den nationalen Bestimmungen für radioaktives Material erfolgen.
6.5 Art und Inhalt des Behältnisses und spezielles Zubehör für den Gebrauch
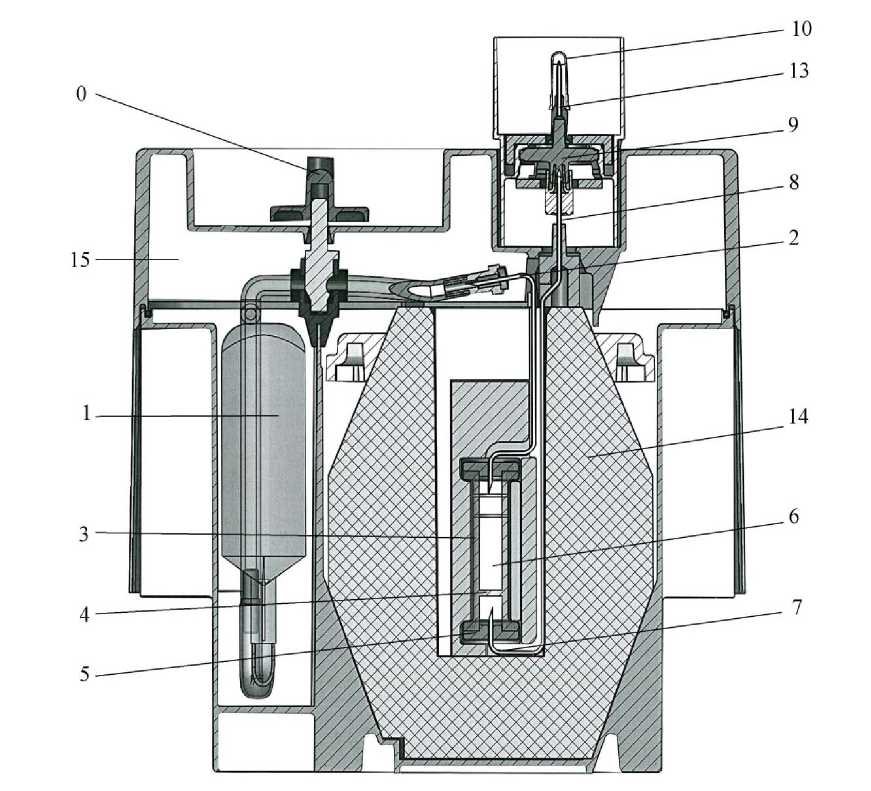
Das System besteht aus:
- Einem weichen Plastikbeutel (1) mit 180 ml Elutionsmittel (0,9 % Natriumchlorid und 0,005 % wässrige Natriumnitratlösung). Der Beutel ist durch eine Edelstahlnadel (2) mit der Spitze der Chromatographiesäule verbunden.
- Einer Chromatographiesäule aus Glas (3) mit einem Filter an der Unterseite, um ein Auslaufen des Aluminiumoxids zu verhindern. Die Säule ist an beiden Enden mit Deckeln verschlossen, die von Metallkapseln gehalten werden (5). Die Säule enthält das Aluminiumoxid (6), das die Molybdat-Ionen adsorbiert und gegenüber den Pertechnetat-Ionen inert ist.
- Einer Nadel, deren eines Ende mit der Unterseite der Säule verbunden ist (7). Am anderen Ende (8) ist sie mit einer Sterilfiltrationseinheit (9) verbunden. Die Sterilität der Elutionsnadel (13) dieser Einheit ist durch eine Schutzkappe (10) gewährleistet.
Die Säule und die Nadeln werden durch eine zylindrisch-konische Bleiabschirmung (14) mit einer
Mindestdicke von 52 mm geschützt. Das ganze System wird in eine parallelflache Verkleidung
(23 x 21 x 14 cm) aus geformtem Nylon (15) eingesetzt.
11
Neben der Elutionsstation ist ein Hohlraum mit einem Sicherheitsventil (0), das während des Transports (O) geschlossen ist.
Elumatic III wird in einem dichten Metallbehälter geliefert.
Der Generator wird in einem dichten Metallbehälter geliefert und enthält:
- 180 ml Elutionslösung in einem PVC-Beutel, der mit der Säule verbunden ist.
- eine Durchstechflasche mit 0,25 ml bakteriostatischer Lösung (0,02 % Lauryl-
dimethylbenzylammonium-bromid in Wasser für Injektionszwecke).
- 10 x 15-ml-Teilvakuum-Durchstechflaschen für die Elution (TC-ELU-5), steril, pyrogenfrei und unter Teilvakuum, das die Elution von 5 ml erlaubt.
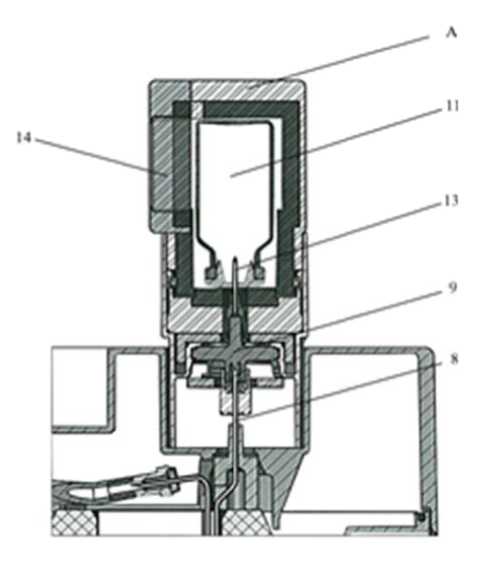
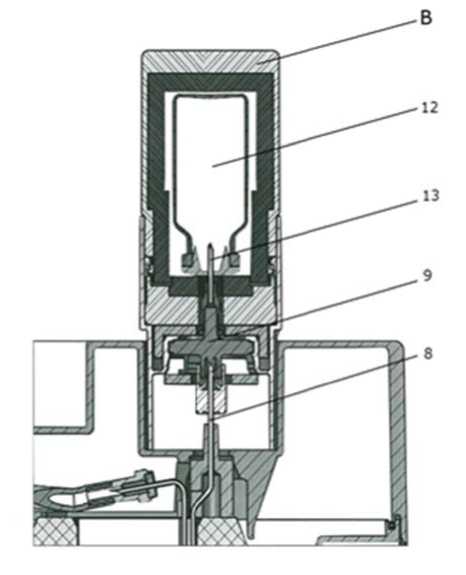
Ein Behälter (A) für die Elutionsdurchstechflasche (11) und ein Behälter (B) für die Durchstechflasche mit der bakteriostatischen Lösung (12) werden mit der ersten Bestellung geliefert.
Elutionsdurchstechflaschen: 15 ml-Durchstechflasche aus farblosem Klarglas gemäß der Ph.Eur. Typ I, mit Chlorbutyl-Gummistopfen und Aluminiumkapseln verschlossen.
Packungsgröße:
Elumatic III enthält einen Radionuklidgenerator mit folgenden erhältlichen Aktivitäten zum Kalibrierzeitpunkt (12.00 MEZ):
|
2 |
4 |
6 |
8 |
10 |
12 |
16 |
20 |
GBq Natriumpertechnetat(99mTc) |
|
2,4 |
4,8 |
7,2 |
9,6 |
12 |
14,4 |
19,2 |
24 |
GBq Natriummolybdat (99Mo) |
Die Aktivität ist auf dem Etikett angegeben.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Allgemeine Warnhinweise
Radioaktive Arzneimittel dürfen nur von dazu berechtigten Personen in speziell dafür bestimmten klinischen Bereichen in Empfang genommen, gehandhabt und verabreicht werden. Die Entgegennahme, Lagerung, Anwendung sowie der Transport und die Entsorgung unterliegen den gesetzlichen Bestimmungen und/oder den entsprechenden Genehmigungen der zuständigen Aufsichtsbehörde.
Radiopharmaka sind in einer Art und Weise zuzubereiten, welche den Anforderungen in Bezug auf Strahlenschutz und pharmazeutische Qualität entspricht. Entsprechende Vorsichtsmaßnahmen zur Einhaltung steriler Bedingungen sind zu treffen.
Die Verabreichung ist so durchzuführen, dass das Risiko einer Kontamination des Arzneimittels und einer Strahlenexposition der Anwender so gering wie möglich bleibt. Eine geeignete Abschirmung ist zwingend erforderlich.
Die Anwendung von radioaktiven Arzneimitteln setzt andere Personen einem Risiko durch externe Strahlung oder Kontamination durch Urin, Erbrochenes usw. aus. Daher müssen Strahlenschutzmaßnahmen gemäß nationalen Bestimmungen eingehalten werden.
Vor Entsorgung des Generators muss die Restaktivität abgeschätzt werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Bei jedem Patienten ist eine sorgfältige Abwägung zwischen dem zu erwartenden diagnostischen Nutzen und dem mit der Strahlenexposition verbundenen Risiko vorzunehmen. Um die Strahlendosis so gering wie möglich zu halten, darf die zu verabreichende Aktivität nicht höher bemessen werden als für den Erhalt der diagnostischen Information erforderlich ist.
Vor der Anwendung sollte die Unversehrtheit der Verpackung und die Radioaktivität überprüft werden.
Der Inhalt der Durchstechflasche sollte unter aseptischen Bedingungen nach Durchstechen des zuvor desinfizierten Stopfens mit einer sterilisierten Einwegnadel auf eine Spritze gezogen werden. Die Durchstechflasche darf auf keinen Fall geöffnet werden und muss abgeschirmt gehandhabt werden.
CIS bio GmbH
Member of IBA Molecular group of Companies Alt-Moabit 91d 10559 Berlin
Tel. 01804 247 246 Fax 01804 247 329
8. ZULASSUNGSNUMMER
28406.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 9. Juni 2006
Datum der letzten Verlängerung der Zulassung: 10. Februar 2014
10. STAND DER INFORMATION
Februar 2014
11. DOSIMETRIE Strahlenexposition
Die Strahlenexposition hängt von einer Vorbehandlung mit blockierenden Substanzen, wie Perchlorat oder Iodid, sowie vom Ausmaß körperlicher Aktivität ab.
Die geschätzten absorbierten Strahlendosen einzelner Organe nach direkter intravenöser Anwendung von Natriumpertechnetat (99mTc) bei gesunden Personen sind in folgenden Tabellen angegeben.
Die Werte der nachstehenden Tabelle beziehen sich auf Anwendungen ohne vorab verabreichte blockierende Substanzen. Die Daten wurden der Veröffentlichung "Radiation Dose to Patients from Radiopharmaceuticals" ICRP Publication 80 entnommen.
TABELLE 2
|
Organ |
Aufgenommene Dosis je Einheit verabreichter Aktivität |
(mGy/MBq) | |||
|
Erwach sener |
15 Jahre |
10 Jahre |
5 Jahre |
1 Jahr | |
|
Nebennieren |
0,0037 |
0,0047 |
0,0072 |
0,011 |
0,019 |
|
Blase |
0,018 |
0,023 |
0,030 |
0,033 |
0,060 |
|
Knochenoberfläche |
0,0054 |
0,0066 |
0,0097 |
0,014 |
0,026 |
|
Gehirn |
0,0020 |
0,0025 |
0,0041 |
0,0066 |
0,012 |
|
Brust |
0,0018 |
0,0023 |
0,0034 |
0,0056 |
0,011 |
|
Gallenblase |
0,0074 |
0,0099 |
0,016 |
0,023 |
0,035 |
|
Magen-Darm-T rakt | |||||
|
Magen |
0,026 |
0,034 |
0,048 |
0,078 |
0,16 |
|
Dünndarm |
0,016 |
0,020 |
0,031 |
0,047 |
0,082 |
|
Dickdarm |
0,042 |
0,054 |
0,088 |
0,14 |
0,27 |
|
Oberer Dickdarm |
0,057 |
0,073 |
0,12 |
0,20 |
0,38) |
|
Unterer Dickdarm |
0,021 |
0,028 |
0,045 |
0,072 |
0,13) |
|
Herz |
0,0031 |
0,0040 |
0,0061 |
0,0092 |
0,017 |
|
Nieren |
0,0050 |
0,0060 |
0,0087 |
0,013 |
0,021 |
|
Leber |
0,0038 |
0,0048 |
0,0081 |
0,013 |
0,022 |
|
Lunge |
0,0026 |
0,0034 |
0,0051 |
0,0079 |
0,014 |
|
Muskeln |
0,0032 |
0,0040 |
0,0060 |
0,0090 |
0,016 |
|
Speiseröhre |
0,0024 |
0,0032 |
0,0047 |
0,0075 |
0,014 |
|
Ovarien |
0,010 |
0,013 |
0,018 |
0,026 |
0,045 |
|
Bauchspeicheldrüse |
0,0056. |
0,0073 |
0,011 |
0,016 |
0,027 |
|
Rotes Knochenmark |
0,0036 |
0,0045 |
0,0066 |
0,0090 |
0,015 |
|
Speicheldrüse |
0,0093 |
0,012 |
0,017 |
0,024 |
0,039 |
|
Haut |
0,0018 |
0,0022 |
0,0035 |
0,0056 |
0,010 |
|
Milz |
0,0043 |
0,0054 |
0,0081 |
0,012 |
0,021 |
|
T estes |
0,0028 |
0,0037 |
0,0058 |
0,0087 |
0,016 |
|
Thymus |
0,0024 |
0,0032 |
0,0047 |
0,0075 |
0,014 |
|
Schilddrüse |
0,022 |
0,036 |
0,055 |
0,12 |
0,22 |
|
Uterus |
0,0081 |
0,010 |
0,015 |
0,022 |
0,037 |
|
Sonstige Gewebe |
0,0035 |
0,0043 |
0,0064 |
0,0096 |
0,017 |
|
Effektive Dosis (mSv/MBq) |
0,013 |
0,017 |
0,026 |
0,042 |
0,079 |
Die effektive Dosis, die sich aus der Anwendung von 80 MBq Natriumpertechnetat (99mTc) zur Schilddrüsen- und Speicheldrüsenszintigraphie ergibt, beträgt 1,04 mSv. Die absorbierte Dosis in den Zielorganen (Schilddrüse und Speicheldrüse) beträgt dabei 1,76 mGy bzw. 0,74 mGy.
Die effektive Dosis, die sich aus der Anwendung von 400 MBq Natriumpertechnetat (99mTc) zum Nachweis eines Meckel Divertikels ergibt, beträgt 5,2 mSv. Die absorbierte Dosis in der Magenschleimhaut beträgt dabei 10,4 mGy.
Vom kritischen Organ (oberer Dickdarm) wird bei einer Applikation von 400 MBq eine Dosis von 22,8 mGy absorbiert.
Die angegebenen Strahlenexpositionen gelten bei normaler Funktion aller Natriumpertechnetat (99mTc) anreichernden Organe. Über- bzw. Unterfunktion (z. B. von Schilddrüse, Magenschleimhaut oder Nieren) sowie Präsenz von ausgedehnten Prozessen mit gestörter BlutHirn-Schranke oder renalen Abflussstörungen können zu veränderten, lokal auch stark erhöhten Strahlenexpositionen führen.
Die in der folgenden Tabelle aufgeführten Werte beziehen sich auf Anwendungen mit vorab verabreichten blockierenden Substanzen. Die Daten wurden der Veröffentlichung "Radiation Dose to Patients from Radiopharmaceuticals“ ICRP Publication 80 entnommen.
TABELLE 3
Aufgenommene Dosis je Einheit verabreichter Aktivität (mGy/MBq)
|
Organ |
Erwachsener |
15 |
10 |
5 Jahre |
1 Jahr |
|
Nebennieren |
0,0029 |
0,0037 |
0,0056 |
0,0086 |
0,016 |
|
Blase |
0,03 |
0,038 |
0,048 |
0,05 |
0,091 |
|
Knochenoberfläche |
0,0044 |
0,0054 |
0,0081 |
0,012 |
0,022 |
|
Gehirn |
0,002 |
0,0026 |
0,0042 |
0,0071 |
0,012 |
|
Brust |
0,0017 |
0,0022 |
0,0032 |
0,0052 |
0,010 |
|
Gallenblase |
0,003 |
0,0042 |
0,007 |
0,001 |
0,0013 |
|
Magen-Darm-T rakt | |||||
|
Magen |
0,0027 |
0,0036 |
0,0059 |
0,0086 |
0,015 |
|
Dünndarm |
0,0035 |
0,0044 |
0,0067 |
0,01 |
0,018 |
|
Dickdarm |
0,0036 |
0,0048 |
0,0071 |
0,01 |
0,018 |
|
(Oberer Dickdarm |
0,0032 |
0,0043 |
0,0064 |
0,01 |
0,017) |
|
(Unterer Dickdarm |
0,0042 |
0,0054 |
0,0081 |
0,011 |
0,0019) |
|
Herz |
0,0027 |
0,0034 |
0,0052 |
0,0081 |
0,014 |
|
Nieren |
0,0044 |
0,0054 |
0,0077 |
0,011 |
0,019 |
|
Leber |
0,0026 |
0,0034 |
0,0053 |
0,0082 |
0,015 |
|
Lunge |
0,0023 |
0,0031 |
0,0046 |
0,0074 |
0,013 |
|
Muskeln |
0,0025 |
0,0031 |
0,0047 |
0,0072 |
0,013 |
|
Speiseröhre |
0,0024 |
0,0031 |
0,0046 |
0,0075 |
0,014 |
|
Ovarien |
0,0043 |
0,0054 |
0,0078 |
0,011 |
0,019 |
|
Bauchspeicheldrüse |
0,003 |
0,0039 |
0,0059 |
0,0093 |
0,016 |
|
Rotes Knochenmark |
0,0025 |
0,0032 |
0,0049 |
0,0072 |
0,013 |
|
Haut |
0,0016 |
0,002 |
0,0032 |
0,0052 |
0,0097 |
|
Milz |
0,0026 |
0,0034 |
0,0054 |
0,0083 |
0,015 |
|
Testes |
0,003 |
0,004 |
0,006 |
0,0087 |
0,016 |
|
Thymus |
0,0024 |
0,0031 |
0,0046 |
0,0075 |
0,014 |
|
Schilddrüse |
0,0024 |
0,0031 |
0,005 |
0,0084 |
0,015 |
|
Uterus |
0,006 |
0,0073 |
0,011 |
0,014 |
0,023 |
|
Sonstige Gewebe |
0,0025 |
0,0031 |
0,0048 |
0,0073 |
0,013 |
|
Effektive Dosis |
0,0042 |
0,0054 |
0,0077 |
0,011 |
0,019 |
(mSv/MBq)
12. ANWEISUNGEN ZUR ZUBEREITUNG VON RADIOAKTIVEN ARZNEIMITTELN
Elution
Die üblichen Vorsichtsmaßnahmen in Bezug auf Sterilität und Strahlenschutz sind einzuhalten. Den Stopfen der Elutionsdurchstechflasche vor jeder Elution desinfizieren.
Warnhinweis:
Keinen Ethanol oder Ethyläther zur Desinfektion der Nadel oder des Stopfens verwenden, da dies den Elutionsprozess beeinträchtigen kann.
Die Elutionsnadel (13) vor möglicher bakterieller Kontamination zwischen zwei Elutionen schützen, indem die Durchstechflasche mit der bakteriostatischen Lösung (12) auf die Nadel aufgesetzt wird.
Für zufriedenstellende Ergebnisse die nachstehende Abfolge beachten:
Erste Elution:
BEVOR die
Elutionsdurchstechflasche eingesetzt wird, das Sicherheitsventil ÖFFNEN ( Nr. 0: ©). Das Ventil erst schließen, wenn der Generator nicht mehr verwendet wird, NIEMALS zwischen zwei Elutionen.
Zur Elution des Generators die Schutzkappe der Elutionsnadel (10) durch den Elutionsbehälter (A) mit einer Durchstechflasche (11) des gewünschten Elutionsvolumens ersetzen.
Die Elution kann durch das Bleiglasfenster (14) des Behälters (A) beobachtet werden. Mindestens drei Minuten warten, bis die Elution beendet ist.
Vor Gebrauch ist die Klarheit des Eluats zu überprüfen. Falls das Eluat nicht klar und farblos ist, muss es verworfen werden.
Nach der Elution den Behälter (A) mit der Elutionsdurchstechflasche sofort durch den Behälter (B) mit der Durchstechflasche mit der bakteriostatischen Lösung (12) zum Schutz der Nadel ersetzen.
Elutionsvolumen
Der Generator Elumatic III ist für die Elution der gesamten verfügbaren Technetium (99mTc)-Aktivität in 5 ml konzipiert. Fraktionierte Elutionen sind daher unnötig. Andererseits kann die Elution in größeren Volumen wie 10 oder 14 ml erfolgen.
Verwendungsmöglichkeiten
Die auf dem Etikett angegebene Aktivität des Elumatic III ist in verfügbarem Technetium (99mTc) zum Kalibrierzeitpunkt (12 Uhr MEZ) ausgedrückt.
Die verfügbare Aktivität des Technetium (99mTc) ist abhängig:
- von der Molybdän (99Mo)-Aktivität zum Zeitpunkt der Elution;
- von der Zeitspanne seit der letzten Elution.
Die maximale Radioaktivität des eluierbaren Natriumpertechnetats (99mTc) jeder Generatorgröße kann durch Bezugnahme auf folgende Tabelle bestimmt werden:
TABELLE 4
|
-8 |
-7 |
-6 |
-5 |
-4 |
-3 |
-2 |
-1 |
0 |
+ 1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
+9 |
+ 10 |
+ 11 |
+ 12 |
+ 13 |
+ 14 | |||
|
GBq |
2 |
15,02 |
11,67 |
9,07 |
7,05 |
5,48 |
4,26 |
3,31 |
2,57 |
2 |
1,55 |
1,21 |
0,94 |
0,73 |
0,57 |
0,44 |
0,34 |
0,27 |
0,21 |
0,16 |
0,13 |
0,10 |
0,08 |
0,06 |
2 |
|
GBq |
4 |
30,03 |
23,34 |
18,14 |
14,10 |
10,96 |
8,52 |
6,62 |
5,15 |
4 |
3,11 |
2,42 |
1,88 |
1,46 |
1,13 |
0,88 |
0,69 |
0,53 |
0,41 |
0,32 |
0,25 |
0,19 |
0,15 |
0,12 |
4 |
|
GBq |
6 |
45,05 |
35,01 |
27,21 |
21,15 |
16,44 |
12,78 |
9,93 |
7,72 |
6 |
4,66 |
3,62 |
2,82 |
2,19 |
1,70 |
1,32 |
1,03 |
0,80 |
0,62 |
0,48 |
0,38 |
0,29 |
0,23 |
0,18 |
6 |
|
GBq |
8 |
60,07 |
46,69 |
36,29 |
28,20 |
21,92 |
17,04 |
13,24 |
10,29 |
8 |
6,22 |
4,83 |
3,76 |
2,92 |
2,27 |
1,76 |
1,37 |
1,07 |
0,83 |
0,64 |
0,50 |
0,39 |
0,30 |
0,24 |
8 |
|
GBq |
10 |
75,08 |
58,36 |
45,36 |
35,25 |
27,40 |
21,30 |
16,55 |
12,87 |
10 |
7,77 |
6,04 |
4,70 |
3,65 |
2,84 |
2,20 |
1,71 |
1,33 |
1,04 |
0,80 |
0,63 |
0,49 |
0,38 |
0,29 |
10 |
|
GBq |
12 |
90,10 |
70,03 |
54,43 |
42,31 |
32,88 |
25,56 |
19,86 |
15,44 |
12 |
9,33 |
7,25 |
5,63 |
4,38 |
3,40 |
2,65 |
2,06 |
1,60 |
1,24 |
0,96 |
0,75 |
0,58 |
0,45 |
0,35 |
12 |
|
GBq |
16 |
120,1 3 |
93,37 |
72,57 |
56,41 |
43,84 |
34,08 |
26,49 |
20,59 |
16 |
12,44 |
9,67 |
7,51 |
5,84 |
4,54 |
3,53 |
2,74 |
2,13 |
1,66 |
1,29 |
1,00 |
0,78 |
0,60 |
0,47 |
16 |
|
GBq |
20 |
150,1 6 |
116,7 1 |
90,72 |
70,51 |
54,80 |
42,59 |
33,11 |
25,73 |
20 |
15,54 |
12,08 |
9,39 |
7,30 |
5,67 |
4,41 |
3,43 |
2,66 |
2,07 |
1,61 |
1,25 |
0,97 |
0,76 |
0,60 |
20 |
Hinweis: Die Tage mit dem Minuszeichen sind die Tage vor dem Datum auf dem Etikett (Kalibrierzeitpunkt), die Daten mit dem Pluszeichen sind die Tage nach diesem Datum.
Die verfügbaren Technetium (99mTc)-Aktivitäten bei Elutionen alle 24 Stunden lassen sich anhand von Tabelle 5 berechnen:
TABELLE 5
|
Vorhergehender Tag |
Kalibrierzeitpunkt | |||||||
|
-8 |
-7 |
-6 |
-5 |
-4 |
-3 |
-2 |
-1 |
0 |
|
751 |
584 |
454 |
353 |
274 |
213 |
166 |
129 |
100 |
|
Verfügbare Aktivität in % (99mTc), bezogen auf den Kalibrierzeitpunkt, an den vorhergehenden Tagen (gerundete Werte) | ||||||||
|
Kalibrierzeitpunkt |
Folgende Tage | |||||||||||||
|
0 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
+9 |
+ 10 |
+ 11 |
+ 12 |
+ 13 |
+14 |
|
100 |
78 |
60 |
47 |
36 |
28 |
22 |
17 |
13 |
10 |
8 |
6 |
5 |
4 |
3 |
|
Verfügbare Aktivität in % (99mTc), bezogen auf den Kalibrierzeitpunkt, an den Tagen danach (gerundete Werte) | ||||||||||||||
Es ist auch möglich, Elumatic III vor Ablauf von 24 Stunden zu eluieren, indem man "Teilzeit"-Elutionen durchführt. Tabelle 6 zeigt den Prozentsatz an Technetium (99mTc)-Aktivität, der nach Zeiten von 0 bis 23 Stunden erhalten werden kann.
TABELLE 6
|
Zeitspanne seit der letzten Elution (Stunden) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
23 |
|
Korrekturfaktor |
0,0 0 |
0,1 1 |
0,2 1 |
0,3 0 |
0,3 9 |
0,4 5 |
0,5 1 |
0,6 2 |
0,7 1 |
0,7 9 |
0,8 5 |
0,8 9 |
0,9 3 |
0,9 6 |
0,9 9 |
1,0 0 |
|
Zerfall von (99Mo) |
100 |
98, 95 |
97, 92 |
96, 90 |
95, 89 |
94, 88 |
93, 97 |
91, 94 |
90, 03 |
88, 16 |
86, 33 |
84, 53 |
82, 78 |
81, 05 |
79, 37 |
78, 54 |
|
% verfügbares (99mTc) (gerundete Werte) |
0 |
11 |
21 |
29 |
37 |
43 |
48 |
57 |
64 |
70 |
73 |
75 |
77 |
78 |
79 |
79 |
|
Verfügbare Aktivität in % der (99mTc)-Aktivität der vorhergehenden Elution (Werte gelten nur, wenn die Elution vor der vorhergehenden Elution 24 h zurückliegt) | ||||||||||||||||
Beispiele
a) Ein 10 GBq Generator wird 24 Stunden nach dem Kalibrierzeitpunkt eluiert. Die erzielte Technetium (99mTc)-Aktivität beträgt (Tabelle 5):
10 x
78
100
7,8 GBq
b) Derselbe Generator wird 6 Stunden später eluiert. Die erzielte Technetium (99mTc)-Aktivität beträgt (Tabellen 5 und 6):
7,8 x
48
100
3,7 GBq
c) Derselbe Generator wird 18 Stunden später, das heißt 48 Stunden nach dem Kalibrierzeitpunkt, eluiert. Die erforderlichen 24 Stunden zum Erreichen des (99Mo)-(99mTc)-Gleichgewichts sind noch nicht vergangen, und die Technetium (99mTc)-Aktivität beträgt anstatt 6,0 GBq (Tabellen 5 und 6: Korrekturfaktor):
93
100
5,6 GBq
Das wird in folgender Tabelle zusammengefasst:
TABELLE 7
|
Montag |
Dienstag |
Mittwoch |
Donnerstag |
Freitag | |||
|
Elutionszeit |
8.00 |
8.00 |
8.00 |
8.00 |
8.00 | ||
|
Eluierte Radioaktivität 10 GBq am Dienstag |
13 |
10 |
7,8 |
6,0 |
4,7 | ||
|
Elutionszeit |
8.00 |
8.00 |
8.00 |
14.00 |
8.00 |
12.00 |
8.00 |
|
Derselbe Generator zu verschiedenen Zeiten eluiert (GBq) |
13 |
10 |
7,8 |
3,7 |
5,6 |
2,1 |
4,5 |
Hinweis:
Wartet der Anwender 48 Stunden oder länger zwischen zwei Elutionen, erhält er die in Tabelle 5 angegebene Aktivität mit 1,1 multipliziert (dieser Faktor berücksichtigt das "Gleichgewicht", das nach 48 Stunden zwischen Molybdän (99Mo) und Technetium (99mTc) eintritt). Diese Bemerkung gilt vor allem:
- für die erste Elution; die vorhergehende Elution wurde mehrere Tage zuvor im Produktionslabor durchgeführt;
- wenn der Generator eine große Aktivität besitzt.
Vorteil der Teilzeit-Elutionen
Die potentielle Verwendung eines Generators kann durch die Teilzeitelutionen erheblich erhöht werden. Elumatic III hat den Vorteil eines geringen Elutionsvolumens. Durch die Wahl eines geeigneten Volumens für die Elutionsdurchstechflasche kann die gewünschte Volumenaktivität erzielt werden, selbst wenn die Zeitspanne zwischen zwei Elutionen nur wenige Stunden beträgt.
Beispiel:
Eine Elution von 10 GBq erfolgte um 10.00 Uhr in 14 ml. Die Volumenaktivität beträgt 0,71 GBq/ml. Eine neue Elution um 14.00 Uhr, 4 Stunden nach der ersten, ergibt 3,7 GBq. Wird diese Aktivität in 5 ml statt wie vorher 14 ml aufgefangen, beträgt die Volumenaktivität 0,74 GBq/ml und ist damit höher als am Morgen.
Tabelle 8 zeigt, dass über die Woche verteilt eine vergleichsweise konstante Volumenaktivität erzielt werden kann:
TABELLE 8
|
Kalibrier zeitpunkt |
Elutionen an folgenden Tagen | |||||
|
0 |
+1 |
+2 |
+3 |
+4 |
+5 | |
|
Eluierte GBq Aktivität |
10 |
7,8 |
6,0 |
4,7 |
3,6 |
2,8 |
|
Elutionsvolume ml n |
14 |
14 |
10 |
8* |
5 |
5 |
|
Volumenaktivit GBq/ml ät |
0,71 |
0,56 |
0,60 |
0,59 |
0,72 |
0,56 |
* Um ein Endvolumen von 8 ml zu erreichen, werden 3 ml der 0,9%igen Natriumchloridlösung zu den in eine TC-ELU-5-Durchstechflasche eluierten 5 ml hinzugegeben.
Qualitätskontrolle
Das Eluat sollte auf folgende Kriterien geprüft werden: Klarheit der Lösung, pH-Wert, Radioaktivität, Gamma-Spektrum.
Von dem Anwender ist bei Inbetriebnahme des Radionuklidgenerators entsprechend der Richtlinie Strahlenschutz in der Medizin eine Prüfung auf Molybdän-Durchbruch gemäß DIN 6854 durchzuführen.
Um den Gehalt an Molybdän (99Mo) vor der Injektion abzuschätzen, wird das Gammasstrahlungsspektrum einer Probe des Eluats von 37 MBq mit einem Natriumiodiddetektor mit einer Bleiabschirmung von 6 mm Dicke zwischen der Probe und dem Detektor untersucht.
Der Anzeigewert in der Region entsprechend dem 0,740 MeV Photon des Molybdän (99Mo) darf dabei nicht den Wert überschreiten, der bei Messung einer Standardlösung von 37 kBq Molybdän (99Mo) unter den gleichen Bedingungen erhalten wird. Dabei werden alle Messungen bezogen auf das Datum und die Stunde der Applikation berechnet.
Warnung:
Die maximale im Generator bei der Entgegennahme enthaltene Radioaktivität kann höher sein als auf dem Etikett am entsprechenden Kalibrierzeitpunkt angegeben. Zur Bestimmung der maximalen im Generator enthaltenen Radioaktivität zum Zeitpunkt der Entgegennahme siehe Tabelle 4, aus der die maximale Radioaktivität des eluierbaren Natriumpertechnetats (99mTc) für jede Generatorgröße hervorgeht.
Gewicht des (99mTc) + ("Tc) im Eluat
Das Molybdän (99Mo) wird in Technetium (99mTc) (87,6 % des Molybdän (99Mo) Zerfalls) und Technetium (99Tc) (12,4 % des Molybdän (99Mo)-99 Zerfalls) umgesetzt. Damit ist die eluierte Lösung nicht "trägerfrei". Das Gesamtgewicht ((99Tc) + (99mTc)), ausgedrückt in Mg im Eluat, kann mit der folgenden vereinfachten Formel berechnet werden:
, (99mTc) Aktivität im Eluat x k
W (^g) = *-1-f-
k = 5,142 x 10-3, wenn die Aktivität in GBq ausgedrückt wird.
F ist das Verhältnis zwischen der Zahl der Technetium (99mTc) (N99m) Atome und der Gesamtzahl der Technetiumatome (Nt):
F =
N99m
Nt
Die Werte dieses Verhältnisses, ausgedrückt als Zeit zwischen zwei Elutionen, werden in nachstehender Tabelle angegeben:
TABELLE 9
|
Stunden |
Tage | ||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 | |
|
0 |
- |
0,282 |
0,133 |
0,078 |
0,051 |
0,035 |
0,025 |
|
3 |
0,740 |
0,252 |
0,123 |
0,073 |
0,048 |
0,033 |
0,024 |
|
6 |
0,630 |
0,227 |
0,115 |
0,069 |
0,046 |
0,032 |
0,023 |
|
9 |
0,541 |
0,206 |
0,107 |
0,066 |
0,044 |
0,031 |
0,022 |
|
12 |
0,468 |
0,187 |
0,100 |
0,062 |
0,042 |
0,029 |
0,021 |
|
15 |
0,408 |
0,171 |
0,094 |
0,059 |
0,040 |
0,028 |
0,020 |
|
18 |
0,358 |
0,157 |
0,088 |
0,056 |
0,038 |
0,027 |
0,020 |
|
21 |
0,317 |
0,144 |
0,083 |
0,053 |
0,036 |
0,026 |
0,019 |
Beispiele:
1) Das Technetium (99mTc) aus einem Elumatic III wurde in 5 ml eluiert; die gemessene Aktivität beträgt 10 GBq; die vorhergehende Elution wurde 27 Stunden zuvor durchgeführt. Das Gewicht des Technetiumträgers ist:
W (pg) = 10 x 5,142 x10-3/0,252 = 0,204 pg
das entspricht 0,041 pg/ml.
2) Das Technetium (99mTc) wird 4 Tage nach der Herstellung aus einem Elumatic III eluiert, das ist die erste Elution für den Anwender. Bei einer Aktivität von 11 GBq (der Generator ist in der Gleichgewichtsrate, die am Ende der Tabelle 7 genannt wird), die in 5 ml eluiert wird, beträgt das Gewicht des Technetiumträgers:
W (pg) =11 x 5,142 x 10-3/0,051 = 1,11 pg
Das entspricht 0,222 pg/ml, das heißt 5mal so viel Träger wie im obenstehenden Beispiel. Obwohl sie gering ist, kann diese Technetium-Menge die Markierungsausbeute einiger Verbindungen beeinflussen.
Diese Bemerkung trifft nicht nur auf Elumatic III, sondern auf alle Technetium (99mTc)-Generatoren zu.
Tabelle 10 zeigt die Gewichtsvariation des Technetiumträgers bei einem 10 GBq Generator ab Dienstag bei täglicher Elution in Abständen von 24 Stunden unter der Voraussetzung, dass die erste Elution 3 Tage vor der vom Montag stattgefunden hat.
TABELLE 10
|
Montag |
Dienstag |
Mittwoch |
Donnersta g |
Freitag | |
|
Eluierte GBq Radioaktivität |
14,1 |
10 |
7,8 |
6,0 |
4,7 |
|
Gewicht des Technetiumträgers in pg für das gesamte Eluat |
0,933 |
0,182 |
0,142 |
0,109 |
0,086 |
13. VERKAUFSABGRENZUNG
Verschreibungspflichtig.
26