Elumatic Iii, Technetium[(99M)Tc]Radionuklidgenerator
Strahlenwarnzeichen
Radioaktives Arzneimittel Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator 2 - 20 GBq
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Natriumpertechnetat (99mTc)-Injektionslösung wird mittels eines (99Mo/99mTc)-Radionuklid-generators hergestellt. Technetium (99mTc) zerfällt unter Emission von Gamma-Strahlung mit einer mittleren Energie von 140 keV und einer Halbwertszeit von 6,01 Stunden zu Technetium (99Tc), das aufgrund seiner langen Halbwertszeit von 2,13 x 105 Jahren als quasistabil angesehen werden kann.
Der Radionuklidgenerator, der das an eine chromatographische Säule adsorbierte Mutternuklid Molybdän (99Mo) enthält, liefert die sterile Natriumpertechnetat (99mTc)-Injektionslösung.
Das Molybdän (99Mo) auf der Säule befindet sich im Gleichgewicht mit dem gebildeten Tochternuklid Technetium (99mTc). Die Generatoren werden mit den folgenden Molybdän (99Mo)-Aktivitäten zum Aktivitäts-Referenzzeitpunkt geliefert, woraus sich, unter der Annahme einer 100%igen Ausbeute und einem Zeitabstand von 24 h zum vorherigen Elutionsvorgang sowie unter Berücksichtigung des Branchfaktors (Korrekturfaktor) von etwa 87 % für Molybdän (99Mo), die folgenden Technetium (99mTc)-Aktivitäten ergeben.
|
99mT c Aktivität (maximale theoretisch eluierbare Aktivität am Kalibrierzeitpunkt, 12:00 Uhr MEZ) |
2 |
4 |
6 |
8 |
10 |
12 |
16 |
20 |
GBq |
|
99Mo Aktivität (am Kalibrierzeitpunkt, 12:00 uhr MEZ) |
2,5 |
5 |
7 |
9,5 |
12 |
14,5 |
19 |
24 |
GBq |
Sonstiger Bestandteil mit bekannter Wirkung:
1 ml Natriumpertechnetat (99mTc)-Lösung enthält 3,6 mg Natrium.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Radionuklidgenerator
4.1 Anwendungsgebiete
Dieses Arzneimittel ist ein Diagnostikum.
Das Eluat (Natriumpertechnetat (99mTc)-Injektionslösung) aus dem Radionuklidgenerator wird angewendet zur
• Radiomarkierung von Kits für radioaktive Arzneimittel, die zur radioaktiven Markierung mit einer solchen Lösung entwickelt und zugelassen wurden.
• Schilddrüsen-Szintigraphie: Direkte Darstellung und Messung der Schilddrüsenaufnahme, zum Erhalt von Informationen über Größe, Lage, Nodularität und Funktion der Drüse im Falle einer Schilddrüsenerkrankung.
• Speicheldrüsen-Szintigraphie: Diagnostik chronischer Sialadenitiden (z. B. SjögrenSyndrom) sowie Beurteilung der Speicheldrüsenfunktion und der Durchgängigkeit des Speichelganges bei Erkrankungen der Speicheldrüsen und zur Kontrolle des Ansprechens auf therapeutische Maßnahmen (insbesondere Radioiodtherapie).
• Lokalisierung ektopischer Magenschleimhaut (Meckel-Divertikel).
• Tränengang-Szintigraphie: zur Beurteilung funktioneller Störungen des Tränenflusses und zur Kontrolle des Ansprechens auf therapeutische Maßnahmen.
4.2 Dosierung und Art der Anwendung
Dosierung
Wenn Natriumpertechnetat (99mTc) intravenös verabreicht wird, können die Aktivitäten in Abhängigkeit von der erforderlichen klinischen Information und den verwendeten Geräten stark variieren. Die Injektion von Aktivitäten, die über den lokalen diagnostischen Referenzwerten liegen, ist für die betreffende Indikation zu rechtfertigen. Folgende Aktivitäten werden empfohlen:
Erwachsene (70 kg) und ältere Menschen
• Schilddrüsen-Szintigraphie:
• Speicheldrüsen-Szintigraphie:
20 - 80 MBq
30 - 150 MBq für statische Bilder und bis zu 370 MBq für dynamische Bilder
• Szintigraphie des Meckel-Divertikels: 300 - 400 MBq
• Tränengang-Szintigraphie: 2 - 4 MBq pro Tropfen pro Auge
Eingeschränkte Nierenfunktion
Da es bei Patienten mit eingeschränkter Nierenfunktion zu einer erhöhten Strahlenbelastung kommen kann, ist die zu verabreichende Aktivität sorgfältig abzuwägen.
Kinder und Jugendliche
Die Anwendung bei Kindern und Jugendlichen muss unter Berücksichtigung der klinischen Notwendigkeit und Beurteilung des Nutzen-Risiko-Verhältnisses in dieser Patientengruppe sorgfältig abgewogen werden.
Bei Kindern und Jugendlichen muss die zu verabreichende Aktivität angepasst und kann gemäß den Empfehlungen der Dosierungskarte für Kinder der Europäischen Gesellschaft für Nuklearmedizin (EANM) berechnet werden - durch Multiplikation der Basisaktivitäten (zu Berechnungszwecken) mit dem gewichtsabhängigen Korrekturfaktor (siehe Tabelle 1).
A[MBq]verabreicht = Basisaktivität * Faktor
Schilddrüsen-Szintigraphie
Verabreichte Aktivität [MBq] = 5,6 MBq x Korrekturfaktor (Tabelle 1).
Eine Mindestaktivität von 10 MBq ist erforderlich, um eine ausreichende Bildqualität zu erhalten.
Nachweis/Lokalisierung ektopischer Magenschleimhaut Verabreichte Aktivität [MBq] = 10,5 MBq x Korrekturfaktor (Tabelle 1).
Eine Mindestaktivität von 20 MBq ist erforderlich, um eine ausreichende Bildqualität zu erhalten.
Tabelle 1: Gewichtsabhängige Korrekturfaktoren bei Kindern und Jugendlichen (für Schilddrüsen-Szintigraphie und Nachweis/Lokalisierung ektopischer Magenschleimhaut) entsprechend EANM-Richtlinien von Mai 2008
|
Gewicht [kg] |
Faktor |
Gewicht [kg] |
Faktor |
Gewicht [kg] |
Faktor |
|
3 |
1 |
22 |
5,29 |
42 |
9,14 |
|
4 |
1,14 |
24 |
5,71 |
44 |
9,57 |
|
6 |
1,71 |
26 |
6,14 |
46 |
10,00 |
|
8 |
2,14 |
28 |
6,43 |
48 |
10,29 |
|
10 |
2,71 |
30 |
6,86 |
50 |
10,71 |
|
12 |
3,14 |
32 |
7,29 |
52-54 |
11,29 |
|
14 |
3,57 |
34 |
7,72 |
56-58 |
12,00 |
|
16 |
4,00 |
36 |
8,00 |
60-62 |
12,71 |
|
18 |
4,43 |
38 |
8,43 |
64-66 |
13,43 |
|
20 |
4,86 |
40 |
8,86 |
68 |
14,00 |
Speicheldrüsen-Szintigraphie
Die Arbeitsgruppe Pädiatrie der EANM (1990) empfiehlt, die an ein Kind zu verabreichende Aktivität anhand der kleinsten Dosierung für Erwachsene angepasst an das Körpergewicht des Kindes gemäß der nachstehenden Tabelle 2 zu berechnen. Eine Mindestaktivität von 10 MBq ist erforderlich, um eine ausreichende Bildqualität zu erhalten.
Tabelle 2: Gewichtsabhängige Korrekturfaktoren bei Kindern und Jugendlichen (für Speicheldrüsen-Szintigraphie) entsprechend Empfehlungen der EANM 1990
|
Gewicht [kg] |
Faktor |
Gewicht [kg] |
Faktor |
Gewicht [kg] |
Faktor |
|
3 |
0,1 |
22 |
0,50 |
42 |
0,78 |
|
4 |
0,14 |
24 |
0,53 |
44 |
0,80 |
|
6 |
0,19 |
26 |
0,56 |
46 |
0,82 |
|
8 |
0,23 |
28 |
0,58 |
48 |
0,85 |
|
10 |
0,27 |
30 |
0,62 |
50 |
0,88 |
|
12 |
0,32 |
32 |
0,65 |
52-54 |
0,90 |
|
14 |
0,36 |
34 |
0,68 |
56-58 |
0,92 |
|
16 |
0,40 |
36 |
0,71 |
60-62 |
0,96 |
|
18 |
0,44 |
38 |
0,73 |
64-66 |
0,98 |
|
20 |
0,46 |
40 |
0,76 |
68 |
0,99 |
Szintigraphie der Tränengänge
Die empfohlenen Aktivitäten gelten sowohl für Erwachsene als auch für Kinder.
Art der Anwendung
Zur intravenösen Anwendung oder zur Anwendung am Auge.
Zur Mehrfachanwendung.
Hinweise zur Zubereitung des Arzneimittels vor der Anwendung, siehe Abschnitt 12.
Zur Vorbereitung der Patienten, siehe Abschnitt 4.4.
Bei Schilddrüsen-Szintigraphie, Speicheldrüsen-Szintigraphie und zum Nachweis/zur Lokalisierung ektopischer Magenschleimhaut wird die Natriumpertechnetat (99mTc)-Lösung als intravenöse Injektion verabreicht. Bei der Tränengang-Szintigraphie werden die Tropfen in jedes Auge einzeln eingetropft (Anwendung am Auge).
Bildaufnahme
Schilddrüsen-Szintigraphie: 20 Minuten nach intravenöser Injektion.
Speicheldrüsen-Szintigraphie: unmittelbar nach der intravenösen Injektion und in regelmäßigen Abständen für 15 Minuten.
Nachweis/Lokalisierung ektopischer Magenschleimhaut: unmittelbar nach der intravenösen Injektion und in regelmäßigen Abständen für 30 Minuten.
Tränengang-Szintigraphie: dynamische Aufnahmen innerhalb von 2 Minuten nach dem Eintropfen, gefolgt von statischen Aufnahmen in regelmäßigen Abständen innerhalb von 20 Minuten.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Potenzial für Überempfindlichkeitsreaktionen oder anaphylaktische Reaktionen Bei Auftreten von Überempfindlichkeitsreaktionen oder anaphylaktischen Reaktionen muss die Verabreichung des Arzneimittels sofort abgebrochen und, falls erforderlich, eine intravenöse Behandlung eingeleitet werden. Um sofortige Notfallmaßnahmen ergreifen zu können, müssen die erforderlichen Arzneimittel sowie die entsprechende Notfallausrüstung (z. B. Endotrachealtubus und Beatmungsgerät) griffbereit sein.
Individuelles Nutzen-Risiko-Verhältnis
Die Strahlenexposition muss bei jedem Patienten durch den erwarteten Nutzen gerechtfertigt sein. Die zu verabreichende Aktivität darf nicht höher bemessen werden, als für den Erhalt der diagnostischen Information erforderlich ist.
Eingeschränkte Nierenfunktion
Da es bei diesen Patienten zu einer erhöhten Strahlenbelastung kommen kann, ist das NutzenRisiko-Verhältnis sorgfältig abzuwägen.
Kinder und Jugendliche
Angaben zur Anwendung bei Kindern und Jugendlichen, siehe Abschnitt 4.2.
Da die effektive Dosis pro MBq größer ist als bei Erwachsenen, ist eine besonders sorgfältige Indikationsstellung erforderlich (siehe Abschnitt 11).
Eine Blockade der Schilddrüsen (ausgenommen bei Schilddrüsen-Szintigraphie) ist bei Kindern und Jugendlichen besonders wichtig.
Patientenvorbereitung
Bei bestimmten Indikationen ist unter Umständen eine Vorbehandlung der Patienten mit Schilddrüsenblockern bzw. Thyreostatika erforderlich.
Patienten sollten vor der Untersuchung gut hydriert sein und aufgefordert werden, in den ersten Stunden nach der Untersuchung so oft wie möglich die Blase zu entleeren, um die Strahlenexposition zu vermindern.
Zur Vermeidung falsch positiver Ergebnisse oder zur Minimierung der Strahlung durch Verringerung der Pertechnetat (99mTc)-Anreicherung in der Schild- oder Speicheldrüse sollte vor einer Tränengang-Szintigraphie oder Szintigraphie des Meckel-Divertikels ein Schilddrüsenblocker verabreicht werden. Im Gegensatz dazu darf vor Schilddrüsen-, Nebenschilddrüsen- oder Speicheldrüsen-Szintigraphie kein Schilddrüsenblocker angewendet werden.
Vor Anwendung der Natriumpertechnetat (99mTc)-Lösung zur Szintigraphie eines MeckelDivertikels sollte der Patient 3 bis 4 Stunden nüchtern bleiben, um die Darmperistaltik gering zu halten.
Nach einer in wVo-Markierung von Erythrozyten mit Zinnionen als Reduktionsmittel wird Natriumpertechnetat (99mTc) primär in Erythrozyten eingebaut. Daher sollte eine MeckelSzintigraphie vor oder erst einige Tage nach einer in wVo-Markierung von Erythrozyten erfolgen.
Nach der Untersuchung
Enger Kontakt mit Säuglingen und schwangeren Frauen ist während der ersten 12 Stunden einzuschränken.
Besondere Warnhinweise
Die Natriumpertechnetat (99mTc)-Injektionslösung enthält 3,6 mg/ml Natrium.
Abhängig vom Zeitpunkt der Verabreichung der Injektion kann der dem Patienten verabreichte Natriumgehalt in manchen Fällen größer als 1 mmol (23 mg) sein. Bei Patienten, die eine kochsalzarme Diät einhalten müssen, ist dies zu berücksichtigen.
Wird die Natriumpertechnetat (99mTc)-Lösung für die Markierung eines Kits verwendet, muss bei Bestimmung des Gesamt-Natriumgehalts das Natrium im Eluat und im Kit berücksichtigt werden. Siehe Gebrauchsinformation des betreffenden Kits.
Bei der Speicheldrüsen-Szintigraphie muss mit einer geringeren Spezifität der Methode im Vergleich zu MR-Sialographie gerechnet werden.
Hinweise zur Vermeidung von Gefahren für die Umwelt, siehe Abschnitt 6.6.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Atropin, Isoprenalin und Analgetika können eine Verzögerung der Magenentleerung verursachen und dadurch bei Abdomendarstellungen eine Umverteilung des Pertechnetats (99mTc) bewirken.
Laxanzien sind abzusetzen, da sie zu einer Reizung des Gastrointestinaltrakts führen können. Kontrastmitteluntersuchungen (z. B. mit Barium) und Untersuchungen des oberen Gastrointestinaltrakts sind innerhalb von 48 Stunden vor Verabreichung von Pertechnetat (99mTc) zur Szintigraphie eines Meckel- Divertikels zu vermeiden.
Viele pharmakologische Substanzen sind dafür bekannt, die Aufnahme in die Schilddrüse zu beeinflussen:
• Thyreostatika (z. B. Carbimazol oder andere Imidazolderivative wie Propylthiouracil), Salizylate, Steroide, Natrium-Nitroprussid, Natrium-Sulfobromophthalein und Perchlorat sollten vor der Schilddrüsen-Szintigraphie für 1 Woche nicht verabreicht werden.
• Phenylbutazon und Expektoranzien sollten für 2 Wochen nicht verabreicht werden.
• Natürliche oder synthetische Schilddrüsenhormone (z. B. Thyroxin-Natrium, Liothyronin-Natrium, Schilddrüsenextrakt) sollten für 2-3 Wochen nicht verabreicht werden.
• Amiodaron, Benzodiazepine und Lithium sollten für 4 Wochen nicht verabreicht werden.
• Intravenöse Kontrastmittel sollten innerhalb von 1-2 Monaten vor der Untersuchung nicht verabreicht worden sein.
4.6 Fertilität, Schwangerschaft und Stillzeit
Frauen im gebärfähigen Alter
Falls die Verabreichung radioaktiver Arzneimittel an Frauen im gebärfähigen Alter erforderlich ist, ist es wichtig festzustellen, ob diese Frau schwanger ist oder nicht. Jede Frau mit ausgebliebener Menstruation muss als schwanger betrachtet werden bis das Gegenteil bewiesen ist. Bestehen Zweifel hinsichtlich einer möglichen Schwangerschaft (falls eine Regelblutung ausgeblieben ist, falls die Regelblutungen sehr unregelmäßig sind usw.) müssen der Patientin immer alternative Untersuchungsmethoden angeboten werden, bei denen keine ionisierende Strahlung eingesetzt wird (sofern es diese gibt).
Schwangerschaft
Natriumpertechnetat (99mTc) darf bei schwangeren Frauen nur bei medizinischer Notwendigkeit angewendet werden und wenn der zu erwartende individuelle Nutzen das Risiko für Mutter und Kind übersteigt. Alternativ sollten nicht-radiologische Verfahren zur Diagnostik in Betracht gezogen werden.
99mTc (als freies Pertechnetat) ist plazentagängig.
Stillzeit
Bevor ein radioaktives Arzneimittel bei einer stillenden Mutter angewendet wird, sollte überlegt werden, ob die Untersuchung bis zum Ende der Stillzeit verschoben werden kann und ob das am besten geeignete radioaktive Arzneimittel gewählt wurde unter Berücksichtigung der Ausscheidung von Radioaktivität in die Muttermilch. In den Fällen, bei denen die Anwendung eines radioaktiven Arzneimittels unverzichtbar ist, muss das Stillen für mindestens 12 Stunden unterbrochen und die abgepumpte Muttermilch verworfen werden.
Enger Kontakt mit Säuglingen ist während dieser Zeit einzuschränken.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Natriumpertechnetat (99mTc)-Lösung hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Es liegen Angaben zu unerwünschten Wirkungen aus Spontanmeldungen vor. Bei den berichteten Wirkungen handelte es sich um anaphylaktoide Reaktionen, vegetative Reaktionen sowie verschiedene Arten von Reaktionen am Verabreichungsort der Injektion. Natriumpertechnetat (99mTc) aus dem Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator wird zur radioaktiven Markierung verschiedener Substanzen verwendet. Diese Arzneimittel haben im Allgemeinen ein höheres Nebenwirkungspotential als Pertechnetat (99mTc). Daher sind die berichteten Nebenwirkungen eher den markierten Substanzen als Pertechnetat (99mTc) zuzuschreiben. Welche Arten von Nebenwirkungen nach intravenöser Verabreichung der Pertechnetat (99mTc)-markierten Zubereitung auftreten können, hängt von der jeweiligen Substanz ab. Die entsprechenden Angaben sind in der Fachinformation des jeweiligen Kits enthalten, das zur Zubereitung des radioaktiven Arzneimittels verwendet wird.
Liste der Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt: Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Erkrankungen des Immunsystems
Häufigkeit nicht bekannt*: anaphylaktoide Reaktionen (z. B. Dyspnoe, Koma, Urtikaria, Erythem, Ausschlag, Pruritus, Ödem an verschiedenen Stellen, z. B. Gesichtsödem)
Erkrankungen des Nervensystems
Häufigkeit nicht bekannt*: vasovagale Reaktionen (z. B. Synkope, Tachykardie, Bradykardie, Schwindelgefühl, Kopfschmerz, verschwommenes Sehen, Hitzegefühl)
Erkrankungen des Gastrointestinaltrakts Häufigkeit nicht bekannt*: Erbrechen, Übelkeit, Diarrhö
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufigkeit nicht bekannt*: Reaktionen an der Injektionsstelle aufgrund von Extravasat (z. B. Cellulitis, Schmerz, Erythem, Schwellung)
* Nebenwirkungen aus Spontanmeldungen
Ionisierende Strahlen können Krebs und Erbgutveränderungen verursachen. Da die effektive Strahlendosis bei Gabe der maximalen empfohlenen Aktivität von 400 MBq bei 5,2 mSv liegt, sind diese Effekte mit geringer Wahrscheinlichkeit zu erwarten.
Beschreibung ausgewählter Nebenwirkungen
Anaphylaktische Reaktionen (z. B. Dyspnoe, Koma, Urtikaria, Erythem, Ausschlag, Pruritus, Ödem an verschiedenen Stellen, z. B. Gesichtsödem)
Anaphylaktische Reaktionen wurden nach intravenöser Injektion von Natrium-perchtechnetat (99mTc) berichtet und beinhalten verschiedene Haut- oder Atemwegsymptome wie Hautreizungen, Ödeme oder Dyspnoe.
Vegetative Reaktionen (Erkrankungen des Nervensystems und des Gastrointestinaltrakts) Einzelfälle schwerer vegetativer Reaktionen wurden berichtet, jedoch handelte es sich bei den meisten berichteten Nebenwirkungen um gastrointestinale Reaktionen wie Übelkeit oder Erbrechen. Andere Berichte beinhalten vasovagale Reaktionen wie Kopfschmerz oder Schwindelgefühl. Vegetative Wirkungen werden eher auf die Untersuchungssituation als auf Technetium (99mTc) zurückgeführt, vor allem bei ängstlichen Patienten.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Andere Berichte beschreiben lokale Reaktionen an der Injektionsstelle. Solche Reaktionen werden durch Extravasation des radioaktiven Materials während der Injektion verursacht. Die beobachten Reaktionen reichen von lokaler Schwellung bis hin zur Cellulitis. Abhängig von der verabreichten Radioaktivität und der markierten Substanz kann eine größere Extravasation eine chirurgische Behandlung erfordern.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Im Fall einer Strahlenüberdosis mit Natriumpertechnetat (99mTc) sollte die vom Patienten absorbierte Strahlendosis, wenn möglich, durch beschleunigte Ausscheidung des Radionuklids aus dem Körper (durch Defäkation, forcierte Diurese und möglichst häufiges Entleeren der Blase) verringert werden.
Die Aufnahme in die Schilddrüse, Speicheldrüsen und die Magenschleimhaut kann deutlich vermindert werden, wenn Natriumperchlorat unmittelbar nach einer versehentlichen zu hohen Dosis von Natriumpertechnetat (99mTc) verabreicht wird.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Radiodiagnostika, verschiedene Radiodiagnostika für die Schilddrüse, ATC-Code: V09FX01
Bei Dosierungen in den für diagnostische Zwecke üblichen Bereichen wurden keine pharmakodynamischen Wirkungen beobachtet.
5.2 Pharmakokinetische Eigenschaften
Verteilung
Das Pertechnetat-Ion hat eine ähnliche biologische Verteilung wie Iodid- und Perchlorat-Ionen und reichert sich vorübergehend in den Speicheldrüsen, im Plexus chorioideus, im Magen (in der Magenschleimhaut) und in der Schilddrüse an und werden von dort unverändert ausgeschieden. Das Pertechnetat-Ion weist auch eine Tendenz zur Anreicherung in Gebieten erhöhter Vaskularisierung oder mit abnormer Gefäßpermeabilität auf, vor allem wenn es durch Vorbehandlung mit Schilddrüsenblockern zur Hemmung der Aufnahme in Drüsenstrukturen kommt. Bei intakter Blut-Hirn-Schranke tritt Pertechnetat (99mTc) nicht in das Hirngewebe über.
Organaufnahme
Im Blut liegen 70-80 % des intravenös injizierten Natriumpertechnetats (99mTc) an Proteine, hauptsächlich unspezifisch an Albumin, gebunden vor. Der ungebundene Anteil (20-30 %) reichert sich vorrübergehen in Schilddrüse, Speicheldrüsen, Magen- und Nasenschleimhaut sowie Plexus chorioideus an.
Natriumpertechnetat (99mTc) wird im Gegensatz zu Iodid jedoch weder in die thyreoidale Hormonsynthese eingeschleust (organifiziert) noch im Dünndarm resorbiert. In der Schilddrüse wird die maximale Anreicherung, abhängig von Funktionszustand und Iodsättigung (bei Euthyreose ca. 0,3-3 %, bei Hyperthyreose und Iodmangel bis 25 %) etwa 20 Minuten nach Injektion erreicht und nimmt danach rasch wieder ab. Ähnliches gilt für die Belegzellen der Magenschleimhaut und die Azinuszellen der Speicheldrüsen.
Die Schilddrüse gibt Natriumpertechnetat (99mTc) unverändert in die Blutbahn ab, während Speicheldrüsen und Magen Natriumpertechnetat (99mTc) in den Speichel bzw. Magensaft sezernieren. Die Anreicherung durch die Speicheldrüse liegt in der Größenordnung von 0,5 % der applizierten Aktivität, wobei das Maximum nach etwa 20 Minuten erreicht wird. Eine Stunde nach Injektion liegt die Konzentration im Speichel um das 10-30fache höher als im Plasma. Die Exkretion kann durch Zitronensaft oder über eine Reizung des Parasympathikus beschleunigt werden, die Aufnahme wird durch Perchlorat vermindert.
Elimination
Die Plasmahalbwertszeit beträgt ungefähr 3 Stunden. Natriumpertechnetat (99mTc) erfährt im Organismus keine nennenswerte Metabolisierung. Ein Teil wird sehr schnell renal, der Rest langsamer über Faeces, Speichel- und Tränenflüssigkeit eliminiert. Die Ausscheidung erfolgt während der ersten 24 Stunden nach Injektion hauptsächlich über die Nieren (ca. 25 %) und während der folgenden 48 Stunden über den Stuhl. Ca. 50 % der verabreichten Aktivität werden innerhalb der ersten 50 Stunden ausgeschieden. Wenn die selektive Pertechnetat (99mTc)-Aufnahme in die Drüsenstrukturen durch Vorbehandlung mit Blockern gehemmt ist, erfolgt die Ausscheidung auf dem gleichen Wege, aber die Nierenclearance ist erhöht.
Die oben genannten Informationen sind nicht gültig, wenn Natriumpertechnetat (99mTc) zur Markierung anderer Radiopharmaka verwendet wird.
5.3 Präklinische Daten zur Sicherheit
Es liegen keine Daten zur akuten, subakuten und chronischen Toxizität nach Einmalverabreichung oder wiederholter Verabreichung vor.
Die bei klinischen Diagnoseverfahren verabreichte Menge an Natriumpertechnetat (99mTc) ist sehr klein und abgesehen von allergischen Reaktionen wurden keine anderen unerwünschten Wirkungen beobachtet.
Dieses Arzneimittel ist nicht zur regelmäßigen oder kontinuierlichen Anwendung bestimmt. Mutagenitätsstudien und Langzeit-Kanzerogenitätsstudien wurden nicht durchgeführt. Reproduktionstoxizität
Der Übertritt von Pertechnetat (99mTc) aus intravenös verabreichtem Natriumpertechnetat (99mTc) wurde bei Mäusen untersucht. Ohne vorherige Gabe von Perchlorat wurde bei Mäusen im trächtigen Uterus bis zu 60 % der injizierten (99mTc)-Dosis nachgewiesen. Die Gabe an Mäuse während der Trächtigkeit und/oder Laktation führte bei den Nachkommen zu vermindertem Gewicht, Haarlosigkeit und Sterilität.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
• Beutel mit Elutionslösung Natriumchlorid Natriumnitrat
Wasser für Injektionszwecke
• Elutionsdurchstechflaschen Stickstoff unter vermindertem Druck
Bakteriostatische Lösung: Lauryldimethylbenzylammonium-bromid (0,02 %)
Das Arzneimittel darf, außer mit den unter Abschnitt 12 aufgeführten, nicht mit anderen
Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Radionuklidgenerator: 20 Tage nach dem Herstellungsdatum.
Der Kalibrierzeitpunkt und das Verfalldatum sind auf der Kennzeichnung angegeben.
Natriumpertechnetat (99mTc)-Eluat: Im Kühlschrank lagern (2 °C - 8 °C) und innerhalb von
10 Stunden nach der Elution verwenden.
Elutionsdurchstechflaschen: 2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Radionuklidgenerator: Nicht über 25 °C lagern.
Eluat: Aufbewahrungsbedingungen nach Elution des Arzneimittels, siehe Abschnitt 6.3.
Die Lagerung muss in Übereinstimmung mit den nationalen Bestimmungen für radioaktives
Material erfolgen.
6.5 Art und Inhalt des Behältnisses und spezielles Zubehör für den Gebrauch
Das System besteht aus:
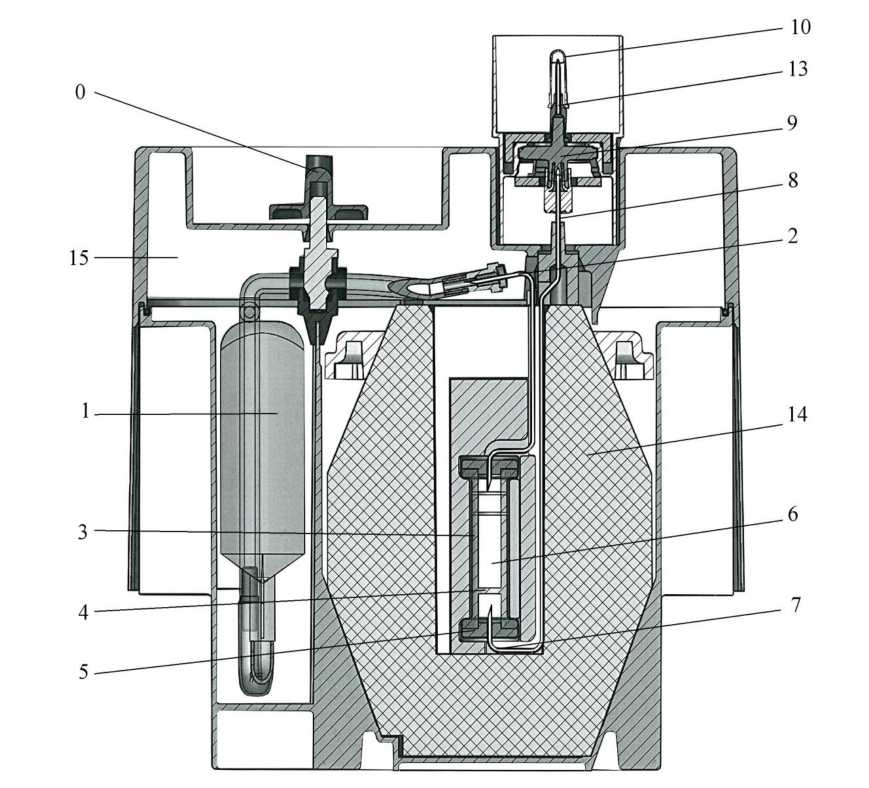
• Einem weichen Plastikbeutel (1) mit 250 ml Elutionsmittel (0,9 % Natriumchlorid und 0,005 % wässrige Natriumnitratlösung). Der Beutel ist durch eine Edelstahlnadel (2) mit der Spitze der Chromatographiesäule verbunden.
• Einer Chromatographiesäule aus Glas (3) mit einem Filter an der Unterseite (4), um ein Auslaufen des Aluminiumoxids zu verhindern. Die Säule ist an beiden Enden mit Deckeln verschlossen, die von Metallkapseln gehalten werden (5). Die Säule enthält das Aluminiumoxid (6), das die Molybdat-Ionen adsorbiert und gegenüber den Pertechnetat-Ionen inert ist.
• Einer Nadel, deren eines Ende mit der Unterseite der Säule verbunden ist (7). Am anderen Ende (8) ist sie mit einer Sterilfiltrationseinheit (9) verbunden. Die Sterilität der Elutionsnadel (13) dieser Einheit ist durch eine Schutzkappe (10) gewährleistet.
Die Säule und die Nadeln werden durch eine zylindrisch-konische Bleiabschirmung (14) mit einer
Mindestdicke von 52 mm geschützt. Das ganze System wird in eine parallelflache Verkleidung
(23 x 21 x 14 cm) aus geformtem Nylon (15) eingesetzt.
Neben der Elutionsstation ist ein Hohlraum mit einem Sicherheitsventil (0), das während des
Transports (O) geschlossen ist.
Der Generator wird in einem dichten Metallbehälter geliefert und enthält:
• 250 ml Elutionslösung in einem PP-Beutel, der mit der Säule verbunden ist.
• eine Durchstechflasche mit 0,25 ml bakteriostatischer Lösung (0,02 % Lauryl-dimethyl-benzylammonium-bromid in Wasser für Injektionszwecke).
• 10 x 15-ml-Teilvakuum-Durchstechflaschen für die Elution (TC-ELU-5), steril, pyrogenfrei und unter Teilvakuum, das die Elution von 5 ml erlaubt.
Ein Behälter (A) für die Elutionsdurchstechflasche (11) und ein Behälter (B) für die Durchstechflasche mit der bakteriostatischen Lösung (12) werden mit der ersten Bestellung geliefert (siehe Abbildungen in Abschnitt 12).
Elutionsdurchstechflaschen: 15 ml-Durchstechflasche aus farblosem Klarglas gemäß der Ph.Eur. Typ I, mit Chlorbutyl-Gummistopfen und Aluminiumkapseln verschlossen.
Packungsgrößen:
Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator enthält einen Radionuklidgenerator mit Aktivitäten von 2, 4, 6, 8, 10, 12, 16 oder 20 GBq Natriumpertechnetat (99mTc) zum Kalibrierzeitpunkt (12:00 Uhr MEZ).
Die Aktivität ist auf dem Etikett angegeben.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Allgemeine Warnhinweise
Radioaktive Arzneimittel dürfen nur von dazu berechtigten Personen in speziell dafür bestimmten klinischen Bereichen in Empfang genommen, gehandhabt und verabreicht werden. Die Entgegennahme, Lagerung, Anwendung sowie der Transport und die Entsorgung unterliegen den gesetzlichen Bestimmungen und/oder den entsprechenden Genehmigungen der zuständigen Aufsichtsbehörde.
Radiopharmaka sind in einer Art und Weise zuzubereiten, welche die Anforderungen in Bezug auf Strahlenschutz und pharmazeutische Qualität erfüllen. Entsprechende Vorsichtsmaßnahmen zur Einhaltung steriler Bedingungen sind zu treffen.
Falls die Unversehrtheit des Generators oder der Durchstechflaschen zu irgendeinem Zeitpunkt zweifelhaft ist, dürfen diese nicht verwendet werden.
Die Verabreichung ist so durchzuführen, dass das Risiko einer Kontamination des Arzneimittels und einer Strahlenexposition der Anwender so gering wie möglich bleibt. Eine geeignete Abschirmung ist zwingend erforderlich.
Die Verabreichung von radioaktiven Arzneimitteln setzt andere Personen einem Risiko durch externe Strahlung oder Kontamination durch Urin, Erbrochenes usw. aus. Daher müssen Strahlenschutzmaßnahmen gemäß den nationalen Bestimmungen eingehalten werden.
Vor Entsorgung des Generators muss die Restaktivität abgeschätzt werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
CIS bio GmbH
Member of IBA Molecular group of companies Alt-Moabit 91d 10559 Berlin
Tel. 01804 247 246 Fax 01804 247 329
8. ZULASSUNGSNUMMER
28406.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 9. Juni 2006
Datum der letzten Verlängerung der Zulassung: 05 Januar 2012
10. STAND DER INFORMATION
Juli 2016
11. DOSIMETRIE
Untenstehende Daten wurden der Veröffentlichung „Radiation Dose to Patients from Radiopharmaceuticals“ ICRP Publication 80 entnommen und unter folgenden Annahmen berechnet:
(i) Ohne Vorbehandlung mit einer blockierenden Substanz
|
Organ |
Aufgenommene Dosis je Einheit verabreichter Aktivität (mGy/MBq) | ||||
|
Erwachsene |
15 Jahre |
10 Jahre |
5 Jahre |
1 Jahr | |
|
Nebennieren |
0,0037 |
0,0047 |
0,0072 |
0,011 |
0,019 |
|
Blase |
0,018 |
0,023 |
0,030 |
0,033 |
0,060 |
|
Knochenoberfläche |
0,0054 |
0,0066 |
0,0097 |
0,014 |
0,026 |
|
Gehirn |
0,0020 |
0,0025 |
0,0041 |
0,0066 |
0,012 |
|
Brust |
0,0018 |
0,0023 |
0,0034 |
0,0056 |
0,011 |
|
Gallenblase |
0,0074 |
0,0099 |
0,016 |
0,023 |
0,035 |
|
Magen-Darm-T rakt | |||||
|
Magen |
0,026 |
0,034 |
0,048 |
0,078 |
0,16 |
|
Dünndarm |
0,016 |
0,020 |
0,031 |
0,047 |
0,082 |
|
Dickdarm |
0,042 |
0,054 |
0,088 |
0,14 |
0,27 |
|
Oberer Dickdarm |
0,057 |
0,073 |
0,12 |
0,20 |
0,38 |
|
Unterer Dickdarm |
0,021 |
0,028 |
0,045 |
0,072 |
0,13 |
|
Herz |
0,0031 |
0,0040 |
0,0061 |
0,0092 |
0,017 |
|
Nieren |
0,0050 |
0,0060 |
0,0087 |
0,013 |
0,021 |
|
Leber |
0,0038 |
0,0048 |
0,0081 |
0,013 |
0,022 |
|
Lunge |
0,0026 |
0,0034 |
0,0051 |
0,0079 |
0,014 |
|
Muskeln |
0,0032 |
0,0040 |
0,0060 |
0,0090 |
0,016 |
|
Speiseröhre |
0,0024 |
0,0032 |
0,0047 |
0,0075 |
0,014 |
|
Ovarien |
0,010 |
0,013 |
0,018 |
0,026 |
0,045 |
|
Bauchspeicheldrüse |
0,0056. |
0,0073 |
0,011 |
0,016 |
0,027 |
|
Rotes Knochenmark |
0,0036 |
0,0045 |
0,0066 |
0,0090 |
0,015 |
|
Speicheldrüse |
0,0093 |
0,012 |
0,017 |
0,024 |
0,039 |
|
Haut |
0,0018 |
0,0022 |
0,0035 |
0,0056 |
0,010 |
|
Milz |
0,0043 |
0,0054 |
0,0081 |
0,012 |
0,021 |
|
T estes |
0,0028 |
0,0037 |
0,0058 |
0,0087 |
0,016 |
|
Thymus |
0,0024 |
0,0032 |
0,0047 |
0,0075 |
0,014 |
|
Schilddrüse |
0,022 |
0,036 |
0,055 |
0,12 |
0,22 |
|
Uterus |
0,0081 |
0,010 |
0,015 |
0,022 |
0,037 |
|
Sonstige Gewebe |
0,0035 |
0,0043 |
0,0064 |
0,0096 |
0,017 |
|
Effektive Dosis (mSv/MBq) |
0,013 |
0,017 |
0,026 |
0,042 |
0,079 |
Die effektive Dosis, die sich aus der intravenösen Anwendung von 400 MBq Natrium-pertechnetat (99mTc) bei einem Erwachsenen mit einem Körpergewicht von 70 kg ergibt, beträgt etwa 5,2 mSv.
(ii) Nach Vorbehandlung mit einer blockierenden Substanz
|
Organ |
Aufgenommene Dosis je Einheit verabreichter Aktivität (mGy/MBq) | ||||
|
Erwachsene |
15 Jahre |
10 Jahre |
5 Jahre |
1 Jahr | |
|
Nebennieren |
0,0029 |
0,0037 |
0,0056 |
0,0086 |
0,016 |
|
Blase |
0,03 |
0,038 |
0,048 |
0,05 |
0,091 |
|
Knochenoberfläche |
0,0044 |
0,0054 |
0,0081 |
0,012 |
0,022 |
|
Gehirn |
0,002 |
0,0026 |
0,0042 |
0,0071 |
0,012 |
|
Brust |
0,0017 |
0,0022 |
0,0032 |
0,0052 |
0,010 |
|
Gallenblase |
0,003 |
0,0042 |
0,007 |
0,001 |
0,0013 |
|
Magen-Darm-T rakt | |||||
|
Magen |
0,0027 |
0,0036 |
0,0059 |
0,0086 |
0,015 |
|
Dünndarm |
0,0035 |
0,0044 |
0,0067 |
0,01 |
0,018 |
|
Dickdarm |
0,0036 |
0,0048 |
0,0071 |
0,01 |
0,018 |
|
Oberer Dickdarm |
0,0032 |
0,0043 |
0,0064 |
0,01 |
0,017 |
|
Unterer Dickdarm |
0,0042 |
0,0054 |
0,0081 |
0,011 |
0,0019 |
|
Herz |
0,0027 |
0,0034 |
0,0052 |
0,0081 |
0,014 |
|
Nieren |
0,0044 |
0,0054 |
0,0077 |
0,011 |
0,019 |
|
Leber |
0,0026 |
0,0034 |
0,0053 |
0,0082 |
0,015 |
|
Lunge |
0,0023 |
0,0031 |
0,0046 |
0,0074 |
0,013 |
|
Muskeln |
0,0025 |
0,0031 |
0,0047 |
0,0072 |
0,013 |
|
Speiseröhre |
0,0024 |
0,0031 |
0,0046 |
0,0075 |
0,014 |
|
Ovarien |
0,0043 |
0,0054 |
0,0078 |
0,011 |
0,019 |
|
Bauchspeicheldrüse |
0,003 |
0,0039 |
0,0059 |
0,0093 |
0,016 |
|
Rotes Knochenmark |
0,0025 |
0,0032 |
0,0049 |
0,0072 |
0,013 |
|
Haut |
0,0016 |
0,002 |
0,0032 |
0,0052 |
0,0097 |
|
Milz |
0,0026 |
0,0034 |
0,0054 |
0,0083 |
0,015 |
|
T estes |
0,003 |
0,004 |
0,006 |
0,0087 |
0,016 |
|
Thymus |
0,0024 |
0,0031 |
0,0046 |
0,0075 |
0,014 |
|
Schilddrüse |
0,0024 |
0,0031 |
0,005 |
0,0084 |
0,015 |
|
Uterus |
0,006 |
0,0073 |
0,011 |
0,014 |
0,023 |
|
Sonstige Gewebe |
0,0025 |
0,0031 |
0,0048 |
0,0073 |
0,013 |
|
Effektive Dosis (mSv/MBq) |
0,0042 |
0,0054 |
0,0077 |
0,011 |
0,019 |
Nach Vorbehandlung des Patienten mit einer blockierenden Substanz und Verabreichung von 400 MBq Natriumpertechnetat (99mTc) bei einem Erwachsenen mit einem Körpergewicht von 70 kg beträgt die effektive Dosis etwa 1,7 mSv.
Die Strahlendosis, die nach Anwendung von Natriumpertechnetat (99mTc) zur Szintigraphie des Tränenganges von der Augenlinse aufgenommen wird, beträgt schätzungsweise 0,038 mGy/MBq. Dies entspricht einer effektiven Dosis von weniger als 0,01 mSv bei einer verabreichten Aktivität von 4 MBq.
Die angegebenen Strahlenexpositionen gelten nur bei normaler Funktion aller Organe, die Natriumpertechnetat (99mTc) anreichern. Über- bzw. Unterfunktion (z. B. von Schilddrüse, Magenschleimhaut oder Nieren) sowie Störungen der Blut-Hirn-Schranke oder renale Abflussstörungen können zu veränderten, lokal auch stark erhöhten Strahlenexpositionen führen.
Die Oberflächendosisraten und die angereicherte Dosis hängen von vielen Faktoren ab. Die Strahlenexposition der Umgebung und für das Personal ist kritisch und sollte daher gemessen werden.
12. ANWEISUNGEN ZUR ZUBEREITUNG VON RADIOAKTIVEN ARZNEIMITTELN
Die Elution durch den Generator muss in Einrichtungen stattfinden, die hinsichtlich der Sicherheit der Anwendung von radioaktiven Arzneimitteln die nationalen Bestimmungen erfüllen.
Die eluierte Lösung ist eine klare und farblose Natriumpertechnetat (99mTc)-Lösung, mit einem pH-Wert zwischen 5 und 7 und einer radiochemischen Reinheit von mindestens 95 %.
Bei einer Verwendung der Natriumpertechnetat (99mTc)-Lösung zur Markierung eines Kits für ein radioaktives Arzneimittel beachten Sie bitte die Produktinformation des jeweiligen Kits.
Elution
Die üblichen Vorsichtsmaßnahmen in Bezug auf Sterilität und Strahlenschutz sind einzuhalten. Den Stopfen der Elutionsdurchstechflasche vor jeder Elution desinfizieren.
Warnhinweis
Keinen Ethanol oder Ethyläther zur Desinfektion der Nadel oder des Stopfens verwenden, da dies den Elutionsprozess beeinträchtigen kann.
Die Elutionsnadel (13) vor möglicher bakterieller Kontamination zwischen zwei Elutionen schützen, indem die Durchstechflasche mit der bakteriostatischen Lösung (12) auf die Nadel aufgesetzt wird.
Für zufriedenstellende Ergebnisse die nachstehende Abfolge beachten: Erste Elution:

BEVOR die Elutionsdurchstechflasche eingesetzt wird, das Sicherheitsventil ÖFFNEN (Nr. 0: ©). Das Ventil erst schließen, wenn der Generator nicht mehr verwendet wird, NIEMALS zwischen zwei Elutionen.
Zur Elution des Generators die Schutzkappe der Elutionsnadel (10) durch den Elutionsbehälter (A) mit einer Durchstechflasche (11) des gewünschten Elutionsvolumens ersetzen.
Die Elution kann durch das Bleiglasfenster (14) des Behälters (A) beobachtet werden. Mindestens drei Minuten warten, bis die Elution beendet ist.
Vor Gebrauch ist die Klarheit des Eluats zu überprüfen. Falls das Eluat nicht klar und farblos ist, muss es verworfen werden.
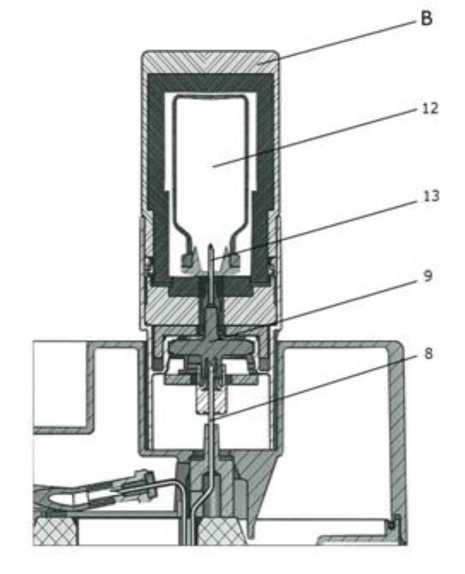
Nach der Elution den Behälter (A) mit der Elutionsdurchstechflasche sofort durch den Behälter (B) mit der Durchstechflasche mit der bakteriostatischen Lösung (12) zum Schutz der Nadel ersetzen.
Elutionsvolumen
Der Generator Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator ist für die Elution der gesamten verfügbaren Technetium (99mTc)-Aktivität in 5 ml konzipiert. Fraktionierte Elutionen sind daher unnötig. Andererseits kann die Elution in größeren Volumen wie 10 oder 14 ml erfolgen.
Verwendungsmöglichkeiten
Die auf dem Etikett angegebene Aktivität des Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator ist in verfügbarem Technetium (99mTc) zum Kalibrierzeitpunkt (12:00 Uhr MEZ) ausgedrückt.
Die verfügbare Aktivität des Technetium (99mTc) ist abhängig von:
• der Molybdän (99Mo)-Aktivität zum Zeitpunkt der Elution;
• der Zeitspanne seit der letzten Elution.
Die maximale Radioaktivität des eluierbaren Natriumpertechnetats (99mTc) jeder Generatorgröße kann durch Bezugnahme auf folgende Tabelle bestimmt werden:
Tabelle 3
|
-8 |
-7 |
-6 |
-5 |
-4 |
-3 |
-2 |
-1 |
0 |
+ 1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
+9 |
+ 10 |
+ 11 |
+ 12 |
+ 13 |
+ 14 | |||
|
GBq |
2 |
15,02 |
11,67 |
9,07 |
7,05 |
5,48 |
4,26 |
3,31 |
2,57 |
2 |
1,55 |
1,21 |
0,94 |
0,73 |
0,57 |
0,44 |
0,34 |
0,27 |
0,21 |
0,16 |
0,13 |
0,10 |
0,08 |
0,06 |
2 |
|
GBq |
4 |
30,03 |
23,34 |
18,14 |
14,10 |
10,96 |
8,52 |
6,62 |
5,15 |
4 |
3,11 |
2,42 |
1,88 |
1,46 |
1,13 |
0,88 |
0,69 |
0,53 |
0,41 |
0,32 |
0,25 |
0,19 |
0,15 |
0,12 |
4 |
|
GBq |
6 |
45,05 |
35,01 |
27,21 |
21,15 |
16,44 |
12,78 |
9,93 |
7,72 |
6 |
4,66 |
3,62 |
2,82 |
2,19 |
1,70 |
1,32 |
1,03 |
0,80 |
0,62 |
0,48 |
0,38 |
0,29 |
0,23 |
0,18 |
6 |
|
GBq |
8 |
60,07 |
46,69 |
36,29 |
28,20 |
21,92 |
17,04 |
13,24 |
10,29 |
8 |
6,22 |
4,83 |
3,76 |
2,92 |
2,27 |
1,76 |
1,37 |
1,07 |
0,83 |
0,64 |
0,50 |
0,39 |
0,30 |
0,24 |
8 |
|
GBq |
10 |
75,08 |
58,36 |
45,36 |
35,25 |
27,40 |
21,30 |
16,55 |
12,87 |
10 |
7,77 |
6,04 |
4,70 |
3,65 |
2,84 |
2,20 |
1,71 |
1,33 |
1,04 |
0,80 |
0,63 |
0,49 |
0,38 |
0,29 |
10 |
|
GBq |
12 |
90,10 |
70,03 |
54,43 |
42,31 |
32,88 |
25,56 |
19,86 |
15,44 |
12 |
9,33 |
7,25 |
5,63 |
4,38 |
3,40 |
2,65 |
2,06 |
1,60 |
1,24 |
0,96 |
0,75 |
0,58 |
0,45 |
0,35 |
12 |
|
GBq |
16 |
120,1 3 |
93,37 |
72,57 |
56,41 |
43,84 |
34,08 |
26,49 |
20,59 |
16 |
12,44 |
9,67 |
7,51 |
5,84 |
4,54 |
3,53 |
2,74 |
2,13 |
1,66 |
1,29 |
1,00 |
0,78 |
0,60 |
0,47 |
16 |
|
GBq |
20 |
150,1 6 |
116,7 1 |
90,72 |
70,51 |
54,80 |
42,59 |
33,11 |
25,73 |
20 |
15,54 |
12,08 |
9,39 |
7,30 |
5,67 |
4,41 |
3,43 |
2,66 |
2,07 |
1,61 |
1,25 |
0,97 |
0,76 |
0,60 |
20 |
Hinweis: Die Tage mit dem Minuszeichen sind die Tage vor dem Datum auf dem Etikett (Kalibrierzeitpunkt), die Daten mit dem Pluszeichen sind die Tage nach diesem Datum.
Die verfügbaren Technetium (99mTc)-Aktivitäten bei Elutionen alle 24 Stunden lassen sich anhand von Tabelle 4 berechnen:
Tabelle 4
|
Vorhergehender T ag |
Kalibrierzeitpunkt | |||||||
|
-8 |
-7 |
-6 |
-5 |
-4 |
-3 |
-2 |
-1 |
0 |
|
751 |
584 |
454 |
353 |
274 |
213 |
166 |
129 |
100 |
|
Verfügbare Aktivität in % (99mTc), bezogen auf den Kalibrierzeitpunkt, an den vorhergehenden Tagen (gerundete Werte) | ||||||||
|
Kalibrierzeitpunkt |
Folgende Tage | |||||||||||||
|
0 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
+9 |
+ 10 |
+ 11 |
+ 12 |
+ 13 |
+ 14 |
|
100 |
78 |
60 |
47 |
36 |
28 |
22 |
17 |
13 |
10 |
8 |
6 |
5 |
4 |
3 |
|
Verfügbare Aktivität in % (99mTc), bezogen auf den Kalibrierzeitpunkt, an den Tagen danach (gerundete Werte) | ||||||||||||||
Es ist auch möglich, Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator vor Ablauf von 24 Stunden zu eluieren, indem man "Teilzeit“-Elutionen durchführt. Tabelle 5 zeigt den Prozentsatz an Technetium (99mTc)-Aktivität, der nach Zeiten von 0 bis 23 Stunden erhalten werden kann.
Tabelle 5
|
Zeitspanne seit der letzten Elution (Stunden) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
23 |
|
Korrekturfaktor |
0,00 |
0,11 |
0,21 |
0,30 |
0,39 |
0,45 |
0,51 |
0,62 |
0,71 |
0,79 |
0,85 |
0,89 |
0,93 |
0,96 |
0,99 |
1,00 |
|
Zerfall von (99Mo) |
100 |
98,95 |
97,92 |
96,90 |
95,89 |
94,88 |
93,97 |
91,94 |
90,03 |
88,16 |
86,33 |
84,53 |
82,78 |
81,05 |
79,37 |
78,54 |
|
% verfügbares (99mTc) (gerundete Werte) |
0 |
11 |
21 |
29 |
37 |
43 |
48 |
57 |
64 |
70 |
73 |
75 |
77 |
78 |
79 |
79 |
|
Verfügbare Aktivität in % der (99mTc)-Aktivität der vorhergehenden Elution (Werte gelten nur, wenn die Elution vor der vorhergehenden Elution 24 h zurückliegt) | ||||||||||||||||
Beispiele
a) Ein 10 GBq Generator wird 24 Stunden nach dem Kalibrierzeitpunkt eluiert. Die erzielte Technetium (99mTc)-Aktivität beträgt (Tabelle 4):
10 x
78
100
7,8 GBq
b) Derselbe Generator wird 6 Stunden später eluiert. Die erzielte Technetium (99mTc)-Aktivität beträgt (Tabellen 4 und 5):
7,8 x
48
100
3,7 GBq
c) Derselbe Generator wird 18 Stunden später, das heißt 48 Stunden nach dem Kalibrierzeitpunkt, eluiert. Die erforderlichen 24 Stunden zum Erreichen des (99Mo)-(99mTc)-Gleichgewichts sind noch nicht vergangen, und die Technetium (99mTc)-Aktivität beträgt anstatt 6,0 GBq (Tabellen 4 und 5: Korrekturfaktor):
93
100
5,6 GBq
Das wird in folgender Tabelle zusammengefasst:
Tabelle 6
|
Montag |
Dienstag |
Mittwoch |
Donnerstag |
Freitag | |||
|
Elutionszeit |
8.00 |
8.00 |
8.00 |
8.00 |
8.00 | ||
|
Eluierte Radioaktivität 10 GBq am Dienstag |
13 |
10 |
7,8 |
6,0 |
4,7 | ||
|
Elutionszeit |
8.00 |
8.00 |
8.00 |
14.00 |
8.00 |
12.00 |
8.00 |
|
Derselbe Generator zu verschiedenen Zeiten eluiert (GBq) |
13 |
10 |
7,8 |
3,7 |
5,6 |
2,1 |
4,5 |
Hinweis
Wartet der Anwender 48 Stunden oder länger zwischen zwei Elutionen, erhält er die in T abelle 4 angegebene Aktivität mit 1,1 multipliziert (dieser Faktor berücksichtigt das "Gleichgewicht", das nach 48 Stunden zwischen Molybdän (99Mo) und Technetium (99mTc) eintritt). Diese Bemerkung gilt vor allem: 1
Beispiel
Eine Elution von 10 GBq erfolgte um 10:00 Uhr in 14 ml. Die Volumenaktivität beträgt 0,71 GBq/ml. Eine neue Elution um 14:00 Uhr, 4 Stunden nach der ersten, ergibt 3,7 GBq. Wird diese Aktivität in 5 ml statt wie vorher 14 ml aufgefangen, beträgt die Volumenaktivität 0,74 GBq/ml und ist damit höher als am Morgen.
Tabelle 7 zeigt, dass über die Woche verteilt eine vergleichsweise konstante Volumenaktivität erzielt werden kann:
Tabelle 7
|
Kalibrier zeitpunkt |
Elutionen an folgenden Tagen | ||||||
|
0 |
+1 |
+2 |
+3 |
+4 |
+5 | ||
|
Eluierte Aktivität |
GBq |
10 |
7,8 |
6,0 |
4,7 |
3,6 |
2,8 |
|
Elutionsvolumen |
ml |
14 |
14 |
10 |
81 |
5 |
5 |
|
Volumenaktivität |
GBq/ml |
0,71 |
0,56 |
0,60 |
0,59 |
0,72 |
0,56 |
* Um ein Endvolumen von 8 ml zu erreichen, werden 3 ml der 0,9%igen Natriumchloridlösung zu den in eine TC-ELU 5 Durchstechflasche eluierten 5 ml hinzugegeben.
Qualitätskontrolle
Das Eluat sollte auf folgende Kriterien geprüft werden: Klarheit der Lösung, pH-Wert, Radioaktivität, Gamma-Spektrum.
Von dem Anwender ist bei Inbetriebnahme des Radionuklidgenerators entsprechend der Richtlinie Strahlenschutz in der Medizin eine Prüfung auf Molybdän-Durchbruch gemäß DIN 6854 durchzuführen.
Um den Gehalt an Molybdän (99Mo) vor der Injektion abzuschätzen, wird das Gammastrahlungsspektrum einer Probe des Eluats von 37 MBq mit einem Natriumiodiddetektor mit einer Bleiabschirmung von 6 mm Dicke zwischen der Probe und dem Detektor untersucht.
Der Anzeigewert in der Region entsprechend dem 0,740 MeV Photon des Molybdän (99Mo) darf dabei nicht den Wert überschreiten, der bei Messung einer Standardlösung von 37 kBq Molybdän (99Mo) unter den gleichen Bedingungen erhalten wird. Dabei werden alle Messungen bezogen auf das Datum und die Stunde der Applikation berechnet.
Warnung
Die maximale im Generator bei der Entgegennahme enthaltene Radioaktivität kann höher sein als auf dem Etikett am entsprechenden Kalibrierzeitpunkt angegeben. Zur Bestimmung der maximalen im Generator enthaltenen Radioaktivität zum Zeitpunkt der Entgegennahme siehe Tabelle 3, aus der die maximale Radioaktivität des eluierbaren Natriumpertechnetats (99mTc) für jede Generatorgröße hervorgeht.
Üblicherweise kann das erste Eluat aus dem Generator verwendet werden, sofern nicht anders angegeben. Zur Kitmarkierung kann das Eluat auch 24 Stunden nach der letzten Elution verwendet werden, sofern in der Fachinformation des betreffenden Kits nicht die Verwendung eines frischen Eluats festgelegt ist.
Gewicht des ((99mTc) + (99Tc)) im Eluat
Das Molybdän (99Mo) wird in Technetium (99mTc) (87,6 % des Molybdän (99Mo)-Zerfalls) und Technetium (99Tc) (12,4 % des Molybdän (99Mo)-Zerfalls) umgesetzt. Damit ist die eluierte Lösung nicht "trägerfrei". Das Gesamtgewicht ((99Tc) + (99mTc)), ausgedrückt in Mg im Eluat, kann mit der folgenden vereinfachten Formel berechnet werden:
, (99mTc) Aktivität im Eluat x k
W (^g) = (-1-ef-
k = 5,142 x 10-3, wenn die Aktivität in GBq ausgedrückt wird.
F ist das Verhältnis zwischen der Zahl der Technetium (99mTc)-Atome (N99m) und der Gesamtzahl der Technetiumatome (Nt):
_ _ N99m
F = Nt
Die Werte dieses Verhältnisses, ausgedrückt als Zeit zwischen zwei Elutionen, werden in nachstehender Tabelle angegeben:
Tabelle 8
|
Stunden |
Tage | ||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 | |
|
0 |
- |
0,282 |
0,133 |
0,078 |
0,051 |
0,035 |
0,025 |
|
3 |
0,740 |
0,252 |
0,123 |
0,073 |
0,048 |
0,033 |
0,024 |
|
6 |
0,630 |
0,227 |
0,115 |
0,069 |
0,046 |
0,032 |
0,023 |
|
9 |
0,541 |
0,206 |
0,107 |
0,066 |
0,044 |
0,031 |
0,022 |
|
12 |
0,468 |
0,187 |
0,100 |
0,062 |
0,042 |
0,029 |
0,021 |
|
15 |
0,408 |
0,171 |
0,094 |
0,059 |
0,040 |
0,028 |
0,020 |
|
18 |
0,358 |
0,157 |
0,088 |
0,056 |
0,038 |
0,027 |
0,020 |
|
21 |
0,317 |
0,144 |
0,083 |
0,053 |
0,036 |
0,026 |
0,019 |
Beispiele
1) Das Technetium (99mTc) aus einem Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator wurde in 5 ml eluiert; die gemessene Aktivität beträgt 10 GBq; die vorhergehende Elution wurde 27 Stunden zuvor durchgeführt. Das Gewicht des Technetiumträgers ist:
W (qg) = 10 x 5,142 x10-3/0,252 = 0,204 Mg
das entspricht 0,041 qg/ml.
2) Das Technetium (99mTc) wird 4 Tage nach der Herstellung aus einem Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator eluiert, das ist die erste Elution für den Anwender. Bei einer Aktivität von 11 GBq (der Generator ist in der Gleichgewichtsrate, die am Ende der Tabelle 6 genannt wird), die in 5 ml eluiert wird, beträgt das Gewicht des Technetiumträgers:
W (Mg) =11 x 5,142 x 10-3/0,051 = 1,11 qg
Das entspricht 0,222 pg/ml, das heißt 5mal so viel Träger wie im obenstehenden Beispiel. Obwohl sie gering ist, kann diese Technetium-Menge die Markierungsausbeute einiger Verbindungen beeinflussen.
Diese Bemerkung trifft nicht nur auf Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator, sondern auf alle Technetium (99mTc)-Generatoren zu.
Tabelle 9 zeigt die Gewichtsvariation des Technetiumträgers bei einem 10 GBq Generator ab Dienstag bei täglicher Elution in Abständen von 24 Stunden unter der Voraussetzung, dass die erste Elution 3 Tage vor der vom Montag stattgefunden hat.
Tabelle 9
|
Montag |
Dienstag |
Mittwoch |
Donnerstag |
Freitag | |
|
Eluierte pR Radioaktivität q |
14,1 |
10 |
7,8 |
6,0 |
4,7 |
|
Gewicht des Technetiumträgers in pg für das gesamte Eluat |
0,933 |
0,182 |
0,142 |
0,109 |
0,086 |
13.
VERKAUFSABGRENZUNG
Verschreibungspflichtig.
22
für die erste Elution; die vorhergehende Elution wurde mehrere Tage zuvor im Produktionslabor durchgeführt;
• wenn der Generator eine große Aktivität besitzt.
Vorteil der Teilzeit-Elutionen
Die potentielle Verwendung eines Generators kann durch die Teilzeitelutionen erheblich erhöht werden. Elumatic III, Technetium[(99m)Tc]Radionuklidgenerator hat den Vorteil eines geringen Elutionsvolumens. Durch die Wahl eines geeigneten Volumens für die Elutionsdurchstechflasche kann die gewünschte Volumenaktivität erzielt werden, selbst wenn die Zeitspanne zwischen zwei Elutionen nur wenige Stunden beträgt.