Mova Nitrat Pipette
Fachinformation
1. Bezeichnung des Arzneimittels MOVA NITRAT PIPETTE®
Wirkstoff: Silbernitrat
2. Qualitative und quantitative Zusammensetzung
1 Pipette zu 0,5 ml enthält: Silbernitrat 5 mg (1%)
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Augentropfen
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur einmaligen Blennorrhoe-Prophylaxe Neugeborener (Crede'sche Prophylaxe) innerhalb der 1. Stunde nach der Geburt.
4.2 Dosierung und Art der Anwendung
Dosierung
Nach der Geburt wird jeweils 1 Tropfen in jedes Auge geträufelt.
Art der Anwendung
1. Bei der Anwendung von Mova Nitrat Pipette® wird das Tragen von Einmalhandschuhen empfohlen, um eine Schwarzfärbung der Haut durch Spritzer der Silbernitrat-Lösung zu vermeiden.
2. Beim Erstgebrauch das Aluminiumsachet an der markierten Stelle (— X —) aufschneiden und den Pipettenblock entnehmen.
3. Eine Pipette durch Abknicken und seitliches Abziehen vom Pipettenblock abtrennen.
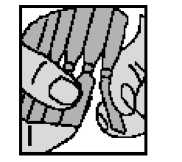
4. Den verbliebenen Pipettenblock in das Aluminiumsachet zurücklegen und gut verschließen, um die Pipetten vor Licht und Wärme zu schützen.
5. Die Pipette mit Daumen und Zeigefinger festhalten und mit dem Pipettenboden kurz 2 - 3 mal auf eine feste Unterlage klopfen, damit die Silbernitrat-Lösung in den unteren Teil der Pipette gelangt.
6. Die Pipette öffnen, indem die etikettierte Fahne abgedreht und gleichzeitig leicht nach oben weggezogen wird. Hierbei die Pipette senkrecht nach oben halten und ohne Druck, am besten mit Daumen und Zeigefinger kurz unterhalb des Pipettenköpfchens fixieren.
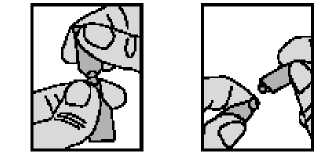
7. Aus der Pipette mit nach unten gerichteter Öffnung mit leichtem Druck je einen Tropfen in jedes Auge träufeln.
8. Die Pipette danach sofort verwerfen, nicht nochmals verwenden!
Mova Nitrat Pipette® ist zur einmaligen Anwendung bestimmt.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten
sonstigen Bestandteile.
Die Anwendung der 1%-igen Silbernitratlösung ist bei Hornhautläsionen kontraindiziert.
Keine Anwendung bei Chlamydien-Konjunktivitis.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
• Es darf nur einprozentige Silbernitratlösung aus frisch geöffneten Einmalampullen verwendet werden.
• Silbernitrat ist ätzend bei Haut- und Schleimhautkontakt.
• Der Kontakt der 1%-igen Silbernitratlösung mit der Haut oder anderen Körperoberflächen soll vermieden werden, da Verfärbungen der Haut auftreten können. Überflüssige Flüssigkeit auf der Haut und auf dem Augenlid ist daher zu entfernen, um Hautverfärbungen vorzubeugen.
• Stets sollte in den Bindehautsack appliziert werden, ohne dabei mit der Ampulle Hornhautläsionen zu verursachen.
• Nach dem Einträufeln der 1%-igen Silbernitratlösung ist eine Spülung nicht erforderlich. Obwohl nicht geprüft, wird gelegentlich angenommen, dass eine Spülung die Effizienz der Silbernitrat-Prophylaxe reduzieren kann.
• Die Prophylaxe darf nicht später als 1 Stunde nach der Geburt erfolgen.
• Die prophylaktische Maßnahme ist sowohl bei Vaginal- als auch bei Schnittentbindungen empfohlen.
• Die Anwendung von 1% Silbernitrat bietet keinen Schutz gegenüber einer Chlamydien-Konjunktivitis.
• NaCl-Spülungen zur Silberpräzipitation sind zwar der richtige Weg zur Therapie von Silbernitrat-Verätzungen, müssen aber frühzeitig einsetzen. Die verbleibenden Silberablagerungen sollten umgehend exzidiert werden, um eine komplikationslose Heilung zu ermöglichen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Entfällt
4.6 Fertilität, Schwangerschaft und Stillzeit
Mova Nitrat Pipette® sollte in der Schwangerschaft und Stillperiode nicht angewendet werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig: Häufig: Gelegentlich: Selten:
Sehr selten: Nicht bekannt:
> 1/10
> 1/100 bis < 1/10
> 1/1000 bis < 1/100
> 1/10.000 bis < 1/1000 < 1/10.000
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar.
|
Organklasse |
Häufig (> 1% bis < 10%) |
Gelegentlich (> 0,1% bis < 1%) |
Selten (> 0,01% bis < 0,1%) |
Sehr selten (< 0,01% oder unbekannt) |
|
Augen erkrankungen |
Schmerzreaktionen (können 6 - 8 Stunden nach der Anwendung auftreten), Schwellungen, Rötungen, eitrige Sekretbildung (Chemische Konjunktivitis*) |
*Diese Konjunktivitis klingt innerhalb von 2 - 4 Tagen üblicherweise folgenlos ab, kann aber auch eine bestehende Infektion maskieren.
Die Silbernitratlösung verfärbt die Haut, wenn sie nicht sofort bei der Applikation entfernt wird.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome der Intoxikation
Gelangen hohe Silbernitratkonzentrationen in das Auge, wie z. B. 10 - 20%-ige Lösungen oder Höllensteinstift (75% Silbernitrat), so entwickelt sich ein zäher, eitriger Ausfluss, die Augenlider röten sich und schwellen stark an, die Konjunktiven zeigen ausgeprägt starke Injektion. Die Kornea erscheint wie von einem Netz überzogen mit eingetrübten Bezirken.
b) Therapie von Intoxikationen
Nach Auswaschen mit Aqua bidest. sofort NaCl-Spülung zur Silberpräzipitation durchführen. Applikation von Antibiotika-Salben und Homatropin für etwa 1 Woche. Bei verletzungsbedingten Ablagerungen von Silber in den tieferen Schichten der Kornea sollten diese umgehend exzidiert werden, um eine komplikationslose Heilung zu ermöglichen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Chemotherapeutikum / Antiseptikum ATC-Code: S01AX02
Silbernitrat, AgNO3, ist ein farbloses, geruchloses, aus durchscheinenden Kristallen bestehendes Salz, das in Wasser und in Alkohol leicht löslich ist. Die Substanz ist lichtempfindlich, insbesondere bei Anwesenheit reduzierender Stoffe. Silbernitrat führt zur Denaturierung von Proteinen in Konzentrationen unter 10-4 mol/L und nach Kontakt mit organischen Substanzen kommt es schon bei geringen Mengen zur Verfärbung unter Abscheidung von fein verteiltem, schwarzem Silber.
Bereits vor 100 Jahren wurde die Beobachtung gemacht, dass Schwermetalle in sehr geringen Konzentrationen eine antimikrobielle Wirkung entfalten, und man bezeichnete dies als oligodynamische Wirkung.
Die 1%-ige Silbernitratlösung (10.000 mg/L) ist gegenüber verschiedenen Stämmen von Neisseria gonorrhoeae antbakteriell wirksam. Die MHK von Silbernitrat gegenüber Gonokokken, u.a. auch Penicillinase- und ß-Lactamase-produzierenden Stämmen, liegt bei 51 mg/L. Die antibakterielle Wirksamkeit einer 1%-igen Lösung von Silbernitrat (10.000 mg/L) bleibt auch durch Verdünnung bei topischer Anwendung am Auge gegenüber Gonokokken bestehen.
Die Dosierung, je 1 Tropfen einer 1%-igen Silbernitratlösung (ca. 20 pL bis 30 pL bei einer Konzentration von 10.000 mg/L) in den Konjunktivalsack beider Augen, erreicht in jedem Fall antibakteriell wirksame Konzentration, insbesondere gegen Gonokokken.
Antibakteriell wirksame Konzentrationen an Silbernitrat werden auch gegenüber anderen Bakterien, z. B. Haemophilus influenzae, Diplococcus pneumoniae, Streptococcus pyogenes und Staphylococcus aureus erreicht.
Allgemeine pharmakodynamische Wirkungen sind bei topischer Anwendung von 1%-igem Silbernitrat (1 Tropfen einmalig) nicht zu erwarten.
Resistenzentwicklung gegenüber Silbernitrat ist unbekannt.
Laut Angaben der Weltgesundheitsorganisation (WHO) ist die 1%-ige Silbernitratlösung bakterizid gegenüber allen Stämmen von Neisseria gonorrhoea. Somit werden auch die Stämme erfasst, die gegenüber Antibiotika eine Resistenz entwickelt haben.
Gegenüber den Chlamydien (Chl. trachomatis) zeigt Silbernitratlösung keine ausreichende Wirksamkeit.
5.2 Pharmakokinetische Eigenschaften
Verteilung
Nach einmaliger topischer Anwendung entfaltet die 1%-ige Silbernitratlösung die bakterizide Wirkung auf der Epitheloberfläche von Konjunktiva bzw. Kornea.
Silbernitrat ist plazentagängig und tritt in die Amnionflüssigkeit über. Außerdem wird Silbernitrat in die Muttermilch sezerniert.
Resorption
Daten zur Resorption des Wirkstoffes durch das Epithel in tiefere Schichten der einzelnen Augenabschnitte bzw. Daten zur Resorption in das System im Rahmen dieses Anwendungsbereiches liegen nicht vor.
5.3. Präklinische Daten zur Sicherheit
Aus tierexperimentellen Studien sind keine teratogenen und embryotoxischen Wirkungen bekannt. Eine Mutagenität, Teratogenität und Embryotoxizität ist beim Menschen jedoch nicht sicher auszuschließen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Gereinigtes Wasser
Die wässrige Lösung enthält kein Konservierungsmittel.
6.2 Inkompatibilitäten
Um eine Schwarzfärbung von Haut durch Spritzer der Silbernitratlösung zu vermeiden, ist die überflüssige Flüssigkeit von Augen und Haut sowie von kunststoffbeschichteten Oberflächen zu entfernen.
6.3 Dauer der Haltbarkeit
Dauer der Haltbarkeit im unversehrten Behältnis: 36 Monate bei intaktem Aluminiumsachet.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern, insbesondere nicht im Bereich einer Rotlichtlampe!
Das Aluminiumsachet darf erst unmittelbar vor Gebrauch entfernt werden. Die Pipette ist nur zum einmaligen Gebrauch bestimmt.
6.5 Art und Inhalt des Behältnisses
1 Pipette 10 Pipetten
100 Pipetten (Anstaltspackung)
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. Inhaber der Zulassung
Aristo Pharma GmbH Wallenroder Str. 8 - 10 13435 Berlin Tel.: +49 30 71094 4200 Fax: +49 30 71094 4250
8. Zulassungsnummer
6389966.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
28.05.2004
10. Stand der Information
März 2014
11. Verkaufsabgrenzung
Apothekenpflichtig
6