Serevent Diskus
1
Wortlaut der für die Fachinformation vorgesehenen Angaben
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
Serevent® Dosier-Aerosol
25 pg/Dosis, Druckgasinhalation, Suspension Serevent ® Diskus®
50 pg/Dosis, einzeldosiertes Pulver zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Serevent Dosier-Aerosol
1 Sprühstoß enthält 36,3 pg Salmeterolxinafoat, entsprechend 25 pg Salmeterol (abgegeben aus dem Ventil). Dies entspricht einer aus dem Mundrohr abgegebenen Menge von 21 pg Salmeterol.
Serevent Diskus
1 Einzeldosis enthält in 12,5 mg Pulver zur Inhalation 72,5 pg Salmeterolxinafoat, entsprechend 50 pg Salmeterol.
Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORMEN
Serevent Dosier-Aerosol Druckgasinhalation, Suspension
Serevent Diskus
Einzeldosiertes Pulver zur Inhalation
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Langzeitbehandlung von Atemwegserkrankungen mit Verengung der Atemwege durch Krämpfe der Bronchialmuskulatur (obstruktive Atemwegserkrankungen), wie z. B. Asthma bronchiale (anfallsweise auftretende Atemnot durch Atemwegsverkrampfung, insbesondere nächtliches Asthma), chronische Bronchitis und Blählunge (Lungenemphysem).
Gleichzeitig soll beim Asthma bronchiale eine regelmäßige Therapie mit entzündungshemmenden Arzneimitteln (inhalative und/oder orale Kortikoide) sichergestellt werden, da Serevent kein Ersatz hierfür ist. Diese Behandlung mit Kortikoiden ist regelmäßig weiterzuführen.
Warnhinweis:
Serevent Dosier-Aerosol und Serevent Diskus sollen nicht für die Akutbehandlung eines Asthmaanfalls eingesetzt werden.
4.2 Dosierung, Art und Dauer der Anwendung Dosierung
Die Dosierung richtet sich nach Art und Schwere der Erkrankung.
Für den Behandlungserfolg ist es wichtig, Serevent Dosier-Aerosol oder Serevent Diskus regelmäßig anzuwenden.
Für Erwachsene und Kinder ab 4 Jahren gelten folgende Empfehlungen:
Serevent Dosier-Aerosol
Eine Einzeldosis muss stets aus 2 Sprühstößen bestehen, um eine gleichförmige Dosierung zu gewährleisten.
Erwachsene:
2-mal täglich 2 Sprühstöße inhalieren.
Bei stärkeren Beschwerden kann die Dosis auf Anweisung des Arztes auf 2-mal täglich 4 Sprühstöße erhöht werden.
Kinder ab 4 Jahren:
2-mal täglich 2 Sprühstöße inhalieren.
Serevent Diskus
Erwachsene:
2-mal täglich 1 Einzeldosis inhalieren.
Bei stärkeren Beschwerden kann die Dosis auf Anweisung des Arztes auf 2-mal täglich 2 Einzeldosen erhöht werden.
Kinder ab 4 Jahren:
2-mal täglich 1 Einzeldosis inhalieren.
Serevent Dosier-Aerosol und Serevent Diskus
Die Behandlung mit Serevent Dosier-Aerosol und Serevent Diskus soll unter Berücksichtigung dieser Dosierungsempfehlungen und beim Asthma in Ergänzung zu einer entzündungshemmenden Dauertherapie mit Glukokortikosteroiden zur Inhalation oder anderen entzündungshemmend wirkenden Substanzen erfolgen. Bei der COPD wird eine Therapie mit Glukokortikosteroiden derzeit nicht regulär empfohlen.
Der Abstand der einzelnen Inhalationen sollte etwa 12 Stunden betragen. Die bronchienerweiternde Wirkung setzt im Allgemeinen 10 bis 20 Minuten nach der Inhalation ein und hält ca. 12 Stunden an. Die maximale Wirksamkeit wird normalerweise nach 2 Stunden erreicht.
Bei Erwachsenen soll die Tagesgesamtdosis 8 Sprühstöße (Serevent Dosier-Aerosol) bzw.
4 Einzeldosen (Serevent Diskus), bei Kindern 4 Sprühstöße (Serevent Dosier-Aerosol) bzw.
2 Einzeldosen (Serevent Diskus), nicht überschreiten, da eine höhere Dosierung im Allgemeinen keinen zusätzlichen therapeutischen Nutzen erwarten lässt, aber die Wahrscheinlichkeit des Auftretens auch schwerwiegender Nebenwirkungen erhöht werden kann.
Art der Anwendung
Serevent Dosier-Aerosol und Serevent Diskus sind ausschließlich zur Inhalation bestimmt.
Bedienungsanleitung:
Alle Punkte der Bedienungsanleitung sollten sorgfältig beachtet werden.
Serevent Dosier-Aerosol
Vor der ersten Anwendung des Dosier-Aerosols oder wenn es für eine Woche oder länger nicht angewendet wurde, ist die Schutzkappe durch leichtes Zusammendrücken der Seitenflächen vom Mundrohr abzuziehen. Das Dosier-Aerosol ist gut zu schütteln. Um sicherzustellen, dass das DosierAerosol funktioniert, sind dann zwei Sprühstöße in die Luft auszulösen.
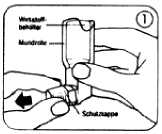
1. Durch leichtes Zusammendrücken der Seitenflächen die Schutzkappe vom Mundrohr entfernen (Abb. 1).
2. Das Mundrohr inklusive des Wirkstoffbehälters auf das Vorhandensein von losen Fremdkörpern prüfen.
3. Das Dosier-Aerosol kräftig schütteln, um sicherzustellen, dass mögliche Fremdkörper entfernt werden und der Inhalt gleichmäßig durchmischt wird.
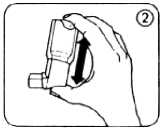
4. Das Dosier-Aerosol zwischen Daumen und Zeigefinger so halten, wie auf der Abbildung 2 gezeigt, aufrecht mit dem Behälterboden nach oben.
Das Dosier-Aerosol ist bei der Inhalation senkrecht, mit dem Boden nach oben zu halten, unabhängig von der Körperposition. Nach Möglichkeit sollte die Anwendung im Sitzen oder Stehen erfolgen.
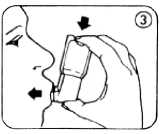
5. Langsam so tief wie möglich ausatmen, dann das Mundrohr mit den Lippen fest umschließen, aber nicht auf das Mundrohr beißen (Abb. 3).
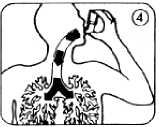
6. Tief und gleichmäßig durch das Mundrohr einatmen. Kurz nach Beginn des Einatmens den Wirkstoffbehälter einmal fest nach unten drücken; währenddessen weiter gleichmäßig und tief einatmen (Abb. 4).
7. Den Atem so lange wie möglich anhalten. Das Mundrohr absetzen und den Zeigefinger vom oberen Ende des DosierAerosols nehmen.
8. Wenn ein weiterer Sprühstoß inhaliert werden soll, das Dosier-Aerosol weiterhin aufrecht halten und ca. eine halbe Minute warten, bevor die Schritte 3 bis 7 wiederholt werden.
9. Nach jedem Gebrauch die Schutzkappe wieder auf das Mundrohr aufsetzen, um Schmutz und Staub fernzuhalten.
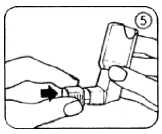
10. Die Schutzkappe wieder auf das Mundrohr aufsetzen, indem diese bis zum Einrasten fest auf das Mundrohr gedrückt wird (Abb. 5).
Wichtig:
Die Schritte 5, 6 und 7 nicht hastig durchführen. Es ist wichtig, mit dem Einatmen zu beginnen, bevor der Sprühstoß ausgelöst wird.
Reinigung des Dosier-Aerosols
Das Mundrohr sollte mindestens einmal in der Woche gereinigt werden.
1. Die Schutzkappe abziehen.
2. Der Wirkstoffbehälter darf nicht vom Mundrohr getrennt werden.
3. Das Mundstück und das Mundrohr innen und außen mit einem trockenen Tuch oder Taschentuch abwischen.
4. Die Schutzkappe wieder aufsetzen.
Der Wirkstoffbehälter darf nicht in Wasser gelegt werden.
Hinweise:
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen. Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen und nach Vorschrift des Arztes anwenden.
Falls mit Hilfe des Volumatic® Inhalationsgerätes inhaliert werden soll, bitte die Bedienungsanleitung für das Gerät beachten.
Serevent Diskus
Beschreibung des Diskus
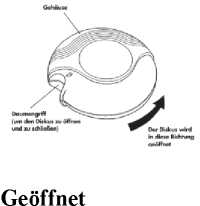
Geschlossen
Wenn der Diskus aus der Originalpackung genommen wird, befindet er sich in „geschlossener” Stellung.
Ein unbenutzter Diskus enthält 60 Einzeldosen des Arzneimittels in Pulverform.
Jede Einzeldosis ist genau abgemessen und separat verpackt. Wartung und Nachfüllen sind nicht erforderlich.
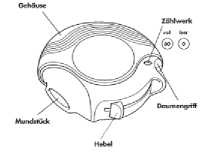
Das Gehäuse schützt den Diskus, wenn er nicht in Gebrauch ist.
Das Zählwerk oben auf dem Diskus zeigt an, wie viele Einzeldosen verbleiben. Die Zahlen 5 bis 0 erscheinen in ROT, um darauf aufmerksam zu machen, dass nur noch wenige Einzeldosen übrig sind.
Wie der Diskus funktioniert
Der Diskus ist einfach zu benutzen. Zur Inhalation einer Einzeldosis den 4 Schritten, wie unten beschrieben, folgen:
1. Öffnen
2. Vorbereiten der Inhalation
3. Inhalieren
4. Schließen
1. Öffnen
Um den Diskus zu öffnen, diesen in einer Hand halten und den Daumen der anderen Hand auf den Daumengriff legen (Abb. 1). Den Daumengriff so weit wie möglich von sich weg schieben.
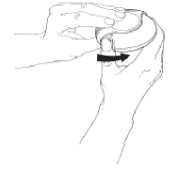
2. Vorbereiten der Inhalation
Den Diskus so halten, dass das Mundstück zum Körper gerichtet ist. Den Hebel so weit wie möglich von sich weg schieben (Abb. 2), bis ein Klicken zu hören ist. Der Diskus ist jetzt einsatzbereit. Die Freigabe der Einzeldosis wird durch das Zählwerk angezeigt. Den Hebel nicht unnötig verschieben, denn dadurch werden überflüssige Einzeldosen freigegeben.
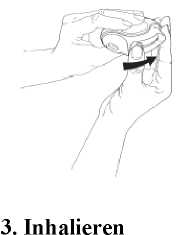
Bevor mit der Inhalation begonnen wird, bitte diese Hinweise sorgfältig lesen:
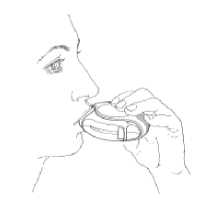
■ Den Diskus vom Mund entfernt halten. So weit wie möglich ausatmen. Nicht in den Diskus hineinatmen.
■ Das Mundstück an die Lippen setzen (Abb. 3). Gleichmäßig und tief durch den Diskus einatmen, nicht durch die Nase.
■ Den Diskus vom Mund nehmen.
■ Den Atem etwa 10 Sekunden anhalten bzw. solange es möglich ist.
■ Langsam ausatmen.
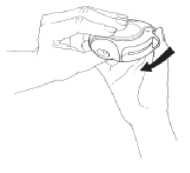
4. Schließen
Um den Diskus zu schließen, den Daumen in den Daumengriff legen und ihn so weit wie möglich zu sich zurück schieben (Abb. 4).
Dadurch gelangt der Hebel automatisch in seine Ausgangsposition zurück. Der Diskus ist jetzt wieder für eine neue Inhalation einsatzbereit.
Wiederholte Inhalation
Wenn verordnet wurde, mehr als eine Einzeldosis zu inhalieren, bitte die Schritte 1 bis 4 wiederholen.
Bitte beachten:
■ Den Diskus trocken aufbewahren.
■ Den Diskus schließen, wenn er nicht benutzt wird.
■ Nicht in den Diskus hineinatmen.
■ Den Hebel nur verschieben, wenn inhaliert werden soll.
4.3 Gegenanzeigen
Serevent Dosier-Aerosol
Überempfindlichkeit gegen den Wirkstoff Salmeterolxinafoat oder Norfluran (HFA 134a).
Serevent Diskus
Überempfindlichkeit gegen den Wirkstoff Salmeterolxinafoat oder Milchprotein.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Behandlung mit Salmeterol sollte nicht bei Patienten mit sich deutlich verschlechterndem oder akut verschlechterndem Asthma oder während einer akuten schweren Exazerbation begonnen werden.
Serevent sollte nicht als Initialtherapie zur Asthmabehandlung eingesetzt werden und ist dafür auch nicht ausreichend.
Eine plötzliche und zunehmende Verschlechterung der Asthmakontrolle kann potentiell lebensbedrohlich sein. In diesem Fall ist eine Erhöhung der Kortikoiddosis in Betracht zu ziehen. Bei Patienten mit einem erhöhten Risiko oder mit starken täglichen Schwankungen der Lungenfunktionswerte kann eine Überwachung der täglichen Peak-Flow-Werte angezeigt sein. Als Erhaltungstherapie bei der Asthmabehandlung sollte Salmeterol in Kombination mit inhalativen oder oralen Kortikosteroiden gegeben werden. Langwirkende Bronchodilatatoren sollten nicht als einzige Therapie oder als Hauptbestandteil einer Erhaltungstherapie bei der Asthmabehandlung gegeben werden (siehe Abschnitt 4.1).
Ein ansteigender Bedarf an Bronchodilatatoren zur Verbesserung der Symptome, insbesondere inhalativen kurzwirksamen Beta-2-Sympathomimetika, ist ein Anzeichen für eine Verschlechterung der Asthmakontrolle.
Im Rahmen einer Therapie des Asthma bronchiale ersetzt Salmeterol nicht die orale oder inhalative Behandlung mit Kortikoiden. Es ist hier zusätzlich anzuwenden. Die Patienten mit Asthma bronchiale müssen darauf hingewiesen werden, diese laufende Behandlung mit Kortikosteroiden auf keinen Fall abzubrechen und die empfohlenen Dosierungen nicht ohne Rücksprache mit dem Arzt zu verringern, auch wenn sie sich besser fühlen.
Sobald eine Kontrolle der Asthmasymptome erreicht ist, kann in Betracht gezogen werden, die Dosis von Salmeterol stufenweise auf die niedrigste wirksame Dosis zu verringern. Bei der schrittweisen Reduktion der Dosis ist eine regelmäßige Untersuchung des Patienten wichtig. Die Dosis für Patienten, die 2-mal täglich 100 pg Salmeterol erhalten, kann auf 2-mal täglich 50 pg Salmeterol verringert werden. Bei Patienten, die 2-mal täglich 50 pg Salmeterol erhalten, kann die ausschließliche Behandlung mit inhalativen Kortikoiden erwogen werden.
Während der Behandlung mit Salmeterol können schwere Asthma-assoziierte unerwünschte Ereignisse und Exazerbationen auftreten. Die Patienten sollten aufgefordert werden, die Behandlung fortzusetzen, aber ärztlichen Rat einzuholen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese nach Therapiebeginn mit Salmeterol verschlimmern.
Wie bei anderen Inhalationsbehandlungen können paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens nach der Anwendung ausgelöst werden (siehe Abschnitt 4.8).
Über die pharmakologischen Nebenwirkungen einer Behandlung mit Beta-2-Agonisten wie Tremor, subjektive Palpitationen und Kopfschmerzen ist berichtet worden. Diese sind aber meist vorübergehend und klingen bei regelmäßiger Behandlung wieder ab (siehe Abschnitt 4.8).
Bei allen Sympathomimetika, insbesondere bei Anwendung von höheren als den therapeutischen Dosen, können gelegentlich Wirkungen auf das Herz-Kreislauf-System wie ein Anstieg des systolischen Blutdrucks und der Herzfrequenz auftreten. Daher ist Salmeterol bei Patienten mit bestehenden Herz-Kreislauf-Erkrankungen mit Vorsicht anzuwenden.
Bei Tachykardie, tachykarder Arrhythmie und idiopathischer hypertropher subvalvulärer Aortenstenose sollte Salmeterol nur bei strenger Indikationsstellung und mit Vorsicht angewendet werden.
Es wurde sehr selten über Anstiege des Blutzuckerspiegels berichtet. Dies sollte bei der Verschreibung für Patienten mit anamnestisch bekanntem Diabetes mellitus berücksichtigt werden (siehe Abschnitt 4.8).
Bei Patienten mit unausgeglichener diabetischer Stoffwechsellage sollte Salmeterol nur bei strenger Indikationsstellung und mit Vorsicht angewendet werden. Diese Patienten sind laufend ärztlich zu überwachen.
Bei Patienten mit Thyreotoxikose sollte Salmeterol nur bei strenger Indikationsstellung und mit Vorsicht angewendet werden.
Die Therapie mit Beta-2-Sympathomimetika kann zu einer potenziell schweren Hypokaliämie führen. Daher ist insbesondere bei Patienten mit niedrigen Ausgangskalium-Werten oder besonderen Risiken hinsichtlich einer Senkung des Blutkaliumspiegels dieser Wert regelmäßig zu kontrollieren und gegebenenfalls Kalium zuzuführen. Hypokaliämie kann besonders ausgeprägt sein bei Patienten mit schwerem Asthma, die gleichzeitig mit Theophyllin, Kortikoiden und/oder Diuretika behandelt werden. Zusätzlich kann eine Hypoxie die hypokaliämische Wirkung von Beta-2-Sympathomimetika verstärken.
In diesen Fällen und bei Patienten, die ein Digitalis-haltiges Arzneimittel erhalten, sollten Serumkaliumspiegel kontrolliert werden.
Daten aus einer großen klinischen Studie (Salmeterol Multi-Center Asthma Research Trial, SMART) weisen darauf hin, dass afro-amerikanische Patienten unter Salmeterol ein höheres Risiko für schwere atemwegsbedingte Ereignisse oder Todesfälle haben als unter Placebo (siehe Abschnitt 5.1). Es ist nicht bekannt, ob dies auf pharmakogenetische oder andere Faktoren zurückzuführen ist. Patienten mit schwarz-afrikanischer oder afro-karibischer Abstammung sollten daher aufgefordert werden, die Behandlung fortzusetzen, aber ärztlichen Rat zu suchen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese unter der Anwendung von Serevent verschlechtern.
Die gleichzeitige Einnahme von systemischem Ketoconazol erhöht den Plasmaspiegel von Salmeterol signifikant. Dies kann zu einem vermehrten Auftreten systemischer Effekte (z. B. Verlängerung des QT-Intervalls und Palpitationen) führen. Die gleichzeitige Anwendung von Serevent mit starkwirksamen CYP3A4-Inhibitoren (wie z. B. Ketoconazol) sollte daher vermieden werden, es sei denn, der Nutzen überwiegt das potenziell erhöhte Risiko systemischer Nebenwirkungen der Behandlung mit Salmeterol (siehe Abschnitte 4.5 und 5.2).
Wenn eine Narkose unter Verwendung von halogenierten Anästhetika geplant ist, sollte darauf geachtet werden, dass Serevent Dosier-Aerosol bzw. Serevent Diskus innerhalb von mindestens 12 Stunden vor Narkosebeginn möglichst nicht mehr angewendet werden.
Die Patienten sollten in die richtige Anwendung ihres Inhalationsgerätes eingewiesen werden und die richtige Anwendung sollte überprüft werden, um sicherzustellen, dass das inhalierte Arzneimittel die Lunge optimal erreicht.
Serevent Dosier-Aerosol
Da die systemische Resorption zum großen Teil über die Lunge erfolgt, kann sich die Deposition des Arzneimittels in der Lunge durch die Anwendung eines Dosier-Aerosols zusammen mit einer Inhalierhilfe ändern. Daher sollte beachtet werden, dass dies zu einem erhöhten Risiko für das Auftreten von systemischen Nebenwirkungen führen kann, so dass eine Dosisanpassung erforderlich sein kann.
Kinder
Die Behandlung von Kindern unter 4 Jahren mit Serevent Dosier-Aerosol bzw. Serevent Diskus kann nicht empfohlen werden, da bisher keine ausreichenden Erfahrungen vorliegen.
Die Anwendung von Serevent Dosier-Aerosol bzw. Serevent Diskus kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Gabe von Salmeterolxinafoat, systemischen Beta-2-Sympathomimetika und Theophyllin kann die antiobstruktive Wirkung von Theophyllin verstärken, es muss aber auch mit einer Zunahme unerwünschter Wirkungen, z. B. Herzrhythmusstörungen, gerechnet werden. Zu den Auswirkungen der gleichzeitigen Gabe von Salmeterolxinafoat und Theophyllin liegen noch nicht genügend Erfahrungen vor. Ähnliches gilt auch für die gleichzeitige Anwendung von Katecholaminen.
Beta-Blocker können die Wirkung von Salmeterolxinafoat abschwächen oder aufheben. Sowohl selektive als auch nicht-selektive Beta-Blocker sind zu vermeiden, es sei denn, zwingende Gründe für deren Anwendung liegen vor.
Die Therapie mit einem Beta-2-Sympathomimetikum kann zu einer potenziell schweren Hypokaliämie führen. Besondere Vorsicht ist bei akutem, schwerem Asthma geboten, da die gleichzeitige Verabreichung von Diuretika, Glukokortikosteroiden, Laxantien oder Xanthin-Derivaten wie z. B. Theophyllin die hypokaliämische Wirkung von Salmeterol verstärken kann.
Starkwirksame CYP3A4-Inhibitoren
Die gleichzeitige Anwendung von Ketoconazol (einmal täglich 400 mg, oral) und Salmeterol (2-mal täglich 50 pg, inhalativ) über 7 Tage führte bei 15 gesunden Probanden zu einem signifikanten Anstieg der Plasmakonzentration von Salmeterol (1,4fache Cmax und 15fache AUC). Dies kann, verglichen mit der Behandlung mit Salmeterol oder mit Ketoconazol allein, zu einem vermehrten Auftreten anderer systemischer Effekte der Behandlung mit Salmeterol (z. B. Verlängerung des QT-Intervalls und Palpitationen) führen (siehe Abschnitt 4.4).
Klinisch signifikante Auswirkungen auf Blutdruck, Herzfrequenz, Blutglucosespiegel und Blutkaliumspiegel wurden nicht beobachtet. Die gleichzeitige Anwendung mit Ketoconazol erhöhte die Eliminationshalbwertszeit des Salmeterols nicht und ergab keine vermehrte Akkumulation des Salmeterols nach wiederholter Anwendung.
Die gleichzeitige Anwendung mit Ketoconazol sollte vermieden werden, es sei denn, der Nutzen überwiegt das potenziell erhöhte Risiko systemischer Nebenwirkungen der Behandlung mit Salmeterol. Wahrscheinlich besteht ein ähnliches Risiko einer Wechselwirkung mit anderen starkwirksamen CYP3A4-Inhibitoren (z. B. Itraconazol, Telithromycin, Ritonavir).
Moderatwirksame CYP3A4-Inhibitoren
Die gleichzeitige Anwendung von Erythromycin (3-mal täglich 500 mg, oral) und Salmeterol (2-mal täglich 50 pg, inhalativ) über 6 Tage führte bei 15 gesunden Probanden zu einem geringfügigen, aber statistisch nicht signifikanten Anstieg der Plasmakonzentration von Salmeterol (1,4fache Cmax und 1,2fache AUC). Die gleichzeitige Anwendung mit Erythromycin war nicht mit einer schwerwiegenden Nebenwirkung verbunden.
4.6 Schwangerschaft und Stillzeit
Es liegen nur begrenzte Informationen über die Anwendung von Salmeterol bei schwangeren Frauen (weniger als 300 Schwangerschaftsverläufe) vor.
Tierversuche zeigen keine direkte oder indirekte schädigende Wirkung hinsichtlich der Reproduktionstoxizität, ausgenommen Hinweisen auf einige schädigende Wirkungen auf den Fötus bei sehr hohen Dosierungen.
Es gibt keine geeigneten und kontrollierten Studien mit Salmeterol bei schwangeren Frauen. Die Wirkung von Salmeterol auf die Schwangerschaft ist beim Menschen nicht bekannt.
Vorzugsweise sollte als Vorsichtsmaßnahme die Anwendung von Serevent in der Schwangerschaft vermieden werden.
Verfügbare pharmakodynamische/toxikologische Daten bei Tieren zeigten einen Übertritt von Salmeterol in die Muttermilch. Ein Risiko für den Säugling kann nicht ausgeschlossen werden.
Eine Entscheidung, ob das Stillen eingestellt oder die Behandlung mit Serevent vorübergehend abgesetzt oder ganz darauf verzichtet werden soll, muss unter Berücksichtigung des Nutzen des Stillens für das Kind und des Nutzens der Therapie für die Mutter getroffen werden.
Serevent Dosier-Aerosol
Bei Studien mit HFA 134a hat sich keine Auswirkung auf die Fortpflanzungsleistung und die Laktation bei erwachsenen bzw. zwei aufeinander folgenden Generationen von Ratten oder auf die Entwicklung des Fötus bei Ratten oder Kaninchen gezeigt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Nachfolgend sind die Nebenwirkungen nach Systemorganklassen und absoluter Häufigkeit (alle berichteten Ereignisse) aufgelistet. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1.000 bis < 1/100), selten (> 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), einschließlich Einzelfälle.
Die Angaben für häufige und gelegentliche Nebenwirkungen sind aus den Daten der klinischen Studien abgeleitet, wobei ihr Auftreten in der Placebo-Gruppe nicht berücksichtigt wurde. Sehr seltene Nebenwirkungen stammen aus Spontanberichten nach Markteinführung.
Die folgenden Häufigkeiten wurden für die Standard-Dosierung von 2-mal täglich 50 ^g bestimmt. Häufigkeiten bei der höheren Dosierung von 2-mal täglich 100 ^g wurden gegebenenfalls entsprechend berücksichtigt.
|
Organklassen |
Nebenwirkungen |
Häufigkeit |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen einschließlich: | |
|
Hautausschlag (Juckreiz und Rötung) |
Gelegentlich | |
|
Anaphylaktische Reaktionen, einschließlich Ödem und Angioödem, Bronchospasmus und anaphylaktischer Schock |
Sehr selten | |
|
Stoffwechsel- und Ernährungsstörungen |
Hypokaliämie |
Selten |
|
Hyperglykämie |
Sehr selten | |
|
Psychiatrische Erkrankungen |
Nervosität |
Gelegentlich |
|
Schlaflosigkeit |
Selten | |
|
Erkrankungen des Nervensystems |
Tremor* |
Häufig |
|
Kopfschmerzen* |
Häufig | |
|
Schwitzen |
Gelegentlich | |
|
Störungen des Geschmacksempfindens |
Gelegentlich | |
|
Schwindel |
Selten | |
|
Herzerkrankungen |
Palpitationen* |
Häufig |
|
Tachykardie |
Gelegentlich | |
|
Beeinflussung des Blutdrucks (Senkung oder Erhöhung) |
Selten | |
|
Herzrhythmusstörungen (einschließlich Vorhofflimmern, supraventrikuläre Tachykardie und Extrasystolie) |
Sehr selten | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Husten |
Gelegentlich |
|
Irritation der Rachenschleimhaut |
Sehr selten | |
|
Paradoxer Bronchospasmus |
Sehr selten | |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit |
Sehr selten |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskelkrämpfe |
Häufig |
|
Arthralgien |
Sehr selten | |
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort |
Unspezifische Brustschmerzen |
Sehr selten |
* siehe Abschnitt 4.4
Tremor und Tachykardien treten häufiger auf, wenn Dosen über 2-mal täglich 50 ^g angewandt werden.
Wie bei anderen Inhalationsbehandlungen können paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens nach der Anwendung ausgelöst werden. In diesem Fall sollte sofort ein kurzwirksamer Bronchodilatator mit schnellem Wirkungseintritt inhaliert werden. Die Behandlung mit Serevent soll unverzüglich abgebrochen werden, der Patient untersucht und ggf. alternative Therapien eingeleitet werden (siehe Abschnitt 4.4).
Serevent Diskus
Lactose enthält geringe Mengen Milchprotein und kann deshalb allergische Reaktionen hervorrufen. Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Schwindel, Erhöhung des systolischen Blutdrucks, Tremor, Kopfschmerzen und Tachykardie sind Anzeichen und Symptome einer Überdosierung mit Salmeterol.
Darüber hinaus kann eine Hypokaliämie auftreten. Daher sollte der Kaliumspiegel im Blut überwacht werden. Eine Kaliumsubstitution sollte erwogen werden.
Im Falle einer Überdosierung sollte der Patient unterstützend mit entsprechender Überwachung wie erforderlich behandelt werden. Die weitere Behandlung der Überdosierung sollte wie klinisch angezeigt durchgeführt werden oder sollte, wo zutreffend, entsprechend den Empfehlungen der Giftinformationszentralen erfolgen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mittel bei Atemwegserkrankungen, selektive Beta-2-Rezeptor-Agonisten, ATC-Code: R03AC12
Salmeterol ist ein weitgehend selektives Beta-2-Sympathomimetikum mit langer Wirkungsdauer.
Salmeterol bewirkt bei reversibler Atemwegsobstruktion eine ca. 12 Stunden anhaltende Bronchodilatation. Die bronchodilatatorische Wirkung setzt im Allgemeinen ca. 10 bis 20 Minuten nach Inhalation ein. Die maximale Wirksamkeit wird normalerweise nach 2 Stunden erreicht.
Nach regelmäßiger Anwendung zeigt sich erfahrungsgemäß eine Verbesserung der Lungenfunktion.
In-vitro-Tests haben gezeigt, dass die Freisetzung von Mediatoren, wie z. B. Histamin, Leukotriene und Prostaglandin D2, aus menschlichem Lungengewebe durch Salmeterol über einen längeren Zeitraum gehemmt wird.
Beim Menschen inhibiert Salmeterol die Früh- und Spätreaktion nach Inhalation von Allergenen und bewirkt eine deutliche Reduktion der bronchialen Hyperreaktivität.
Nach inhalativ verabreichten Einzeldosen von 0,4 mg Salmeterol und mehr wurde eine Abnahme des Plasmakaliums festgestellt.
Salmeterol Multi-Center Asthma Research Trial (SMART)
SMART war eine multizentrische, randomisierte, doppel-blinde, placebo-kontrollierte Parallelgruppen-Studie in den USA über 28 Wochen.
In dieser Studie wurden randomisiert 13.176 Patienten einer Behandlung mit Salmeterol (50 pg 2-mal täglich) und 13.179 Patienten Placebo zugeordnet, jeweils zusätzlich zu ihrer üblichen AsthmaTherapie. In die Studie wurden Patienten mit Asthma eingeschlossen, die 12 Jahre oder älter waren und zu diesem Zeitpunkt Asthma-Medikamente (aber keine langwirksamen Beta-2-Sympathomimetika) anwendeten. Eine Basistherapie mit ICS wurde zu Studienbeginn dokumentiert, war aber in der Studie nicht gefordert. Primärer Endpunkt in SMART war die Gesamtanzahl der atemwegsbedingten Todesfälle und atemwegsbedingten lebensbedrohlichen Ereignisse.
Haupt-Ergebnisse SMART: Primärer Endpunkt
|
Patientengruppe |
Anzahl der primären Endpunktereignisse / Patientenzahl |
Relatives Risiko (95% Konfidenz-Intervall) | |
|
Salmeterol |
Placebo | ||
|
Alle Patienten |
50 / 13.176 |
36 / 13.179 |
1,40 (0,91; 2,14) |
|
Patienten, die inhalative Steroide anwendeten |
23 / 6.127 |
19 / 6.138 |
1,21 (0,66; 2,23) |
|
Patienten, die keine inhalativen Steroide anwendeten |
27 / 7.049 |
17 / 7.041 |
1,60 (0,87; 2,93) |
|
Afro-amerikanische Patienten |
20 / 2.366 |
5 / 2.319 |
4,10 (1,54; 10,90) |
|
(Die Risiko-Angaben in Fettdruck sind statistisch signifikant bei 95% Konfic |
enz-Intervall.) | ||
Haupt-Ergebnisse von SMART in Abhängigkeit von der Anwendung inhalativer Steroide zu Studienbeginn: Sekundäre Endpunkte
|
Patientengruppe |
Anzahl der sekundären Endpunktereignisse / Patientenzahl |
Relatives Risiko (95% Konfidenz-Intervall) | |
|
Salmeterol |
Placebo | ||
|
Atemwegsbedingte Todesfälle | |||
|
Patienten, die inhalative Steroide anwendeten |
10 / 6.127 |
5 / 6.138 |
2,01 (0,69; 5,86) |
|
Patienten, die keine inhalativen Steroide anwendeten |
14 / 7.049 |
6 / 7.041 |
2,28 (0,88; 5,94) |
|
Gesamtzahl asthmabedingter Todesfälle und lebensbedrohlicher Ereignisse | |||
|
Patienten, die inhalative Steroide anwendeten |
16 / 6.127 |
13 / 6.138 |
1,24 (0,60; 2,58) |
|
Patienten, die keine inhalativen Steroide anwendeten |
21 / 7.049 |
9 / 7.041 |
2,39 (1,10; 5,22) |
|
Asthmabedingte Todesfälle | |||
|
Patienten, die inhalative Steroide anwendeten |
4 / 6.127 |
3 / 6.138 |
1,35 (0,30; 6,04) |
|
Patienten, die keine inhalativen Steroide anwendeten |
9 / 7.049 |
0 / 7.041 |
* |
(*= konnte nicht berechnet werden, da in der Placebo-Gruppe keine entsprechenden Ereignisse eingetreten waren.
Die Risikoangaben in Fettdruck sind statistisch signifikant [95% Konfidenz-Intervall]).
Die sekundären Endpunkte in der obigen Tabelle erreichten statistische Signifikanz in der GesamtPopulation. Die sekundären Endpunkte der „Gesamtzahl von Todesfällen und lebensbedrohlichen Ereignissen jeglicher Ursache“, „Todesfällen jeglicher Ursache“ und „Krankenhauseinweisungen jeglicher Ursache“ erreichten keine statistische Signifikanz in der Gesamt-Population.
5.2 Pharmakokinetische Eigenschaften
In einer placebo-kontrollierten Crossover-Interaktionsstudie mit 15 gesunden Probanden führte die gleichzeitige Anwendung von Salmeterol (2-mal täglich 50 pg) und dem CYP3A4-Inhibitor Ketoconazol (einmal täglich 400 mg) über 7 Tage zu einem signifikanten Anstieg der Plasmakonzentration von Salmeterol (1,4fache Cmax und 15fache AUC). Bei wiederholter Anwendung ergab sich keine vermehrte Salmeterol-Akkumulation. Drei Probanden wurden wegen Verlängerung des QT-Intervalls oder Sinustachykardie mit Palpitationen aus der Studie ausgeschlossen. Bei den verbleibenden 12 Probanden führte die gleichzeitige Anwendung von Salmeterol mit Ketoconazol nicht zu einer signifikanten Auswirkung auf Herzfrequenz, Blutkaliumspiegel oder QT-Dauer (siehe Abschnitte 4.4 und 4.5).
Bioverfügbarkeit
Nach regelmäßiger Inhalation von 50 pg Salmeterol 2-mal täglich wurden als maximale Plasmakonzentrationen etwa 0,2 ng/ml gemessen. Die Plasmaspiegel nahmen nach Erreichen von Cmax rasch ab. Teilweise wurde ein zweiter niedrigerer Peak beobachtet, der wahrscheinlich durch die Resorption des verschluckten Dosisanteiles verursacht wird.
Da Salmeterol seine Wirkung lokal in der Lunge entfaltet, korreliert die Plasmakonzentration nicht mit dem therapeutischen Effekt.
Nach Inhalation aus einem Dosier-Aerosol oder Diskus gelangt nur ein Teil des Wirkstoffes in die Lunge. Bis zu 80% der inhalativ verabreichten Dosis werden verschluckt. Salmeterol wird rasch aus dem Gastrointestinaltrakt resorbiert und zu einem großen Teil metabolisiert. Der Hauptmetabolit ist ein Hydroxylierungsprodukt des Salmeterols und erscheint - wahrscheinlich nach biliärer Exkretion -in den Faeces.
Wird Salmeterolxinafoat über längere Dauer inhalativ verabreicht, kann auch 1-Hydroxy-2-naphthoesäure im Blutkreislauf nachgewiesen werden. Die Steady-State-Plasmakonzentration der Substanz beträgt circa 100 ng/ml. 1-Hydroxy-2-naphthoesäure besitzt keine pharmakologische Aktivität.
Die Plasmaproteinbindung beträgt für Salmeterol etwa 93%, für 1-Hydroxy-2-naphthoesäure mehr als 97%.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Sehr hohe Dosen Salmeterolxinafoat - im Vergleich zu der therapeutischen Dosierung - wurden bei verschiedenen Anwendungsarten verabreicht.
Approximative LD50
Maus, oral > 150 mg/kg KG
Ratte, oral > 1.000 mg/kg KG
Die inhalative Gabe von 2,9 mg/kg KG wurde von Ratten symptomlos vertragen; Hunde zeigten nach 0,7 mg/kg KG die zu erwartenden pharmakologischen Effekte (Vasodilatation und Tachykardie).
Zur Überdosierung mit Salmeterol siehe Abschnitt 4.9.
Chronische Toxizität
In Untersuchungen zur chronischen Toxizität wurden hohe Salmeterolxinafoat-Gaben Ratten und Hunden oral, inhalativ sowie kombiniert (inhalativ und oral) über Zeiträume von maximal 18 Monaten verabreicht. Nach Inhalation traten nur bei Ratten, einer Tierspezies, die ungewöhnlich empfindlich auf inhalierte Stoffe reagiert, geringfügige Veränderungen des Kehlkopfes auf. Auch hohe systemische Dosen wurden gut vertragen. Anstieg der Pulsfrequenz, Hypertrophie der Skelettmuskulatur und Veränderungen von Laborwerten (z. B. Glucose- und Kaliumspiegel) wurden beobachtet. Diese Effekte resultieren aus der bei sehr hoher Dosierung ausgeprägten pharmakologischen Aktivität von Salmeterol. Eine Übertragbarkeit auf den Menschen ist jedoch nicht gegeben, da die systemisch wirksame Salmeterol-Menge nach Inhalation therapeutischer Dosen vernachlässigbar gering ist.
Reproduktionstoxikologie
In reproduktionstoxikologischen Studien an Ratten und Kaninchen wurden bei einigen Kaninchenföten Veränderungen festgestellt, wie sie für die Klasse der Beta-2-Agonisten typisch sind. Während langjähriger Anwendung anderer Beta-2-Sympathomimetika beim Menschen ergaben sich keine Hinweise, dass diese Effekte für die Behandlung von Frauen in therapeutischer Dosierung von Bedeutung sind.
Zur Anwendung während der Schwangerschaft und Stillzeit siehe Abschnitt 4.6.
Kanzerogenität
Nach Gabe von Salmeterolxinafoat über nahezu die gesamte Lebensdauer kommt es dosisabhängig, wie auch bei anderen Beta-2-Sympathomimetika, zu einem vermehrten Auftreten von Hyperplasien der Muskulatur und von Leiomyomen (gutartige Tumore der glatten Muskulatur) des Mesovariums bei
Ratten und des Uterus bei Mäusen. Nach vorherrschender Meinung ist eine Übertragbarkeit auf den Menschen nicht gegeben.
In einer Ratten-Langzeitstudie wurde bei den behandelten Tieren eine gesteigerte Inzidenz an Hypophysenadenomen registriert. Ebenfalls eine Vermehrung von Hypophysenadenomen wurde bei behandelten weiblichen Ratten in einer 18-Monats-Toxizitätsstudie beobachtet. Da Hypophysenadenome bei dem verwandten Ratten-Stamm als häufigste spontan auftretende Tumore gelten und der entsprechende Dosisbereich weit über der therapeutischen Dosis für den Menschen liegt, kann bei therapeutischer Anwendung von Salmeterol eine tumorigene und kanzerogene Wirkung auf den Menschen mit relativer Sicherheit ausgeschlossen werden.
Mutagenität
Untersuchungen zur Mutagenität ergaben keine Hinweise auf ein genotoxisches Potenzial.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Serevent Dosier-Aerosol Norfluran (HFA 134a).
Serevent Diskus
Lactose-Monohydrat (enthält Milchprotein).
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, dürfen diese Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Serevent Dosier-Aerosol 2 Jahre
Serevent Diskus 2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Serevent Dosier-Aerosol
Die Schutzkappe wieder auf das Mundrohr aufsetzen, indem diese bis zum Einrasten fest auf das Mundrohr gedrückt wird.
Nicht über 30°C lagern.
Behälter steht unter Druck!
In der Originalverpackung aufbewahren, um den Inhalt vor Hitze, direkter Sonnenbestrahlung und Frost zu schützen!
Nicht gegen Flammen oder auf glühende Gegenstände sprühen!
Nicht gewaltsam öffnen oder verbrennen.
Nur völlig entleert wegwerfen.
Wie bei den meisten inhalativen Arzneimitteln in Druckbehältern kann die therapeutische Wirkung des Arzneimittels abnehmen, wenn der Behälter kalt ist.
Serevent Diskus
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Nicht über 30°C lagern.
6.5 Art und Inhalt der Behältnisse
Serevent Dosier-Aerosol Druckgasinhalation, Suspension
1 Dosier-Aerosol mit 12,0 g Suspension zur Inhalation (mind. 120 Sprühstöße zu je 25 pg Salmeterol).
Doppelpackung mit 2 x 1 Dosier-Aerosol mit 12,0 g Suspension zur Inhalation (mind. 120 Sprühstöße zu je 25 pg Salmeterol).
Klinikpackungen:
Packungen mit 10 Dosier-Aerosolen mit 12,0 g Suspension zur Inhalation (mind. 120 Sprühstöße zu je 25 pg Salmeterol).
Zur vereinfachten Anwendung von Serevent Dosier-Aerosol ist außerdem erhältlich:
Volumatic® Inhalationsgerät CE.
Serevent Diskus
Einzeldosiertes Pulver zur Inhalation 1 Diskus mit 60 Einzeldosen Pulver zur Inhalation.
Doppelpackung mit 2 x 1 Packung mit 60 Einzeldosen Pulver zur Inhalation.
Klinikpackungen:
Packungen mit 10 x 60 Einzeldosen Pulver zur Inhalation.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
GlaxoSmithKline GmbH & Co. KG 80700 München Service Tel.: 0800 1 22 33 55 Service Fax: 0800 1 22 33 66 E-Mail: produkt.info@gsk.com http: //www .glaxosmithkline.de
8. ZULASSUNGSNUMMERN
Serevent Dosier-Aerosol Zul.-Nr.: 25243.00.00
Serevent Diskus Zul.-Nr.: 25243.00.01
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/VERLÄNGERUNG DER ZULASSUNGEN
Datum der Erteilung der Zulassungen: 07. Juli 1995
Datum der letzten Verlängerung der Zulassungen: 11. Februar 2004
10. STAND DER INFORMATION
Februar 2015
11. VERKAUFSABGRENZUNG V erschreibungspflichtig