Vantas 50 Mg Implantat
Gebrauchsinformation: Information für den Anwender
Vantas 50 mg Implantat Wirkstoff: Histrelinacetat
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht:
1. Was ist Vantas und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Vantas beachten?
3. Wie ist Vantas anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Vantas aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Vantas und wofür wird es angewendet?
• Vantas ist ein Verabreichungssystem für Arzneimittel, das chirurgisch unter der Haut platziert (oder implantiert) wird.
• Es wird in der Behandlung von fortgeschrittenem Prostatakrebs eingesetzt, um die durch den Prostatakrebs verursachten Beschwerden zu lindern.
• Der Wirkstoff ist Histrelinacetat. Jedes Vantas Implantat enthält in etwa 50 mg Histrelinacetat. Nach der Implantation unter die Haut setzt Vantas über einen Zeitraum von 12 Monaten täglich 41 Mikrogramm Histrelin (entsprechend 50 Mikrogramm Histrelinacetat) im Körper frei.
• Histrelin blockiert im Körper die Herstellung und Sekretion von Hormonen, so dass der Testosteron-Spiegel erniedrigt ist oder sogar so stark absinkt, dass es im Blut nicht mehr nachweisbar ist.
2. Was sollten Sie vor der Anwendung von Vantas beachten?
Vantas darf nicht angewendet werden:
• Bei Überempfindlichkeit (Allergie) gegen den Wirkstoff Histrelinacetat, gegen andere Arzneimittel, die als GnRH (Gonadotropin-Freisetzungshormon)-Agonisten bezeichnet werden, oder einen der sonstigen Bestandteile von Vantas. (Für eine Liste der sonstigen Bestandteile siehe Abschnitt 6.)
• Bei Frauen. Vantas wurde an Frauen nicht untersucht und darf bei Frauen nicht angewendet werden.
• Bei Kindern und Jugendlichen unter 18 Jahren. Vantas wurde an Kindern und Jugendlichen nicht untersucht und ist deshalb bei Kindern und Jugendlichen unter 18 Jahren kontraindiziert.
Wenn Sie meinen, dass einer der oben genannten Punkte auf Sie zutrifft, dürfen Sie das Implantat nicht eingesetzt bekommen, bevor Sie dies nicht mit ihrem Arzt geklärt haben. Befolgen Sie die Ihnen gegebenen Ratschläge.
Warnhinweise und Vorsichtsmaßnahmen
Es ist möglich, dass sich in der ersten Woche der Behandlung Ihre Symptome verschlechtern oder neue Symptome auftreten. (Siehe Abschnitt 4: Nebenwirkungen). In diesem Fall kontaktieren Sie bitte umgehend Ihren Arzt.
Informieren Sie Ihren Arzt, wenn Sie einige der folgenden Erkrankungen haben, oder wenn Sie ein erhöhtes Risiko dafür haben könnten, denn Sie könnten häufigere Untersuchungen brauchen, wenn:
• Sie eine Stoffwechselerkrankung haben,
• Sie eine Herzerkrankung haben,
• Sie Zuckerkrankheit (Diabetes) haben.
Bei Patienten, die Vantas angewendet haben, ist über das Auftreten von Depressionen, die schwer sein können, berichtet worden. Wenn Sie Vantas anwenden und bei sich depressive Verstimmungen bemerken, informieren Sie Ihren Arzt.
Die Anwendung des Arzneimittels Vantas kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Anwendung von Vantas zusammen mit anderen Arzneimitteln
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden bzw. in der letzten Zeit angewendet haben oder anwenden möchten, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Es ist bisher nicht bekannt, ob Vantas andere Arzneimittel beeinflusst oder durch andere Arzneimittel beeinflusst wird.
Schwangerschaft und Stillzeit
Vantas wurde weder an Schwangeren noch an stillenden Frauen untersucht und darf bei Frauen nicht angewendet werden.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Direkt nach der Implantation sollten Sie aufgrund der Inzision und der Nähte vorsichtig sein. Es liegen noch keine abgeschlossenen Studien zu den Auswirkungen von Vantas auf die Verkehrstüchtigkeit vor.
Wichtige Informationen über bestimmte sonstige Bestandteile von Vantas
Das Behältnis dieses Arzneimittels enthält Kautschuk. Kautschuk kann Überempfindlichkeitsreaktionen oder schwere Allergien hervorrufen.
3. Wie ist Vantas anzuwenden?
• Für die Einführung des Implantats darf nur das Vantas Implantationsinstrument verwendet werden.
• Das Implantat wird durch Ihren Arzt auf der Innenseite Ihres Oberarms unter der Haut implantiert.
• Dazu betäubt der Arzt Ihren Arm, macht einen kleinen Schnitt (Inzision) und platziert das Implantat unter der Haut.
• Der Schnitt wird mit Nähten und speziellen Wundpflastern verschlossen und mit einem Verband versehen.
Während der ersten Woche:
• Der Verband sollte mindestens einen Tag belassen werden.
• Sie dürfen die chirurgischen Steri-Strips nicht entfernen. Steri-Strips sehen aus wie Nahtmaterial; der Arzt verwendet sie, um die Hautwunde zu verschließen, die er zum Einsetzen des Implantats gemacht hat. Sie fallen von alleine ab.
• Vermeiden Sie in den ersten 7 Tagen nach Einsetzen des Implantats das Heben schwerer Lasten und anstrengenden Sport mit dem betroffenen Arm.
• Während der ersten 24 Stunden nach Einsetzen des Implantats ist der betroffene Arm trocken und sauber zu halten. Sie dürfen 24 Stunden lang weder baden noch schwimmen.
Während des ersten Jahres:
• Vergessen Sie nicht, ihren Arzt zu den Routineuntersuchungen aufzusuchen, welche angeboten werden, um sicherzustellen, dass das Implantat weiterhin an Ort und Stelle ist und funktioniert.
• Das Implantat kann an der Stelle, an der es eingesetzt wurde, durch die Haut nach außen dringen. Dies geschieht nur äußerst selten. Vielleicht bemerken Sie, wenn es durch die Haut tritt, aber manchmal kann dies auch geschehen, ohne dass Sie etwas bemerken. Wenn Sie meinen, dass das Implantat ausgetreten ist, nehmen Sie bitte umgehend Kontakt mit Ihrem Arzt auf.
• Ihr Arzt wird mit Blutuntersuchungen, bei denen er zum Beispiel das prostataspezifische Antigen (PSA) oder den Testosteron-Spiegel kontrolliert, überprüfen, ob Sie auf die Behandlung ansprechen.
• Nach 12 Monaten muss das Implantat entfernt werden.
• Möglicherweise ist das Implantat unter der Haut nicht leicht zu ertasten. Wenn es zu dem Zeitpunkt, an dem es entfernt werden soll, nicht ertastet werden kann, kann Ihr Arzt eine Ultraschalluntersuchung oder einen CT-Scan veranlassen, um es zu lokalisieren.
• Nach der Entfernung kann ihr Arzt dann ein neues Implantat einsetzen, um die Behandlung fortzuführen.
Wenn Sie eine größere Menge von Vantas angewendet haben, als Sie sollten
Es gibt keine Erfahrungen mit einer Überdosierung von Vantas. Sie erhalten das Implantat unter
strenger ärztlicher Kontrolle.
Wenn Sie die Anwendung von Vantas abbrechen
Falls Sie die Behandlung mit diesem Arzneimittel beenden wollen, wenden Sie sich bitte an Ihren
Arzt.
Falls Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, fragen Sie Ihren Arzt.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Das Medikament kann in der ersten Behandlungswoche einen vorübergehenden Anstieg der Testosteron-Serumkonzentrationen verursachen. Dadurch können sich Ihre Symptome für einige Wochen verschlechtern. Außerdem können neue Symptome auftreten.
Informieren Sie Ihren Arzt sofort, wenn:
• neue oder verstärkte Knochenschmerzen auftreten
• Sie sich kraftlos fühlen
• Sie ein Schwächegefühl in den Beinen entwickeln
• Sie Blut im Urin haben
• Sie Probleme beim Urinieren haben oder nicht urinieren können.
An der Stelle, an der das Implantat eingesetzt wird, kann es während der Implantation, während und eine Zeitlang nach der Entfernung zu Schmerzen, blauen Flecken und Rötungen kommen. Diese Reaktionen verschwinden normalerweise ohne Behandlung innerhalb von zwei Wochen.
Wenn die Stelle, an der das Implantat eingesetzt wurde, nicht zu heilen sondern sich statt dessen zu verschlimmern scheint (Blutungen, Rötung, Schmerzen), informieren Sie bitte Ihren Arzt.
Falls Sie irgendeine der folgenden Nebenwirkungen bemerken, informieren Sie bitte Ihren Arzt:
Die Häufigkeiten werden wie folgt definiert:
|
Sehr häufig: |
betrifft mehr als 1 Behandelten in 10 |
|
Häufig: |
betrifft 1 bis 10 Behandelte von 100 |
|
Gelegentlich: |
betrifft 1 bis 10 Behandelte von 1.000 |
|
Selten: |
betrifft 1 bis 10 Behandelte von 10.000 |
|
Sehr selten: |
betrifft weniger als 1 Behandelten von 10.000 |
|
Nicht bekannt: |
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar |
Sehr häufige Nebenwirkungen sind:
• Hitzewallungen (Rötung von Gesicht und/oder Nacken).
Häufige Nebenwirkungen sind:
• eingeschränkte Nierenfunktion, häufiges Wasserlassen, Harnverhaltung (Schwierigkeiten beim Wasserlassen);
• Kurzatmigkeit bei Belastung;
• Änderungen der Stimmungslage, Depression, Einschlafstörungen, verringertes sexuelles Interesse;
• Schwindelgefühle, Kopfschmerzen;
• Erröten;
• Hodenschrumpfung, Vergrößerung der Brüste, Impotenz;
• Hautreaktionen an der Implantationsstelle, wie Schmerzen, Druckschmerz und Rötungen;
• andere Reaktionen auf die Implantation, zum Beispiel Schwäche und Müdigkeit;
• vorübergehende Schädigung von Leberzellen;
Gelenkschmerzen, Schmerzen in Armen und Beinen;
• Verstopfung;
• Gewichtszunahme, erhöhte Blutzuckerwerte;
• zusätzlicher Haarwuchs.
Gelegentlich auftretende Nebenwirkungen sind:
• Anämie,
• Abdominalbeschwerden, Übelkeit;
• Ödeme, Essattacken, Hyperkalzämie, Hypercholesterinämie, Appetitzunahme;
• Reizbarkeit;
• Tremor;
• Gewichtsverlust;
• Herzklopfen (Palpitationen) bzw. unregelmässiger Herzschlag (Extrasystolen);
• ungewöhnliche Blutungen;
• blaue Flecken, Nachtschweiß, Jucken, übermäßiges Schwitzen;
• Rückenschmerzen, Muskelkrämpfe, Muskelverspannungen, Nackenschmerzen;
• Schwierigkeiten beim Wasserlassen, Blut im Urin, Nierensteine, Nierenversagen;
• Brustschmerz, Brustdruckschmerz, Jucken im Genitalbereich, sexuelle Dysfunktion;
• Kältegefühle, Lethargie, Unwohlsein, periphere Ödeme, Schmerzen, Schwellungen;
• ureteraler Stentverschluss;
• blaue Flecken
• veränderte Blutlaborwerte, einschließlich: erhöhter Leberenzymwerte (erhöhte Aspartat-Aminotransferase), erhöhte Laktatdehydrogenase im Blut, erhöhte Testosteronwerte im Blut, abnormale Nierenfunktionstests (verringerte Kreatinin-Clearance), erhöhte saure Prostata-Phosphatase
Selten auftretende Nebenwirkungen sind:
• Hautinfekte;
• Entzündungen an der Anwendungsstelle.
Nebenwirkungen mit nicht bekannter Häufigkeit sind:
• Glukoseintoleranz, Verschlechterung einer bestehenden Zuckerkrankheit (Diabetes);
• Herz-Kreislauf-Erkrankung, Herzprobleme, z. B. mit dem Herzrhythmus;
• Hautausschlag;
• Verringerung der Knochendichte, zerbrechliche Knochen (Osteoporose).
Informieren Sie bitte Ihren Arzt, wenn Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt über das nationale Meldesystem anzeigen.
Deutschland
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de Österreich
Bundesamt für Sicherheit im Gesundheitswesen
Inst. Pharmakovigilanz
Traisengasse 5
AT-1200 WIEN
Fax: + 43 (0) 50 555 36207
Website: http://www.basg.gv.at/
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Vantas aufzubewahren?
• Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
• Sie dürfen dieses Arzneimittel nach dem auf dem Umkarton und auf dem Etikett der Durchstechflasche hinter „verwendbar bis:“ angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
• Das Implantat im Kühlschrank lagern (2°C - 8°C). Nicht einfrieren.
• Das Implantat in der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
• Das Implantationsinstrument nicht über 25°C lagern. Nicht im Kühlschrank lagern oder einfrieren
• Das Implantationsinstrument in der Originalverpackung aufbewahren, um den Inhalt vor Sonnenlicht zu schützen.
• Durchstechflasche und Implantationsinstrument nach der Anwendung entsorgen. Nur zum einmaligen Gebrauch.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen Was Vantas enthält
• Der Wirkstoff ist Histrelinacetat. Jedes Implantat enthält ungefähr 50 mg Histrelinacetat, entsprechend 41 mg Histrelin.
• Die sonstigen Bestandteile sind im Kern des Implantats enthalten. Der Kern enthält den Bestandteil Stearinsäure (E570). Vier Wirkstoff-Pellets sind von einer Acryl-CopolymerHülle umgeben. Die Acryl-Copolymer-Hülle besteht aus (2-Hydroxyethyl)methacrylat, (2-Hydroxypropyl)methacrylat und [2-Ethyl-2-(methacryloyloxymethyl)propan-1,3-diyl]bis(methacrylat). Diese Kunststoffe wurden alle schon früher in Implantaten verwendet.
• Die sterile Lösung zum Lagern besteht aus Natriumchlorid und Wasser Injektionszwecken.
Wie Vantas aussieht und Inhalt der Packung
Vantas ist ein Implantat und wird in einem Karton mit bernsteinfarbenem Kunststoffbeutel geliefert, der die Durchstechflasche mit einem Vantas Implantat enthält.
Das Implantationsinstrument befindet sich in einem Polyethylen-Beutel. Dieser ist in einem Karton verpackt.
Die Durchstechflasche, die das Implantat enthält, ist mit einem Teflon-beschichteten Stopfen (Chlorobutylisoprenkautschuk) und einer Aluminiumsversiegelung versehen. Der Stopfen enthält Kautschuk. Das Implantat sieht aus wie ein dünnes Röhrchen und ist in 2 ml steriler 1,8 % Natriumchlorid-Lösung eingetaucht.
Das Produkt enthält außerdem eine Packungsbeilage, in der das Verfahren zum Einsetzen und Entfernen des Implantats für Ihren Arzt beschrieben wird, sowie diesen Beipackzettel.
Pharmazeutischer Unternehmer Hersteller
Orion Corporation Orion Pharma Orionintie 1 02200 Espoo Finnland
Orion Corporation Orionintie 1 02200 Espoo Finnland
Örtlicher Vertreter
Orion Pharma GmbH Notkestraße 9 D-22607 Hamburg
Zulassungsnummer in Österreich: Z.Nr.: 1-29068 Zulassungsnummer in Deutschland: Zul.-Nr.: 66817.00.00
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Österreich, Bulgarien, Tschechien, Dänemark, Estland, Finnland, Frankreich, Deutschland, Griechenland, Irland, Ungarn, Lettland, Litauen, Norwegen, Polen, Portugal, Rumänien, Slowenien, Slowakei, Spanien, Schweden: Vantas
Belgien, Luxemburg, Niederlande: Vantasse
Diese Gebrauchsinformation wurde zuletzt überarbeitet im August 2013.
<-------------------------------------------------------------------------------
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Anleitung zum Einsetzen und Entfernen des Implantats
Vantas wird in einem Karton mit bernsteinfarbenem Kunststoffbeutel geliefert, der die sterile Durchstechflasche mit dem Implantat enthält. Das Instrument zur Implantation befindet sich in einem Polyethylenbeutel in einem anderen Karton.
Um das Risiko einer Wundinfektion zu verringern, ist es wichtig, dass aseptische Techniken befolgt werden. Zum Einsetzen und Entfernen des Implantats werden sterile Handschuhe benötigt.
Identifizieren der Stelle, an der das Implantat eingesetzt werden soll
Der Patient sollte auf dem Rücken liegen und den weniger benutzten Arm (bei Rechtshändern der linke Arm) nach außen abwinkeln, so dass der Arzt einfach Zugang zur Innenseite des Oberarms hat. Den Arm mit Lagerungshilfen stützen, um es dem Patienten zu erleichtern, den Arm in dieser Position zu halten. Die beste Stelle für die Implantation befindet sich ungefähr in der Mitte zwischen der Schulter und dem Ellenbogen in der Furche zwischen dem Musculus biceps brachii und dem Musculus triceps brachii.
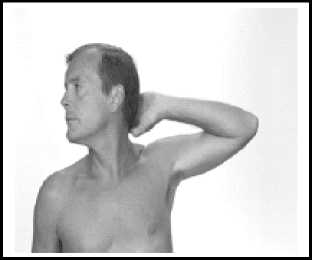
Vorbereitung des Implantationsinstruments
Das Implantationsinstrument muss vor der Implantationsstelle und vor der Implantation vorbereitet werden. Das Implantationsinstrument aus seinem sterilen Beutel nehmen. Das Instrument wird ausgeliefert mit komplett ausgefahrener Kanüle. Dies muss überprüft werden, dazu muss die Stellung des grünen Knopfs für das Zurückziehen verifiziert werden. Der Knopf muss ganz vorne, in Richtung Kanüle und vom Handgriff weg stehen.

Das Metallsiegel von dem Fläschchen entfernen, den Gummistopfen entfernen und mit einer Mosquito-Klemme das Implantat an einer Spitze greifen. Das Implantat sollte nicht im Mittelbereich gegriffen werden, um es nicht zu beschädigen oder zu verbiegen.
Das Implantat in das Implantationsinstrument einführen. Das Implantat liegt so in der Kanüle, dass nur die Spitze an der Abschrägung sichtbar wird.
Einsetzen des Implantats
Die Einführstelle mit Povidon-Jod abwischen und ein Lochtuch (zur Verdeutlichung nicht im entsprechenden Foto abgebildet) über die Stelle legen.
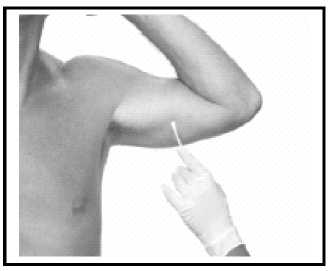

Anästhesie
Vergewissern Sie sich, dass der Patient nicht allergisch gegen Lidocain/Adrenalin ist. Ein paar Milliliter des Anästhetikums injizieren, dabei an der vorgesehenen Einführstelle beginnen und fächerförmig infiltrieren. Die Anästhesie muss mindestens die Länge des Implantats (32 mm) abdecken.
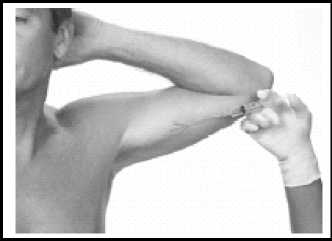
Inzision
Mit einem Skalpell auf der Innenseite des Oberarms senkrecht zum Verlauf des Bizeps eine flache 2-3 mm lange Hautinzision anlegen.
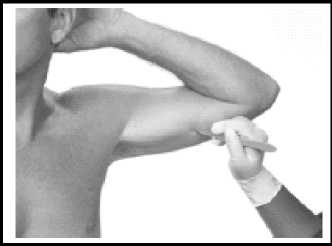
Einsetzen
Das Implantationsinstrument wie abgebildet, am Handgriff greifen.

Die Spitze des Instruments mit der Abschrägung nach oben in die Inzision einführen und das Instrument subkutan entlang dem anästhesierten Bereich bis zur Markierungslinie auf der Kanüle einführen. Um eine subkutane Platzierung sicherzustellen, sollte das Implantationsinstrument während der Einführung immer die Haut sichtbar anheben. Dabei ist sicherzustellen, dass das Implantationsinstrument nicht in das Muskelgewebe eindringt.

Das Instrument fixieren und glei
nopf zum Zurückziehen legen. Den
Knopf drücken, um den Verriegelungsmechanismus zu lösen, und ihn unter Beibehaltung der Positionierung des Instruments bis zum Anschlag zurückziehen. Die Kanüle wird dadurch aus der Inzision gezogen und das Implantat bleibt in der Dermis zurück. Das Implantationsinstrument aus der Inzisionsstelle entfernen. Die Lage des freigesetzten Implantats kann durch Palpation überprüft werden.
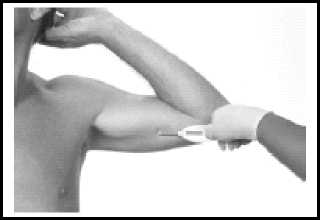
Hinweis: Um zu verhindern, dass das Implantat beschädigt wird, darf nicht mehr versucht werden das Implantat nach Rückzug weiter vorzuschieben. Soll der Eingriff noch mal wiederholt werden, muss zuerst das Implantationsinstrument entfernt, das Implantat an der Spitze herausgezogen, der Knopf zum Zurückziehen wieder ganz nach vorne gedrückt werden und danach das Implantat neu geladen werden. Der Eingriff kann dann wiederholt werden.
Verschluss der Inzision
Die Inzision mit ein oder zwei Nähten (optional) so verschließen, dass die Knoten in der Inzision liegen. Eine dünne Lage einer antibiotischen Salbe direkt auf die Inzision auftragen. Die Inzision mit zwei chirurgischen Steri-Strips verschließen. Eine Wundkompresse (10 cm) auf die Inzisionsstelle legen und mit einer Binde fixieren.
Entfernung des alten Implantats und Einsetzen eines neuen Implantats
Nach einer Behandlungsdauer von 12 Monaten muss das Vantas Implantat entfernt werden. Lokalisieren des Implantats
Das Implantat kann in dem Bereich, in dem sich die Inzision des letzten Jahres befindet, durch Palpation lokalisiert werden. Normalerweise ist das Implantat einfach zu ertasten. Auf das distale Ende des Implantats drücken, um die proximale Spitze relativ zur alten Inzision zu lokalisieren.
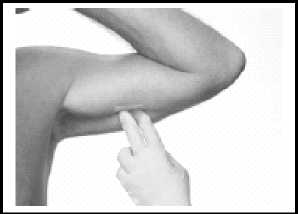
Falls das Implantat schwierig zu lokalisieren ist, kann es mit Ultraschall lokalisiert werden. Falls das Implantat bei der Ultraschalluntersuchung nicht lokalisiert werden kann, können andere Bildgebungsverfahren, wie CT oder MRT zur Lokalisierung eingesetzt werden.
Vorbereitung des OP-Gebiets
Die Lagerung des Patienten und die Vorbereitung der Implantationsstelle unterscheiden sich nicht vom Verfahren bei der Erstimplantation. Das Gebiet über und um das Implantat mit Povidon-Jod abwischen. Das Gebiet mit einem Lochtuch abdecken.
Anästhesie
Vergewissern Sie sich zuerst, dass der Patient nicht allergisch gegen Lidocain/Adrenalin ist. Drücken Sie danach auf die Implantatspitze, die am weitesten von der ursprünglichen Inzisionsstelle entfernt liegt. Eine kleine Menge des Anästhetikums an der Spitze injizieren, die näher an der Inzisionsstelle liegt, danach die Kanüle über die ganze Länge des Implantats, aber unterhalb des Implantates entlang führen und dabei kontinuierlich eine kleine Menge Anästhetikum in die Haut injizieren. Durch das Anästhetikum wird das Implantat innerhalb der Dermis angehoben. Beim Einsetzen des neuen Implantats haben Sie die Möglichkeit das Implantat in die gleiche „Tasche” wie das alte Implantat einzuführen oder unter Verwendung derselben Inzisionsstelle das neue Implantat in die entgegengesetzte Richtung einzuführen. Wenn Sie sich dafür entscheiden das Implantat in die entgegengesetzte Richtung einzuführen, müssen Sie vor der Explantation die neue Position des Implantats auch mit Lokalanästhetikum infiltrieren.
Inzision/Explantation
Mit einem Skalpell Nr. 11 eine 2-3 mm lange und ungefähr 1-2 mm tiefe Inzision im Bereich der Spitze anlegen. Üblicherweise ist dann die Spitze des Implantats durch eine dünne PseudoGewebekapsel sichtbar. Falls das Implantat nicht sichtbar ist, auf die distale Spitze des Implantats drücken und es in Richtung Inzision massieren. Die Pseudo-Gewebekapsel vorsichtig einkerben, um die Polymer-Spitze freizulegen.
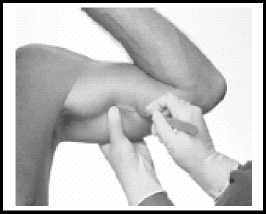
Die Spitze mit einer Mosquito-Klemme greifen und das Implantat herausziehen.
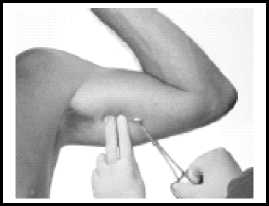
Beim Einführen des neuen Implantats vorgehen, wie bereits oben beschrieben. Das neue Implantat kann durch die gleiche Inzisionsstelle eingeführt werden. Alternativ kann es auch in den anderen Arm implantiert werden.
Lagerung:
Das Implantationsinstrument ist in dem Beutel steril verpackt. Nicht über 25°C lagern. Nicht im Kühlschrank lagern oder einfrieren. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Pharmazeutischer Unternehmer : Orion Corporation
Orionintie 1 02200 Espoo Finnland
12